大鼠早期骨关节炎软骨下骨结构与骨改建相关基因表达研究*
兰贵华,张 波,刘 苹,翁土军,邓蔓菁△
(第三军医大学大坪医院野战外科研究所:1.口腔科;2.第四研究室创伤、烧伤与复合伤国家重点实验室,重庆 400042)
大鼠早期骨关节炎软骨下骨结构与骨改建相关基因表达研究*
兰贵华1,张波2,刘苹2,翁土军2,邓蔓菁1△
(第三军医大学大坪医院野战外科研究所:1.口腔科;2.第四研究室创伤、烧伤与复合伤国家重点实验室,重庆 400042)
[摘要]目的考察创伤性关节炎早期软骨下骨的微结构变化和基因表达变化,探索软骨下骨的骨重建特点及其在关节软骨退变中的作用。 方法选择13只SD大鼠,利用内侧半月板撕裂(MMT)模型模拟创伤性骨关节炎,右侧膝关节行MMT手术,左侧行假手术,术后3周处死大鼠并取膝关节组织标本4%PFA固定。取10只SD大鼠的造模侧及对照侧胫骨关节,利用micro-CT 扫描并重建分析软骨下骨的微结构变化。标本脱钙后石蜡包埋切片,番红O固绿染色,普通光学显微镜观察摄片。另取3只SD大鼠,提取软骨下骨的组织RNA,RT-PCR检测两组之间骨形成标志基因(ALP、RUNX2、OCN)与骨吸收相关基因(TRAP、CTSK、MMP9)mRNA水平的表达变化。结果MMT术后3周,胫骨关节micro-CT扫描显示模型组软骨下骨的小梁骨结构紊乱,软骨下骨小梁骨的骨体积分数(BV/TV)、骨小梁连接密度(Conn.D)、骨小梁厚度(Tb.Th)降低(P<0.05),骨小梁间隔(Tb.Sp)增大(P<0.05)。组织病理结果显示,模型组关节软骨未发生明显结构变化、软骨下骨骨小梁结构稀疏。与对照组比较,模型组骨形成标记基因mRNA表达水平降低(P<0.05),骨吸收相关基因mRNA表达水平升高(P<0.05)。结论大鼠膝关节内侧MMT诱导的创伤性骨关节模型早期,软骨下骨体积分数降低、骨小梁厚度变薄,成骨细胞的标志基因表达下降,破骨细胞的功能基因表达增加。
[关键词]骨关节炎;软骨下骨;微结构;micro-CT
骨关节炎(osteoarthritis,OA)是一种关节退行性疾病,临床主要表现为关节疼痛和关节功能障碍等,严重影响患者的生活质量。其主要病理表现为关节软骨的丢失,软骨下骨的硬化和骨赘的形成等。引起OA的主要因素有衰老、炎症和创伤等。目前,关节软骨与软骨下骨在OA中的作用尚未完全阐明,以往研究认为关节软骨的退变导致了软骨下骨的继发改变[1],越来越多的研究表明软骨下骨在OA的发生、发展中发挥重要作用。在结构上,由于软骨下骨与关节软骨紧密相连,关节软骨的退变必然导致软骨下骨的改变。本研究通过考察创伤性OA早期软骨下骨微结构变化和基因表达变化,明确软骨下骨的骨重建特点。
1材料与方法
1.1材料动物为8周龄雄性SD大鼠,由第三军医大学大坪医院野战外科研究所实验动物中心提供。Trizol(美国Invitrogen公司),GoScript逆转录试剂盒(美国Promega公司),micro-CT(瑞士VivoCT公司),病理切片机(德国Laica公司),番红O(美国Sigma公司),固绿FCF(生工生物),RNAlater(美国Life公司),分光光度计(美国Thermo公司),实时定量PCR仪(美国Applied Biosystems公司),显微镜(日本Olympus公司)。
1.2方法
1.2.1分组及造模 取8周龄健康SD大鼠13只,雄性,体质量200~220 g,无关节病变。分为两组,第1组10只,第2组3只。术前1 d用8%硫化钠溶液将双侧膝关节备皮,范围为关节上下各2 cm。3%戊巴比妥钠按30 mg/kg大鼠腹腔注射麻醉,麻醉成功后动物仰卧,消毒铺巾,备皮。模型侧:取右膝关节内侧长约0.8 cm切口,沿内侧副韧带切断,打开内侧关节腔进入关节腔,找到内侧半月板,用微创剪剪断,生理盐水冲洗,依层缝合,术中不损伤软骨面。假手术侧:同时取对侧膝关节,入路同前,打开关节腔,冲洗,关闭切口[2]。大鼠术后不做任何处理,分开饲养,自由活动及进食。
1.2.2标本采集和处理3周后,将两组大鼠脱颈处死,取双侧胫骨近端,第1组用4%多聚甲醛固定。第2组去除胫骨关节软骨,获得软骨下骨组织,并将组织放置于RNAlater中,备用。
1.2.3显微CT检查将胫骨标本垂直固定在适配容器内,沿标本长轴方向,从胫骨近端骨骺上极扫描至干骺端下极。扫描条件:球管电压55 kV,球管电流145 μA,8 W,矩阵2 048×2 048,分辨率19 μm。将扫描所得 DICOM图像,用SCANCO工作站软件V6.1进行软骨下骨分析和三维重建,观察分析创伤性OA模型中早期软骨下骨的影像表现。
1.2.4组织学观察完成显微CT扫描后,将大鼠的双侧胫骨标本用4%多聚甲醛固定24 h,0.5 mol/L EDTA 脱钙,针刺反应阳性后进行乙醇梯度脱水、透明、浸蜡和石蜡包埋,从冠状面对每个样本进行6 μm连续切片,并进行番红O固绿染色,中性树胶封片,光学显微镜下观察并拍照。
1.2.5实时荧光定量PCR(RT-PCR)检测软骨下骨骨形成与骨吸收相关基因mRNA的表达通过液氮保护下研磨软骨下骨,利用Trizol一步法抽提软骨下骨组织总RNA,分光光度计测吸光度(A)260/280及RNA水平。逆转录为cDNA备用,应用ABI step one实时PCR System进行操作。使用Primer5.0设计引物GAPDH上游:5′-CAA GTT CAA CGG CAC AGT CA-3′,GAPDH下游:5′-ACA TAC TCA GCA CCA GCA TCA C-3′;Runx2上游:5′-AAC TTC CTG T-GC TCC GTG CT-3′,Runx2下游:5′-CTC CGG CCT ACA AAT CTC AGA-3′;OCN上游:5′-GAC AAG TCC CAC ACA GCA AC-3′,OCN下游:5′-CCG GAG TCT ATT C-AC CAC CT-3′;ALP上游:5′-AAA TGC CCT GAA ACT CCA AA-3′,ALP下游 :5′-ATC TCC AGC CGT GTC TCC TC-3′;CTSK上游:5′-TGA CTC TGA AGA CGC TT-ACCC-3′,CTSK下游:5′-CAC ATT ATC ACG GTC GCA GTT-3′;TRAP上游:5′-ACG GCT ACC TAC GCT TTC AC-3′,TRAP下游:5′-CCC TCC CTC AGA CCC ATT-AG-3′;MMP9上游:5′-ATG GTT TCT GCC CCA GTG AG-3′,MMP9下游:5′-CCT TTA GTG GTG CAG GCA GA-3′。RT-PCR反应条件:95 ℃,预变性10 min,95 ℃,变性15 s,57 ℃退火15 s,72 ℃延伸30 s,反应40个循环。结果分析:目的基因的相对表达量=2-△△Ct(Ct=Ct1-Ct2,Ct1:待测基因的临界循环数,Ct2:GAPDH的临界循环数)。
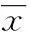
2结果
2.1考察软骨下骨微结构改变的影像学表现术后3周,胫骨近端通过micro-CT扫描与分析,模型侧较假手术侧关节小梁骨结构发生改变(图1),软骨下骨小梁骨的骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁连接密度(Conn.D)降低(P<0.05),骨小梁间距(Tb.Sp)增加(P<0.05),骨小梁数目(Tb.N)减少但差异无统计学意义(P>0.05),见表1。
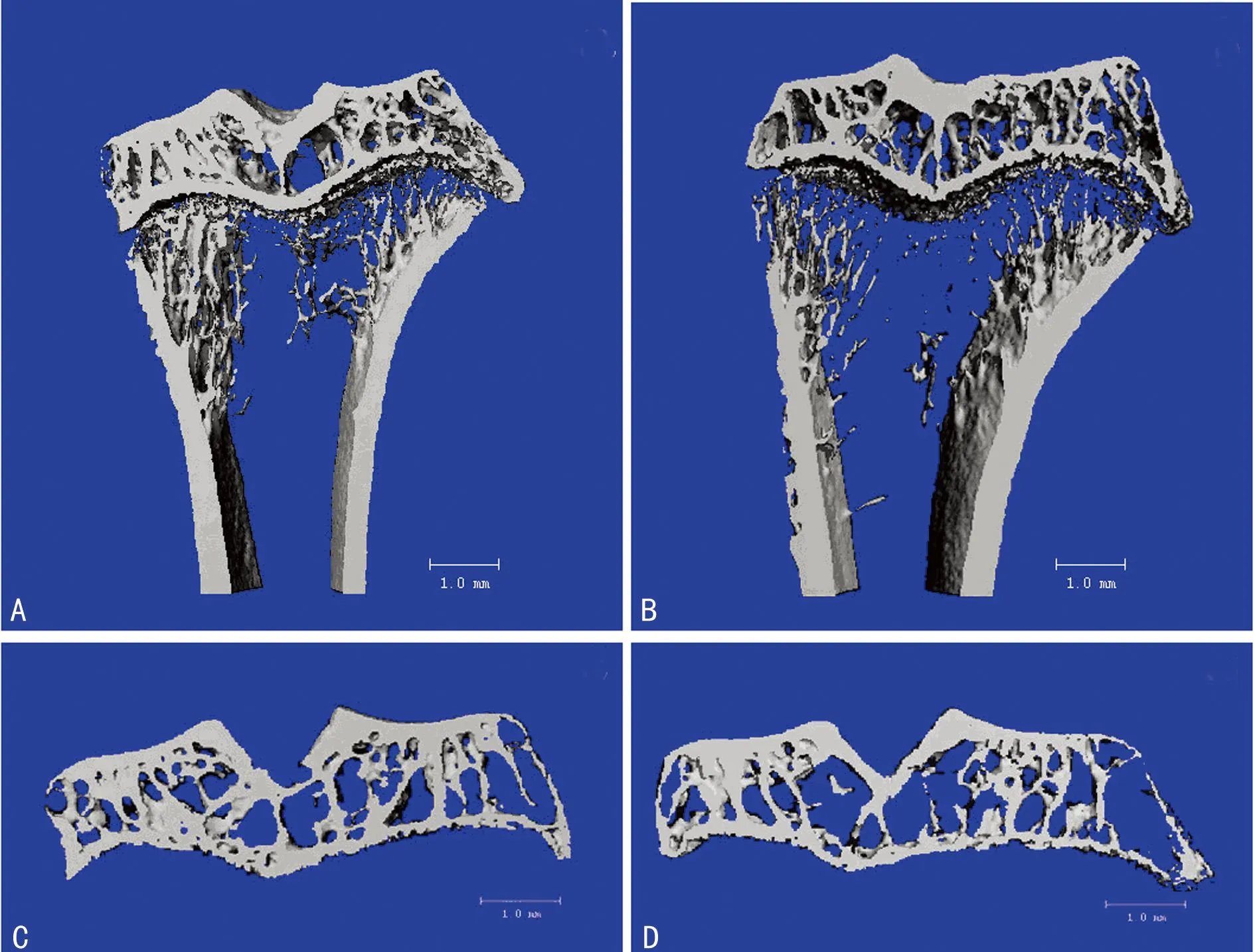
A、C:假手术侧;B、D:模型侧。
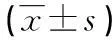
图1 胫骨micro-CT扫描结果
*:P<0.05,与假手术侧比较。
2.2番红O固绿染色为明确术后3周软骨下骨的病理学改变,行胫骨组织切片分析,两组中关节软骨未发生明显退变,而模型侧软骨下骨骨小梁结构较假手术侧稀疏。结果显示骨关节炎早期将影响软骨下骨结构的改建,见图2。
2.3软骨下骨组织RT-PCRRT-PCR结果显示,术后3周软骨下骨的成骨细胞相关基因ALP、RUNX2、OCN大量表达,MMT侧小于假手术侧(P<0.05),表明骨形成降低。破骨细胞相关基因TRAP、CTSK、MMP9表达升高,且MMT侧高于假手术侧(P<0.01),结果表明,创伤性骨关节炎早期软骨下骨重建加快,骨吸收大于骨形成,见图3。
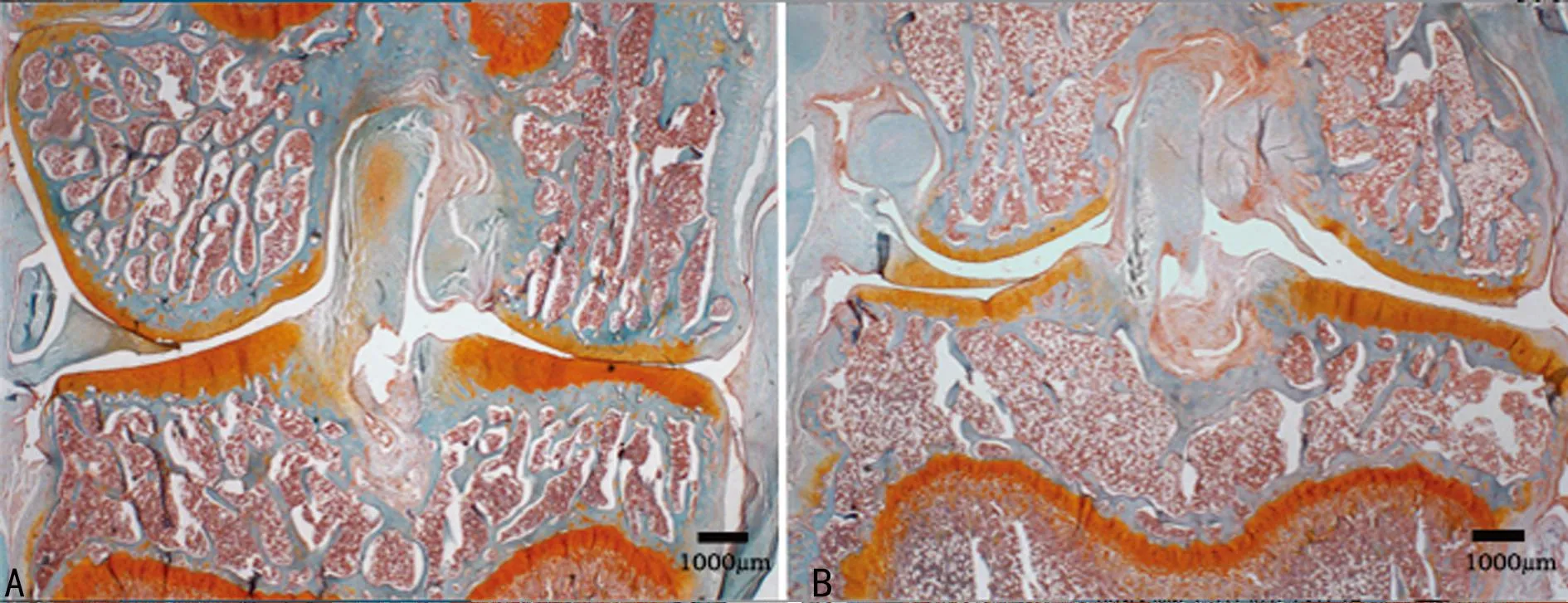
A:假手术侧;B:模型侧。
图2番红O固绿染色的组织病理学切片(×20)
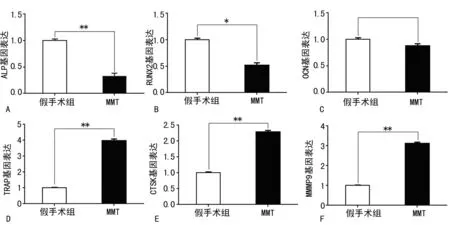
A:ALP基因表达;B:RUNX2基因表达;C:OCN基因表达;D:TRAP基因表达;E:CTSK基因表达;F:MMP9基因表达;*:P<0.05,**:P<0.01。
图3软骨下骨mRNA中骨形成与骨吸收基因的表达
3讨论
目前,通过实验动物模型模拟人OA来研究其发生、发展,其具有造模周期相对较短,操作简便,能模拟OA随时间进展的基本病理过程,能复制出OA的退变过程,以及软骨下骨骨重建的特点。OA动物模型包括自发性和诱发性动物模型,从实验周期、成本控制等方面考虑,诱发性动物模型应用更为广泛。诱发性OA模型的主要方法包括机械制动、药物注射和手术方法[3]。本研究中所使用的模型骨关节炎实验动物模型由Bendele[2]提出,术后3周就能造成关节退行性变,特点是软骨细胞和蛋白多糖减少,骨赘形成等。此实验动物模型得到了广大学者的认可[4-7]。
以往研究认为OA的主要病理变化为软骨的退变引起了软骨下骨的改变,近年来越来越多的研究表明软骨下骨的改变是OA的始因,软骨下骨的结构、生物力学性能及生物学方面的变化与OA密切相关[8]。本研究表明,3周时关节软骨未出现明显组织学变化,而软骨下骨小梁体积减小,骨小梁变薄,表现为轻度的骨吸收,表明在OA早期,软骨下骨转换活跃,骨吸收大于骨形成,软骨下骨的改变早于关节软骨的退变。OA早期软骨下骨骨重建加快,软骨下骨转换的增加,以及之后软骨下骨的硬化与OA的进展密切相关。因此,考察软骨下骨骨体积有利于全面了解OA的病理变化过程。在Hayami等[9]的研究中发现OA早期软骨下骨量减少,骨转换加快,骨吸收大于骨形成。软骨下骨骨改建与OA的发生、发展密切相关,在OA的发生、发展中起重要作用,抑制软骨下骨的异常骨转换可能减缓OA进展。Stupina等[10]研究发现,改变软骨下骨的微结构和改善其血管化能增强软骨细胞的新陈代谢,实现软骨和软骨下骨的体内平衡和改善组织营养,恢复其功能。在Botter等[11]用micro-CT三维成像技术观察大鼠OA动物模型4周后造模处骨组织的变化,发现软骨下骨板的厚度下降,骨小梁之间的连接减少,体积减小,骨小梁间距增加。OA早期常伴有骨重塑加快引起的骨量丢失,晚期可见骨转换率降低并引起软骨下骨板致密化及软骨全部丢失。OA 早期软骨下骨重塑过程加快,软骨下骨板变薄[12]。OA早期未出现临床症状时,OA患者受累骨关节骨吸收标志物水平明显升高,提示OA软骨下骨重塑加快早于软骨受损的发生[13]。
RT-PCR结果显示,MMT侧骨形成基因表达降低,而骨吸收基因表达升高。CTSK和TRAP基因作为破骨细胞特殊生物学标记物,可以作为检测破骨细胞功能的指标。有研究表明CTSK、TRAP和MMP9基因在OA软骨下骨中表达明显上调[14-16]。ALP、RUNX2及OCN基因在成骨过程中发挥重要作用,在早期OA中表达下调[17]。在OA的发生、发展中,软骨下骨的重建可能起着至关重要的作用[18],干预OA的骨重塑过程可能减缓其进展。Hayami等[19]在ACLT OA模型中发现抑制CTSK能够保持软骨下骨的完整性,防止软骨退化,减少骨赘的形成。抑制软骨下骨的过快骨吸收可以延缓软骨的退变。比如一些抑制破骨细胞功能的药物通过改善软骨下骨的骨重建能延缓软骨退变,从而治疗OA[20]。
综上所述,在早期OA中,软骨下骨微结构发生明显改变,软骨下骨在OA的发生、发展中发挥重要作用,研究早期OA软骨下骨的变化能预测随后疾病的症状及结构的发展。本研究考察了软骨下骨的骨重建变化及骨改建特点,发现早期OA软骨下骨骨小梁减少、骨吸收增强,为调控软骨下骨的骨转换防治早期OA提供了实验依据。
参考文献
[1]Yamada K,Healey R,Amiel D,et al.Subchondral bone of the human knee joint in aging and osteoarthritis[J].Osteoarthritis Cartilage,2002,10(5):360-369.
[2]Bendele AM.Animal models of osteoarthritis[J].J Musculoskelet Neuronal Interact,2001,1(4):363-376.
[3]佘国荣,查振刚,汪飞,等.软骨下骨量变化与软骨退变的相关性[J].中国组织工程研究,2015(20):3134-3140.
[4]Prasadam I,Mao X,Wang Y,et al.Inhibition of p38 pathway leads to OA-like changes in a rat animal model[J].Rheumatology (Oxford),2012,51(5):813-823.
[5]Yu DG,Nie SB,Liu FX,et al.Dynamic alterations in microarchitecture,mineralization and mechanical property of subchondral bone in rat medial meniscal tear model of osteoarthritis[J].Chin Med J (Engl),2015,128(21):2879-2886.
[6]Bove SE,Laemont KD,Brooker RM,et al.Surgically induced osteoarthritis in the rat results in the development of both osteoarthritis-like joint pain and secondary hyperalgesia[J].Osteoarthritis Cartilage,2006,14(10):1041-1048.
[7]Wei T,Kulkarni NH,Zeng QQ,et al.Analysis of early changes in the articular cartilage transcriptisome in the rat meniscal tear model of osteoarthritis:pathway comparisons with the rat anterior cruciate transection model and with human osteoarthritic cartilage[J].Osteoarthritis Cartilage,2010,18(7):992-1000.
[8]Karsdal MA,Leeming DJ,Dam EB,et al.Should subchondral bone turnover be targeted when treating osteoarthritis[J].Osteoarthritis Cartilage,2008,16(6):638-646.
[9]HayamiT,PickarskiM,ZhuoY,etal.Characterizationofarticularcartilageandsubchondralbone
changes in the rat anterior cruciate ligament transection and meniscectomized models of osteoarthritis[J].Bone,2006,38(2):234-243.
[10]Stupina TA,Stepanov MA,Teplen′kii MP.Role of subchondral bone in the restoration of articular cartilage[J].Bull Exp Biol Med,2015,158(6):820-823.
[11]Botter SM,van Osch GJ,Waarsing JH,et al.Quantification of subchondral bone changes in a murine osteoarthritis model using micro-CT[J].Biorheology,2006,43(3/4):379-388.
[12]Intema F,Sniekers YH,Weinans H,et al.Similarities and discrepancies in subchondral bone structure in two differently induced canine models of osteoarthritis[J].J Bone Miner Res,2010,25(7):1650-1657.
[13]Bolbos RI,Zuo J,Banerjee S,et al.Relationship between trabecular bone structure and articular cartilage morphology and relaxation times in early OA of the knee joint using parallel MRI at 3 T[J].Osteoarthritis Cartilage,2008,16(10):1150-1159.
[14]贺占坤,沈杰威.MMP-2、MMP-3、MMP-9和TIMP-1评价膝关节骨性关节炎的临床研究[J].重庆医学,2013,42 (32):3872-3874.
[15]Drake FH,Dodds RA,James IE,et al.Cathepsin K,but not cathepsins B,L,or S,is abundantly expressed in human osteoclasts[J].J Biol Chem,1996,271(21):12511-12516.
[16]Andersen TL,del COM,Kirkegaard T,et al.A scrutiny of matrix metalloproteinases in osteoclasts:evidence for heterogeneity and for the presence of MMPs synthesized by other cells[J].Bone,2004,35(5):1107-1119.
[17]Zhang R,Fang H,Chen Y,et al.Gene expression analyses of subchondral bone in early experimental osteoarthritis by microarray[J].PLoS One,2012,7(2):e32356.
[18]Hofstaetter JG,Wang J,Yan J,et al.Changes in bone microarchitecture and bone mineral density following experimental osteonecrosis of the hip in rabbits[J].Cells Tissues Organs,2006,184(3/4):138-147.
[19]Hayami T,Zhuo Y,Wesolowski GA,et al.Inhibition of cathepsin K reduces cartilage degeneration in the anterior cruciate ligament transection rabbit and murine models of osteoarthritis[J].Bone,2012,50(6):1250-1259.
[20]Zhen G,Wen C,Jia X,et al.Inhibition of TGF-beta signaling in mesenchymal stem cells of subchondral bone attenuates osteoarthritis[J].Nat Med,2013,19(6):704-712.
Research on the subchondral bone architecture and bone remodeling related genes change in the initial stage of osteoarthritis in rat*
Lan Guihua1,Zhang Bo2,Liu Ping2,Weng Tujun2,Deng Manjing1△
(1.DepartmentofStomatology,DapingHospital&ResearchInstituteofSurgery,ThirdMilitaryMedicalUniversity,Chongqing400042,China;2.Department4,DapingHospital&ResearchInstituteofSurgery,ThirdMilitaryMedicalUniversity,StateKeyLaboratoryofTrauma,BurnsandCombinedInjury,Chongqing400042,China)
[Abstract]ObjectiveTo investigate the changes of microarchitecture and gene expression of subchondral bone in the initial stage of traumatic arthritis,to explore the characteristics of subchondral bone remodeling and its role in the articular cartilage degeneration.MethodsThe medial meniscal tear (MMT) was performed on the right knees of 13 SD rats to simulate the traumatic osteoarthritis,while sham operation on the control group.Three weeks later, all the rats were executed and dissected,with proximal tibiae being kept and distributed into the two groups,10 respectively.Micro-computed tomography (micro-CT) was adopted to reconstruct and analyze the subchondral bone.After being fixed by 4% paraformaldehyde,all the samples were decalcified until six weeks passed,followed by paraffin-sectioning,safranin O and fast green staining,and examining and photographing under an ordinary optical microscope.The RNA of another 3 SD rats′ subchondral bone was extracted,and a real-time PCR test was carried out to illuminate the expression variation of bone-formation marker genes (ALP,RUNX2,and OCN),and bone-resorption marker genes(TRAP,CTSK and MMP9),between the two groups.ResultsThree weeks after MMT surgery,subchondral bone disorders were observed among the experimental samples through micro-CT scanning.There was lesser BV/TV,Conn.D and Tb.Th(P<0.05) and more Tb. Sp(P<0.05) in the experimental group compared with the control group.In the pathological section,arthritic degeneration was not spotted in both groups,but trabeculae of the experimental group were found to be sparse.Compared with control group,the level of mRNA expression of the bone-formation marker genes of the experimental group was decreased(P<0.05),while bone-resorption related genes increased(P<0.05).ConclusionThe model of initial traumatic osteoarthritis induced by MMT in rats′ knees showed an active bone remodeling,more bone absorbing than bone formation,lowered bone volume,and microarchitecture changing of the subchondral bone.
[Key words]osteoarthritis;subchondral bone;microarchitecture;micro-CT
doi:·论著·10.3969/j.issn.1671-8348.2016.16.004
*基金项目:国家重点基础研究发展计划(973计划)资助项目(2011CB964701)。
作者简介:兰贵华(1987-),在读硕士,主要从事口腔医学院的研究。△通讯作者,Tel:(023)68757575;E-mail:iradeng@163.com。
[中图分类号]R363.2
[文献标识码]A
[文章编号]1671-8348(2016)16-2170-03
(收稿日期:2016-01-11修回日期:2016-03-22)

