NGAL及MMP9在原发性肝癌患者血清中表达及意义
唐成佳,余天雾
(重庆医科大学附属永川医院肝胆外科,重庆永川 404000)
NGAL及MMP9在原发性肝癌患者血清中表达及意义
唐成佳,余天雾△
(重庆医科大学附属永川医院肝胆外科,重庆永川 404000)
[摘要]目的探讨原发性肝癌(PHC)患者血清中性粒细胞明胶酶相关脂质运载蛋白(NGAL)及基质金属蛋白酶9(MMP9)的变化及临床意义。方法采用酶联免疫吸附测定(ELISA)检测47例PHC患者(PHC组)及19例健康体检者健康血清中NGAL及MMP9水平,并分析二者与临床病理的联系,同时使用ROC曲线分析二者对PHC的诊断价值,Kaplan-Meier生存曲线分析不同NGAL、MMP9水平的生存差异。结果PHC组NGAL、MMP9水平明显高于健康体检者对照组,差异有统计学意义(P<0.05);NGAL及MMP9的水平在Ⅲ~Ⅳ期组高于Ⅰ~Ⅱ期,差异有统计学意义(P<0.05);血清 MMP9、NGAL检测灵敏度分别为 70.2%和83.0%。二者联合检测可提高灵敏度至94.9%。Kaplan-Meier生存分析发现血清NGAL水平高患者预后差。结论PHC患者血清NGAL及MMP9与PHC的发生、发展密切相关;联合检测血清水平NGAL及MMP9可明显提高敏感度,对PHC诊断及预后指标有一定的价值。
[关键词]原发性肝癌;中性粒细胞明胶酶相关脂质运载蛋白;基质金属蛋白酶9
原发性肝癌(primary hepatic carcinoma,PHC)是指肝内原发而非转移的肝脏恶性肿瘤。PHC发生率占全部恶性肿瘤的5%,世界范围内每年大约100万人受PHC的影响,其病死率与患病率几乎相同。中国是PHC的发病率高的地区之一,达到全球的50%以上,PHC的病死率高,病死率及患病率均排在消化系恶性肿瘤的第2位,术后5年生存率平均仅为20%左右。
中性粒细胞明胶酶相关脂质运载蛋白(NGAL)是Kjeldsenl等[1]于1993年在研究人中性粒细胞中基质金属蛋白酶9(MMP9)时发现的,属于Lipocalin家族成员。近年来研究发现,NGAL与多种肿瘤如胃癌、乳腺癌、结肠癌的发生、发展有关,在上述肿瘤中均发现NGAL高表达且与肿瘤浸润、转移或预后有关。而NGAL在肝癌中的表达情况,国内外鲜见相关报道,本研究采用酶联免疫吸附测定(ELISA)检测肝癌患者血清中NGAL及MMP9的表达情况,并分析二者与临床病理的联系。
1资料与方法
1.1一般资料收集2009年3月至2010年3月在本院肝胆外科就诊的47例PHC患者(PHC组)的血清,其中男24例,女23例,年龄40~85岁,平均年龄63.2岁,高分化17例,低分化30例,均在术前收集,所有诊断均经病理切片证实;同时收集本院体检科19例健康体检人员血清作为健康对照组,所有入组人员均告知检查目的,并签署知情同意书。PHC的诊断符合中国抗癌协会肝癌专业委员会修订的PHC的临床诊断与分期标准。采用一次性无菌肝素化的玻璃试管收集每位入组病例晨起空腹静脉血 3 mL,3 000 r/min×10 min,取上清液分装于无菌玻璃试管中置于-70 ℃冰箱中冻存备用。
1.2主要试剂人 NGAL ELISA 检测试剂盒、人MMP9 ELISA试剂盒均购于武汉博士德公司;酶标仪购于Thermo公司。
1.3方法
1.3.1ELISA检测PHC患者血清NGAL、MMP9表达ELISA检测参照试剂盒说明书进行。从-80 ℃冰箱中取出待测血清标本,室温下解冻,配置标准品,加样,37 ℃温育30 min。洗涤液充分洗涤 4~6 次,加酶,37 ℃温育 30 min,洗涤4~6 次,加入显色剂 A 及B 液各 50 μL,37 ℃避光显色15 min,每孔加终止液,以空白孔调零,终止后 15 min内, 于酶标仪中405 nm 波长测量各孔的吸光度(OD)值,并绘制标准曲线,计算各待测孔中样品浓度。
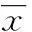
2结果
2.1两组血清NGAL及MMP9水平比较PHC组NGAL、MMP9水平为(31.9±9.0)ng/mL、(336.1±85.7)ng/mL明显高于健康对照组(18.0±8.6)ng/mL、(190.0±62.4)ng/mL,差异有统计学意义(P<0.05)。
2.2PHC患者血清NGAL及MMP9表达与临床病理的联系随着PHC TNM分期的增加,NGAL及MMP9的表达率也逐渐增加,NGAL及MMP9的水平在Ⅲ~Ⅳ期为(33.6±7.8)ng/mL、(357.5±85.2)ng/mL,高于Ⅰ~Ⅱ期(27.4±8.4)ng/mL、(291.2±82.4)ng/mL,差异有统计学意义(P<0.05);NGAL及MMP9的水平与患者的年龄、性别、肿瘤发生部位及肿瘤大小、分化程度等比较,差异无统计学意义(P>0.05)。
2.3ROC曲线分析血清MMP9和NGAL的曲线下面积分别为0.890和0.864,血清MMP9对PHC诊断价值略高于NGAL。血清MMP9最佳临界值为268.50 ng/mL,灵敏度和特异度分别为70.2%和94.7%;血清NGAL最佳临界值为24.50 ng/mL,灵敏度和特异度分别为83.0%和78.9%。联合检测受试者血清MMP9和血清NGAL 中任一检测结果为阳性即为患者。联合检测可提高灵敏度至94.9%,但特异度降低至74.7%。
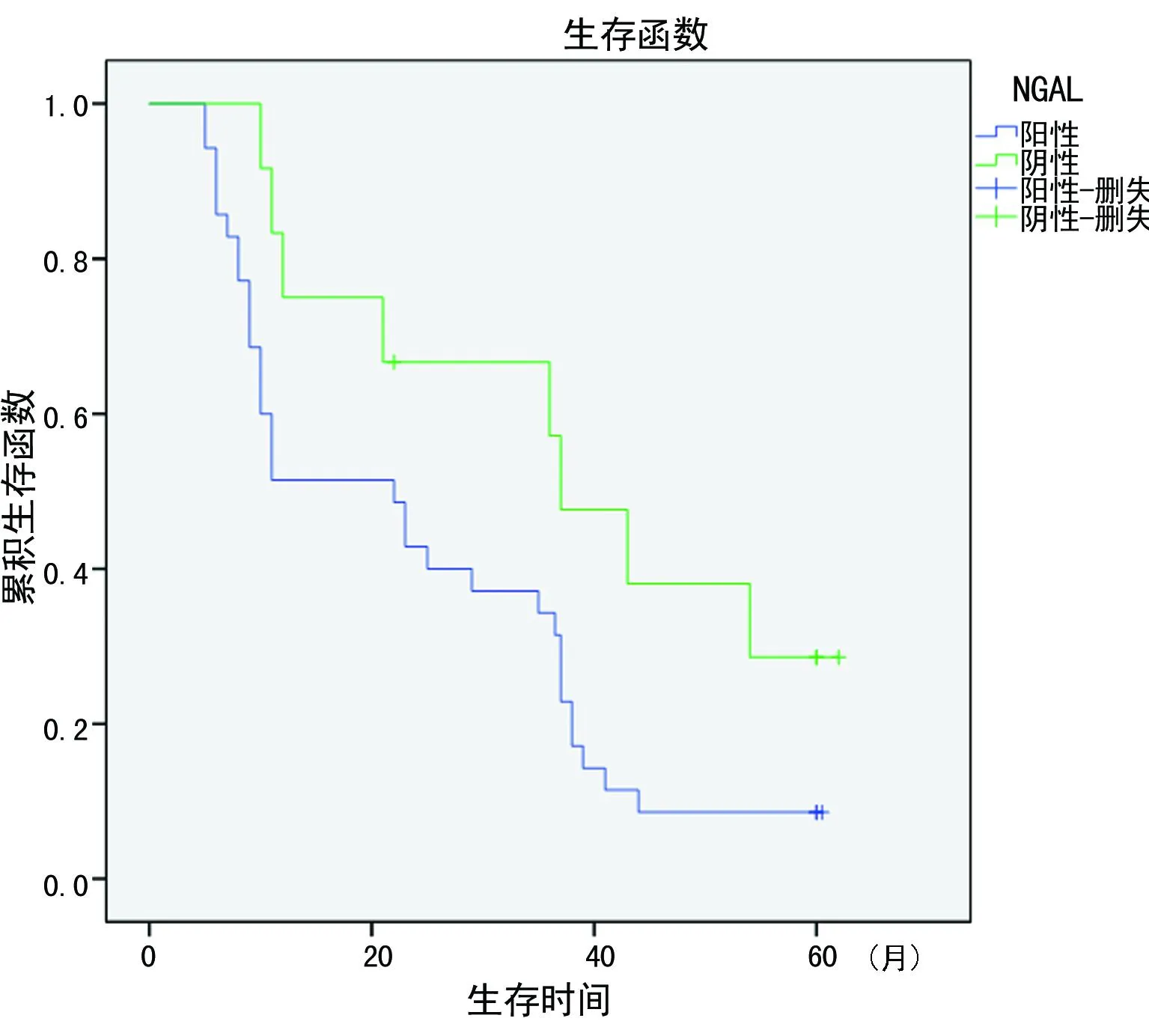
图1 不同血清NGAL水平的PHC患者的生存曲线
2.4生存分析对47例PHC患者进行5年随访调查,以血清NGAL≥24.50 ng/mL,MMP9≥268.50 ng/mL为阳性;血清中NGAL<24.50 ng/mL,MMP9<268.50 ng/mL为阴性。进行Kaplan-Meier生存分析,MMP9、NGAL阳性组及阴性组患者的中位生存期分别为22.0、37.0个月。生存曲线显示NGAL阳性表达者的生存时间明显低于阴性表达(P<0.05),而MMP9水平与患者生存时间无明显相关性(P>0.05),见图1、2。

图2 不同血清MMP9水平的肝癌患者的生存曲线
3讨论
我国是世界上的肝癌大国,肝癌患者总数占世界肝癌患者的55%[2],其病死率达26.26/100 000。肿瘤的侵袭和转移是导致患者死亡的重要原因。
肿瘤发生侵袭转移细胞外基质的降解是首要条件。基质金属蛋白酶(MMPs)是一组能够降解细胞外基质和基底膜成分的重要蛋白水解酶, MMP9又称明胶酶B(gelatinaso B) 作为MMPs家族中的重要一员。可与 MMP9 形成复合物,拮抗 TIMP-1 对 MMP9 的抑制作用,从而增加 MMP9 的活性,促进对细胞外基质的降解。此外,MMP9还可以促使血管内皮生长因子(VEGF)释放,增加肿瘤血管生成,促进肿瘤侵袭转移[3-4]。本研究发现,血清中MMP9水平在PHC组明显高于健康对照组,差异有统计学意义(P<0.05),且与肿瘤的临床分期密切相关,说明MMP9在肿瘤发生、发展中起着重要作用。
NGAL是在研究 MMP9 时发现的小分子蛋白,属于脂质运载蛋白超家族[1],其基因定位于染色体 9q34 上,全长为5 869 bp,其中包括 1 659 bp 的 5′端非转录区,178 bp 的 3′端非转录区,以及3 696 bp 的原初转录区[5]。NGAL 蛋白具有脂质运载蛋白家族的典型β-折叠桶(β-barrel)结构,它由连续氢键连接的8段反向平行的 β 折叠链构成的,其封闭端的 β4~β5环上有游离的硫基(C87),可与 MMP9 等蛋白分子形成二硫键,形成异源二聚体,再与金属蛋白酶组织抑制剂(TIMP-1)形成 NGAL/MMP9/TIMP-1 三元复合物,从而调节MMP9等分子的活性[6]。
近年研究发现,NGAL与多种肿瘤如胃癌、乳腺癌、结肠癌的发生、发展有关。Zhang等[7]已使用免疫组织化学法检测了138例肝癌患者组织中NGAL及其受体的表达。发现肝癌患者组织中NGAL及受体表达明显高于癌旁组织,二者表达与肿瘤的不良预后密切相关。Wang等[8]也发现胃癌组织中NGAL表达明显高于正常癌旁组织,其表达与肿瘤大小、Lauren′s 分级、淋巴结转移及血管浸润有关。而也发现患者血清中NGAL表达与临床病理分期有关,同时发现血清中NGAL表达比CA199和CEA更具有标志性,与患者预后更相关。而结直肠肿瘤NGAL基因的表达是否参与肿瘤浸润、转移尚不明确,Hu等[9]认为,NGAL可通过MMP9依赖及非MMP9依赖(铁依赖减少E-cadherin)的机制,减弱细胞间黏附,促进肿瘤血管形成、浸润和远处转移。本研究发现,血清中NGAL水平与临床病理分期密切相关,提示NGAL可能参与了肿瘤的浸润与转移,但也有人发现NGAL高表达于结肠癌组织中,但其淋巴结转移灶却未见表达,认为NGAL在转移过程中作用可能没有发挥主要作用[10], 在体外试验中,异常表达的NGAL可抑制结肠癌细胞的浸润及肝转移[11],NGAL可能不能作为腺瘤癌变的标志物[12]。
本研究提示,PHC组NGAL及MMP9水平明显高于健康对照组,差异有统计学意义(P<0.05)。Ⅲ~Ⅳ期NGAL、MMP9水平明显高于Ⅰ~Ⅱ期,经长期随访调查显示,血清中NGAL阳性的肝癌患者的生存率低于NGAL阴性的PHC患者,NGAL阳性患者的中位生存期明显低于NGAL阴性,提示血清中NGAL水平与患者的预后密切相关。血清MMP9水平与患者生存时间无明显相关性,可能与样本量偏小有关。ROC分析得出,单独检测血清NGAL、MMP9水平,其敏感度均较低,二者联合检测可明显提高其敏感度,而其特异度有所下降,可能由于血清 MMP9 和 NGAL 可在多种肿瘤中异常表达,故缺乏对于PHC特异性,但二者作为诊断及判断PHC预后的指标仍有一定的价值。
参考文献
[1]Kjeldsenl JA.Primary structure of NGAL.A novel protein associated with human neutrophil gelatinase[J].J Biol Chem,1993,268(14):10425-10432.
[2]Hepatol JG.Prevention of hepatocellular carcinoma in the Asia-Pacific region:consensus statements[J].J Gastroenterol Hepatol,2010,25(4):657-663.
[3]Nagase H,Visse R,Murphy G.Structure and function of matrix metalloproteinases and TIMPs[J].Cardiovasc Res,2006,69(3):562-573.
[4]Flannery CR.MMPs and ADAMTSs:functional studies[J].Front Biosci,2006(11):544-569.
[5]Cowland JB,Borregaard N.Molecular characterization and pattern of tissue expression of the gene for neutrophil gelatinase-associated lipocalin from humans[J].Genomics,1997,45(1):17-23.
[6]Coles M,Diercks T,Muehlenweg B,et al.The solution structure and dynamics of human neutrophil gelatinase-associated lipocalin[J].J Mol Biol,1999,289(1):139-157.
[7]Zhang Y,Fan Y,Mei Z.NGAL and NGALR overexpression in human hepatocellular carcinoma toward a molecular prognostic classification.[J].Cancer Epidemiology,2012,36(5):294-299.
[8]Wang HJ,He XJ,Ma YY,et al.Expressions of neutrophil gelatinase-associated lipocalin in gastric cancer:a potential biomarker for prognosis and an ancillary diagnostic test[J].Anat Rec (Hoboken),2010,293(11):1855-1863.
[9]Hu L,Hittelman W,Lu T,et al.NGAL decreases E-cadherin-mediated cell-cell adhesion and increases cell motility and invasion through Rac1 in colon carcinoma cells[J].Lab Invest,2009,89(5):531-548.
[10]Candido S,Maestro R,Polesel J,et al.Roles of neutrophil gelatinase-associated lipocalin (NGAL) in human cancer[J].Oncotarget,2014,5(6):1576-1594.
[11]Lee HJ,Lee EK,Lee KJ,et al.Ectopic expression of neutrophil gelatinase-associated lipocalin suppresses the invasion and liver metastasis of colon cancer cells[J].Int J Cancer,2006,118(10):2490-2497.
[12]Mclean MH,Thomson AJ,Murray GI,et al.Expression of neutrophil gelatinase-associated lipocalin in colorectal neoplastic progression:a marker of malignant potential?[J].Br J Cancer,2013,108(12):2537-2541.
Detection of peripheral NGAL and MMP9 levels and its clinical significance in primary hepatic carcinoma
Tang Chengjia,Yu Tianwu△
(DepartmentofHepatobiliarySurgery,theAffiliatedYongchuanHospitalofChongqingMedicalUniversity,Yongchuan,Chongqing404000,China)
[Abstract]ObjectiveTo explore the changes of matrix metalloproteinase 9(MMP9) and neutrophil gelatinase associated lipocalin(NGAL) in primary hepatic carcinoma and its clinical significance.MethodsEnzyme-linked immunosorbent assay (ELISA) was used to detect the serum level of MMP9 and NGAL in 47 patients with primary hepatic carcinoma and 19 healthy controls.The association between serum MMP9 and NGAL levels with the clinicopathological features of hepatic carcinoma were evaluated.ROC curves were used to analyze the influence of MMP9 and NGAL on the diagnostic value.Kaplan-Meier method was used to evaluate the relationship between the expressions of NGAL and MMP9 and the prognosis of patients with HCC.ResultsSerum MMP9 and NGAL levels in hepatic carcinoma patients are significantly higher compared with normal controls(P≤0.05).The serum level of MMP9 and NGAL in primary hepatic carcinoma was positively correlated with TNM stage(P≤0.05).The sensitivity and specificity of MMP9 and NGAL for primary hepatic carcinoma were 70.2% and 83.0%.The sensitivity of the joint detection were 94.9%.Kaplan Meier survival curves showed that cumulative survival rates of patients with positive expression of NGAL were significantly lower than those of patients with negative expression.ConclusionMMP9 and NGAL might play an important role in gastric cancer generation and development.Monitoring of serum MMP9 and NGAL levels might be helpful for diagnosis and evaluation of prognosis for primary hepatic carcinoma.
[Key words]primary hepatic carcinoma;NGAL;matrix metalloproteinase 9
作者简介:唐成佳(1985-),住院医师,硕士,主要从事肝脏肿瘤研究。△通讯作者,Tel:13996104299;E-mail:ytw0000@163.com。
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.17.017
[中图分类号]R735.7
[文献标识码]A
[文章编号]1671-8348(2016)17-2357-03
(收稿日期:2015-12-12修回日期:2016-02-02)

