生普洱与熟普洱茶中原花青素含量的比较分析
侯冬岩,刁全平,李铁纯,回瑞华,武晓英
(鞍山师范学院 化学与生命科学学院,辽宁 鞍山 114007)
生普洱与熟普洱茶中原花青素含量的比较分析
侯冬岩,刁全平,李铁纯,回瑞华,武晓英
(鞍山师范学院 化学与生命科学学院,辽宁 鞍山 114007)
摘要对生普洱与熟普洱茶中原花青素含量进行测定,通过条件实验确定了最佳提取条件,并建立了原花青素的光谱分析方法.方法的回收率为 96.7%~101%,相对标准偏差小于0.06 %.生普洱茶中原花青素的含量为56.34 mg/g,熟普洱茶中未检出原花青素.
关键词生普洱茶;熟普洱茶;原花青素
原花青素是植物中广泛存在的聚多酚类混合物,是一大类黄烷-3-醇衍生物的总称,主要由儿茶素的单体、二聚体、三聚体、十聚体等组合而成[1].近些年的研究表明,原花青素具有抗氧化、清除自由基、抑制肿瘤、抗诱变的能力[2~4],其抗氧化能力是VE的50倍,VC的20倍.近年来原花青素被广泛应用于保健品、药品、化妆品等领域.
目前,关于原花青素的测定方法还无统一标准,而文献报道的几种方法中,正丁醇法[5]受原花青素结构的影响较大,对于低聚合度原花青素的测定并不适宜,香草醛-硫酸法[6]由于硫酸的强氧化作用也使得测定结果偏低.本文在低浓度香草醛-盐酸法[7]基础上进行了改进,采用超声波法提取生普洱与熟普洱茶中原花青素,对提取条件进行了条件实验,对生普洱与熟普洱茶中原花青的含量进行比较分析.
1实验部分
1.1仪器与试剂
UV-036紫外分光光度计(美国Varian公司);RE-52C旋转蒸发器(上海亚荣生化仪器厂);KQ-250B型超声波清洗器(昆山市超声波仪器有限公司);离心机(上海安亭科学仪器厂).
原花青素标准品:天津市金测分析技术有限公司;甲醇、氯仿、乙酸乙酯、盐酸、香草醛等试剂均为分析纯.
1.2实验样品
勐海生普洱茶和勐海熟普洱茶,均产于云南.
1.3实验方法
1.3.1标准溶液配制精确称取0.010 g原花青素标准品,置于10 mL容量瓶中,加甲醇稀释溶解定容至刻度,得到浓度为1.00 mg/mL标准品储备液,摇匀,备用.
1.3.21%香草醛溶液精确称取1.000 g香草醛加甲醇溶解并稀释,置于100 mL容量瓶中定容至刻度,摇匀,备用.
1.3.38%盐酸溶液从浓盐酸中准确移取8.00 mL,定容至100 mL容量瓶中备用.
1.3.4样品前处理及样品溶液的制备[8]将茶样品粉碎,过0.45 mm的筛,得茶样品粉末.
准确称取茶样粉末2.00 g置于50 mL 锥形瓶中,加入10 mL 90%甲醇溶液,在20 ℃下超声提取4次,每次提取60 min,再放入离心机中,以3 000 r/min离心20 min后,合并提取液并从中准确移取1 mL提取液至10 mL容量瓶中,用90%甲醇定容,摇匀,作为样品储备液备用.
1.3.5原花青素吸收曲线的绘制及测定波长的确定准确移取1.3.1标准溶液1 mL,置于10 mL具塞试管中,加入5 mL1∶1混合的1%的香草醛-8%盐酸溶液,放入30 ℃的水浴中避光加热30 min,取出静置至室温,在波长400~800 nm范围内扫描,最大吸收波长为500 nm.
准确移取1.3.4样品储备液1 mL,置于10 mL具塞试管中,加入5 mL1∶1混合后的1%的香草醛-8%盐酸溶液,在30 ℃的水浴中避光加热30 min,后取出静置至室温,在波长400~800 nm范围内扫描,最大吸收波长为500 nm.原花青素可做为测定的标准品,测定波长为500 nm.

图1 原花青素标准品标准曲线
1.3.6标准曲线的绘制分别取1.00,1.50,3.00,4.50,6.00,7.50 mL的原花青素标准溶液于10 mL的容量瓶中,加入5 mL1∶1混合的1%的香草醛-8%盐酸溶液,放入30 ℃的水浴锅中避光加热30 min,取出静置至室温.在吸收波长为500 nm处测定A值,A与浓度关系的回归方程为:A=1.179 8×C-0.010 7,相关系数r=0.999 2,在0.20~1.50 mg/mL范围内,A与浓度C呈良好线性关系,如图1所示.
1.3.7测定方法两种茶样分别按1.3.4处理,在500 nm波长下分别测定其吸光度值,每个样品测定3次,按标准曲线法求出其原花青素的含量,结果列于表1.
2结果分析
2.1超声波法提取茶样中原花青素条件实验
2.1.1溶剂浓度的选择精确称取2.00 g粉碎后的茶样于50 mL锥形瓶中,分别加入10 mL浓度为60%,70%,80%,90%,95%和100%的甲醇溶液,在室温下超声20 min,取出放入离心机以3 000 r/min离心20 min,取出,从提取液中准确移取1 mL,用相应提取浓度的甲醇定容至10 mL容量瓶中,为样品提取储备液.从储备液中准确移取1 mL,置于10 mL具塞试管中,加入5 mL1∶1混合后的1%的香草醛-8%盐酸溶液,放入30 ℃的水浴锅中避光加热30 min,后取出静置至室温后在500 nm处测得吸光度A值,见图2.由图2可知:在甲醇浓度为80%时,吸光度值为最大.
2.1.2超声提取时间的选择精确称取2.00 g粉碎后的茶样于50 mL锥形瓶中,加入10 mL浓度为80%的甲醇溶液,在室温下以不同时间进行超声,取出放入离心机中以3 000 r/min离心20 min,取出,从提取液中准确移取1 mL定容至10 mL容量瓶中为样品提取储备液.从储备液中准确移取1 mL,置于10 mL具塞试管中,加入5 mL1∶1混合后的1%的香草醛-8%盐酸溶液,放入30 ℃的水浴锅中避光加热30 min,后取出静置至室温后在500 nm处测得吸光度A值,见图3.由图3可知,在相同的测定条件下,超声时间为50 min时测得的吸光度值为最大.
2.1.3超声提取次数的选择精确称取2.00 g粉碎后的茶样于50 mL锥形瓶中,加入10 mL浓度为80%的甲醇溶液,室温下分别超声提取1,2,3,4,5,6次,每次超声提取50 min,取出放入离心机中以3 000 r/min的速度离心20 min,合并提取液至250 mL圆底烧瓶中浓缩至10 mL,从提取液中准确移取1 mL定容至10 mL容量瓶中为样品提取储备液.从储备液中准确移取1 mL,置于10 mL具塞试管中,加入5 mL1∶1混合后的1%的香草醛-8%盐酸溶液,放入30 ℃的水浴锅中避光加热30 min,后取出静置至室温后在500 nm处测得吸光度值,如图4.

图2 不同浓度甲醇的选择 图3 超声提取时间对原花青素提取率的影响
由图4可知,在相同的条件下,超声次数为5次时,样品吸光度值为最大.2.1.4超声提取温度的选择精确称取2.00 g粉碎后的茶样于50 mL锥形瓶中,加入10 mL浓度为80%的甲醇溶液,在不同温度进行超声,超声后放入离心机中以3 000 r/min离心20 min合并提取液至250 mL圆底烧瓶中浓缩至10 mL,从提取液中准确移取1 mL定容至10 mL容量瓶中为样品提取储备液.从储备液中准确移取1 mL,置于10 mL具塞试管中,加入5 mL1∶1混合后的1%的香草醛-8%盐酸溶液,放入30 ℃的水浴锅中避光加热30 min,后取出静置至室温后在500 nm处测得吸光度A值,见图5.

图4 超声提取次数对原花青素提取率的影响 图5 超声提取温度对原花青素提取率的影响
由图5可知,在相同的测定条件下,超声温度为40 ℃时测得的吸光度值为最大.
条件实验结果表明,最佳提取条件为:超声温度40 ℃、超声次数5次、超声时间50 min、甲醇溶剂浓度为80%.
2.2样品稳定性实验
用1.3.4的方法配制茶样品进行稳定性实验,结果表明:样品放置120 min,测得其吸光度值基本不变.

表1 方法精密度
2.3方法精密度实验
按1.3.5的测定条件,制备一定浓度的标准品溶液,测定9次,求得其标准偏差及变异系数,结果列于表1.
2.4方法回收率实验
取1.3.4相同浓度的样品,按标准加入法加入3个不同浓度的原花青素标准品溶液,测定A值,计算回收率,结果见表2.
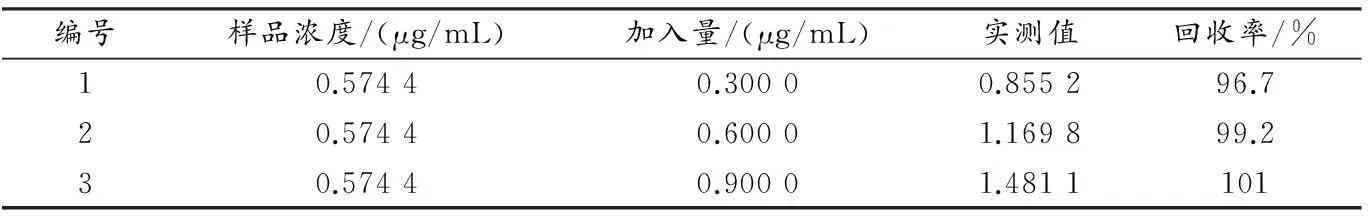
表2 方法回收率
2.5样品中原花青素含量的测定
将茶样在500 nm波长下分别测定其吸光度值,按标准曲线法定量分析出其中所含原花青素的含量,结果列于表3.
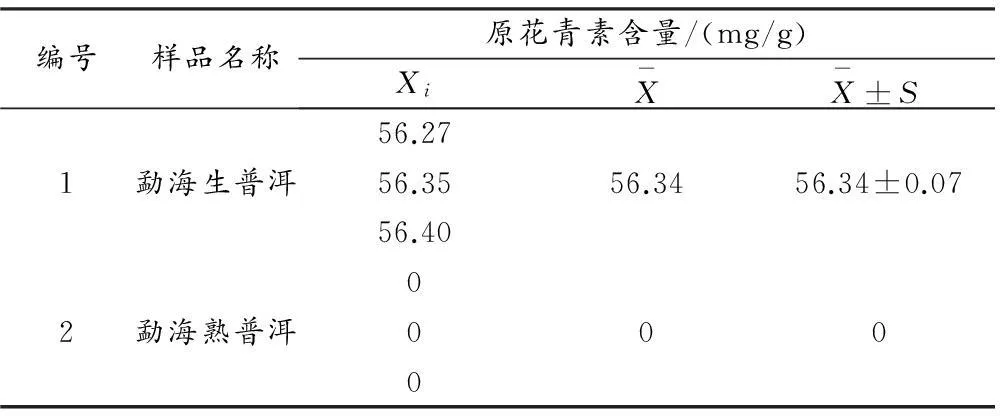
表3 原花青素的含量
3结论
实验结果表明,生普洱茶中原花青素的含量为56.34 mg/g,熟普洱茶中未检测出含有原花青素.
生普洱茶是由鲜采茶叶经杀青、掇捻、干燥后而成.熟普洱茶是生普洱茶经过“渥堆”工序,通过湿熟作用,以人工方式速成发酵.实验结果可知熟普洱茶在发酵过程中使原花青素的含量减少.
目前国内外的研究仅限于对葡萄、山楂、银杏、高粱等植物中原花青素的研究[2~4],对于茶叶中原花青素的研究少见报道.因此对茶叶中原花青素含量的分析很有必要,可以丰富我国原花青素的天然植物资源,并且对茶叶中化学成分的分析及其进一步的开发利用起到一定推动作用.
参考文献
[1] 李凤英,崔蕊静,郑立红,等.植物中原花青素含量的分析测定[J].分析与检测,2004,30(5):147-149.
[2] 吕丽爽,曹栋.葡萄籽低聚原花青素抗氧化性的研究[J].食品科技,2000(4):41-42.
[3] 凌智群,张晓辉,谢笔钢,等.原花青素的药理学研究进展[J].中国药理学通报,2002,18(1):9-12.
[4] 赵超英.葡萄籽提取原花青素的营养保健功能[J].中国食品卫生杂志,2000,12(6):38-41.
[5] Porter L,Hrstich L,Chan B.The conversion of procyanidins and prodelphinidins to cyanidins and delphinidins[J].Phytochemistry,1986,25:223-2303.
[6] Deshpande S,Cherycm M.Evaluation of vanillinassy for tannin analysis of dry beans[J].J Food Sci,1985,50:905-910.
[7] 李春阳,许时婴,王璋.低浓度香草醛-盐酸法测定葡萄籽、梗中原花青素含量的研究[J].食品工业科技分析检测,2004,25(6):128-130.
[8] 侯冬岩,回瑞华,刘晓媛.黑茶黄酮的光谱分析及抗氧化性能研究[J].鞍山师范学院学报,2009,11(4):21-24.
(责任编辑:陈欣)
The comparative analysis of procyanidins content in raw pu-erh tea and cooked pu-erh tea
HOU Dongyan,DIAO Quanping,LI Tiechun,HUI Ruihua,WU Xiaoying
(School of Chemistry and Life Science,Anshan Normal University,Anshan Liaoning 114007,China)
AbstractRaw pu-erh tea and cooked pu-erh tea procyanidins content were determined,the best extraction conditions were determined by condition experiments,procyanidins spectrum analysis method is established.Method of recovery is 96.7%~101%,relative standard deviation less than 0.06%.Compare the raw pu-erh tea and cooked pu-erh tea procyanidins content.
Key wordsraw pu-erh tea;cooked pu-erh tea;procyanidins
收稿日期2016-02-20
基金项目辽宁省教育厅科学技术基金资助课题(20331079).
作者简介侯冬岩(1962-),男,吉林省吉林市人,鞍山师范学院化学与生命科学学院教授,主要从事天然功能食品科学研究.
中图分类号O657.3
文献标识码A文章篇号1008-2441(2016)02-0037-04

