表皮生长因子对牦牛卵丘细胞低氧诱导因子-1α表达的影响及与凋亡的关联性分析
张译夫,潘阳阳,温泽星,余四九
(甘肃农业大学 动物医学院 甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
表皮生长因子对牦牛卵丘细胞低氧诱导因子-1α表达的影响及与凋亡的关联性分析
张译夫,潘阳阳,温泽星,余四九*
(甘肃农业大学 动物医学院 甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
旨在研究EGF是否通过调控HIF-1α抑制牦牛卵丘细胞凋亡。本研究在牦牛卵丘细胞体外培养时加入不同浓度的EGF,运用qRT-PCR和免疫荧光技术检测HIF-1α、Bcl-2和Bax的表达,用一步法TUNEL检测不同处理组卵丘细胞的凋亡情况。结果表明:(1)牦牛卵丘细胞体外培养液中添加不同浓度的EGF后,卵丘细胞HIF-1α和BaxmRNA的相对表达量降低,Bcl-2 mRNA的相对表达量增加,且具有浓度依赖性;当EGF浓度为50 ng·mL-1时,HIF-1α和BaxmRNA的相对表达量最低,Bcl-2 mRNA的相对表达量最高。(2)向其体外培养液中添加不同浓度的EGF后,卵丘细胞HIF-1α和Bax蛋白的相对表达量降低,Bcl-2蛋白的相对表达量增加,且具有浓度依赖性;当EGF浓度为50 ng·mL-1时,HIF-1α和Bax蛋白的相对表达量最低,Bcl-2蛋白的相对表达量最高。(3)TUNEL凋亡检测表明,对照组中卵丘细胞凋亡率最高,当EGF浓度为25 ng·mL-1时,细胞凋亡率显著降低(P<0.05);当EGF浓度为50 ng·mL-1时,细胞凋亡率最低(P<0.05),但随着EGF浓度的增加,卵丘细胞的凋亡率又升高。本研究结果表明,EGF可通过调控HIF-1α抑制卵丘细胞凋亡,其作用可能与线粒体介导的Bax和Bcl-2凋亡途径相关。
表皮生长因子(EGF);低氧诱导因子-1α(HIF-1α);凋亡;卵丘细胞;牦牛
哺乳动物卵巢上存在数百万的各级卵泡,但在卵泡生长过程中,除少量卵泡可以发育成熟排卵外,其余大部分卵泡都将闭锁退化[1-2]。多数动物胎儿的原始卵泡、初级卵泡闭锁主要是由卵母细胞凋亡引起,而成体卵泡闭锁主要是卵丘细胞凋亡诱导的结果,卵丘细胞的凋亡程度与卵母细胞的成熟状态和发育潜能呈正相关[3-4]。成熟的卵母细胞是体外受精、体细胞核移植胚胎生产的先决条件[5-6],而卵丘细胞(Cumulus cells,CCs)在卵母细胞成熟过程中发挥着重要的生物学作用[7]。研究发现,CCs可通过与卵母细胞的缝隙连接,以旁分泌的方式将其他蛋白或生物学分子传递于卵母细胞进而影响其发育和成熟[6,8]。CCs的扩散程度、细胞数量、细胞质量及形态均会影响到卵母细胞发育能力[7,9]。卵母细胞和卵丘细胞之间的关系是相互的,卵母细胞分泌的一些重要的因子,通过旁分泌作用促进卵丘细胞增生、分化及调节其功能,二者之间相互作用共同调节卵泡的发育[10]。由于卵母细胞与卵丘细胞之间的密切关系,有研究表明,卵丘细胞凋亡引起的卵泡闭锁会影响到卵母细胞的后期发育潜能[11],卵母细胞的发育成熟情况影响后续胚胎的卵裂率及囊胚率[12]。
表皮生长因子(Epidermal growth factor,EGF)最早是从小鼠颌下腺中分离出来的一种多肽类物质,在细胞增殖和分化中起重要作用。EGF可通过多种信号途径调节相关基因转录表达,抑制多种类型细胞凋亡,促进细胞增殖和分化,从而发挥抑制凋亡的生物学效应,细胞凋亡途径很多,如线粒体介导的细胞凋亡途径中的B-细胞淋巴瘤/白血病-2原癌基因(B-cell lymphoma/Leukemia-2,Bcl-2)。Bcl-2作为抗凋亡蛋白重要成员,在细胞中主要结合B细胞淋巴瘤/白血病基因伴随x蛋白(B-cell lymphoma/Leukemia associated x protein,Bax)而抑制凋亡发生[13]。目前发现低氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α)的靶基因有100多个。P.Carmeliet等[14]研究发现,HIF-1α与Bcl-2、p53因子的表达存在密切关系,由于低氧应激可以导致许多生物障碍,HIF-1α在调控细胞生长和凋亡可能具有普遍的病理生理学意义。G.L.Wang等[15]研究发现,HIF-1是通过抑制Bcl-2表达的信号途径来促进神经细胞凋亡的。HIF-1α也可能在心肌Bcl-2、Bax的表达调节中发挥作用,进而调节细胞凋亡的发生[16]。
牦牛是生活在海拔最高处的哺乳动物,主要产于中国青藏高原海拔3 000 m以上地区。牦牛生产能力低下,繁殖活动具有明显的季节性,妊娠期为250~260 d,本具有一年产一胎的能力,但是由于生存环境等相关因素的影响,牦牛的实际繁殖能力一般仅为两年一胎或三年两胎[17]。因此,本研究以牦牛卵丘细胞为研究对象,检测不同浓度EGF对其凋亡的影响,并分析了EGF对HIF-1α及凋亡相关基因Bax、Bcl-2表达的影响,以探讨EGF抑制牦牛卵丘细胞凋亡的相关分子机制,为进一步阐明EGF在卵母细胞成熟及早期胚胎发育机制中的作用提供理论依据。
1 材料及方法
1.1主要试剂
DMEM/F12、胎牛血清(FBS)、PBS及双抗(PS)购自Gibco公司(美国);表皮生长因子(EGF)、胰蛋白酶购自Sigma公司(美国);HIF-1α抗体(bs-0737R)、Bax抗体(bs-0127R)、Bcl-2抗体(bs-0032R)及荧光二抗(bs-0295G-FITC)购自博奥森(北京);微量RNA提取试剂盒、两步法反转录试剂盒及PCR Mix购自Promega(美国);SYBR Green Ⅱ荧光定量PCR试剂盒(TaKaRa,大连);一步法TUNEL细胞凋亡检测试剂盒(产品编号:C1088)、免疫荧光检测所用试剂均购自南京碧云天生物公司;其他试剂均为国产分析纯。
1.2样品采集
牦牛卵巢样品采自青海省西宁市乐家湾屠宰场,采样时间为9~11月份,将采集的卵巢置于30~35 ℃的含PS的无菌生理盐水中,于6 h内带回实验室。
1.3卵丘细胞的分离及培养
参照潘阳阳等[18]的方法,并适当修改。将采集回来的卵巢用预先37 ℃平衡2 h的生理盐水清洗3次,用12号针头抽取卵巢表面直径2~10 mm卵泡中的卵泡液,体视显微镜下挑选出胞质均匀且含3层以上卵丘层的卵丘卵母细胞复合体(COC);震荡器震荡2 min后,收集分散的卵丘细胞,1 000 r·min-1离心5 min,弃上清。然后用培养液(90%DMEM/F12 +1% PS+9% FBS)离心洗涤2次,置25 mm2的培养瓶悬浮培养。
1.4EGF作用卵丘细胞
取第2代卵丘细胞,培养至指数生长期,用0.05%的胰蛋白酶消化,台盼蓝染色检测细胞存活率达80% 以上时,调整细胞密度为4×105个,接种到六孔板中于5% CO2、37 ℃培养,待细胞生长稳定后,撤除血清,加入EGF。分别设阴性对照组(不加EGF,即0 ng·mL-1)和EGF处理组(EGF终浓度分别为25、50、100和200 ng·mL-1),重复5次,EGF处理时间根据预试验确定为24 h,分别收集处理细胞用于后续试验。
1.5总RNA提取,反转录及PCR扩增
每个处理组随机收集4孔,PBS清洗3次后,微量RNA提取试剂盒提取总RNA,两步法反转录试剂盒合成第一链cDNA。PCR反应体系为20 μL:1 μL cDNA(200 ng·μL-1),上下游引物各0.5 μL(0.2 μmol·mL-1),PCR Mix 10 μL,ddH2O 8 μL。取10 μL PCR产物,用1%琼脂糖凝胶电泳检测(120 V,20 min),紫外灯下观察,并利用凝胶成像系统采集图像,确定引物特异性。
1.6qRT-PCR 检测HIF-1α、Bax和Bcl-2 mRNA的表达
根据GenBank公布的牛HIF-1α、Bax和Bcl-2的mRNA序列设计引物,引物具体信息见表1,引物序列由上海生工生物工程股份有限公司合成。反应体系为1 μL cDNA(200 ng·μL-1),上下游引物各0.4 μL(0.2 μmol·mL-1),2×SYBR Green II PCR mix 10 μL,Passive Reference Dye II 0.4 μL,ddH2O 7.8 μL,总反应体系为20 μL。反应条件:95 ℃预变性10 s;95 ℃变性10 s、退火10 s(退火温度见表1 )、72 ℃延伸 10 s,共34个循环,每个样品重复5次。根据熔解曲线判断反应的特异性,获得每个样品的CT值,采用2-ΔΔCT法计算目的基因的相对表达量,试验重复5次。
表1引物信息
Table 1The information of primers
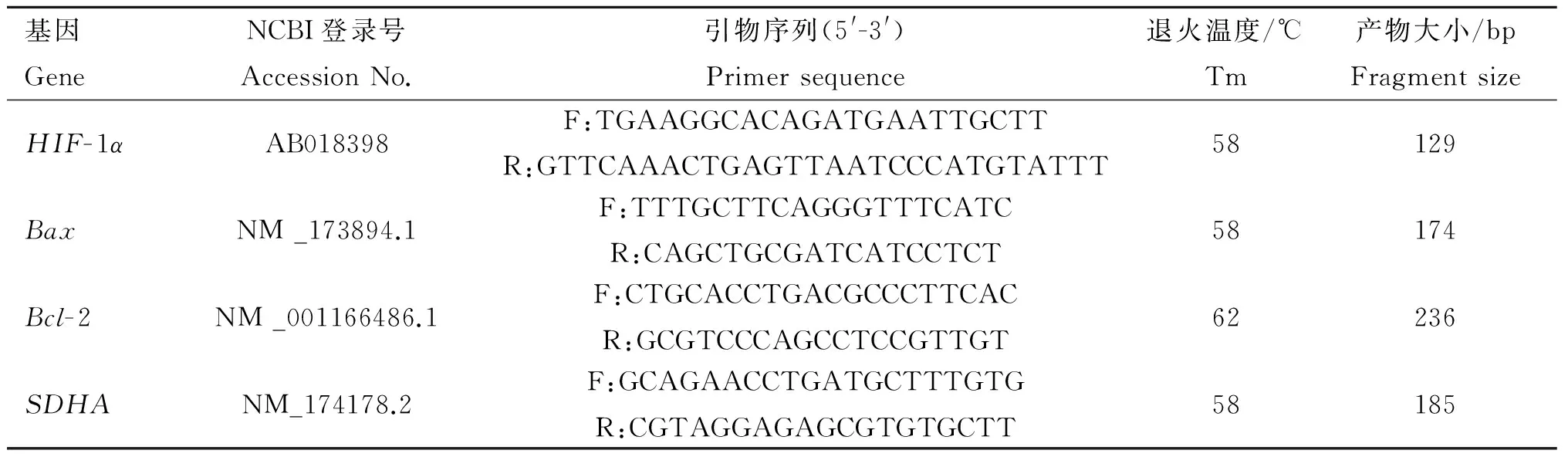
基因GeneNCBI登录号AccessionNo.引物序列(5'-3')Primersequence退火温度/℃Tm产物大小/bpFragmentsizeHIF-1αAB018398F:TGAAGGCACAGATGAATTGCTTR:GTTCAAACTGAGTTAATCCCATGTATTT58129BaxNM_173894.1F:TTTGCTTCAGGGTTTCATCR:CAGCTGCGATCATCCTCT58174Bcl-2NM_001166486.1F:CTGCACCTGACGCCCTTCACR:GCGTCCCAGCCTCCGTTGT62236SDHANM_174178.2F:GCAGAACCTGATGCTTTGTGR:CGTAGGAGAGCGTGTGCTT58185
HIF-1α、Bax和Bcl-2.目的基因;SDHA.内参基因
HIF-1α,BaxandBcl-2.The purpose genes;SDHA.Reference gene
1.7 免疫细胞荧光染色检测HIF-1α、Bax及Bcl-2蛋白的分布
将细胞用PBS 清洗3 遍后,加入固定液室温固定30 min,然后用免疫染色洗涤液洗3遍,用含0.2% TritonX-100免疫染色封闭液封闭1 h,加入一抗,4 ℃孵育过夜(对照组用PBS代替一抗),洗3遍后,置于FITC 标记的二抗中,室温避光孵育1 h,清洗3 遍后,DAPI染色3~5 min。荧光显微镜观察并拍照。使用Imagepro-Plus 6.0对荧光照片进行平均光密度(Mean density)分析,选择测量参数IOD和area,读取IOD SUM及area SUM数据,根据mean density=(IOD SUM)/(area SUM),即为图片中细胞的平均荧光强度值。
1.8一步法TUNEL细胞凋亡检测
将贴壁的细胞用PBS洗涤1次,4%多聚甲醛固定30~60 min后,PBS再洗涤1次,0.1%TritonX-100冰浴2 min,PBS洗涤2次。每个样品加入50 μL的TUNEL检测液,37 ℃避光孵育60 min,PBS洗涤3次后,置于荧光显微镜下拍照。
1.9数据分析
采用SPSS 19.0统计软件对数据进行单因素方差分析,每组至少重复3次。P<0.05表示差异显著。
2 结 果
2.1引物特异性的确定
对PCR产物进行1% 琼脂糖凝胶电泳检测,HIF-1α、Bax、Bcl-2及内参基因SDHA均出现与目的片段大小相同的片段(图1)。扩增效率曲线表明扩增效果良好,经熔解曲线分析HIF-1α、Bax、Bcl-2及内参基因SDHA分别出现单一产物峰(图2)。
图1 EGF不同作用浓度组牦牛卵丘细胞HIF-1α、Bax、Bcl-2及SDHA 的PCR电泳产物检测Fig.1 The PCR products of HIF-1α,Bax,Bcl-2 and SDHA in yak cumulus cells in different groups

图2 HIF-1α、Bax、Bcl-2及SDHA基因的熔解曲线Fig.2 The melting curves of HIF-1α,Bax,Bcl-2 and SDHA genes
2.2EGF对牦牛卵丘细胞HIF-1α、Bax和Bcl-2 mRNA表达的影响
如图3所示,加入不同浓度的EGF后,HIF-1αmRNA的相对表达量发生显著变化。其中50 ng·mL-1EGF处理组,HIF-1αmRNA相对表达量最低,且与25 ng·mL-1EGF组差异不显著;100 ng·mL-1EGF处理组与0 ng·mL-1EGF处理组的相对表达量差异不显著,200 ng·mL-1EGF处理组的相对表达量最高。不同EGF浓度处理组Bax、Bcl-2 mRNA相对表达量检测显示(图3),对照组中,Bax的相对表达量最高,而Bcl-2的相对表达量最低;EGF作用浓度为25 ng·mL-1时,Bax的相对表达量较低,而Bcl-2的相对表达量较高;在EGF作用浓度为50 ng·mL-1时,Bax的相对表达量最低,而Bcl-2的相对表达量最高;EGF作用浓度为100 ng·mL-1时,Bax和Bcl-2的相对表达量与50 ng·mL-1浓度的相对表达量差异不显著;200 ng·mL-1EGF作用浓度组,Bax的相对表达量显著高于100 ng·mL-1组(P<0.05),Bcl-2的相对表达量显著低于100 ng·mL-1组,都与对照组差异不显著。

组间比较,不同上标表示差异显著(P<0.05)Comparison among groups,different superscripts mean significant difference (P<0.05)图3 不同浓度EGF对牦牛卵丘细胞HIF-1α、Bax和Bcl-2基因表达的影响Fig.3 Effect of different concentration of EGF on HIF-1α, Bax and Bcl-2 mRNA expression
2.3EGF对牦牛卵丘细胞HIF-1α、Bax和Bcl-2蛋白表达的影响
对加入不同浓度EGF的牦牛卵丘细胞进行HIF-1α、Bax和Bcl-2蛋白免疫荧光染色检测如图4所示:所有的牦牛卵丘细胞均表达HIF-1α、Bax和Bcl-2蛋白,且主要位于细胞核中,而细胞质中荧光较弱。图4的量化分析结果如图5所示:HIF-1α蛋白在50 ng·mL-1EGF作用组相对表达量最低,且与100 ng·mL-1EGF组差异不显著;25 ng·mL-1EGF处理组HIF-1α 蛋白的相对表达量显著高于50 ng·mL-1EGF组(P<0.05);200 ng·mL-1EGF处理组HIF-1α 蛋白的相对表达量显著高于其他组(P<0.05),但与对照组差异不显著;对照组Bax蛋白相对表达量最高,25 ng·mL-1EGF组Bax蛋白相对表达量降低(P<0.05),在EGF为50 ng·mL-1浓度表达量最低(P<0.05),100 ng·mL-1EGF组Bax蛋白相对表达量与50 ng·mL-1EGF组差异不显著,200 ng·mL-1EGF组与对照组差异不显著;对照组Bcl-2蛋白相对表达量最低,25 ng·mL-1EGF组Bcl-2蛋白相对表达量显著增加(P<0.05),Bcl-2在50 ng·mL-1EGF作用组蛋白相对表达量最高(P<0.05),100 ng·mL-1EGF组Bcl-2蛋白的相对表达量有所降低,但与50 ng·mL-1EGF组差异不显著,200 ng·mL-1EGF处理组的相对表达量与对照组差异不显著。
2.4EGF对牦牛卵丘细胞凋亡的抑制作用
对不同处理组细胞进行TUNEL凋亡检测,如图6、表2所示,对照组中卵丘细胞凋亡率最高,为(73.14±4.72)%;25 ng·mL-1EGF组细胞凋亡率显著降低,为(62.85±4.38)% (P<0.05);50 ng·mL-1EGF组,细胞凋亡率最低,为(48.32±2.16)% (P<0.05),与100 ng·mL-1EGF组细胞凋亡率(51.25±1.84)%差异不显著;200 ng·mL-1EGF组细胞凋亡率显著高于100 ng·mL-1EGF组细胞凋亡率,为(71.06±3.63)%,与对照组凋亡率差异不显著。
表2EGF对牦牛卵丘细胞凋亡的抑制作用
Table 2Effects of EGF on apoptosis of yak cumulus cells
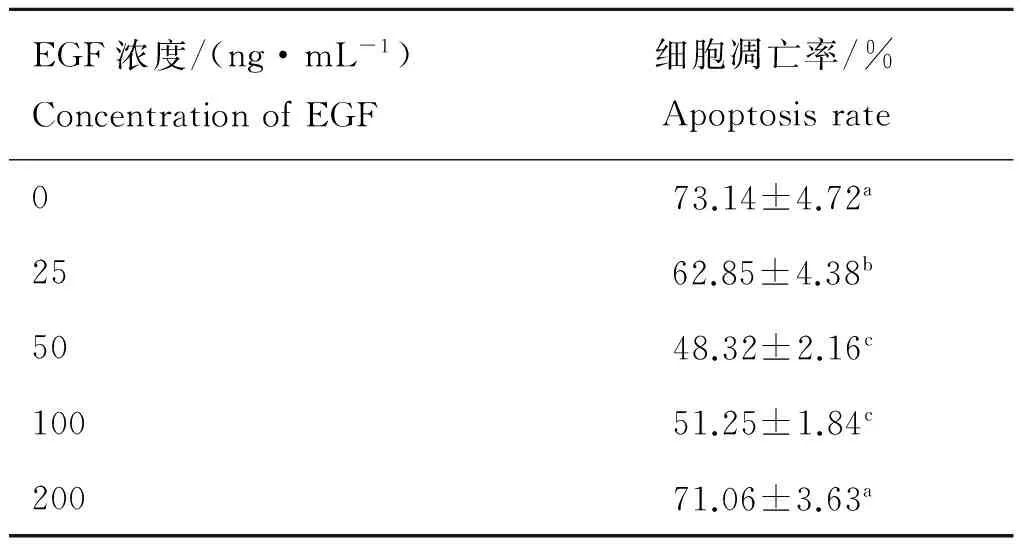
EGF浓度/(ng·mL-1)ConcentrationofEGF细胞凋亡率/%Apoptosisrate073.14±4.72a2562.85±4.38b5048.32±2.16c10051.25±1.84c20071.06±3.63a
同一列中不同字母表示差异显著(P<0.05)
The different letters in the same column mean significant difference (P<0.05)
3 讨 论
卵母细胞成熟过程中,包围其周围的卵丘细胞可通过分泌一系列蛋白调控卵母细胞质量,甚至影响后期胚胎的发育[19]。同时卵丘细胞在胚胎体外培养过程中,常作为共培养体系细胞,质量完好的卵丘细胞可提高胚胎的发育能力[20]。综上表明,卵丘细胞的质量对卵母细胞的成熟和早期胚胎发育具有至关重要的作用。
EGF作为重要的细胞因子可促进细胞的分化和增殖[21]。研究发现,EGF对多数哺乳动物的卵母细胞成熟具有促进作用[22],包括牛[23]、水牛[24]和绵羊[25]。由于对卵母细胞进行裸卵培养时,添加EGF并未促进卵母细胞成熟,表明这种作用通过卵丘层细胞介导完成[21]。
牦牛长期生活在低氧的环境,其细胞体外培养必然对氧刺激更加敏感。HIF是缺氧应答中起核心作用的转录应答因子,目前发现,HIF-1α的靶基因有100多个。EGF可以抑制低氧导致的人胚胎滋养层细胞凋亡,且主要的调控基因为Bax和P53[23,26]。而Bax为Bcl-2家族促凋亡成员,其作用可导致细胞线粒体外膜造成损伤,并释放凋亡蛋白进一步促进内质网释放Ca2+[27]。Bax蛋白过表达加速细胞凋亡进程,Bcl-2 作为凋亡抑制基因,Bcl-2 蛋白表达能够阻止多种刺激因素引起的细胞凋亡[28]。

A~E.0 、25、50、100和200 ng·mL-1;绿色荧光分别为HIF-1α、Bax和Bcl-2蛋白标记,DAPI为细胞核标记A-E.0,25,50,100 and 200 ng·mL-1;The HIF-1α,Bax and Bcl-2 protein were stained with green fluorescence,nuclei were stained with DAPI图4 牦牛卵丘细胞HIF-1α、Bax和Bcl-2蛋白的免疫荧光染色结果(Bar=200 μm )Fig.4 The detection of HIF-1α,Bax and Bcl-2 protein on yak cumulus cells by method of immunofluorescence (Bar=200 μm )

组间比较,不同上标表示差异显著(P<0.05)Comparison among groups,different superscripts mean significant difference (P<0.05)图5 不同浓度EGF对牦牛卵丘细胞HIF-1α、Bax及Bcl-2蛋白表达的影响Fig.5 Effect of different concentration of EGF on HIF-1α,Bax and Bcl-2 protein expression
本研究首次分析EGF对牦牛卵丘细胞的凋亡调控及机制,在牦牛卵丘细胞培养液中加入不同浓度的EGF后,HIF-1α、Bax和Bcl-2 mRNA和蛋白的相对表达均发生了改变,且与细胞凋亡程度密切相关,而HIF-1α、Bax和Bcl-2蛋白主要分布于卵丘细胞的胞核中。随着EGF浓度的增加,HIF-1α和BaxmRNA及蛋白的相对表达量随之降低,Bcl-2 mRNA和蛋白的相对表达量随之升高,细胞的凋亡率也随之降低;当EGF浓度为50 ng·mL-1时,HIF-1α和BaxmRNA及蛋白的相对表达量最低,而Bcl-2 mRNA和蛋白的相对表达量最高,细胞的凋亡率也最低;当EGF浓度增大后,其作用效果反而有所减弱。一步法TUNEL细胞凋亡检测结果显示,EGF可明显降低细胞的凋亡率,且具有剂量依赖性,在50 ng·mL-1EGF组凋亡率最低,EGF浓度继续增大后,凋亡率高于50 ng·mL-1EGF组,低于对照组的凋亡率。可见EGF可降低牦牛卵丘细胞HIF-1α的表达,降低Bax的表达,提高Bcl-2的表达,降低细胞凋亡率,最佳作用浓度为50 ng·mL-1,其结果将为阐明EGF对卵母细胞成熟及早期胚胎的发育机制提供理论依据。

A~E.0、25、50、100和200 ng·mL-1;F.空白对照。绿色荧光为凋亡标记A-E.0,25,50,100 and 200 ng·mL-1;F.Blank control.Apoptotic marker was stained with green fluorescence图6 不同处理组牦牛卵丘细胞凋亡检测 (Bar=100 μm)Fig.6 Detection the apoptosis of yak cumulus cells in different groups (Bar=100 μm)
4 结 论
牦牛卵丘细胞体外培养中添加EGF可降低HIF-1α及Bax的表达,提高Bcl-2的表达,降低细胞凋亡率,且其作用浓度具有剂量依赖性,最佳浓度为50 ng·mL-1。证明EGF可通过调控HIF-1α抑制卵丘细胞凋亡,其作用可能是通过影响线粒体介导的Bax和Bcl-2凋亡途径实现的。本研究为阐明EGF抑制卵丘细胞凋亡的分子机制提供了新的依据,为进一步揭示EGF在卵母细胞成熟及早期胚胎发育过程中的作用机制提供理论基础。
[1]BAKER T G.A quantitative and cytological study of germ cells in the human ovaies [J].ProcRSocLondBBiolSci,1963,158:417-433.
[2]BYSKOV A G.Follicular at resia.In:Jones R E,ed.The vertebrate ovary [M].New York:Plenum Press,1978:533-562.
[3]李海军,靳木子,张睿彪,等.卵丘细胞凋亡与增殖对牛卵母细胞体外发育的影响[J].中国农业科学,2011,44(8):1702-1709.
LI H J,JIN M Z,ZHANG R B,et al.Effect of cumulus cells apoptosis and proliferation on the bovine oocyte developmentinvitro[J].ScientiaAgriculturaSinica,2011,44(8):1702-1709.(in Chinese)
[4]HUGHES F M J R,GOROSPE W C.Biochemical identification of apoptosis (programmed cell death) in granulosa cells:evidence for a potential mechanism underlying follicular atresia [J].Endocrinology,1991,129(5):2415-2422.
[5]GILCHRIST R B,LANE M,THOMPSON J G.Oocyte-secreted factors:regulators of cumulus cell function and oocyte quality[J].HumReprodUpdate,2008,14(2):159-177.
[6]LOURENÇO B,SOUSA A P,ALMEIDA-SANTOS T,et al.Relation of cumulus cell status with single oocyte maturity,fertilization capability and patient age[J].JReprodInfertil,2014,15(1):15-21.
[7]UYAR A,TORREALDAY S,SELI E.Cumulus and granulosa cell markers of oocyte and embryo quality[J].FertilSteril,2013,99(4):979-997.
[8]LISLE R S,ANTHONY K,RANDALL M A,et al.Oocyte-cumulus cell interactions regulate free intracellular zinc in mouse oocytes[J].Reproduction,2013,145(4):381-390.
[9]YERUSHALMI G M,SALMON-DIVON M,YUNG Y,et al.Characterization of the human cumulus cell transcriptome during final follicular maturation and ovulation[J].MolHumReprod,2014,20(8):719-735.
[10]EPPIG J J.Growth and development of the mammalian oocyte granulosa cell complex in culture.In:Trounson A O & Gosden R G (eds).Biology and pathology of oocyte[M].Cambridge:CUP,2003:273-282.[11]HØST E,GABRIELSEN A,LINDENBERG S,et al.Apoptosis in human cumulus cells in relation to zona pellucida thickness variation,maturation stage,and cleavage of the corresponding oocyte after intracytoplasmic sperm injection [J].FertilSteril,2002,77(3):511-515.
[12]MAKAREVICH A V,MARKKULA M.Apoptosis and cell proliferation potential of bovine embryos stimulated with insulin-like growth factor I duringinvitromaturation and culture [J].BiolReprod,2002,66(2):386-392.
[13]LEIBOWITZ B,YU J.Mitochondrial signaling in cell death via theBcl-2 family[J].CancerBiolTher,2010,9(6):417-422.
[14]CARMELIET P,DOR Y,HERBERT J M,et al.Role of HIF-1α in hypoxia-mediated apoptosis,cell proliferation and tumor angiogenesis[J].Nature,1998,394(6692):485-490.
[15]WANG G L,JIANG B H,RUE E A,et al.Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2tension [J].ProcNatlAcadSciUSA,1995,92(12):5510-5514.
[16]洪欣,董宏彬,杜宏伟,等.低氧及低氧预处理时心肌细胞HIF-1α与凋亡相关蛋白表达的变化[J].中国应用生理学杂志,2005,21(4):423-426.HONG X,DONG H B,DU H W,et al.Changes in expression of apoptosis correlative proteins and HIF-1 during acute hypoxia and hypoxic preconditioning in cultured cardiomyocyte of rat[J].ChineseJournalofAppliedPhysiology,2005,21(4):423-426.(in Chinese)[17]YU S J,HUANG Y M,CHEN B X.Reproductive patterns of the yak.III.Levels of progesterone and oestradiol-17 beta during pregnancy and the periparturient period[J].BrVetJ,1993,149(6):595-602.
[18]潘阳阳,崔燕,樊江峰,等.胰岛素样生长因子-1(IGF-1)对牦牛卵丘细胞热休克蛋白70 (HSP70)表达的影响及其与细胞凋亡的关联性分析[J].农业生物技术学报,2015,23(9):1208-1216.
PAN Y Y,CUI Y,FAN J F,et al.The effect of insulin-like growth factor (IGF-1) on heat shock protein 70 (HSP70) expression of yak (Bosgrunniens) cumulus cells and its relation with apoptosis [J].JournalofAgriculturalBiotechnology,2015,23(9):1208-1216.(in Chinese)
[19]LOLICATO F,BROUWERS J F,VAN DE LEST C H A,et al.The cumulus cell layer protects the bovine maturing oocyte against fatty acid-induced lipotoxicity[J].BiolReprod,2015,92(1):1-16.
[20]赵学明,杜卫华,郝海生,等.卵丘细胞在牛卵母细胞体外受精生产胚胎中的作用[J].农业生物技术学报,2011,19(2):375-380.
ZHAO X M,DU W H,HAO H S,et al.Effects of cumulus cells on bovine embryo produced byinvitrofertilization [J].JournalofAgriculturalBiotechnology,2011,19(2):375-380.(in Chinese)
[21]HARDY K,SPANOS S.Growth factor expression and function in the human and mouse preimplantation embryo[J].JEndocrinol,2002,172(2):221-236.
[22]YU Y,YAN J,LI M,et al.Effects of combined epidermal growth factor,brain-derived neurotrophic factor and insulin-like growth factor-1 on human oocyte maturation and early fertilized and cloned embryo development[J].HumReprod,2012,27(7):2146-2159.
[23]WARZYCH E,PEIPPO J,SZYDLOWSKI M,et al.Supplements toinvitromaturation media affect the production of bovine blastocysts and their apoptotic index but not the proportions of matured and apoptotic oocytes[J].AnimReprodSci,2007,97(3-4):334-343.[24]冯贵雪,卞桂华,王晓丽,等.表皮生长因子对水牛卵母细胞体外培养核质成熟的影响[J].中国畜牧兽医,2007,34(1):75-78.
FENG G X,BIAN G H,WANG X L,et al.Influence of epidermal growth facror on the nuclear and cytoplasm maturation of buffalo oocytesinvitroculture[J].ChineseJournalofVeterinaryMedicine,2007,34(1):75-78.(in Chinese)
[25]刘丑生,陆会宁,张利平,等.EGF 和 IGF-I 对绵羊卵母细胞体外成熟和卵裂的影响[J].畜牧兽医学报,2008,39(5):588-593.
LIU C S,LU H N,ZHANG L P,et al.Effect of EGF,IGF-1 oninvitromaturation and cleavage of ovine oocytes [J].ActaVeterinariaetZootechnicaSinica,2008,39(5):588-593.(in Chinese)
[26]LEVY R,SMITH S D,CHANDLER K,et al.Apoptosis in human cultured trophoblasts is enhanced by hypoxia and diminished by epidermal growth factor[J].AmJPhysiolCellPhysiol,2000,278(5):C982-C988.[27]LI B,YADAV R K,JEONG G S,et al.The characteristics of Bax inhibitor-1 and its related diseases[J].CurrMolMed,2014,14(5):603-615.
[28]CHEN R M,CHEN T L,CHIU W T,et al.Molecular mechanism of nitric oxide-induced osteoblast apoptosis[J].JOrthopRes,2005,23(2):462-468.
(编辑程金华)
The Effect of Epidermal Growth Factor on the Expression of Hypoxia Inducible Factor-1α in Cumulus Cells of Yak (Bosgrunniens) and Its Correlation Analysis with Apoptosis
ZHANG Yi-fu,PAN Yang-yang,WEN Ze-xing,YU Si-jiu*
(TechnologyandResearchCenterofGansuProvinceforEmbryonicEngineeringofBovineandSheep&Goat,CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China)
The present study was carried out to verify whether EGF inhibited the apoptosis of cumulus cells of yak by regulating the expression of HIF-1α.The cumulus cells of yak were culturedinvitrowith the supplement of different concentration of EGF.The expression levels of HIF-1α,Bax and Bcl-2 in different groups were detected by qRT-PCR and immunofluorescence.TUNEL was used to evaluate apoptosis rate.Results showed that:(1) After the addition of different concentration of EGF to the cumulus cells,there would be found a declined mRNA relative expression ofHIF-1αandBaxand an increased mRNA relative expression ofBcl-2,with a characteristic manner of concentration-dependent.When the concentration of EGF was as high as 50 ng·mL-1,the mRNA relative expressions ofHIF-1αandBaxwere the lowest,while that ofBcl-2 was the highest.(2) The protein relative expressions of HIF-1α and Bax were decreased and that of Bcl-2 was increased,with a characteristic manner of concentration-dependent.When the concentration of EGF was as high as 50 ng·mL-1,the protein relative expressions of HIF-1α and Bax were the lowest,while that of Bcl-2 was the highest.(3) Apoptosis detection shown that the apoptosis rate from control group was the highest.It was extremely declined when the concentration of EGF was 25 ng·mL-1(P<0.05),and down to its lowest level when EGF was 50 ng·mL-1(P<0.05),while rose again when EGF was continues to increase.It is concluded from this study that EGF can inhibit the apoptosis of cumulus cells by regulating HIF-1α and may be related to mitochondrial Bax and Bcl-2 apoptotic pathway.
epidermal growth factor (EGF);hypoxia inducible factor-1α (HIF-1α);apoptosis;cumulus cells;yak
10.11843/j.issn.0366-6964.2016.06.010
2015-12-09
国家自然科学基金(31272616;31472244)
张译夫(1991-),女,山西运城人,硕士,主要从事哺乳动物生殖内分泌相关研究,E-mail: 1240219609@qq.com
余四九,教授,E-mail:sjyu@163.com
S823.8+5.2
A
0366-6964(2016)06-1154-08

