兔胎儿成纤维细胞的分离培养和鉴定
魏如雪,赵学明,郝海生,杜卫华,朱化彬
(中国农业科学院北京畜牧兽医研究所,北京 100193)
兔胎儿成纤维细胞的分离培养和鉴定
魏如雪,赵学明,郝海生,杜卫华,朱化彬*
(中国农业科学院北京畜牧兽医研究所,北京 100193)
本研究旨在建立稳定传代的兔胎儿成纤维细胞系及其鉴定方法。取配种后14~15 d的兔胎儿,0.25%胰酶消化胎儿皮肤获得兔胎儿成纤维细胞,体外传代培养;通过观察细胞形态、测定生长曲线、免疫荧光染色、核型分析等鉴定兔胎儿成纤维细胞,PCR扩增SRY基因鉴定2株细胞系性别。研究结果表明,兔胎儿成纤维细胞呈梭形,可在体外快速生长,符合“潜伏期-对数期-平台期”的生长规律;免疫荧光染色结果显示,波形蛋白与纤维连接蛋白染色为阳性,细胞角蛋白染色为阴性,表明兔胎儿成纤维细胞纯度高,活性好;染色体检测结果显示,在传至第5代时,80%的成纤维细胞核型正常,为2n=44,属正常范畴;PCR法检测的2株细胞系均来源于兔雄性胎儿。综上表明,本研究建立了兔胎儿成纤维细胞系体外培养、传代、鉴定及其性别鉴定方法,可为转基因兔、克隆兔、兔诱导性多能性干细胞等研究提供充足、可靠的成纤维细胞来源。
兔胎儿成纤维细胞;细胞分离;培养;鉴定
体细胞培养为生产克隆家畜、转基因家畜以及基因定点修饰和诱导多能性干细胞等研究提供细胞来源。与成年家畜成纤维细胞相比,妊娠不同阶段的早期胎儿皮肤成纤维细胞具有容易体外分离培养、生长速度快、纯度高、易进行基因修饰等优点,成为最为常用的细胞之一[1]。有研究表明,白介素-10、透明质酸[2]、FK506结合蛋白38[3]等物质与胎儿成纤维细胞关系密切,使该类细胞的研究更为深入。
家兔是具有重要毛用和肉用价值的传统经济动物[4],在中国畜牧业生产中具有重要作用。兔也是传统的试验模式动物,与小鼠、猴、猪等试验动物相比,体型适中,易操作,且生理结构和调控机制与人类接近,尤其适用于人类心脑血管疾病等研究[5]。转基因兔、克隆兔[6]以及兔胚胎干细胞[7]与诱导性多能干细胞[5,8]的研究取得巨大进展。兔胎儿成纤维细胞(Rabbit embryonic fibroblast,REF)不仅可作为克隆兔和转基因兔研究的供体细胞,也是重要的饲养层细胞。兔胎儿成纤维细胞系的分离培养与鉴定方法尚不完善,目前没有这方面的详细报道。本试验旨在优化REF细胞分离、培养和鉴定方法,建立稳定的REF细胞分离、培养和鉴定体系。
1 材料与方法
1.1试验材料
1.1.1试验动物自然交配后14~15 d(交配当天记为0 d)的日本大耳白兔,购自北京金牧阳实验动物养殖有限责任公司。
1.1.2试剂0.25%胰酶、DMEM/F12、谷氨酰胺、青链霉素、PBS缓冲液均购自Gibco公司,DMSO和秋水仙素购自Sigma公司。波形蛋白、纤维连接蛋白、细胞角蛋白一抗均购自武汉博士德公司,二抗购自Invitrogen公司。 姬姆萨染料购自北京赛驰生物科技有限公司。DNA提取试剂盒、2×PCR mastermix购自天根生物科技有限公司。
1.2方法
1.2.1胎儿成纤维细胞分离、培养和纯化棒击法处死配种后14~15 d的孕兔,将其仰卧于手术台上。腹部喷洒75%酒精消毒后,沿腹中线用手术刀打开腹腔,找到子宫。子宫如一串葡萄状,每个胎胞有1/2乒乓球大小,每只母兔有8~10个胎儿。用含200 IU·L-1青链霉素的PBS将子宫洗净,移入超静台,置于含少量PBS的10 cm培养皿中,剪开子宫壁,取出胎儿。PBS清洗2遍后,去除胎儿头、四肢、尾和内脏,获得胎兔皮肤。将每只胎兔的皮肤分别置于1.5 mL离心管中,用眼科剪剪碎至组织呈流动状。每管加500 μL 0.25%胰酶,置于37 ℃培养箱内消化10 min。取一滴消化液于显微镜下观察,看到大量悬浮单细胞时加入含10%胎牛血清的500 μL细胞培养液终止消化。用100 μm细胞筛过滤细胞悬液,滤除未消化的组织块。用15 mL离心管收集滤液,1 000 r·min-1离心3 min,弃上清,1 mL细胞培养液重悬沉淀,铺于10 cm培养皿上,补加7 mL培养液,摇匀,置于5% CO2、37 ℃培养箱内培养。REF细胞培养液成分:DMEM/F12、10%胎牛血清、2 mmol·L-1Glutamax和100 IU·mL-1青链霉素。
依据成纤维细胞贴壁较快的特点,本研究采用差速贴壁法纯化细胞。培养3~4 h后观察细胞贴壁生长状况,贴壁成纤维样细胞达到60%左右汇合度时即可换液,除去未贴壁的杂细胞。细胞生长至80%汇合度时进行传代或冻存。每10 cm培养皿加2 mL 0.25%胰酶,培养箱中消化2~3 min,待细胞变圆时加入等体积培养液终止消化。收集细胞悬液,1 000 r·min-1离心3 min,收集沉淀。收集的细胞1∶3传代培养或者冻存。细胞冻存液成分为DMSO∶FBS∶DMEM=1∶2∶7,每10 cm皿细胞沉淀(约3×106个细胞)加1 mL冻存液,重悬后放入1个细胞冻存管中,在4 ℃平衡20 min后,-20 ℃冻存2 h,-80 ℃冻存过夜,最后转入液氮中长期保存。
1.2.2细胞形态学观察普通光学显微镜下观察不同培养代数的兔胎儿成纤维细胞生长形态。
1.2.3生长曲线测定取第2代处于对数生长期的细胞,调整细胞密度为2×104·mL-1,接种于96孔板中。接种后12 h开始计数,每隔12 h计一次,每次计3孔取平均值,共计7 d。以细胞生长时间为横轴,细胞数量为纵轴绘制生长曲线。
1.2.4细胞倍增时间计算及曲线绘制按照细胞计数的结果,依据公式DT=T×lg2/lg(Nt/N0)计算细胞倍增时间。T为培养时间,N0为首次记下的细胞数,Nt为t时间后的细胞数。以细胞生长时间为横轴,细胞倍增时间为纵轴绘制曲线。
1.2.5免疫荧光染色取处于对数生长期且生长状态良好的P2代REF细胞,铺于24孔板中。4%多聚甲醛室温固定细胞15~20 min,Rinse buffer洗两遍;0.1%TritonX-100/PBS室温透化细胞10 min,Rinse buffer洗两遍;5%BSA/TBST室封闭细胞30 min;一抗室温培养1 h,Rinse buffer洗3遍;二抗室温培养30~60 min,Rinse buffer洗3遍;加入Hoechst33342工作液染核10 min,吸出后加入PBS覆盖细胞,荧光倒置显微镜下观察拍照。
1.2.6细胞核型分析取传代后培养18、20、22 h的P5代细胞,加入终浓度为0.1 μg·mL-1的秋水仙素培养4 h。消化成单细胞悬液,转移至15 mL离心管,1 000 r·min-1离心7 min,弃上清。沉淀用4 mL预热的0.075 mol·L-1KCl溶液重悬,37 ℃低渗处理15~20 min。加入等体积4 ℃预冷的固定液(甲醇∶冰醋酸=3∶1)混匀,1 000 r·min-1离心5 min,弃上清液。加入新鲜预冷的固定液,轻轻吹打成单细胞,4 ℃固定60 min以上。1 000 r·min-1离心5 min,弃掉上清液,再用100 μL固定液重悬细胞。取30 μL细胞悬液于-20 ℃载玻片垂直上方50 cm以上处滴片,并立即在酒精灯火焰上烤干。用Giemsa溶液染色10 min后,自来水冲洗掉染液,空气中自然干燥。在放大1 000倍油镜下,对扩展完好的中期染色体相计数。对典型中期染色体拍照,进行染色体组型分析。
1.3PCR扩增SRY基因鉴定胎儿性别
1.3.1引物根据兔SRY基因和GAPDH基因序列设计的引物序列见表1。引物由赛默飞世尔科技(中国)有限公司合成。
表1引物序列
Table 1Primer sequences

基因名称Genes序列号GeneID引物序列(5'-3')Primers产物长度/bpProductsizeSRYNM_001171148.1F:GTGAAGCGACCCATGAACGCA,R:CGGGTATTTCTCCTGTGCAT198GAPDHNM_001082253.1F:AAGGGCGGAGCCAAAAGGGTCA,R:CAGCATCGAAGGTAGAGGAGTG556
1.3.2细胞基因组DNA的提取:天根基因组DNA提取试剂盒提取2株REF细胞系DNA,一只成年公兔耳部组织DNA和一只成年母兔耳部组织DNA,操作步骤参照试剂盒说明书进行,DNA于-20 ℃保存。
1.3.3PCR扩增反应体系:DNA模板100 ng,SRY上下游引物各1 μL,2×PCR mastermix 12.5 μL,补充灭菌双蒸水至25 μL体系,混匀并离心后进行扩增;扩增反应参数:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,共35个循环;72 ℃延伸5 min;4 ℃保存。
1.3.4PCR产物电泳取扩增产物以1%的琼脂糖凝胶进行电泳分析,同时加5 μL 200 bp ladder作为DNA相对分子质量标准。
2 结 果
2.1兔胎儿成纤维细胞的分离培养
兔胎儿的皮肤组织薄嫩,易剪碎,添加胰酶消化10 min后镜检,可观察到大量悬浮单细胞。消化时间不要超过10 min,以免消化过度损伤细胞。3~4 h后即可观察到大量细胞贴壁,细胞呈梭形,胞体细长,边缘清晰,部分细胞核仁明显。细胞密度达到80%左右时,排列紧密,呈火焰状或旋涡状生长。体外培养的REF细胞生长迅速,2~3 d传1代,可传至10代以上。10代以上的细胞出现衰老迹象,胞体平铺,伪足增多,生长速度慢,不适用于后续试验。REF细胞生长形态见图1。
2.2REF细胞生长曲线与倍增时间曲线绘制
P2代REF细胞的生长曲线见图2 。由曲线可以得出,REF细胞的生长规律与小鼠、人、牛等物种的成纤维细胞相似度较高,分为典型的3个生长阶段。0~2 d为平台期,长势不明显,细胞数量稳定升高,但速度较慢;2~5 d为对数期,生长速度较快,是细胞长势最好,活力最高的时期,此时最适用于核移植和重编程等操作;6~7 d为平台期,此时细胞逐渐衰老,数目稳定,增殖不明显,不适用于后续试验。图3为P2代REF细胞的倍增时间曲线,结果表明,在细胞生长速度最快的2~4 d阶段,倍增时间最短且比较稳定,在6~7 d时显著增加,表明此时细胞分裂速度较慢,与生长曲线趋势一致。
2.3免疫荧光染色
参照牛等家畜胎儿成纤维细胞鉴定方法,选择波形蛋白、纤维连接蛋白、角蛋白3种标记蛋白对兔胎儿成纤维细胞进行鉴定。其中波形蛋白和纤维连接蛋白是成纤维细胞的标志,角蛋白是上皮细胞标志。免疫荧光染色结果见图4。试验结果表明,波形蛋白和纤维连接蛋白染色为阳性,角蛋白染色为阴性,与牛、人等成纤维细胞一致。说明所得兔胎儿成纤维细胞纯度高,活性好。

A.原代REF细胞(100×);B.P3代REF细胞(100×);C.P3代REF细胞(40×);D.P10代REF细胞(100×)A.Primary REF cell (100×);B.The third generation of REF cell (100×);C.The third generation of REF cell (40×);D.The tenth generation of REF cell (100×) 图1 兔胎儿成纤维细胞形态Fig.1 The morphology of REF cell
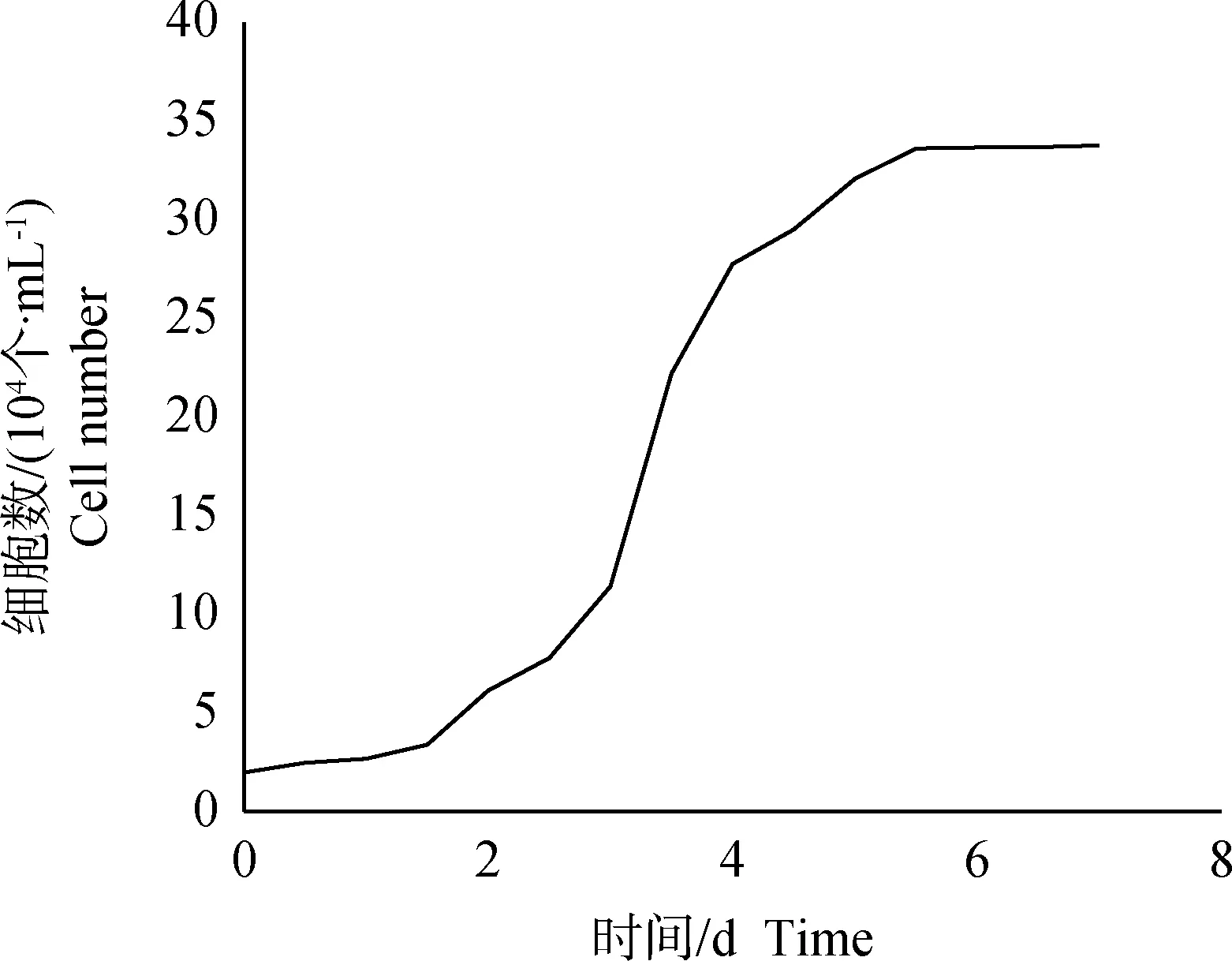
图2 P2代REF细胞生长曲线Fig.2 Growth curve of the second generation REF cell

图3 P2代 REF细胞倍增时间曲线Fig.3 Double time of the second generation REF cell
2.4细胞核型分析
取传代后培养18、20、22 h的P5代细胞进行核型鉴定。试验结果表明,各组核型正常的细胞均占到80%~87%,正常REF细胞核型为2n=44。传代后培养20 h组细胞处于中期分裂相的数目最多,最适宜观察,结果见图5。
2.5SRY基因鉴定兔胎儿性别
根据兔SRY基因和GAPDH基因序列各设计1对引物。扩增成年母兔耳部组织、成年公兔耳部组织、REF1和REF2细胞系的SRY基因,同时扩增REF1细胞系的GAPDH基因作为PCR体系阳性对照,结果见图6。PCR结果表明,可有效地扩增出成年公兔和REF1、REF2细胞系SRY基因以及REF1细胞系GAPDH基因的特异性片段。而在阴性对照成年母兔无任何扩增条带。故有相同扩增条带的REF1、REF2细胞系为雄性胎儿。
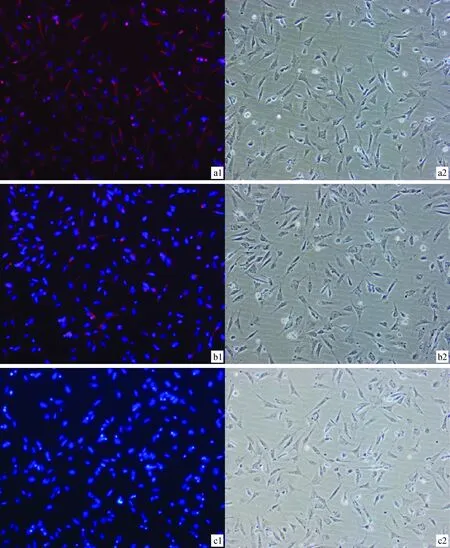
a1、b1、c1.免疫荧光染色波形蛋白、纤维连接蛋白、角蛋白Hoechst33342(100×)。a2、b2、c2.波形蛋白、纤维连接蛋白、角蛋白光镜照片(100×)。(蓝色为Hoechst33342染色;红色为特异性抗体染色)a1,b1,c1.Nuclear staining and specific staining reactions of vimentin,fibronectin and cytokeratin(100×).a2,b2,c2.Light micrograph images of vimentin,fibronectin and cytokeratin specific staining reactions(100×).(Blue for dyeing Hoechst 33342;Red for the specificity of the antibody staining)图4 兔胎儿成纤维细胞免疫荧光检测Fig.4 Specific staining reactions of REF cell

图5 传代后20 h P5代兔胎儿成纤维细胞核型鉴定(1 000×) Fig.5 Karyotype analysis of fifth generation REF cell after 20 hours culture (1 000×)
3 讨 论

M.200 bp DNA marker;1.成年母兔耳部组织DNA(阴性对照);2.成年公兔耳部组织DNA(阳性对照);3、4.雄性胎儿成纤维细胞系REF1、REF2;5.GAPDH(PCR体系阳性对照)M.200 bp DNA marker;1.Ear tissue DNA of adult female rabbit(negative control);2.Ear tissue DNA of adult male rabbit(positive control);3,4.Male fetal REF cell lines REF1 and REF2;5.GAPDH(positive control of PCR reaction system)图6 PCR扩增SRY基因产物电泳分析Fig.6 Amplification products of SRY-PCR
母兔配种后12~18 d[9-11]的胎儿均可作为兔胎儿成纤维细胞的来源。本研究开始时曾使用配种后13.5 d的孕兔,但是胎儿体积过小,难以分辨头、四肢与内脏,所得皮肤组织如细胞少,纯度低。经探索后发现,配种后14~15 d孕龄的胎儿体积适中,长度约1 cm,头、尾、四肢、内脏清晰可辨,易剥除。每个胎儿可得3×106个原代细胞,细胞量大且纯度高,因此后期均选用配种后14~15 d的胎儿分离细胞。为得到最佳状态的REF细胞,本研究采用组织块培养法和胰酶消化法,但组织块培养法在培养两周后并未见有细胞从组织块周边爬出,可能是将组织切得过于细碎所致。胰酶消化法可快速得到大量原代细胞,3~4 d可冻存,因此在本试验中均采用胰酶消化法分离REF细胞。
目前多种家畜如猪[12]、山羊[13]、牛[14]等动物的胎儿成纤维细胞鉴定方法都较成熟,包括形态学观察、生长曲线测定、免疫荧光染色和核型鉴定等。REF细胞形态符合成纤维细胞特征,呈长梭形,与小鼠胎儿成纤维细胞相比胞体更长更大,表明物种间存在差异。本研究生长曲线测定结果表明,当REF生长进入停滞期时,细胞量为3.3×105个·mL-1,而牛胎儿成纤维细胞为8×105个·mL-1[15],人胎儿成纤维细胞为1.8×105个·mL-1,小鼠胎儿成纤维细胞为1.1×105个·mL-1[16]。
免疫荧光检测结果显示,纤维连接蛋白和波形蛋白染色为阳性,与牛皮肤成纤维细胞结果一致[14],符合成纤维细胞特征;细胞角蛋白染色阴性,表明没有上皮细胞污染。纤维连接蛋白是由成纤维细胞分泌的一种糖蛋白,是细胞外基质的重要成分之一,负责胶原之间的连接、细胞的黏附和增殖等[17]。波形蛋白是细胞骨架的成员之一,它存在于中胚层起源的细胞中,如成纤维细胞、内皮细胞和白细胞等[18],并与微管、微丝共同形成了一个细胞支架网络而维持细胞完整性[19]。因此在成纤维细胞鉴定中常选用这两种蛋白作标志蛋白。
正常的细胞核型是用于克隆、转基因、重编程等研究的重要前提,本研究检测所培养的P5代REF细胞核型正常率>80%,属于正常范畴。随细胞传代数增加,细胞衰老严重,而衰老可导致染色质损伤[20],增大核型异常的细胞比率,不利于进行后续研究。因此选取3代以内REF细胞作为核移植或重编程材料,选取5代以内REF细胞作饲养层。SRY是位于雄性Y染色体性别决定区(Sex-determining region)的基因,它在不同动物中高度保守。
SRY基因的表达决定了胚胎沿雄性方向分化。特异性扩增SRY基因的核心序列就可以对动物细胞或胚胎进行性别鉴定。该方法由于操作简便,准确性高,已广泛应用于各种家畜如猪[21]、绵羊[22]、牛[23]等的性别鉴定。本研究采用该方法对培养的2个REF细胞系进行性别鉴定,均扩增出198 bp的特异性DNA片段,这与前人研究结果一致[24],表明2株细胞系均来自雄性胎儿,结果准确可靠。
本研究建立了兔胎儿成纤维细胞体外培养体系,获得可稳定传代、状态良好的REF细胞系。并采用形态学观察、生长曲线测定、免疫荧光检测、核型分析等方法对细胞系进行鉴定,结果符合成纤维细胞的特征。最后使用SRY-PCR法检测2株REF细胞系性别,均为雄性。这为转基因兔、克隆兔、细胞重编程等奠定了试验基础。
[1]LIU J,LUO Y,ZHENG L,et al.Establishment and characterization of fetal fibroblast cell lines for generating human lysozyme transgenic goats by somatic cell nuclear transfer[J].TransgenicRes,2013,22(5):893-903.
[2]BALAJI S,KING A,MARSH E,et al.The role of interleukin-10 and hyaluronan in murine fetal fibroblast function in vitro:implications for recapitulating fetal regenerative wound healing[J].PLoSOne,2015,10(5):e0124302.
[3]WANG X,WANG Y,ZHENG X,et al.Direct interaction between ras homolog enriched in brain and FK506 binding protein 38 in cashmere goat fetal fibroblast cells[J].Asian-AustralJAnimSci,2014,27(12):1671-1677.
[4]洪霞芳.中国兔产业发展研究[D].北京:北京林业大学,2011.
HONG X F.Study on the development of rabbit industry in China[D].Beijing:Beijing Forestry University,2011.(in Chinese)
[5]HONDA A,HIROSE M,HATORI M,et al.Generation of induced pluripotent stem cells in rabbits:potential experimental models for human regenerative medicine[J].JBiolChem,2010,285(41):31362-31369.
[6]GUO Y,ZHANG C S,LI S G,et al.RNAi-mediated stable silencing of HGPRT expression in rabbit fibroblasts and SCNT embryo production[J].ProgBiochemBiophys,2009,36(7):872-879.
[7]JIANG Y,KOU Z,WU T,et al.Xist deficiency and disorders of X-inactivation in rabbit embryonic stem cells can be rescued by transcription-factor-mediated conversion[J].StemCellsDev,2014,23(19):2283-2296.
[8]OSTEIL P,TAPPONNIER Y,MARKOSSIAN S,et al.Induced pluripotent stem cells derived from rabbits exhibit some characteristics of nave pluripotency[J].BiolOpen,2013,2(6):613-628.
[9]李义书.兔类胚胎干细胞体外培养体系的优化与建立[D].杨凌:西北农林科技大学,2008.
LI Y S.Optimization and establishment of aninvitroculture system for rabbit embryonic stem cell [D].Yangling:Northwest A&F University,2008.(in Chinese)
[10]郭志林.小鼠、兔和牛胚胎干细胞分离培养及其向神经样细胞的分化[D].杨凌:西北农林科技大学,2008.
GUO Z L.Isolation,culture andinvitroneural-like cell differentiation of mouse,rabbit and bovine embryonic stem cells[D].Yangling:Northwest A&F University,2008.(in Chinese)
[11]赖良学,郑瑞珍,秦鹏春,等.影响体外培养兔胚发育和兔类ES细胞分离的若干因素[J].中国兽医学报,1996,16(1):16-21.
LAI L X,ZHENG R Z,QIN P C,et al.Several factors affecting development of rabbit embryosinvitroand establishment of rabbit embryonic stem (ES) cell-like cell lines[J].ChineseJournalofVeterinaryScience,1996,16(1):16-21.(in Chinese)
[12]MEHRABANI D,MAHBOOBI R,DIANATPOUR M,et al.Establishment,culture,and characterization of Guinea pig fetal fibroblast cell[J].VetMedInts,2014,2014:510328.
[13]张艳丽,许丹,庞训胜,等.奶山羊胎儿成纤维细胞的分离培养及脂质体法转染研究[J].南京农业大学学报,2010,33(1):81-86.
ZHANG Y L,XU D,PANG X S,et al.Invitroculture diary goat fetal fibroblasts and gene transfection through liposome [J].JournalofNanjingAgriculturalUniversity,2010,33(1):81-86.(in Chinese)
[14]吕长荣.诱导成年牛皮肤成纤维细胞为多能性干细胞的研究[D].杨凌:西北农林科技大学,2011.
LÜ C R.Generation of induced pluripotent stem cells from adult bovine dermal fibroblasts[D].Yangling:Northwest A&F University,2011.(in Chinese)
[15]李扬,郭继彤,吴凯峰,等.牛胎儿成纤维细胞的分离与体外培养[J].细胞生物学杂志,2002,24(4):254-256.
LI Y,GUO J T,WU K F,et al.Dissociation and in vitro culture of bovine fibroblasts[J].ChineseJournalofCellBiology,2002,24(4):254-256.(in Chinese)
[16]张怡,赵连三,汪成孝,等.人胚胎成纤维细胞与小鼠胚胎成纤维细胞生物学特性比较[J].生物医学工程学杂志,2003,20(2):251-254.
ZHANG Y,ZHAO L S,WANG C X,et al.The comparison of biologic character between mouse embryonic fibroblast and human embryonic fibroblast[J].JournalofBiomedicalEngineering,2003,20(2):251-254.(in Chinese)
[17]吴镝,洪权,陈香美,等.利用逆转录病毒RNAi载体抑制心肌成纤维细胞分泌纤维连接蛋白[J].中国科学(C辑:生命科学),2004,34(4):335-342.
WU D,HONG Q,CHEN X M,et al.Using retrovirus RNAi vector inhibit fiber connection proteins secretion by mycocardial fibroblasts[J].ScienceinChinaSeriesCLifeSciences,2004,34(4):335-342.(in Chinese)
[18]COULOMBE P A,WONG P.Cytoplasmic intermediate filaments revealed as dynamic and multipurpose scaffolds[J].NatCellBiol,2004,6(8):699-706.
[19]徐浩翔,闫言.波形蛋白表达和功能的研究进展[J].北京大学学报(医学版),2009,41(5):605-607.
XU H X,YAN Y.Progress of research on the expression and function of vimentin[J].JournalofPekingUniversity(HealthSciences),2009,41(5):605-607.(in Chinese)
[20]HOWARD B H.Replicative senescence:considerations relating to the stability of heterochromatin domains[J].ExpGerontol,1996,31(1-2):281-293.
[21]曹海峰,随刘才,季索菲,等.梅山猪胎儿成纤维细胞的分离培养及SRY-PCR法快速性别鉴定[J].安徽农业大学学报,2011,38(6):907-910.
CAO H F,SUI L C,JI S F,et al.Rapid sex identification by SRY-PCR ofinvitrocultured Meishan pig fetal fibroblast [J].JournalofAnhuiAgriculturalUniversity,2011,38(6):907-910.(in Chinese)
[22]SABERIVAND A,AHSAN S.Sex determination of ovine embryos by SRY and amelogenin (AMEL) genes using maternal circulating cell free DNA[J].AnimReprodSci,2016,164:9-13.
[23]ZHU H,LIN B,CHEN J,et al.Study of a simple and rapid PCR sex identification of bovine embryo[J].JAnimVetAdv,2012,11(11):1847-1852.
[24]侯健,安晓荣,苟克勉,等.Sry-PCR法快速鉴定体外培养兔胎儿成纤维细胞系的性别[J].农业生物技术学报,2001,9(2):191-193.
HOU J,AN X R,GOU K M,et al.Rapid sex determination of cultured rabbit fetal fibroblast cell lines by Sry-PCR [J].JournalofAgriculturalBiotechnology,2001,9(2):191-193.(in Chinese)
(编辑程金华)
Isolation,Culture and Identification of Rabbit Embryonic Fibroblasts
WEI Ru-xue,ZHAO Xue-ming,HAO Hai-sheng,DU Wei-hua,ZHU Hua-bin*
(InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
This research was conducted to establish the stable rabbit embryonic fibroblast cell lines and identification methods. Rabbit embryonic fibroblasts were isolated from 14-15 d rabbit fetus by trypsin enzyme digesting skin tissues, and passagedinvitrosteadily. Morphology observation, growth curve measurement, immunofluorescence and karyotype analysis were applied to cell lines identification. The sex of 2 cell lines were determined by amplifying core sequence of rabbitSRYgene. The results showed that rabbit embryonic were spindle shaped and fibroblasts grew fastinvitro, conforming to the pattern of “latent phase-logarithmic growth phase-stagnate phase”. Immunofluorescence assay showed that vimentin and fibronectin staining were positive, while cytokeratin staining was negative, indicated the high purity and activity of rabbit embryonic fibroblast cells. The result of chromosome analysis showed that 80% ploidy of one cell lines maintained normal (2n=44) when cultured up to passage 5. For cell lines sexing, SRY-PCR analysis suggested the 2 determined cell lines were male. These results indicated that our research could be used to establish rabbit embryonic fibroblast cell lines and determine sex, providing adequate and reliable fibroblast cells for transgenesis, cloning and iPS rabbit research.
rabbit embryonic fibroblasts;isolation;culture;identification
10.11843/j.issn.0366-6964.2016.06.025
2015-12-14
家畜胚胎工程与繁殖创新团队(ASTIP-IAS06-2016);国家自然科学基金面上项目(31472100)
魏如雪(1991-),女,山东德州人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:704446770@qq.com
朱化彬,博士,研究员,主要从事家畜胚胎工程与繁殖研究,E-mail:zhuhuabin@caas.cn
S814.8;S829.1
A
0366-6964(2016)06-1272-08

