缺氧诱导因子-1α对结直肠癌细胞上皮间质转化及侵袭迁移的影响
吴丽丽,孙慧誌,孙冉,赵楠,3,王勇,古强,3,董学易,3,刘芳,3,孙保存,3,4
缺氧诱导因子-1α对结直肠癌细胞上皮间质转化及侵袭迁移的影响
吴丽丽1,孙慧誌1,孙冉2,赵楠1,3,王勇1,古强1,3,董学易1,3,刘芳1,3,孙保存1,3,4
目的探讨缺氧是否能促进不同分化程度结直肠癌细胞上皮间质转化(EMT),并分析缺氧对结直肠癌细胞侵袭、迁移的影响。方法分别选取HCT116(低度分化)和HT-29(高度分化)结直肠腺癌细胞。观察0、10、25、50、100及150 mg/L氯化钴(CoCl2)诱导2种细胞48 h后的形态变化。分析0、10、25、50及100 mg/L CoCl2处理48 h后缺氧诱导因子(HIF)-1α蛋白表达变化,筛选出CoCl2诱导细胞缺氧的最适合浓度。MTT实验检测不同时间点(0、24、48、72及96 h)CoCl2诱导2种结直肠癌细胞的增殖情况,筛选出CoCl2诱导缺氧的最佳时间。最佳浓度和时间条件下,对HCT116和HT-29细胞分别进行缺氧(缺氧组)和常氧(常氧组)处理,Transwell侵袭和划痕实验检测2组2种细胞的侵袭、迁移情况;Western blot实验和RT-PCR实验检测2组HIF-1α、E-cadherin及Vimentin的蛋白及mRNA表达水平。结果50 mg/L CoCl2作用48 h时2种细胞均出现明显的形态改变。2组HCT116、HT-29细胞的HIF-1α蛋白表达水平随CoCl2浓度增加均呈先增后减趋势,50 mg/L为最适宜浓度(P<0.05)。0~96 h时2种细胞不论有无缺氧,细胞增殖能力均呈先增后减趋势(P<0.05),48 h为最佳作用时间。HCT116和HT-29细胞系中缺氧组穿膜细胞数和细胞迁移率均明显高于常氧组(P<0.05)。HCT116、HT-29细胞系中缺氧组HIF-1α、Vimentin的蛋白和mRNA表达水平均高于常氧组,而E-cadherin的蛋白和mRNA表达水平低于常氧组(均P<0.05)。结论缺氧能诱导不同分化程度结直肠癌细胞均发生EMT,并能增强2种结直肠癌细胞的侵袭、迁移能力。
缺氧诱导因子1,α亚基;结直肠肿瘤;上皮间质转化;细胞增殖;肿瘤侵润;细胞运动
微环境缺氧是实体瘤普遍存在的现象,肿瘤为适应缺氧可发生一系列生物学改变,这一过程主要由缺氧诱导因子(HIF)-1α介导[1]。HIF-1α可通过参与RNA转录和调控,从而影响肿瘤细胞的增殖、侵袭及迁移能力,并促进肿瘤血管的生成[2]。在肿瘤侵袭、迁移过程中,上皮间质转化(EMT)可表现为上皮源性标志物减少或缺失,间叶源性标志物增加[3-5]。HIF-1α介导的缺氧信号传导是调节EMT的重要机制。目前,关于缺氧微环境在不同分化程度的肿瘤侵袭转移中是否均产生了影响尚无定论。本研究选择2种不同分化程度的结直肠癌细胞系,通过构建体外缺氧模型,探讨缺氧是否均能促进不同分化程度结直肠癌细胞发生EMT,并分析缺氧对结直肠癌细胞侵袭、迁移的影响。
1材料与方法
1.1实验材料HT-29和HCT116分别为高、低度分化的结直肠腺癌细胞,均购自中国医学科学院基础医学院细胞资源中心。DMEM/F12(Dulbecco’s Modified Eagle Medium:Nutrient Mixture F-12)和IMDM(ISCOVE’s modified DMEM)培养基均购自南京凯基生物公司,胎牛血清购自Thermo公司,Transwell小室购自美国FALCON公司,化学发光液A(Western Bright ECL)和B(Western Bright peroxide)购自Advansta公司。鼠抗人单克隆抗体HIF-1α、E-cadherin及Vimentin均购自美国Abcam公司。兔抗人多克隆抗体β-actin、山羊抗兔IgG抗体及山羊抗鼠IgG抗体均购自北京中杉金桥生物技术有限公司。
1.2方法
1.2.1细胞系培养HT-29加入DMEM/F12培养基+5%胎牛血清,HCT116加入IMDM培养基+10%胎牛血清,加入100 U/mL的青霉素和100 mg/L的链霉素,于37℃5%CO2恒温孵箱中常规培养。
1.2.2不同浓度氯化钴(CoCl2)诱导2种结直肠癌细胞的形态变化HT-29、HCT116细胞分别培养至80%融合时,撤血清继续培养24 h后,加梯度浓度的CoCl2(0、10、25、50、100 及150 mg/L)于完全培养基中继续培养48 h,于倒置显微镜(×100)下分别观察HT-29、HCT116细胞的形态变化。
1.2.3 Western blot实验检测不同浓度CoCl2对结直肠癌细胞HIF-1α蛋白表达的影响取对数生长期的HT-29、HCT116细胞,撤血清继续培养24 h后,胰酶消化离心重悬,参照文献[6]调整细胞浓度至1×106个/mL,分别接种于6孔板中,待细胞贴壁后加不同浓度CoCl2(0、10、25、50及100 mg/L)于完全培养基中继续培养48 h,用细胞裂解液充分裂解细胞,提取总蛋白,在SDS聚丙烯酰胺凝胶中电泳,PVDF膜转膜,5%的脱脂奶粉封闭非特异性抗原后,加一抗,4℃孵育过夜,次日室温恢复后,用TBST洗10 min×3次,加入相应二抗,室温孵育2 h,TBST洗膜3次后,加入200 μL A发光液和200 μL B发光液混匀后显影;扫描电泳条带,以β-actin为内参,根据目的条带与内参条带比值表示目的蛋白相对表达量。筛选出CoCl2诱导缺氧的最适合浓度。按照最适合浓度进行后续细胞实验。缺氧组:HT-29和HCT116细胞分别进行缺氧处理(HT-29-H组、HCT116-H组);常氧组:HT-29和HCT116细胞均进行常氧处理(HT-29-N组、HCT116-N组)。
1.2.4 MTT实验检测不同时间点CoCl2诱导2种结直肠癌细胞增殖情况取对数生长期的HT-29、HCT116细胞常规消化离心重悬后,调整细胞浓度至1×104个/mL后分别接种到5 个96孔板。待细胞贴壁后,缺氧组加入50 mg/L的CoCl2,常氧组加入等量的去离子水,每组设5个复孔,按不同时间点(0、24、48、72及96 h)分别取出一个96孔板,加入50 μL 1×MTT溶液,在37℃培养箱孵育4 h后,弃去培养液,加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪570 nm波长处检测各孔的吸光度(A)值。实验重复3次,取其平均值。结合1.2.2细胞形态变化筛选出CoCl2诱导缺氧的最佳时间。
1.2.5 Transwell侵袭实验检测缺氧组和常氧组细胞侵袭情况Transwell小室包被Matirgel胶置于24孔板内并于培养箱中过夜,缺氧组和常氧组细胞分别培养48 h后,胰酶消化离心重悬后,调整细胞浓度至1×105个/mL,小室内加入200 μL(无血清或含5%血清)的细胞悬液,小室外加入含20%血清的完全培养基。待细胞培养48 h时,取出小室并放入加有500 μL冷甲醇的新孔内固定20 min,用棉签擦去小室内的细胞,磷酸盐缓冲液(PBS)冲洗小室内部1~2遍,0.4%结晶紫加入到(新孔)小室外200 μL、小室内50 μL,待染色40 min,用PBS冲洗小室内部1~2遍后于倒置显微镜(×200)下随机选5个视野计数穿膜细胞数[7],实验重复3次,取其平均值。1.2.6细胞划痕实验检测缺氧组和常氧组细胞迁移情况取对数生长期的HT-29、HCT116细胞分别接种于12孔板,待细胞达80%融合时,缺氧组给予50 mg/L CoCl2处理,常氧组加入等量去离子水分别作用48 h后,用中枪头垂直于细胞表面进行划痕,用无菌PBS洗去刮掉的细胞,加入完全培养基。此时记为划痕0 h,分别在0 h和24 h于倒置显微镜(×40)下拍照测量细胞划痕距离,实验重复3次,取其平均值,计算细胞迁移率。
1.2.7 Western blot实验检测缺氧组和常氧组细胞中HIF-1α、E-cadherin及Vimentin的蛋白表达情况方法同1.2.3。1.2.8反转录聚合酶链反应(RT-PCR)检测缺氧组和常氧组细胞中HIF-1α、E-cadherin及Vimentin的mRNA表达水平用TRizol法提取总RNA,按逆转录试剂盒说明进行,用2×Taq PCR MasterMix产品,以基因组DNA为模板进行PCR扩增,PCR反应条件:94℃预变性3 min;94℃变性30 s,退火(HIF-1α,55.8℃;E-cadherin,56℃;Vimentin,58.7℃;GAPDH,57.5℃)30 s,72℃延伸1 min;72℃延伸5 min,4℃冷却10 min。HIF-1α基因为27个循环,其他基因为30个循环。PCR产物经1%琼脂糖凝胶100 V,25 min电泳,电泳结果用凝胶成像分析仪拍照,电泳条带用Quantity one软件分析,待测基因条带与内参条带比值作为目的基因的相对表达量。各基因引物序列见表1。
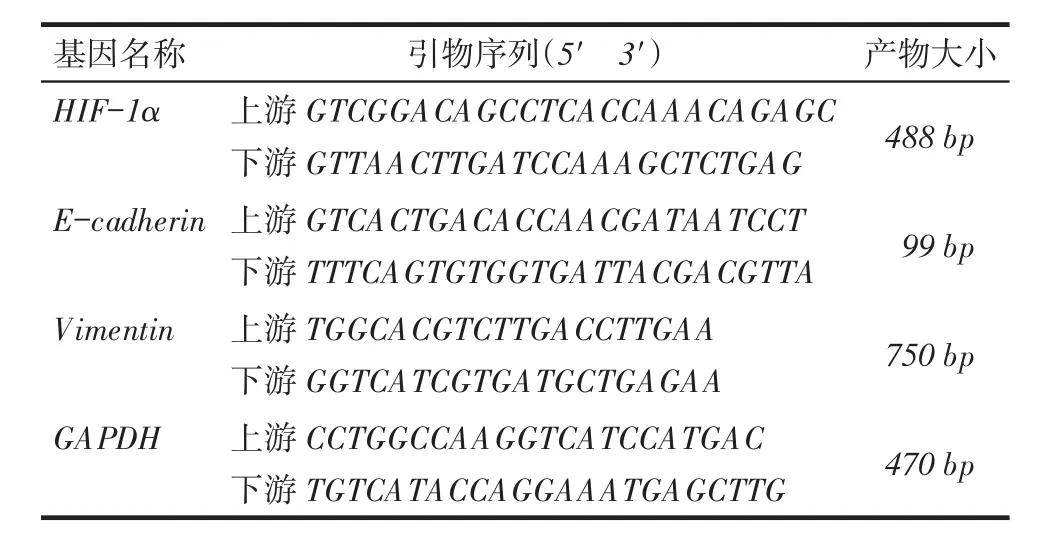
Tab. 1 Primer sequences of HIF-1α,E-cadherin,Vimentin and GAPDH表1 HIF-1α、E-cadherin、Vimentin及GAPDH引物序列
1.3统计学方法采用SPSS 21.0统计学软件进行数据分析。符合正态分布的计量资料采用均数±标准差(x ±s)表示,2组间均数比较采用t检验。多组间均数比较采用单因素方差分析,不同时间点两两比较用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1缺氧微环境下2种结直肠癌细胞的形态变化CoCl2诱导缺氧48 h时,0、10 mg/L细胞形态基本无变化;25 mg/L CoCl2细胞形态开始变化;50 mg/L CoCl2细胞均出现明显的形态改变,细胞间连接变得疏松,细胞伪足增多,呈间质细胞样改变;100、150 mg/L CoCl2细胞开始变圆,有部分细胞从培养板上脱落,细胞出现裂解、死亡,见图1。

B:不同浓度的CoCl2作用于HT-29细胞Fig. 1 Morphological changes of HCT116 and HT-29 cells after treatment with different concentrations of CoCl2(×100)图1 HCT116和HT-29细胞在不同浓度CoCl2作用下的形态学改变(×100)
2.2不同浓度CoCl2作用下2种细胞系中HIF-1α蛋白表达情况HCT116细胞和HT-29细胞的HIF-1α蛋白表达水平均呈先增后减趋势,50 mg/L 时HIF-1α蛋白表达水平均最高(F分别为2620.77、1 320.95,n=3,P<0.05),结合形态学变化,以50 mg/L 为CoCl2作用的最适宜浓度,见图2。

*50 mg/L时HIF-1α蛋白表达水平与0、10、25及100 mg/L比较,均P<0.05;1~5分别为0、10、25、50及100 mg/L CoCl2作用Fig. 2 Effects of different concentrations of CoCl2on the expression of HIF-1α protein in colorectal cancer cells图2 不同浓度CoCl2对结直肠癌细胞HIF-1α蛋白表达的影响
2.3缺氧微环境下2种结直肠癌细胞增殖能力的变化0~96 h时HCT116与HT-29细胞不论有无缺氧,细胞增殖能力均呈先增后减趋势。其中,HCT116-H组72 h时最高,但48 h时A值增长幅度较72 h更大,HT-29-H组48 h时最高,因此,取48 h为最佳作用时间,见表2。
2.4缺氧微环境下2种结直肠癌细胞侵袭和迁移能力的变化HCT116和HT-29细胞系中缺氧组穿膜细胞数和细胞迁移率均明显高于常氧组(P<0.05),见图3、4,表3。

Fig.3 Effects of hypoxiaon cell invasion(Crystal violet,×200)图3 缺氧对细胞侵袭能力的影响(结晶紫染色,×200)

Fig. 4 Effects of hypoxiaon cell migration(×40)图4 缺氧对细胞迁移能力的影响(×40)
2.5缺氧微环境下结直肠癌细胞HIF-1α、E-cadherin及Vimentin蛋白和mRNA表达水平的比较HCT116- H组HIF- 1α及Vimentin蛋白和mRNA表达水平均高于HCT116-N组,而E-cadherin蛋白和mRNA表达水平低于HCT116-N组(均P<0.05);HT-29细胞中HIF-1α、E-cadherin及Vimentin蛋白表达与HCT116细胞类似,见图5、6和表4、5。
3 讨论
在乳腺癌、肝癌研究中显示,肿瘤细胞缺氧微环境可导致肿瘤更具有侵袭性,更易于转移[8-9]。HIF-1α受氧分压的调控,能在缺氧条件下保持稳定,并且是组织缺氧的内在标志物。CoCl2是HIF-1α的特异性诱导剂,常用于体外模拟缺氧微环境[10]。
本研究形态学观察发现,在结直肠癌细胞中,25 mg/L CoCl2作用时,细胞开始出现多角伪足,转变成纤维母细胞样,细胞间连接疏松,彼此间黏附性降低,易于细胞迁移运动;50 mg/L CoCl2作用时,细胞形态变化最显著,当CoCl2浓度升高(100、150 mg/L)时,细胞伪足逐渐消失,开始变圆,部分细胞裂解死亡,表明CoCl2浓度对细胞形态改变具有双向影响。Western blot结果显示,HCT116和HT-29细胞的HIF-1α蛋白表达水平均呈先增后减趋势,50 mg/L 时HIF-1α蛋白表达水平均最高,结合细胞形态变化与HIF-1α表达量的改变,因此,以50 mg/L CoCl2作为诱导缺氧的最适宜浓度。MTT实验结果表明,随着缺氧时间的延长,细胞增殖能力呈先增后减趋势;缺氧达48 h、72 h时,缺氧组与常氧组相比,细胞增殖能力均显著增强,且缺氧组48 h细胞增殖能力增强幅度大于72 h,提示48 h是诱导缺氧的节点;而HT-29细胞缺氧96 h时常氧组增殖率反而较缺氧组高,推测可能是由于随缺氧时间的延长,CoCl2累积的毒性效应或是CoCl2刺激细胞反应性增生加重了缺氧程度,导致缺氧组细胞增殖能力下降。

Tab. 2 Comparison of the proliferation between hypoxia and normoxic groups of HCT116 and HT-29 cells表2 缺氧组和常氧组HCT116、HT-29细胞增殖能力的变化 (n=15,A值,x ±s)

Tab. 3 Comparison of transmembrane numbers and migration rate between hypoxia and normoxia groups in two kinds of cells表3 2种细胞中缺氧组与常氧组穿膜细胞数和细胞迁移率的比较 (n=3,x ±s)
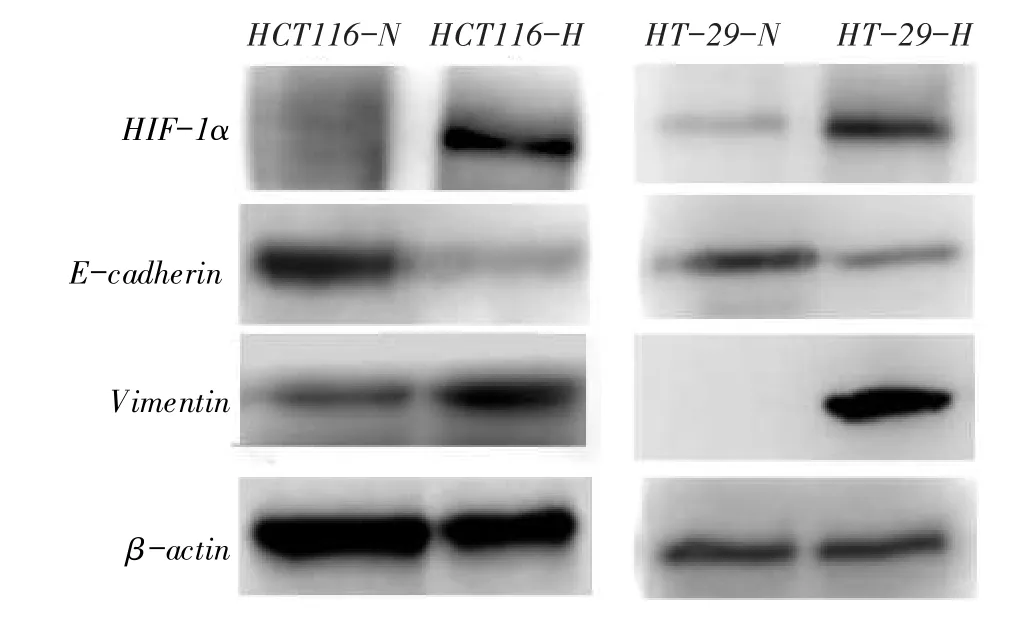
Fig. 5 The expression levels of HIF-1α,E-cadherin and Vimentin protein after treatment with hypoxiain HCT116 and HT-29 cells图5 缺氧对HCT116、HT-29细胞中HIF-1α、E-cadherin及Vimentin蛋白表达的影响
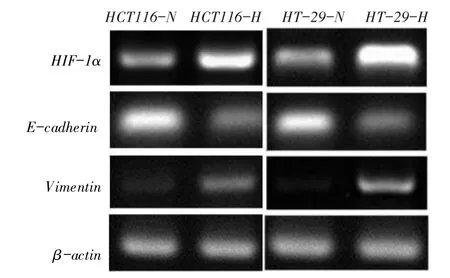
Fig. 6 The expression levels of HIF-1α,E-cadherin and Vimentin mRNA induced by hypoxiain HCT116 and HT-29 cells图6 缺氧对HCT116、HT-29细胞中HIF-1α、E-cadherin及Vimentin mRNA表达的影响
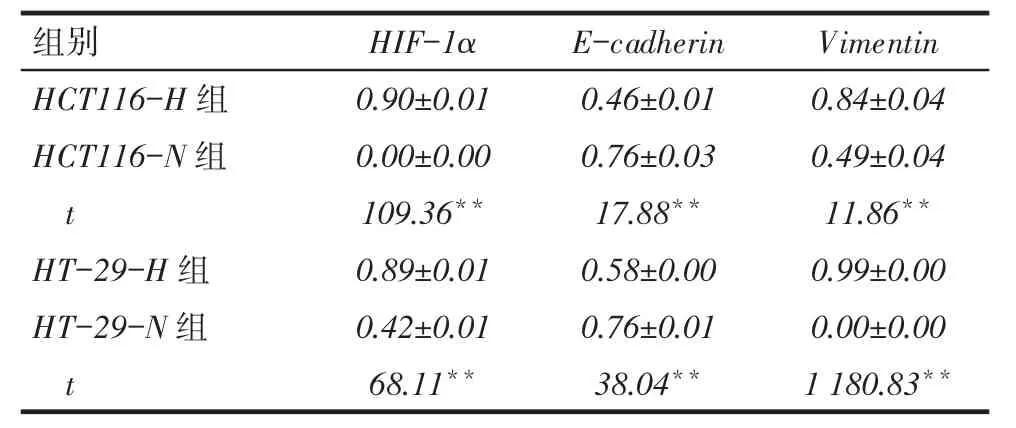
Tab. 4 Comparison of expression levels of HIF-1α,E-cadherin and Vimentin protein表4 各组细胞HIF-1α、E-cadherin及Vimentin蛋白表达量比较 (n=3,x ±s)

Tab. 5 Comparison of expression levels of HIF-1α,E-cadherin and Vimentin mRNA表5 各组细胞HIF-1α、E-cadherin及Vimentin mRNA表达量比较 (n=3,x ±s)
侵袭实验和迁移实验结果显示,HCT116和HT-29细胞系中缺氧组穿膜细胞数和细胞迁移率均明显高于常氧组,表明缺氧诱导不同分化程度细胞的侵袭、迁移能力均显著增强。本研究结果显示,HCT116-H组HIF-1α及Vimentin蛋白和mRNA表达水平均高于HCT116-N组,而E-cadherin蛋白和mRNA表达水平低于HCT116-N组,HT-29细胞类似,表明在HCT116、HT-29细胞中,缺氧诱导可使HIF-1α、Vimentin蛋白及mRNA水平表达增强,同时抑制E-cadherin蛋白及mRNA的表达。王永兴等[11]研究显示,缺氧诱导的HIF-1α蛋白表达增加,而mRNA水平不变,与本研究不同,推测可能由于其使用缺氧培养箱诱导6 h与本实验的CoCl2诱导48 h不同,引起HIF-1α在转录后发生变化,从而导致其mRNA水平的改变不同所致。综合本实验结果,缺氧诱导的不同分化程度结直肠癌细胞均有EMT发生并促进了细胞侵袭、迁移能力。这与Cannito等[12]研究一致,推测机制可能是由于缺氧诱导HIF-1α表达增加,导致其调控EMT过程中的相关转录因子发生了变化,进而诱导EMT标志物表达发生变化,最终导致细胞形态及功能发生变化。
HIF-1α是Snail、ZEB、Twist等转录因子的上游调控因子[13];而这些因子能够识别E-cadherin启动子序列,吸引各种辅助因子,从而抑制E-cadherin的表达[14-15];E-cadherin表达下调是EMT发生的关键[16]。但缺氧微环境诱导不同分化细胞EMT发生的分子机制是否相同尚无定论。HIF-1α可能成为逆转EMT发生的靶点,但HIF-1α在肿瘤侵袭转移中的作用及相关的分子机制仍需进一步研究。
(图1、3、4见插页)
[1]Han YL,Luo Y,He DL. Over-expression of hypoxia-inducible factor-1alpha induces epithelial-mesenchymal transition in LNCaP cells in vitro and in vivo[J]. Zhonghua Nan Ke Xue,2012,18(1):23-28. doi:10.13263/j.cnki.nja.2012.01.014.
[2]Han YL,Cheng YY,Xu YG. Effect of hypoxia inducible factor-1α on hepatocyte growth factor expression under hypoxic conditions in prostate cancer cell line[J]. China JCancer Prev Treat,2012,18(18):1377-1379.[韩毅力,程永毅,徐永刚.低氧条件下HIF-1α对HGF表达影响的观察[J].中华肿瘤防治杂志,2012,18(18):1377-1379].
[3]Theys J,Jutten B,Habets R,et al. E-cadherin loss associated with EMT promotes radio resistance in human tumor cells[J]. Radiother Oncol,2011,99(3):392-397. doi:10.1016/j.radonc.2011.05.044.
[4]Luo Y,He DL,Jiang YG,et al. Role of beta- catenin signaling pathway in EMT of human prostate cancer induced by HIF-1alpha [J]. Zhong Hua Yi Xue Za Zhi,2010,90(16):1131-1136.
[5]Szala S,Jarosz M. Tumor blood vessels[J]. Postepy Hig Med Dosw (Online),2011,65:437-446.
[6]Zhao N,Sun BC,Sun T,et al. Hypoxia-induced vasculogenic mimicry formation via VE-cadherin regulation by Bcl-2[J]. Med Oncol,2012,29(5):3599-3607. doi:10.1007/s12032-012-0245-5.
[7]Zhang Q,Bai XL,Chen W,et al. Wnt/β- catenin signaling enhances hypoxia-induced epithelial-mesenchymal transition in hepatocellular carcinoma via crosstalk with hif- 1α signaling[J]. Carcinogenesis,2013,34(5):962-973. doi:10.1093/carcin/bgt027.
[8]Chen J,Imanaka N,Chen J,et al. Hypoxia potentiates notch signaling in breast cancer leading to decreased E- cadherin expression and increased cell migration and invasion[J]. Br J Cancer,2010,102(2):351-360. doi:10.1038/sj.bjc.6605486.
[9]Yan W,Fu Y,Tian D,et al. PI3 kinase/Akt signaling mediates epithelial- mesenchymal transition in hypoxic hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun,2009,382(3):631-636. doi:10.1016/j.bbrc.2009.03.088.
[10]Copple BL. Hypoxia stimulates hepatocyte epithelial to mesenchymal transition by hypoxia-inducible factor and transforminggrowth factorbeta-dependent mechanisms[J]. Liver Int,2010,30(5):669-682. doi:10.1111/j.1478-3231.2010.02205.x.
[11]Wang YX,Jiang YG,Luo Y,et al. Hypoxia inducible factor-1αdependent epithelial to mesenchymal transition under hypoxic conditions in prostate cancer cells[J]. Journal of Capital Medical University,2014,35(3):278-283.[王永兴,姜永光,罗勇,等.缺氧微环境下缺氧诱导因子-1α对前列腺癌细胞上皮间质转化的影响[J].首都医科大学学报,2014,35(3):278-283]. doi:10.3969/j. issn.1006-7795.2014.03.003.
[12]Cannito S,Novo E,Compagnone A,et al. Redox mechanisms switch on hypoxia-dependent epithelial-mesenchymal transition in cancer cells[J]. Carcinogenesis,2008,29(12):2267-2278.
[13]Guo XC,Shi Y,Chen L,et al. Mechanism of HIF induced epithelial mesenchymal transition[J]. Acad J Chin PLA Med Sch,2015,36(1):90-93.[郭晓川,石燕,陈丽,等.缺氧诱导因子对肿瘤细胞上皮-间质转化的诱导机制[J].解放军医学院学报,2015,36(1):90-93]. doi:10.3969/j.issn.2095-5227.2015.01.028.
[14]Grzegrzolka J,Biala M,Wojtyra P,et al. Expression of EMT Markers SLUG and TWIST in Breast Cancer[J]. Anticancer Res,2015,35(7):3961-3968.
[15]Li S,Zhang J,Yang H,et al. Copper depletion inhibits CoCl2-induced aggressive phenotype of MCF-7 cells viadownregulation of HIF-1 and inhibition of Snail/Twist-mediated epithelial-mesenchymal transition [J]. Sci Rep,2015,5:12410. doi:10.1038/srep12410.
[16]Hui QY,Wei XP. Role of Epithelial Mesenchymal Transition in Cancer Carcinogenesis and Progression[J]. China Cancer,2013,22 (3):219-222.[惠起源,魏晓萍.上皮间质转化在肿瘤发生发展中的作用[J].中国肿瘤,2013,22(3):219-222].
(2015-12-09收稿2016-01-18修回)
(本文编辑陆荣展)
Effects of HIF-1α on epithelial-mesenchymal transition,invasion and migration in colorectal cancer cells
WU Lili1,SUN Huizhi1,SUN Ran2,ZHAO Nan1,3,WANG Yong1,GU Qiang1,3,DONG Xueyi1,3,LIU Fang1,3,SUN Baocun1,3,4
1 Tianjin Medical University,Tianjin 300070,China;2 Tianjin Nan Kai Hospital;3 Tianjin Medical University General Hospital;4 Tianjin Medical University Cancer Institute and Hospital Corresponding Author E-mail:sunbaocun@aliyun.com
Objective To explore whether hypoxia could promote epithelial-mesenchymal transition(EMT)in various differentiated colorectal cancer cells,and analyse the effect of hypoxia on invasion and migration of colorectal cancer cells. Methods HCT116(poorly differentiated)and HT-29(highly differentiated)colorectal adenocarcinoma cells were selected respectively. The morphological changes of two cell lines were observed after 0,10,25,50,100 and 150 mg/L cobalt chloride(CoCl2)treatment for 48 h. The expression of hypoxia-inducible factor-1α(HIF-1α)protein was analysed after 0,10,25,50,100 and 150 mg/L CoCl2treatment for 48 h. An optimal concentration of CoCl2was then selected. Methylthiazolyl tetrazolium(MTT)assay was used to detect the proliferation of two kinds of colorectal cancer cells induced by CoCl2at different time points(0,24,48,72 and 96 h),and to select an optimal time. Under the optimal concentration and time conditions,the HCT116 and HT- 29 cells were processed by hypoxia(hypoxia group)and normoxia(normoxic group). Transwell invasion assay and Wound healing assay were used to detect cell invasion and migration in two groups. Western blot assay and RT-PCR were used to detect protein and mRNA expression levels of HIF-1α,E-cadherin and Vimentin in two groups. Results Two kinds of cells showed obvious morphological changes after 50 mg/L CoCl2treatment for 48 h. HIF-1α protein level first increased and then decreased in two groups of cells with the increased concentration of CoCl2,and 50mg/L CoCl2was the optimal concentration(P<0.05). The cell proliferation showed a tendency to decrease after the increase in both kinds of cells with or without hypoxia for 0-96 h(P<0.05),and 48 h was the optimal time. The transmembrane number and cell migration rate were significantly more in hypoxia group than those of normoxic group(P<0.05). The protein and mRNA levels of HIF-1α and Vimentin were significantly higher in hypoxia group than those of normoxic group in HCT116 and HT-29 cell lines(P<0.05). E-cadherin protein and mRNA levels were significantly lower in hypoxia group than those of normoxic group(P<0.05). Conclusion Hypoxia can promote EMT in different differentiated colorectal cancer cells,and can enhance invasion and migration of two kinds of colorectal cancer cells.
hypoxia-inducible factor1,α subunit;colorectal neoplasms;epithelial-mesenchymal transition;cell proliferation;neoplasm invasion;cell movement
R735.34
A
10.11958/20150385
国家自然科学基金重点项目(81230050);国家自然科学基金面上项目(81572872)
1天津医科大学(邮编300070);2天津市南开医院;3天津医科大学总医院;4天津医科大学肿瘤医院
吴丽丽(1989),女,硕士在读,主要从事肿瘤血管生成拟态的分子调控机制研究
E-mail:sunbaocun@aliyun.com

