双黄连联合万古霉素对耐甲氧西林金黄色葡萄球菌生物被膜抑制作用的研究
张彩萍 谢家祺 濮 娜 倪宏伟 吴 莹*
(大连大学附属新华医院ICU,辽宁 大连 116021)
双黄连联合万古霉素对耐甲氧西林金黄色葡萄球菌生物被膜抑制作用的研究
张彩萍 谢家祺 濮 娜 倪宏伟 吴 莹*
(大连大学附属新华医院ICU,辽宁 大连 116021)
【摘要】目的 研究双黄连联合万古霉素对MRSA生物被膜的影响。方法 平板培养法培养MRSA生物被膜,银染法鉴定。96孔平板培养,分为四组:空白对照组(A组)、双黄连组(B组)、万古霉素组(C组)、双黄连+万古霉素组(D组)。经上述不同药物对生物被膜处理后,比色法测定藻酸盐含量,MTT法测定各组活菌计数。结果 ①B、C、D组作用后藻酸盐含量明显低于A组(P<0.05),D组分别较B组及C组低(P<0.05);②B、C、D组作用后活菌计数明显低于A组(P<0.05),D组活菌计数亦分别较B组及C组低(P<0.05)。结论 双黄连可抑制MRSA生物被膜合成,并有显著抑菌作用,与万古霉素有协同作用。
【关键词】生物被膜;MRSA;双黄连;万古霉素
耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)感染已被公认为世界范围内的三大最难解决的感染性疾病之一,且其耐药性越来越严重[1]。传统的糖肽类抗生素(如万古霉素、替考拉宁等)对于MRSA的敏感性及临床疗效逐年降[2]。而导致MRSA耐药的重要机制之一即生物被膜(Biofilm)形成,生物被膜是指附着在有生命体或无生命体表面的由细菌自身产生的胞外多聚基质包裹的菌细胞结构群体。成熟生物被膜包裹的细菌较浮游状态细菌对抗生素的敏感性降低10~1000倍[3]。而近年研究表明,中药在这一领域具有独特优势[4]。本研究旨在观察双黄连联合万古霉素对MRSA生物被膜的抑制作用[4],为解决MRSA感染这一难题提供新思路。
1 材料与方法
1.1 实验菌株:采用金黄色葡萄球菌(MRSA)ATCC33591菌株(丰寿上海生物科技有限公司)。
1.2 抗菌药物:注射用盐酸万古霉素(礼来苏州制药有限公司);注射用双黄连(哈药三精)。
1.3 实验方法
1.3.1 MIC(最低抑菌浓度)值测定:采用微量肉汤稀释法分别测定万古霉素及双黄连单独应用对受试菌株生物被膜形成前后的MIC值。
1.3.2 MRSA生物被膜的建立与鉴定:①生物被膜的建立:取过夜培养的MRSA,用MH肉汤配置成1×106cfu/mL菌悬液,加入96孔板中,同时每孔中放入已高压灭菌的硅胶片,35 ℃温箱中培养,每48 h更换一次培养基,连续培养7 d后即可形成稳定的生物被膜。②快速银染法鉴定生物被膜:经灭菌生理盐水多次充分漂洗,去掉浮游菌;2.5%戊二醛PBS溶液固定,饱和CaCl2溶液结合5% AgNO3染色,1%对苯二酚溶液显色,5%NaS2O3溶液固定,样品经过上述处理后,若呈灰黑色,则可鉴定为细菌生物被膜[5]。
1.3.3 分组:采用96孔平板进行药物实验,按照所加药物不同,菌液分为4组,每组15孔。分组如下:①空白对照组(蒸馏水);②双黄连组;③万古霉素组;④双黄连+万古霉素组。每孔均加入菌悬液100 μL,实验药物100 μL,药物浓度均采用1 MIC,即每种药物的最低抑菌浓度。
1.3.4 以藻酸盐含量测定各组药物对MRSA生物被膜合成的影响[6]:取经过各药物处理的MRSA菌液100 L1(106cfu/mL),加入表面铺有滤膜的培养基中培养24 h,表面生长物加入2 mL生理盐水中,震荡均匀,离心7000 r/min,10 min除去细菌,取0.5 mL上清液0.95% Na2B4O7•10H2O/H2SO4中,冰浴混匀,加热至100 ℃,10 min,冰浴冷却,再加入0.1 mL 0.125% 咔唑/乙醇,混匀加热至100 ℃,15 min,冰浴冷却至室温,酶标仪530 nm处测OD值,标准曲线通过葡萄糖醛酸内酯经同样处理绘制。
1.3.5 药物对存活细菌数的影响[9]:①活菌计数标准曲线的绘制:取过夜培养的MRSA,调节至0.5麦氏浓度,5倍倍比稀释8次,各取100 L1入96孔板,加入MTT 20 L1,35 ℃培育3 h,加入裂解液终止反应,0.5 h后酶标仪595 nm处测定OD值,以此为横坐标,活菌数为纵坐标绘制标准曲线。②药物对存活细菌数的影响:取出培养好的硅胶片,无菌蒸馏水冲洗后,置入含有各药物及对照组的96孔平板中,35 ℃温箱中培养24 h,MTT法测定各组OD值,标准曲线对应活菌计数。
1.4 统计学方法:藻酸盐浓度及存活细菌数量均为计量资料,组间比较采用单因素方差分析。 SPSS11.5统计软件进行分析,P<0.05具有统计学意义。
2 结 果
2.1 生物被膜形成前后各药物的MIC值:万古霉素对于MRSA质控菌株生物被膜形成前后的MIC值为1 μg/mL vs 3.4 μg/mL;双黄连对于MRSA质控菌株生物被膜形成前后的MIC值为8.6 μg/mL vs 15.2 μg/mL。
2.2 银染法鉴定生物被膜:可见视野内灰黑色生物被膜覆盖,层次多,致密,偶可见球菌形态。
2.3 在MRSA生物被膜形成过程中进行干预对藻酸盐含量的影响:组间两两比较均具有显著性差异。分述如下:与空白对照组相比,双黄连组、万古霉素组、双黄连+万古霉素组藻酸盐含量均降低,差别有显著性(P值均<0.05)。三组组间比较亦有显著性差异,其中以双黄连+万古霉素组藻酸盐含量最低(P<0.05),万古霉素组则较双黄连组低(P<0.05)。见表1。
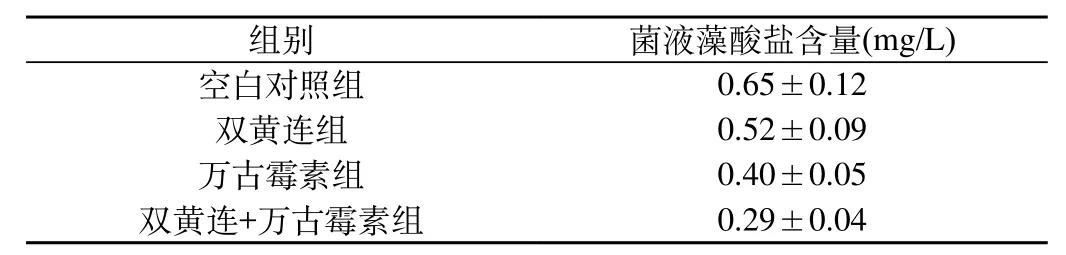
表1 各组藻酸盐含量测定结果
2.4 MRSA生物被膜形成后,药物干预对存活细菌数的影响:①MTT活菌计数标准曲线方程为:y=8.21x-1.33,r=0.9981,线性范围为4.5 ×104~1.7×108cfu/mL。②组间比较均有显著性差异,其中:双黄连组、万古霉素组、双黄连+万古霉素组活菌悬液浓度与空白对照组相比均减低,差别有显著性(P值分别为0.001、0.001和0.001);双黄连+万古霉素组活菌悬液浓度分别较双黄连组、万古霉素组均降低,差别有显著性(P值分别为0.001和0.015)。万古霉素组与双黄连组比较,活菌浓度降低,差别有显著性(P值为0.001)。见表2。
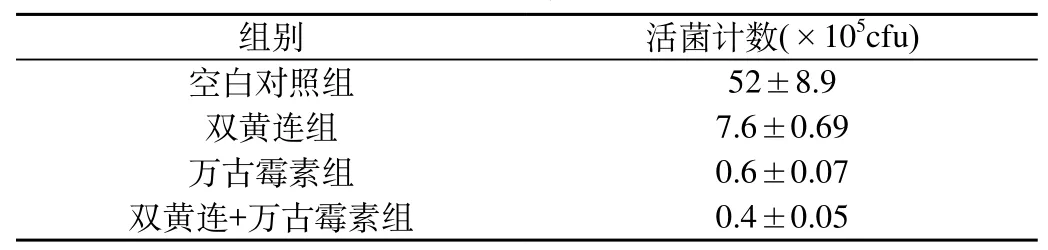
表2 各组活菌计数测定结果
3 讨 论
MRSA感染主要涉及皮肤软组织、肺炎、血行感染及骨关节感染,其中以医院获得性感染较为多见,与侵入性操作(特别是中心静脉导管、假体等植入物)密切相关[1,6]。但近年来,社区获得性MRSA感染亦成增加趋势[7]。一旦发生MRSA感染,患者病死率、致残率及医疗费用均大幅增加。目前,糖肽类抗菌药物万古霉素、替考拉宁仍然是治疗MRSA的最有效药物[8]。但自从日本报道了全球第一例万古霉素敏感性降低的金黄色葡萄球菌,这种情况有所改变[10]。2002年6月在美国又报道了第一例万古霉素耐药的金黄色葡萄球菌[10](Vancomycin-resistant Staphylococcusaureus,VRSA)。国内研究中也有对万古霉素、替考拉宁中介敏感的金黄色葡萄球菌报道。而生物被膜形成则是MRSA耐药性的形成的重要机制之一[11,13]。
生物被膜(biofilm)也称为菌膜(Bacterial biofilm),是指细菌在不利于其生长的环境下产生藻酸盐多糖,使细菌相互粘连形成膜状附着于病灶表面或导管内,可引起一系列病理改变。临床上特别是ICU病房常见的致病菌包括铜绿假单胞菌、不动菌属、葡萄球菌(包括MRSA)、肠杆菌、真菌等均易产生生物被膜,使细菌抵御抗菌药物的杀伤和逃逸宿主的免疫,从而导致临床相关感染的难治性[11-15]。本研究也发现,MRSA生物被膜形成后,抗菌药物MIC值明显升高,提示抗菌活性下降。抑制生物被膜形成,对于改善MRSA耐药问题及万古霉素的临床疗效有重大意义。
在第二阶段的研究中,我们发现万古霉素及双黄连均有抑制MRSA生物被膜形成的作用,且有明显协同作用。分析其原因,可能与两种药物本身的抗菌活性有关[16],活菌数量减少,BF形成减少,藻酸盐含量减少。具体机制仍待进一步研究阐明。但可提示临床早期联合用药的可行性。
在第三阶段研究中,发现双黄连本身即具有一定的抗MRSA抗菌活性,而与万古霉素合用后,协同作用明显。考虑与双黄连增加万古霉素向细菌体内的渗透性有关。其具体机制亦有待进一步研究阐明。此部分研究结果与其他研究中中药制剂(如鱼腥草、黄芩等)亦具有一定的抗MRSA或铜绿假单胞菌活性的结果一致[4,12]。都证明中西医结合治疗感染性疾病的可行性。
此外,本研究的局限性在于实验全程均采用试剂公司购置的MRSA质控菌株,虽保证样本生物特性的一致性,但其与临床感染标本中分离出的MRSA仍有不同[17-18]。故其临床应用性仍待进一步研究完善。
综上,在体外实验中,双黄连联合万古霉素能显著抑制MRSA生物被膜的形成,同时,二者对于MRSA具有显著的协同抗菌作用。这将为临床MRSA感染提供一个新方向。
参考文献
[1] Harris SR,Feil EJ,Holden MT,et al.Evolution of MRSA during hospital transmission and intercontinental spread[J].Science,2010,327(5964):469-474.
[2] 逢崇杰,巩路,田彬,等.替考拉宁和万古霉素对临床分离耐甲氧西林金黄色葡萄球菌体外抗菌活性比较[J].中国抗感染化疗杂志,2005,5(6):360-361.
[3] 姜越,张德纯.表皮葡萄球菌生物被膜形成机制及调控[J].中国微生态学杂志,2011,23(11):1056-1057.
[4] 中华人民共和国卫生部.中药新药临床研究指导原则[M].3版.北京:人民卫生出版社,1997:30.
[5] Wang C,Li M,Dong D,et al.Role of clpP in biofilm formation and virulence of staphylococcus epidermidis [J].Microbes Infect,2007,9(11):1376-1383.
[6] 小林宏行.细菌生物被膜的基础与临床[J].中国临床药理学杂志,1999,15(4):299-307.
[7] Amaral MM,Coelho LR,Flores RP,et al.The predominant variant of the Brazilian epidemic clonal complex of methicillin-resistant Staphylococcus aureus has an enhanced ability to produce biofilm and to adhere to and invade airway epithelial cells[J].J Infect Dis,2005,192(5):801-810.
[8] Rose WE,Poppens PT.Impact of biofilm on the in vitro activity of vancomycin alone and in combination with tigecycline and rifampicin against Staphylococcus aureus[J].J Antimicrob Chemother,2009,63(3):485-488.
[9] Clinical and Laboratory Standards Institute.M100-S23:Performance Standards for Antimicrobial Susceptibility Testing; Twenty-third Informational supplement[M].Wayne,PA:Clinical and Laboratory Standards Institue,2013.
[10] Abouelfetouh AA,Nafee NA,Moussa NK.The degree of virulencedoes not necessarily affect MRSA biofilm strength and response to photodynamic therapy[J].Microb Pathog,2016,91:54-60.
[11] Suzuki N,Ohtaguro N,Yoshida Y,et al.A Compound Inhibits Biofilm Formation of Staphylococcus aureus from Streptomyces[J].Biol Pharm Bull,2015,38(6):889-892.
[12] 梁晓谊,朱海英,刘笑梅,等.两组中药组方对糖尿病足产ESBLs大肠埃希菌和MRSA体外药物敏感试验结果分析[J].检验医学,2015,30(3):261-264.
[13] D'Atanasio N,Capezzone de Joannon A,Mangano G,et al.A New Acid-oxidizing Solution: Assessment of Its Role on Methicillinresistant Staphylococcus aureus (MRSA) Biofilm Morphological Changes[J].Wounds,2015,27(10):265-273.
[14] Murugan K,Usha M,Malathi P,et al.Biofilm forming multi drug resistant Staphylococcus spp.among patients with conjunctivitis[J]. Pol J Microbiol,2010,59(4):233-239.
[15] Díaz-Rodríguez P,Landin M,Rey-Rico A,et al.Bio-inspired porous SiC ceramics loaded with vancomycin for preventing MRSA infections[J].J Mater Sci Mater Med,2011,22(2):339-347.
[16] Al-Bakri AG,Othman G,Afifi FU.Determination of the antib iofilm,antiadhesive,and anti-MRSA activities of seven Salvia species[J].Pharmacogn Mag,2010,6(24):264-270.
[17] Mirani ZA,Jamil N.Effect of sub-lethal doses of vancomycin and oxacillin on biofilm formation by vancomycin intermediate resistant Staphylococcus aureus[J].J Basic Microbiol,2011,51(2):191-195.
[18] Haisma EM,Rietveld MH,de Breij A,et al.nflammatory and antimicrobial responses to methicillin-resistant Staphylococcus aureus in an in vitro wound infection model[J].PLoS One,2013,8(12):e82800.
中图分类号:R969.3
文献标识码:B
文章编号:1671-8194(2016)07-0001-03
基金项目:大连市卫生局科技自主创新与普及推广项目(2011-95)
*通讯作者:E-mail:676893314@163.com
T he Effect of Shuanghuanglyan and V ancom ycyn on Byofylm of M ethycyllyn-resystant Staphylococcus A ureus(M R SA)
ZHANG Cai-ping, XIE Jia-qi, PU Na, NI Hong-wei, WU Ying*
(Department of ICU, Affliated Xinhua Hospital of Dalian University, Dalian 116021, China)
[Abstract]Objective To observe the effect of Shuanghuanglian and vancomycin on the biofilm of MRSA. Methods Modified plate culture method was used to establish in vitro bacterial biofilm model, which was identified by silver nitrate staining. The bacteria were cultured in 96 hole plate and divided into four groups: blank control group (group A), shuanghuanglian group(group B), vancomycin group(group C), V+S group(group D). After the biofilm was treated by vancomycin and/or shuanghuanglian, alginate content was detected by colorimetric method and the number of viable bacteria was measured by MTT method. Results ①The alginate content of groupB, C, D was significantly lower than group A (P<0.05), and which of the group D was lowest. ②The number of viable bacteria of group B, C, D was significantly lower than group A (P<0.05), and which of the group D was lowest too. Conclusion Shuanghuanglian can inhibit synthesis of MRSA biofilm, and has significant inhibitory effect which showed synergistic effect with vancomycin.
[Key words]Biofilm; MRSA; Shuanghuanglian; Vancomycin

