162个显微受精完全失败周期的原因分析
史艳彬 张振强 蒋树艳 李家亓
[摘要] 目的 探討显微受精完全失败的原因和应对策略。 方法 选取本院生殖内分泌科2005年1月~2014年1月收治的经历显微受精完全失败的138位患者的162个周期为A组,曾经发生过完全受精失败但再次助孕有胚胎移植的72位患者的96个周期为B组,两次以上反复完全受精失败的27位患者的33个周期为C组,分析3组患者的年龄、基础内分泌情况、不孕原因、窦卵泡数、用药方案、获卵数、MⅡ卵数等。 结果 B组采卵日E2水平[(1802.8±88.1)pg/ml]显著高于A、C组[(1624.2±195.3)、(1739.4±277.3)pg/ml](P=0.02);B组的获卵数[(3.5±0.6)个]显著多于A、C组[(1.7±0.1)、(2.4±0.3)个](P=0.01);B组MⅡ卵数[(2.9±0.4)个]显著多于A、C组[(1.3±0.1)、(2.1±0.2)个](P=0.01)。B组同一患者在发生完全受精失败周期的获卵数、MⅡ卵数显著少于有胚胎移植周期(P<0.05)。B组的妊娠结局:HCG阳性率为50%,生化妊娠率为16%,临床妊娠率为34%,仅2人成功分娩,活产率为2%。 结论 获卵数和成熟卵数过少可能是显微受精完全失败的最主要原因,提高其获卵数和成熟卵数或许可以增加成功妊娠的机会,但是,有胚胎移植患者的活产率仍很低。
[关键词] 受精失败;卵胞浆内单精子注射;成熟卵母细胞
[中图分类号] R271.14 [文献标识码] A [文章编号] 1674-4721(2016)03(a)-0107-04
[Abstract] Objective To discuss the reason and coping strategy for complete failure of micro fertilization. Methods 162 periods of 138 patients having complete failure of micro fertilization were selected as group A,96 periods of 72 patients having embryo transplantation by assisted reproduction after having previous complete fertilization failure were selected as group B,while 33 periods of 27 patients with more than twice complete failure of fertilization were selected as group C,and patients were treated by department of reproductive endocrinology of our hospital from January 2005 to January 2014.The age,baseline endocrine,reasons of infertility,antral follicle count,therapeutic regimen,retrieved oocyte number,and oocyte number of MⅡ and so on in three groups was analyzed respectively. Results E2 level was significantly higher on OR in group B [(1802.8±88.1) pg/ml] than that in group A and group C [(1624.2±195.3) pg/ml,(1739.4±277.3) pg/ml] (P=0.02).The retrieved oocyte number [(3.5±0.6) oocytes] in group B was significantly higher than that in group A and group C [(1.7±0.1) oocytes,(2.4±0.3) oocytes] (P=0.01).MⅡoocyte number in group B [(2.9±0.4) oocytes] was significantly higher than that in group A and group C [(1.3±0.1) oocytes,(2.1±0.2) oocytes] (P=0.01).Retrieved oocyte number and MII oocyte number during the complete fertilization failure period was significantly fewer than that of having embryo transplantation period in the same patient of group B (P<0.05).Pregnancy outcome of group B:the positive rate of HCG was 50%,the biochemical pregnancy rate was 16%,the clinical pregnancy rate was 34%,only 2 were successful delivery,and the living birth rate was 2%. Conclusion Too fewer retrieved oocyte number and mature oocyte number are possibly the main reason for complete failure of micro fertilization,therefore,to elevate the retrieved oocyte number and mature oocyte number may increase the opportunity of successful pregnancy.However,the live birth rate is still low in patients with embryo transplantation.
[Key words] Fertilization failure;Intracytoplasmic sperm injection;Mature oocyte
随着辅助生殖技术的进步和实验室高端设备的应用,试管婴儿的受精率已接近70%~80%[1],然而还会偶尔遇到完全受精失败(total fertilization failure,TFF)这个令人难以接受的结果,这不仅给患者带来重大的经济损失和心理压力,而且对临床工作也是一个重大考验。
TFF是指所有卵均未能受精,在体外受精(in vitro fertilization,IVF)周期的发生率是5%~10%[2],卵胞质内单精子注射(intracytoplasmic sperm injection,ICSI)周期的发生率是2%~3%[3]。据文献报道,TFF重复出现率接近30%[4],这意味着TFF并不少见,但是关于显微受精后仍然失败的报道很少见。本研究探讨反复显微受精失败的原因和应对策略,现报道如下。
1 资料与方法
1.1 一般资料
选择本院生殖内分泌科2005年1月~2014年1月收治的经历ICSI TFF的138位患者的162个周期为A组,曾经历过TFF再次助孕有胚胎移植的72位患者的96个周期为B组,两次以上TFF的27位患者的33个周期为C组。
1.2 记录的参数
年龄、体重指数(body mass index,BMI),酶联免疫法测定基础血清雌二醇(estradiol,E2)、卵泡刺激激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)水平,窦卵泡数(antral follicle count,AFC),不孕的病因,不孕的时间,男方精子密度和畸精率,促排卵方案,促排卵时间,促排卵药的剂量,给予人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)日血清的E2水平,HCG日直径>17 mm的卵泡数,HCG日内膜厚度,采卵日(oocyte retrieve,OR)血清E2水平,孕酮(progesterone,P)水平,获卵数,第二次减数分裂(meiosis Ⅱ,MⅡ)卵数等指标。
1.3 超促排卵过程
3组患者采用拮抗剂、短方案、微刺方案或长方案进行个体化控制性超促排卵。阴式超声监测卵泡发育和血清E2水平,当至少有3个卵泡平均直径达到17 mm以上时给予HCG 10000 IU,36~38 h采卵。
1.4 显微注射
拾卵获得的卵冠丘复合物在37℃,6%CO2两气培养箱中前培养4~6 h,用透明质酸酶,直径150 μm左右的巴斯德吸管机械性吹打剥除颗粒细胞,将MⅡ卵放置在G-IVF-plus(Vitrolife,瑞典)的微滴中,37℃,6%CO2两气培养箱中继续培养直至显微注射。所有的周期均由本中心資深且能熟练进行显微操作的胚胎师操作。ICSI后16~18 h检查是否出现双原核和双极体。ICSI后第3天进行胚胎移植。受精后对患者进行黄体支持。移植后14日血β-HCG<10 mIU/ml诊断为未妊娠,血β-HCG>10 mIU/ml但后来超声下始终未见妊娠囊诊断为生化妊娠,移植35 d后行腹部超声,宫腔内发现妊娠囊为临床妊娠。
1.5 统计学处理
全部资料和数据应用SPSS 13.0软件进行统计分析,计量资料采用t检验,计数资料采用χ2检验,当组中数据<5时应用Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
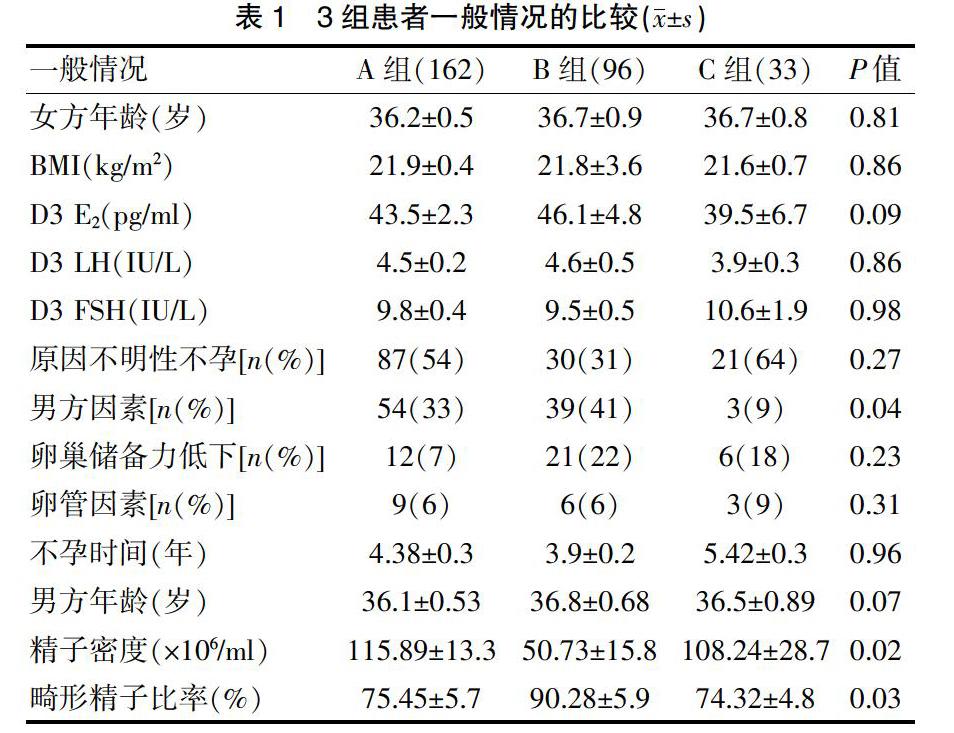
2.1 3组患者一般情况的比较
3组患者的年龄、BMI,月经来潮第3天(D3)E2水平、LH水平、FSH水平,原因不明性不孕、卵巢储备力低下、卵管因素等不孕原因以及不孕时间差异均无统计学意义(P>0.05)(表1)。
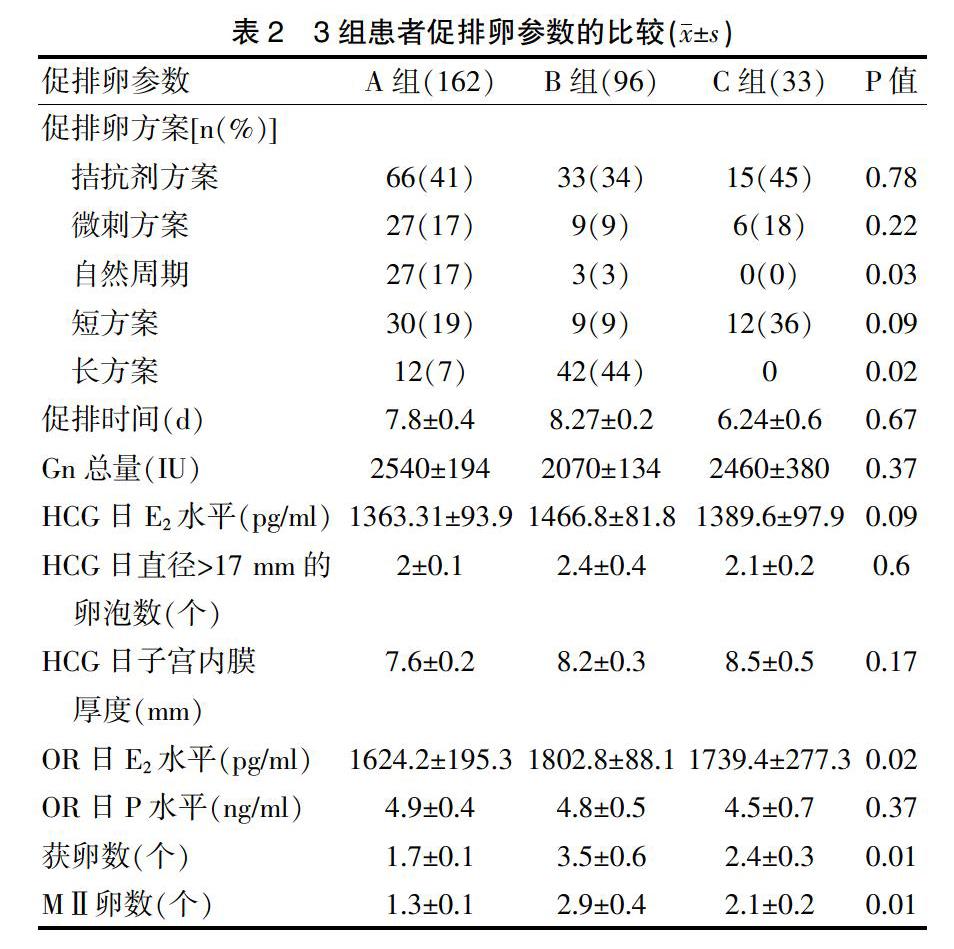
2.2 3组患者促排卵参数的比较
3组的部分促排卵方案、促排时间、Gn总量、HCG日E2水平、HCG日直径>17 mm的卵泡数、HCG日子宫内膜厚度、OR日P水平差异均无统计学意义(P>0.05)(表2)。
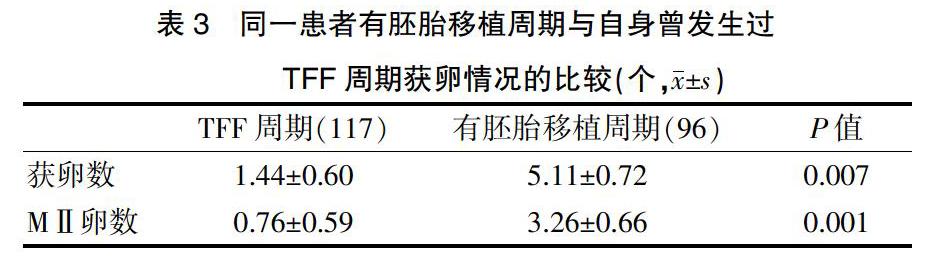
2.3 B组同一患者有胚胎移植周期与自身曾发生过TFF周期获卵数的比较
TFF周期的获卵数显著少于有胚胎移植周期(P=0.007),TFF周期的MⅡ卵数显著少于有胚胎移植周期(P=0.001)。97%(114/117)的TFF周期MⅡ卵数<2个,而73%(70/96)的有胚胎移植周期获得3个以上的MⅡ卵。
2.4 B组的妊娠结局
HCG阳性率为50%(48/96),生化妊娠率为16%(15/96),临床妊娠率为34%(33/96),仅2人成功分娩,活产率为2%(2/96)。
3 讨论
辅助生殖技术中TFF和较差妊娠结局的一个最主要的原因是卵巢低反应导致获卵数和成熟卵母细胞少,卵子质量差[5-7]。Bar-Ami等[8]报道,获卵数≤3个是TFF的一个重要的风险因素。Goudakou等[9]报道,在获卵数≤5个的周期中,患者没有胚胎移植的风险将大大提高。Mao等[10]认为,受精失败经常发生在注射1~2个卵时,风险高达37%,但是如果注射5个以上卵时,风险将降至0.8%。本研究的数据与以前的报道观点一致,91%(147/162)的TFF周期获卵数<2个,随着卵子和成熟卵母细胞数目的增加,可以大大降低受精失败的风险。以前的研究也提示,在同一患者的不同采卵周期,获卵数和成熟卵数在移植周期都显著高于受精失败周期[5]。
卵母细胞的成熟程度也是影响受精结局的一个重要因素[11]。临床医生通常通过卵泡的直径评估卵母细胞的成熟度,但这两者并不总是统一的。卵母细胞的成熟不仅包括细胞核的成熟,还与细胞质的成熟密切相关,这是一个漫长的过程[12]。细胞核的成熟主要是染色体的分离,而细胞质的成熟包括细胞器和细胞骨架适当的空间结构和动力学,这些都是完成受精和随后胚胎发育所必需的。试管婴儿未受精周期的相关研究已揭示了纺锤体和分裂间期的微管异常,这暗示着细胞质和细胞核成分的缺陷也是受精失败的关键原因[13]。卵母细胞中特殊的细胞质异形表型也暗示着卵母细胞本身的缺陷,这将影响卵母细胞的受精能力[14]。与正常细胞质内含物的卵母细胞比较,如果细胞内有较多的包涵体,则受精率、胚胎卵裂率会显著降低,未来胚胎质量发育差[15]。与男性因素不孕比较,女性因素不孕患者卵母细胞的包涵体显著增高。>35岁女性细胞质内的包涵体也显著高于<35岁女性[16]。以前的研究也认为,与碎裂的第一极体比较,完整的第一极体可以预测更高的受精率和囊胚形成率,然而最近的研究也挑战了这个假说,最近的研究显示随着体外培养时间的延长,极体的形态学分级也会发生很大变化[17]。有研究发现,卵母细胞形状不规则、透明带颜色发黑、卵周间隙异常增大等与受精率降低无关,由此可以得出结论——这些卵母细胞的异形表现,仅是差异的表现,而并非异常[18]。
本研究结果显示,TFF治疗周期最常用的方案是拮抗剂方案(41%),短方案(19%),微刺方案(17%),这反映了TFF患者的卵巢反应较差,而在有胚胎移植的周期最常用的方案是长方案(44%),这提示成功的周期有更好的卵巢储备。与卵管性不孕比较,TFF或受精率较低更容易发生于原因不明性不孕。本研究的数据也支持这个观点:原因不明性不孕可能是TFF的一個原因(54%);良好结局患者最主要的原因是男性因素(41%,39/96)。有研究显示,精子形态异常与受精和胚胎质量呈负相关,很多研究也都证实了这种假说。ICSI中,精子的形态学质量在影响受精、植入和妊娠的过程中发挥重要的作用,精子头部的形态学异常,譬如空泡的出现可能会导致较差的实验室和临床结局[19]。传统ICSI失败的患者应用显微注射精子选择系统(intracytoplasmic morphologically selected sperm injection,IMSI)后,受精率(89% vs 79%)、种植率(25% vs 5.9%)和妊娠率(20% vs 7%)都有显著提高[20]。
总之,卵巢储备功能下降和反应不良是受精失败的一个重要因素。曾经显微受精失败并不意味着下一个周期不会成功。在新的周期要选择更佳的促排卵方案,以增加获卵数和成熟卵母细胞的数量。此外,卵母细胞细胞质的成熟度也是影响受精结局的关键因素,胚胎师应根据经验适时剥除颗粒细胞和选择最佳的注射时间,以最大程度地保证受精。
[参考文献]
[1] Swain JE,Pool TB.ART failure:oocyte contributions to unsuccessful fertilization[J].Hum Reprod Update,2008,14(5):431-446.
[2] Mahutte NG,Arici A.Failed fertilization:is it predictable? [J].Curr Opin Obstet Gynecol,2003,15(3):211-218.
[3] Flaherty SP,Payne D,Matthews CD.Fertilization failures and abnormal fertilization after intracytoplasmic sperm injection[J].Hum Reprod,1998,13(Suppl 1):155-164.
[4] Bhattacharya S,Hamilton MP,Shaaban M,et al.Conventional in-vitro fertilisation versus intracytoplasmic sperm injection for the treatment of non-malefactor infertility:a randomised controlled trial[J].Lancet,2001,357(9274):2075-2079.
[5] Combelles CM,Morozumi K,Yanagimachi R,et al.Diagnosing cellular defects in an unexplained case of total fertilization failure[J].Hum Reprod,2010,25(7):1666-1671.
[6] Esfandiari N,Javed MH,Gotlieb L,et al.Complete failed fertilization after intracytoplasmic sperm injection—analysis of 10 years′ data[J].Int J Fertil Womens Med,2005,50(4):187-192.
[7] Melie NA,Adeniyi OA,Igbineweka OM,et al.Predictive value of the number of oocytes retrieved at ultrasound-directed follicular aspiration with regard to fertilization rates and pregnancy outcome in intracytoplasmic sperm injection treatment cycles[J].Fertil Steril,2003,80(6):1376-1379.
[8] Bar-Ami S,Zlotkin E,Brandes JM,et al.Failure of meiotic competence in human oocytes[J].Biol Reprod,1994,50(5):1100-1107.
[9] Goudakou M,Kalogeraki A,Matalliotakis I,et al.Cryptic sperm defects may be the cause for total fertilization failure in oocyte donor cycles[J].Reprod Biomed Online,2012,24(2):148-152.
[10] Mao L,Lou H,Lou Y,et al.Behaviour of cytoplasmic organelles and cytoskeleton during oocyte maturation[J].Reprod Biomed Online,2014,28(3):284-299.
[11] Combelles CM,Morozumi K,et al.Diagnosing cellular defects in an unexplained case of total fertilization failure[J].Hum Reprod,2010,25(7):1666-1671.
[12] Ozdegirmenci O,Dilbaz S,Cinar O,et al.Can serum oestradiol be a predictor of quality of oocytes and embryos,maturation of oocytes and pregnancy rate in ICSI cycles?[J].Gynecol Endocrinol,2011,27(4):279-285.
[13] Grow DR,Oehninger S,Seltman HJ,et al.Sperm morphology as diagnosed by strict criteria:probing the impact of teratozoospermia on fertilization rate and pregnancy outcome in a large in vitro fertilization population[J].Fertil Steril,1994,62(3):559-567.
[14] Chemes EH,Rawe YV.Sperm pathology:a step beyond descriptive morphology.Origin,characterization and fertility potential of abnormal sperm phenotypes in infertile men[J].Hum Reprod Update,2003,9(5):405-428.
[15] Ebner T,Moser M,Sommergruber M,et al.First polar body morphology and blastocyst formation rate in ICSI patients[J].Hum Reprod,2002,17(9):2415-2418.
[16] Verlinsky Y,Lerner S,Illkevitch N,et al.Is there any predictive value of first polar body morphology for embryo genotype or developmental potential?[J].Reprod BioMed Online,2003,7(3):336-341.
[17] Balaban B,Urman B.Effect of oocyte morphology on embryo development and implantation[J].Reprod Biomed Online,2006,12(5):608-615.
[18] Nagy ZP,Rienzi LF,Ubaldi FM,et al.Effect of reduced oocyte aging on the outcome of rescue intracytoplasmic sperm injection[J].Fertil Steril,2006,85(4):901-906.
[19] Barlow P,Englert Y,Puissant F,et al.Fertilization failure in IVF:why and what next?[J].Hum Reprod,1990,5(4):451-456.
[20] Souza Setti A,Ferreira RC,Paes de Almeida Ferreira Braga D,et al.Intracytoplasmic sperm injection outcome versus intracytoplasmic morphologically selected sperm injection outcome:a meta-analysis[J].Reprod Biomed Online,2010,21(4):450-455.
[21] Berkovitz A,Eltes F,Yaari S,et al.The morphological normalcy of the sperm nucleus and pregnancy rate of intracytoplasmic injection with morphologically selected sperm[J].Hum Reprod,2005,20(1):185-190.
(收稿日期:2015-09-16 本文編辑:许俊琴)

