利福平抑制地塞米松诱导骨髓间充质干细胞成脂分化的机制研究
韩 宁, 李增春, 蔡郑东, 徐 翀
(1. 同济大学东方医院急诊创伤外科,上海 200120; 2. 同济大学附属第十人民医院骨科,上海 200172; 3. 上海交通大学附属第一人民医院骨科,上海 200080)
·基础研究·
利福平抑制地塞米松诱导骨髓间充质干细胞成脂分化的机制研究
韩 宁1,2, 李增春1, 蔡郑东2,3, 徐 翀1
(1. 同济大学东方医院急诊创伤外科,上海 200120; 2. 同济大学附属第十人民医院骨科,上海 200172; 3. 上海交通大学附属第一人民医院骨科,上海 200080)
目的 明确利福平对糖皮质激素诱导的大鼠骨髓间充质干细胞(bone marrow stroma cell, BMSC)成脂分化的作用。方法 体外培养Sprague-Dawley大鼠BMSC并随机分为4组: 5μg/ml利福平+10-6mol/L地塞米松(A),PBS+10-6mol/L地塞米松(B),5μg/ml利福平(C)和PBS(D)。分别应用罗丹明123结合流式细胞仪方法和酶联免疫吸附法检测 5μg/ml 利福平对BMSC的P糖蛋白活性和胞内地塞米松蓄积浓度影响。各组孵育14d后,分别进行油红O染色和碱性磷酸酶染色,定量检测三酰甘油含量、碱性磷酸酶活力、过氧化物酶体增殖物激活受体γ(PPARγ) mRNA和Runt相关转录因子2(Runx2)mRNA表达。结果 利福平减少BMSC胞内罗丹明123强度和胞内地塞米松蓄积量(P<0.01)。B组诱导BMSC成脂分化、PPARγ mRNA表达增加和三酰甘油含量升高。A组、C组和D组BMSC未发生成脂分化,PPARγ mRNA表达增加和三酰甘油含量无统计学差异。A组BMSC碱性磷酸酶活性和Runx2 mRNA表达最强(P<0.01),B组碱性磷酸酶活性和Runx2 mRNA表达下降(P<0.01)。结论 利福平上调BMSC的P糖蛋白活性,抑制糖皮质激素诱导的成脂分化。
利福平; P糖蛋白; 骨髓间充质干细胞; 糖皮质激素; 成脂分化
骨髓间充质干细胞(bone marrow stromal cell, BMSC)是一种多能干细胞,可被诱导分化为脂肪细胞、成骨细胞、血管内皮细胞和软骨细胞等[1-3]。其中,糖皮质激素诱导BMSC成脂分化,抑制成骨分化被认为是激素性骨质疏松和激素性股骨头坏死的重要机制[4-5]。
高浓度糖皮质激素诱导BMSC成脂分化,抑制BMSC成骨分化,进而导致骨组织内骨髓脂肪化加剧,骨小梁纤细,发生骨质疏松。在股骨头内糖皮质激素诱导BMSC过度成脂分化升高股骨头内压,引发股骨头内缺血致骨坏死[4-6]。前期研究发现全身应用利福平可上调股骨头内P糖蛋白表达,减少股骨头内脂肪化,骨小梁增粗[4]。P糖蛋白是一种膜蛋白,它通过消耗ATP外泵进入胞内的糖皮质激素,降低胞内激素浓度,削弱激素药理作用[7-8]。由于随着糖皮质激素浓度升高,BMSC成脂分化越显著,成骨分化逐渐减弱[9]。推测利福平可能存在增加BMSC细胞膜上P糖蛋白活性,减少了胞内糖皮质激素蓄积,抑制成脂分化的作用。
为证实上述假设,本研究应用利福平增强BMSC的P糖蛋白活性,明确其对BMSC成脂分化的干预作用和机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级Sprague_Dawley(SD)大鼠,体质量250~300g,7周龄,由同济大学实验动物中心提供。
1.1.2 实验材料 高糖DMEM培养液(美国Gibco公司),10%胎牛血清(以色列Beit Haemek有限公司),含0.02%EDTA的0.25%胰蛋白酶(Gibco公司),percoll分离液(Sigma),利福平(Sigma),地塞米松(Sigma),罗丹明123(Sigma),油红O(sigma),细胞裂解液(sigma),培养瓶、24孔板(美国Corning公司),流式细胞仪(美国Becton Drive),地塞米松的ELISA试剂盒(美国Neogen公司),细胞裂解液(Sigma),三酰甘油酶法定量检测试剂盒(上海钰森生物技术有限公司),碱性磷酸酶活力分析试剂盒(上海钰森生物技术有限公司),TrizoI 试剂(Sigma),ChIoroform(Sigma),SuperScript Ⅱ试剂盒(加拿大I nvitrogen 公司),紫外光分光光度仪(德国Eppendoff公司),U-1500 Spectrophotometer 型分光光度仪(日本HITACHI 公司)。
1.2 实验方法
1.2.1 BMSC分离培养 密度梯度离心联合差速贴壁法分离BMSC[10]。取SD大鼠无菌条件下去除双侧股骨远近侧干骺端,以DMEM高糖完全培养液(含10%胎牛血清)冲洗。冲洗液充分混匀后转移至10ml percoll分离液(d=1.073g/ml)上层,900g离心20min,离心半径12cm。PBS洗涤中间富含BMSC的单个核细胞层两次,单细胞悬液以5×108/ml接种于25cm2培养瓶。置37℃、相对体积分数为5%CO2、饱和湿度的细胞孵箱培养48~72h后全量换液,弃去未贴壁细胞,以后每2~3d换液一次。生长至80%融合后以含0.02%EDTA的0.25%的胰蛋白酶消化传代。
将BMSC以 1×105/ml接种于24孔板,随机分为4组。A组和B组分别加入终浓度为5μg/ml的利福平和PBS,继而再分别加入终浓度为10-6mol/L的地塞米松共同孵育14d。C组和D组仅分别加入终浓度为5μg/ml利福平和PBS孵育14d,作为对照组。
1.2.2 P糖蛋白活性检测 应用Feller[11]介绍的方法检测利福平和维拉帕米对BMSC的P糖蛋白活性影响。1×105/ml的BMSC单细胞悬液分为2组,每组10个样品。置37℃、相对体积分数为5%CO2、饱和湿度的细胞孵箱孵育1h后,加入终浓度为0.2μg/ml罗丹明123。37℃、5%CO2饱和湿度的孵箱中培养30min。PBS洗涤细胞2遍,重悬于DMEM培养液中(各组分别加入终浓度5μg/ml 利福平和PBS)。37℃、5%CO2饱和湿度的孵箱中培养60min,200g离心10min,离心半径12cm。重悬于0.5ml PBS中,立即以流式细胞仪测定荧光强度。激发波长和发射波长分别为488nm和525nm。不含罗丹明123染液的BMSC为对照组。
1.2.3 地塞米松胞内蓄积 应用地塞米松ELISA试剂盒检测BMSC胞内的地塞米松蓄积。1×105/ml的BMSC单细胞悬液分为2组置于24孔板,每组分别加入终浓度5μg/ml利福平和PBS后,继而加入10-6mol/L地塞米松孵育24h,每组10个样本。24h后以细胞裂解液裂解BMSC,900g离心10min。取上清液,根据地塞米松ELISA试剂盒说明书检测各组的地塞米松浓度。
1.2.4 油红O染色 各组分别孵育14d后,以4%多聚甲醛固定10min。蒸馏水洗去固定液,70%乙醇浸渍1min,加油红O染液染色20min, 弃去染液,70%乙醇分化数秒,流水冲洗并用蒸馏水洗5min,苏木精复染。×400光镜下计数各组爬片上胞浆中包含红色脂滴颗粒的脂化细胞。
1.2.5 碱性磷酸酶(AKP)染色 各组孵育14d后,以固定液固定5s。干燥后用基质液染色15min,流水冲洗好晾干;苏木精复染10min后水冲,晾干后镜检。×400光镜下计数各组爬片上AKP表达阳性的细胞。
1.2.6 三酰甘油含量的定量检测 各组孵育14d后,分别以50μl细胞裂解液完全裂解各组细胞,700g离心10min,离心半径12cm。取上清液。测定管取16μl上清液,标准管取16μl R3液,空白管取16μl蒸馏水;分别与1ml R1液混匀,37℃水浴15min。各管分别加入500μl R2液混匀,37℃温箱内静置5min。以空白管调零,550nm测吸光度。根据说明书提供的公式计算血清三酰甘油(TG)浓度(mmol/L)。
1.2.7 AKP含量的定量检测 依据AKP 检测试剂盒说明,各组细胞孵育14d后,重悬于PBS,加入60μl 蛋白上清液与100μl 缓冲液、基质液,充分混匀。各组于37 ℃水浴反应15min,加显色剂150μl终止反应并混匀。各组于酶标仪490nm波长处测定吸光度。
1.2.8 过氧化物酶体增殖物激活受体γ(PPARγ) mRNA和Runt相关转录因子2(Runx2)的mRNA表达 孵育14d后,各组细胞中加入1000ml TrizoI 试剂和200mI ChIoroform,混匀后离心,收集离心液的RNA 层并加入2-ProponoI 500ml继续离心。去除上清液,以75%乙醇清洗沉淀物,离心去除乙醇,以双蒸水溶解RNA。U-1500 Spectrophoto-meter型分光光度仪(HITACHI 公司,日本)测RNA浓度。
取各组RNA 1μg,经DNA 酶处理后,用SuperScript Ⅱ试剂盒经DNA Engine 反转录成cDNA。以cDNA 为模板,用SYBR Green Ⅰ法,在95°C经3min变性后,进行95℃15s、60℃15s 和72℃ 30s反应,40次循环。对各组的荧光PCR 产物进行实时监测分析。每一个周期的最后一个步骤都设置了荧光产物的检测。为确定扩增的特异性,应用循环方案对所有最终聚合酶链反应产物进行了熔融曲线分析。此外,没有反转录反应的样品也进行聚合酶链反应,以排除基因组的核酸污染。从一系列的GAPDH质粒基因组cDNA稀释制备标准曲线。PPARγ和Runx2表达均分别以GAPDH进行标准化。引物在表1中列出。

表1 实时荧光定量聚合酶链反应引物
1.2.9 统计分析 所得的数据均采用Stata 7.0软件进行两两比较t检验。P<0.05为有统计学差异。
2 结 果
2.1 BMSC分离培养
BMSC细胞为长梭形,贴附于培养瓶底部, 每7~10d生长达到融合。以0. 25%胰蛋白酶消化传代,细胞于24h内完全贴壁,形态与原代细胞相似,7~10 d达到融合。取第4~6代细胞用于试验。
2.2 BMSC的P糖蛋白活性检测
5μg/ml利福平处理细胞内平均荧光强度低于PBS处理组(P<0.01)(图1A)。5μg/ml利福平处理后,BMSC胞内地塞米松浓度低于PBS处理组(P<0.01)(图1B)。
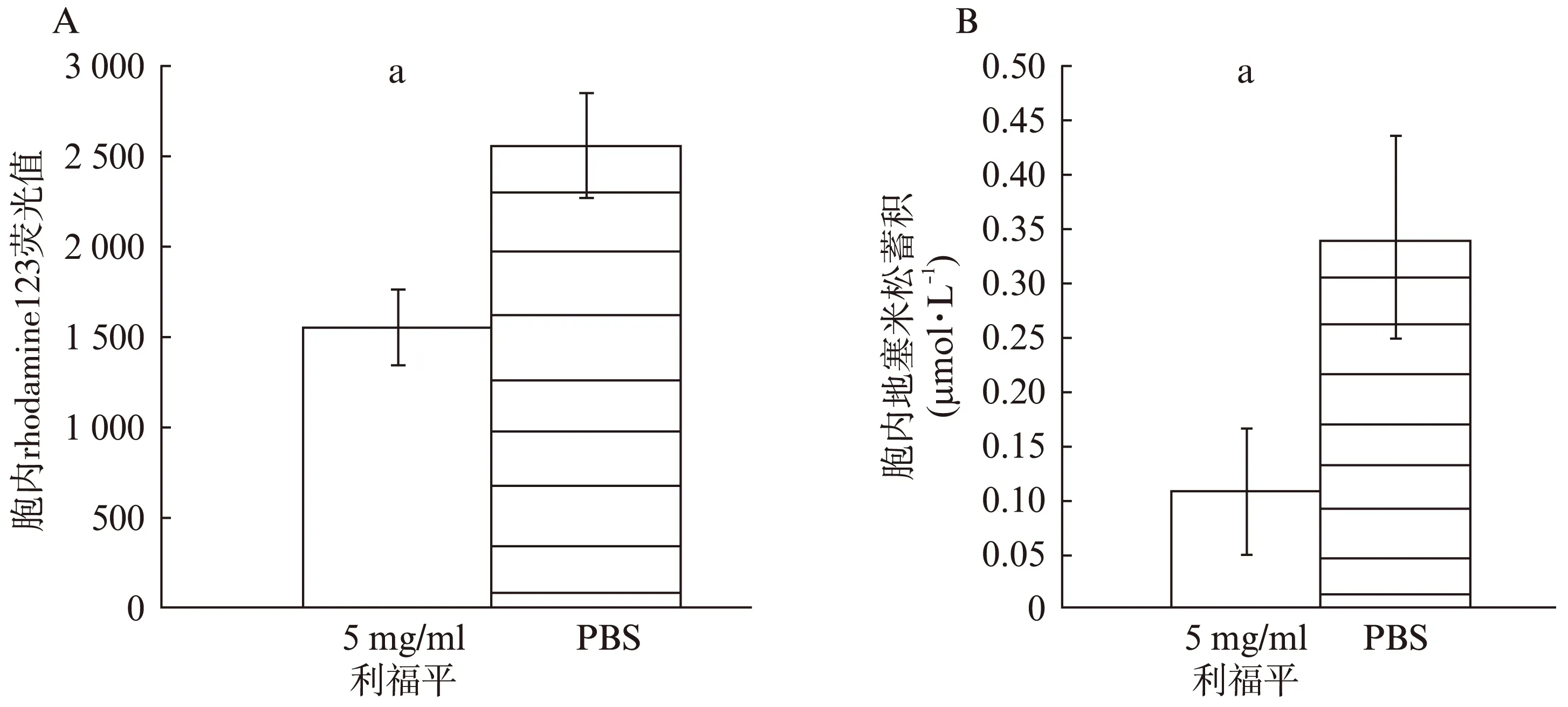
图1 BMSC胞内rhodamine123荧光值和地塞米松蓄积Fig.1 Mean fluorescent value of rhodamine123 and dexamethasone accumulation in BMSCs(A) 5μg/ml利福平减少BMSC胞内rhodamine123荧光值(B) 5μg/ml利福平减少BMSC胞内地塞米松蓄积*PBS处理BMSC与5μg/ml利福平处理BMSC相比较,aP<0.01
2.3 油红O染色
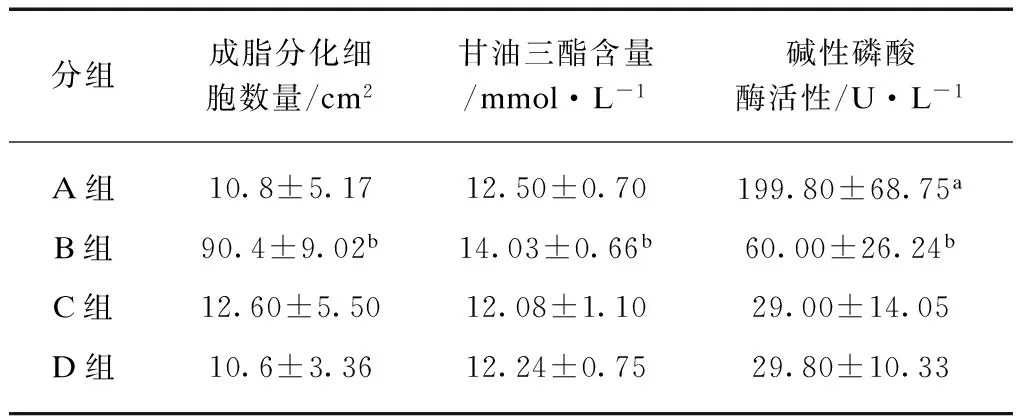
B组中BMSC胞浆中出现逐渐增多的脂滴,被油红O染为红色。A组BMSC未出现脂肪化(图2A)。B组脂化细胞数高于A组。A组脂化细胞数和C组、D组无显著差异(表2)。
2.4 AKP染色
AKP染色阳性细胞呈现紫红色胞浆。A组AKP染色最显著,B组AKP染色减弱。C组和D组BMSC的AKP染色呈阴性(图2B)。

图2 油红O和碱性磷酸酶染色Fig.2 Oil red O staining and AKP staining of BMSCs(A) 油红O染色: B组中10-6mol/L地塞米松导致BMSC成脂分化,胞内出现红色脂滴,应用利福平后,抑制地塞米松诱导的成脂分化: A组、C组和D组油红O染色呈阴性;(B) 碱性磷酸酶染色: A组碱性磷酸酶染色强阳性,阳性细胞胞浆为红色,B组碱性磷酸酶染色减弱,C组和D组染色为阴性
2.5 TG定量检测
B组TG含量高于A组。A组三酰甘油含量和C组、D组无显著差异,表2。
表2 成脂分化细胞数量,三酰甘油和碱性磷酸酶活性定量

分组成脂分化细胞数量/cm2甘油三酯含量/mmol·L-1碱性磷酸酶活性/U·L-1A组10.8±5.1712.50±0.70199.80±68.75aB组90.4±9.02b14.03±0.66b60.00±26.24bC组12.60±5.5012.08±1.1029.00±14.05D组10.6±3.3612.24±0.7529.80±10.33
注: A组与B组、C组和D组相比较,aP<0.01;B组与A组、C组和D组相比较,bP<0.01
2.6 AKP定量检测
A组AKP含量高于B组。B组AKP含量高于C组和D组。C组和D组AKP表达呈阴性(表2)。
2.7 PPARγ mRNA和Runx2 mRNA表达
B组PPARγ mRNA表达高于A组。A组PPARγ mRNA表达和C组、D组无显著差异(图3)。A组Runx2 mRNA表达高于B组。B组Runx2 mRNA表达高于C组和D组。

图3 PPARγ mRNA和Runx2 mRNA定量Fig.3 Quantitative analysis of PPARγ mRNA and Runx2 mRNA(A) PPARγ2 mRNA半定量: B组PPARγ2 mRNA表达最高,A组、C组和D组表达较低,无显著差异(B) Runx2 mRNA半定量: A组Runx2 mRNA表达最高,B组Runx2 mRNA表达降低,C组和D组表达最低,无显著差异*A组与B组相比较, aP<0.01; B组与A组、C组和D组相比较,bP<0.01;A组与B组、C组和D组相比较,cP<0.01
3 讨 论
糖皮质激素是诱导BMSC成脂分化的关键因子[12]。当BMSC成脂分化增强,成骨分化抑制[13]。其中,糖皮质激素浓度是调控BMSC的分化的重要因素。随糖皮质激素浓度升高,BMSC成脂分化增强,成骨分化被抑制。近年来,发现人多药耐药基因1编码的P糖蛋白活性增强能降低糖皮质激素的胞内蓄积[7-8]。前期研究发现,应用维拉帕米抑制P糖蛋白活性后,相同浓度糖皮质激素环境中BMSC成脂分化增强[14]。但增强P糖蛋白活性对糖皮质激素诱导BMSC成脂分化的干预尚缺乏研究。
利福平是常用的P糖蛋白活性增强剂[10]。本研究采用Feller N介绍的荧光染料罗丹明123结合流式细胞仪的方法对P糖蛋白活性进行检测[11]。罗丹明123是特异性的P糖蛋白底物,可被P糖蛋白逆浓度梯度泵至细胞外。利用流式细胞仪检测胞内荧光残留量能够准确反映P糖蛋白活性;胞内罗丹明123蓄积越多,P糖蛋白活性越弱[15]。因此,胞内罗丹明123荧光强度和P糖蛋白活性成反比。本研究中应用5μg/ml利福平对BMSC进行预处理后,显著降低了BMSC胞内罗丹明123荧光染料的蓄积,即上调了P糖蛋白活性。糖皮质激素也是P糖蛋白底物[7-8]。本研究发现利福平升高BMSC的P糖蛋白活性后,BMSC胞内蓄积的地塞米松浓度下降。
高浓度地塞米松诱导BMSC成脂分化[9]。本研究中,10-6mol/L地塞米松诱导BMSC胞内PPARγ表达增加,发生成脂分化。地塞米松浓度是影响BMSC成脂分化的关键调控因素[9]。有研究发现10-6mol/L地塞米松相比10-10mol/L地塞米松诱导的成脂分化更为显著[16]。地塞米松浓度下降,PPARγ表达减少,BMSC成脂分化被抑制[9]。本研究中利福平上调了BMSC的P糖蛋白活性,胞内地塞米松浓度下降,PPARγ表达减少,成脂分化明显受到抑制。由于PPARγ是BMSC成脂分化的关键调控因子,而单纯应用利福平不改变BMSC胞内PPARγ mRNA水平和成脂分化。因此,推测利福平抑制了BMSC的成脂分化是通过上调P糖蛋白活性减少地塞米松在胞内的蓄积,进而降低地塞米松与胞内糖皮质激素受体结合,从而抑制PPARγ介导的BMSC成脂分化。
Runx2和AKP是BMSC早期成骨分化的重要标志[17-18]。本研究中利福平导致地塞米松诱导条件下BMSC的Runx2和AKP表达增加,促进了BMSC的成骨分化。但单独应用利福平并不能增加BMSC的Runx2和AKP表达。同时发现单独应用10-6mol/L地塞米松在诱导BMSC成脂分化的同时,BMSC也表达较弱的成骨标志物AKP和Runx2。因此,推测利福平增强BMSC的成骨分化是通过调控地塞米松对BMSC的诱导作用而呈现。Wang等[13]发现PPARγ会抑制Runx2表达,进而抑制BMSC的成骨分化。应用microRNA下调PPARγ表达后,Runx2表达增加[19]。因此,推测利福平是通过上调BMSC的P糖蛋白表达,降低胞内地塞米松浓度,从而减少了PPARγ表达,削弱了PPARγ对Runx2的抑制作用,促进BMSC成骨分化。
近年来,糖皮质激素诱导BMSC成脂分化被认为是激素性股骨头坏死的重要机制[4-6]。Cui等[20]利用示踪技术发现植入股骨头内的BMSC,全身应用糖皮质激素诱导其在股骨头内转化为脂肪细胞。前期研究发现应用利福平可以减少糖皮质激素诱导的股骨头内脂肪化,改善股骨头内骨形成,降低股骨头坏死率。但有学者认为利福平是通过诱导肝脏细胞色素P450表达和活性,促进激素在肝脏的代谢,削弱激素的药理作用,降低激素性股骨头坏死[21]。本研究有力支持了利福平可直接通过上调股骨头内BMSC的P糖蛋白活性,抑制糖皮质激素诱导的BMSC成脂分化,促进成骨分化。
总之,利福平通过上调BMSC的P糖蛋白活性,降低地塞米松在BMSC胞内蓄积,抑制糖皮质激素诱导的BMSC成脂分化。这为利福平靶向应用于股骨头预防激素性股骨头坏死提供了理论依据。
[1] Grané li C, Karlsson C, Brisby H,et al. The effects of PPAR-γ inhibition on gene expression and the progression of induced osteogenic differentiation of human mesenchymal stem cells[J]. Connect Tissue Res, 2014,55: 262-274.
[2] Takada I, Kouzmenko AP, Kato S. Molecular switching of osteoblastogenesis versus adipogenesis: implications for targeted therapies[J]. Expert Opin Ther Targets, 2009,13: 593-603.
[3] Gharibi B, Abraham AA, Ham J,et al. Adenosine receptor subtype expression and activation influence the differentiation of mesenchymal stem cells to osteoblasts and adipocytes[J]. J Bone Miner Res, 2011,26: 2112-2124.
[4] Han N, Yan Z,Guo CA, et al. Effects of p-glycoprotein on steroid-induced osteonecrosis of the femoral head[J]. Calcif Tissue Int, 2010,87: 246-253.
[5] Lee MJ, Chen HT, Ho ML,et al. PPARγ silencing enhances osteogenic differentiation of human adipose-derived mesenchymal stem cells[J]. J Cell Mol Med, 2013,17: 1188-1193.
[6] Sun ZB, Wang JW, Xiao H, et al. Icariin may benefit the mesenchymal stem cells of patients with steroid-associated osteonecrosis by ABCB1-promoter demethylation: a preliminary study[J]. Osteoporos Int, 2015,26: 187-197.
[7] Li Z, Zhao D, Wang B. ABCB1 gene polymorphisms and glucocorticoid-induced avascular necrosis of the femoral head susceptibility: a meta-analysis[J]. Med Sci Monit, 2014,20: 2811-2816.
[8] Sun Z, Yang S, Ye S, et al. Aberrant CpG islands’ hypermethylation of ABCB1 in mesenchymal stem cells of patients with steroid-associated osteonecrosis[J]. J Rheumatol, 2013,40: 1913-1920.
[9] Yin L, Li YB, Wang YS. Dexamethasone-induced adipogenesis in primary marrow stromal cell cultures: mechanism of steroid-induced osteonecrosis[J]. Chin Med J (Engl), 2006,119: 581-588.
[10] Song G, Ju Y, Shen X, et al. Mechanical stretch promotes proliferation of rat bone marrow mesenchymal stem cells[J]. Colloids Surf B Biointerfaces, 2007,58: 271-277.
[11] Feller N, Kuiper CM, Lankelma J,et al. Function detection of MDR1/P170 and MRP/P190-mediated multidrug resistance in tumor cells by flow cytometry[J]. Br J Cancer, 1995,72: 543-549.
[12] Naito M, Omoteyama K, Mikami Y,et al. Inhibition of Wnt/β-catenin signaling by dexamethasone promotes adipocyte differentiation in mesenchymal progenitor cells, ROB-C26[J]. Histochem Cell Biol, 2012,138: 833-845.
[13] Wang Y, Li J, Liu M, et al. Inhibition of peroxisome proliferator-activated receptor-γ in steroid-induced adipogenic differentiation of the bone marrow mesenchymal stem cells of rabbit using small interference RNA[J]. Chin Med J (Engl), 2014,127: 130-136.
[14] 潘志宏,韩宁. P糖蛋白抑制对体外培养骨髓间充质干细胞成脂分化的影响[J]. 复旦学报: 医学版, 2010,37: 396-408.
[15] Nakaichi M, Takeshita Y, Okuda M, et al. Expression of the MDR1 gene and P-glycoprotein in canine mast cell tumor cell lines[J]. J Vet Med Sci, 2007,69: 111-115.
[16] Ghali O, Broux O, Falgayrac G,et al. Dexamethasone in osteogenic medium strongly induces adipocyte differentiation of mouse bone marrow stromal cells and increases osteoblast differentiation[J]. BMC Cell Biol, 2015,16: 9.
[17] Takahashi T. Overexpression of Runx2 and MKP-1 stimulates transdifferentiation of 3T3-L1 preadipocytes into bone-forming osteoblasts in vitro[J]. Calcif Tissue Int, 2011,88: 336-347.
[18] Mikami Y, Takahashi T, Kato S,et al. Dexamethasone promotes DMP1 mRNA expression by inhibiting negative regulation of Runx2 in multipotential mesenchymal progenitor, ROB-C26[J]. Cell Biol Int, 2008,32: 239-246.
[19] Sun J, Wang Y, Li Y,et al. Downregulation of PPARγ by miR-548d-5p suppresses the adipogenic differentiation of human bone marrow mesenchymal stem cells and enhances their osteogenic potential[J]. J Transl Med, 2014,12: 168.
[20] Cui Q, Wang GJ, Balian G. Pluripotential marrow cells produce adipocytes when transplanted into steroid-treated mice[J]. Connect Tissue Res, 2000,41: 45-56.
[21] Masada T, Iwakiri K, Oda Y, et al. Increased hepatic cytochrome P4503A activity decreases the risk of developing steroid-induced osteonecrosis in a rabbit model[J]. J Orthop Res, 2008,26: 91-95.
Rifampicin inhibits dexamethasone-induced adipogenesis of bone marrow stem cells and its mechanism
HANNing1,2,LIZeng-chun1,CAIZheng-dong2,3,XUChong1
(1. Dept.of Traumatic Surgery, East Hospital, Tongji University, Shanghai 200120, China; 2. Dept.of Orthopaedics, Tenth People’s Hospital, Tongji University, Shanghai 200072, China; 3. Dept. of Orthopaedics, First People’s Hospital, Shanghai Jiaotong University, Shanghai 200080, China)
Objective To investigate the effect of rifampicin on dexamethasone-induced adipogenesis of bone marrow stem cells (BNSCs) and its mechanism. Methods BMSCs were isolated from Sprague-Dawley rats and randomly divided into 4 groups. Group A was treated with 5μg/ml rifampicin and 10-6mol/L dexamethasone; group B was treated with PBS and 10-6mol/L dexamethasone; group C and group D were treated with 5μg/ml rifampicin and PBS, respectively. P-glycoprotein activity and intracellular dexamethasone accumulation with the pretreatment of 5μg/ml rifampicin were determined by flow cytometry and enzyme linked immunosorbent assay (ELISA),respectively. After 14 days, BMSCs in all groups were observed under light microscope after Oil red O and alkaline phosphatase staining; triglyceride and alkaline phosphatase (AKP) activity levels were measured, peroxisome proliferator activated receptor γ (PPARγ) mRNA and runt-related transcription factor 2 (Runx2) mRNA level were detected by RT-fqPCR. Results Intracellular rhodamine123 fluorescence and dexamethasone level significantly decreased after 5μg/ml rifampicin treatment. Adipogenesis was showed in group B with increased PPARγ mRNA and triglyceride level. There were not adipogensis in group A, group C and group D. AKP staining and levels in group A were higher than those in group B. Conclusion Rifampicin can enhance P-gp activity and inhibit glucocorticoid-induced adipogenesis in BMSCs.
Rifampicin; P-glycoprotein; glucocorticoid; bone marrow stromal cells; adipogenesis
10.16118/j.1008-0392.2016.03.004
2016-01-21
浦东新区优秀青年医学人才资助基金(PWRq2012-13)
韩 宁(1980—),男,主治医师,博士.E-mail: smztmp@126.com
李增春.E-mail: smztmp@126.com
R 521
A
1008-0392(2016)03-0021-07

