I~III期结直肠癌淋巴结转移比率与预后关系
吴建海韩方海陈进忠
I~III期结直肠癌淋巴结转移比率与预后关系
吴建海1韩方海2陈进忠1
【摘要】目的 评价I~III期结直肠癌淋巴结转移比率与患者预后的关系。方法 回顾性分析中山大学附属第一医院胃肠胰腺外科2004年6月至2008年11月间446例行根治性切除的结直肠癌患者临床病理数据,探讨结直肠癌预后相关危险因素,评估结直肠癌淋巴结转移比率与患者预后的关系。结果 446例结直肠癌I、II、III期患者的5年总体生存率分别约为87.4%,83.1%和64.8% (Log-rank检验,P<0.001)。我们根据淋巴结转移比率(metastatic lymph node ratio, mLNR)将CRC患者分为三组:A组:mLNR为0;B组:mLNR为>0%~14%;C组:mLNR为>14%。A、B、C组三组患者的5年总体生存率分别约为84.3%、79.6%和49.1%(Log-rank检验,χ2=55.959,P<0.001)。就直肠癌患者而言,A、B、C三组5年生存率分别为79.0%、73.5%和43.2%(Log-rank检验,χ2=26.332,P<0.001)。而对于结肠癌患者来说三组的5年生存率分别为87.1%,80.8%和55.5% (Log-rank检验,χ2=21.214,P<0.001)。单因素和多因素Cox分析均显示,mLNR是结直肠癌独立的预后危险因素,随着mLNR的上升,结直肠癌患者的预后变差。结论 淋巴结转移比率(mLNR)是结直肠癌患者预后的独立危险因素,与N分期类似,但更有优势,可作为评估结直肠癌患者预后的指标之一。
【关键词】结直肠肿瘤; 预后; 淋巴结转移比率
作者单位:361000 福建,1厦门大学附属第一医院内镜中心;510120 广州,2中山大学附属孙逸仙纪念医院胃肠外科
在全世界范围内结直肠癌(colorectal cancer, CRC)是癌症相关死亡最重要的原因之一。世界卫生组织2012年发布的数据显示,结直肠癌发病率在全球范围内仅次于乳腺癌、肺癌和前列腺癌,全年有超过136万新发结直肠癌,结直肠癌死亡人数约为69万人。根据世界卫生组织流行病学调查,我国2012年结直肠癌发病数和死亡数分别超过25万和13万,男女发病率分别为16.9/10万和11.6/10万,死亡率分别为8.9/10万和6.1/10万[1]。在UICC分期里I~III期的结直肠癌患者的5年生存率差异很大,波动在41%到96%[2]。而在患者的术后综合治疗中,TNM分期系统往往起着指导性的作用,也就是取决于肿瘤浸润深度及淋巴结转移情况。结直肠癌患者准确的临床分期不仅可以指导患者术后的综合治疗,也可以避免患者由于病情分期不准确而导致的过度治疗。而在TNM分期中,主要考虑肿瘤浸润深度、淋巴结受累情况和有无远处转移,就第五版TNM分期术后N分期而言,N0指没有淋巴结转移,N1指有1~3个淋巴结转移,N2指有4个或以上淋巴结转移[3-4]。这个分期系统显得过于笼统。最近有很多文献报道提出淋巴结转移比率(mLNR)比TNM分期系统在评估患者生存预后方面更有价值[5-12]。淋巴结转移比率(mLNR)是指术后手术标本中检获阳性淋巴结个数与送检淋巴结总数的比率。然而,有关mLNR在评价结直肠癌患者生存预后方面的作用以及如何确定mLNR的分割点仍然存在较多争议。本研究旨在回顾性研究mLNR与结直肠癌患者预后的关系。
资料与方法
一、一般资料
我们回顾性分析中山大学附属第一医院胃肠胰腺外科2004年6月~2008年11月间的结直肠癌数据库,分析I~III期结直肠癌(CRC)患者预后与患者的mLNR之间的关系。分析因素包括:mLNR分组、pT分期、N分期、术后是否放化疗、性别、年龄段、肿瘤病例类型、肿瘤分化程度以及肿瘤大小。病例纳入标准为:1)患者均未行术前放化疗;2)无远处转移;3)手术达到R0根治性切除;4)有完整随访资料;5)送检淋巴结总数≥12个。排除标准:1)术前行放化疗的患者;2)有远处转移患者;3)姑息性手术患者;4)多源性肿瘤患者;5)失访病例。根据纳入排除标准,从2004年6月至2008年11月间,共有446例符合条件的病例纳入本次研究。
二、随访
所有患者均取得随访资料,全组病例随访终点为患者死亡。患者术后2年内每3~6个月随访一次,之后1年一次,全组病例随访时间5年以上。随访检查项目包括一般临床检查、胸片、肿瘤标记物、腹部CT等。
三、统计学分析
统计学分析采用SPSS19.0软件进行。定量性数值一般表述为均数±标准差。定性资料比较采用卡方检验。结直肠癌患者预后与各临床病理因素的关系,单因素分析采用Kaplan-Meier方法并经过Log-rank检验,多因素分析采用Cox回归模型(进入法,进入标准P<0.05,剔除标准P>0.10)。检验水准为P<0.05。
结 果
一、一般临床病理数据分析
根据第五版TNM分期系统分期,全组中共有I~III期结直肠癌患者446例,其中I期患者为59例(13.5%),II期患者210例(47.1%),III期患者177例(39.5%)。TNM分期I、II、III期患者的5年总体生存率分别约为87.4%,83.1%和64.8% (Log-rank检验,P<0.001,见图1)。表明CRC患者临床TNM分期的上升,预后明显变差。在182例直肠癌患者中,I、II、III期患者例数分别为38例、63例和81例,5年总体生存率分别为86.5%、73.7% 和56.2%(Log-rank检验,P<0.001,见图2)。264例结肠癌患者中,I、II、III期患者例数分别为21例、147例和96例,5年总体生存率分别为83.7%、86.4%和70.9%(Log-rank检验,P=0.005,见图3)。

图1 结直肠癌患者NCCN分期的总体生存曲线比较(P<0.001)

图2 直肠癌患者NCCN分期的总体生存曲线比较(P<0.001)

图3 结肠癌患者NCCN分期的总体生存曲线比较(P=0.005)
所有患者均达到了R0根治性切除,其中男性患者270例(60.5%),女性患者176例(39.5%);平均年龄为57.28±14.21(19~92)岁,以58岁为界,大于58岁病例占220例(49.3%);小于等于58岁患者占226例(50.7%)。所有病例的送检淋巴结总数均≥12个,平均检获淋巴结数目为21.58±11.12(12~116)个,其中直肠组病例平均检获淋巴结个数为19.41±7.43(12~51)个;结肠组病例平均检获淋巴结个数为23.07± 12.87(12~116)个。III期结直肠癌病例平均阳性淋巴结个数为4.60±4.99(1~25)个,中位数为3.0个;其中III期直肠癌病例为5.75±5.70(1~25)个,III期结肠癌病例则为3.63±4.09(1~20)个。全组病例5年随访率为94.6%,平均随访时间为61.53±21.43个月,中位数为62.0月(3~111个月)。根据2014年NCCN推荐标准需要行术后放化疗的II、III期结直肠癌病例为387例,其中有进行术后放化疗的为151例,5年生存率约为77.5%;未行术后放化疗的为235例,5年生存率约为73.0% (P=0.363,见图4)。具体临床病理数据见表1、表2、表3。
二、结直肠癌mLNR分期与术后N分期
淋巴结转移比率(mLNR)=阳性淋巴结数目/送检淋巴结总数。为了便于进行结直肠癌mLNR与术后N分期患者总体生存率进行比较。我们将III期患者的mLNR的中位数作为分割点,把所有CRC病例分为三组:A组:mLNR为0,269例;B组:mLNR为>0%~14%,90例;C组:mLNR为>14%,87例。经过统计学分析,A、B、C组三组患者的5年总体生存率分别约为84.3%、79.6%和49.1% (Log-rank检验,χ2=55.959,P<0.001,见图5)。就直肠癌患者而言,三组5年生存率分别为79.0%、73.5%和43.2%(Log-rank检验,χ2=26.332,P<0.001,见图6)。而对于结肠癌患者来说,三组5年生存率分别为87.1%,80.8%和55.5%(Log-rank检验,χ2=21.214,P<0.001,见图7)。
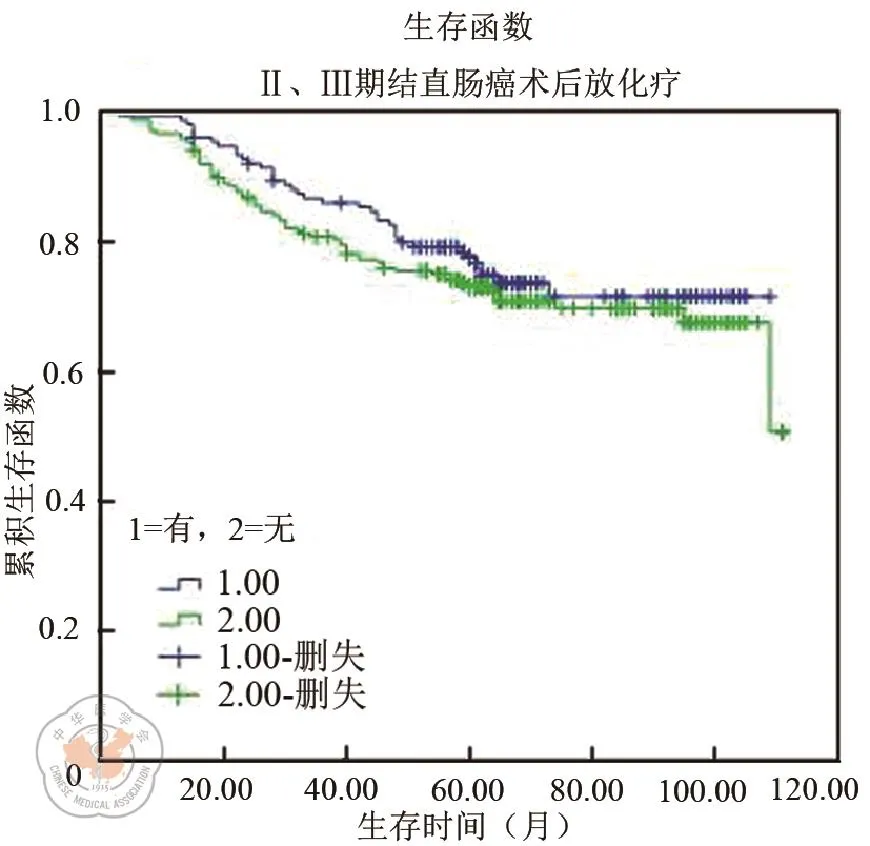
图4 II、III期结直肠癌术后放化疗的总体生存曲线比较(P=0.363)
术后N分期,所有的CRC病例中,N0病例,269例;N1,111例;N2,66例。三组患者的5年总体生存率分别约为84.3%、74.5%和47.1%(Log-rank检验,χ2=45.388,P<0.001,见图8)。直肠癌病例中三组患者的5年总体生存率分别约为79.0%、64.6%和43.5%(Log-rank检验,χ2=19.190,P<0.001,见图9)。结肠癌病例中,三组患者的5年总体生存率分别约为87.1%、78.9%和51.7%。三组患者的5年总体生存率亦存在明显统计学差异(Log-rank检验,χ2=20.705,P<0.001,见图10)。
三、结直肠癌患者总体生存的单因素和多因素分析
为进一步分析mLNR对结直肠癌患者生存预后的影响,我们进行了结直肠癌总体生存的单因素和多因素Cox回归分析。分析的因素包括mLNR、术后T分期、有无放化疗、性别、年龄、肿瘤病理类型、肿瘤分化程度和肿瘤大小。在此需要说明的是,由于mLNR和pN分期存在高度相关,因此在做多因素回归分析的时候不能将他们一起放入回归模型中。446例CRC患者单因素分析中,mLNR、性别、年龄、肿瘤病理类型与结直肠癌患者的预后有关,而术后T分期、是否行术后放化疗、肿瘤的分化程度及肿瘤大小与患者的预后无统计学差异(见表4)。就直肠癌病例而言,单因素分析(见表5)。在结肠癌病例单因素分析中(见表6)。

表1 446例结直肠癌患者临床病理数据与mLNR的关系表
446例CRC患者的多因素Cox回归分析中,mLNR(分割点0.14,P<0.001)和年龄是患者预后的独立危险因素,随着患者mLNR的增加,预后明显变差(见表4)。就直肠癌病例而言,mLNR(分割点0.14,P<0.001)是患者预后唯一的独立危险因素(见表5)。就结肠癌患者来说,mLNR(分割点0.14,P<0.001)和年龄(P=0.002)是患者预后的独立危险因素(见表6)。结直肠癌患者mLNR升高,患者的整体预后变差。
讨 论
我们的研究证实,mLNR是患者预后的独立危险因素之一。近些年来,有文献报道指出,在食管癌、胃癌等许多肿瘤中,使用mLNR会减少肿瘤分期迁移现象[13]。mLNR作为结肠癌的预后因素最早见于2005年Berger等[14]的报道。他们从纳入Intergroup Trial 0089的3411例III期病例中使用mLNR四分位数间距(<0.05,0.05~0.19,0.2~0.39,0.4~1.0)分析指出随着mLNR的上升,患者的生存率显著下降。而在2006年和2007年,两个基于SEER(surveillance, epidemiology, and end results)数据库的研究证实了mLNR在评价结肠癌患者预后方面的价值。De Ridder等[15]分析了26181例III期结肠癌病例,比较pN分期系统和mLNR分期系统,pN1和pN2期病例的5年生存率分别为54%和29%,而mLNR小于和大于0.40的病例5年生存率分别为56%和26%。
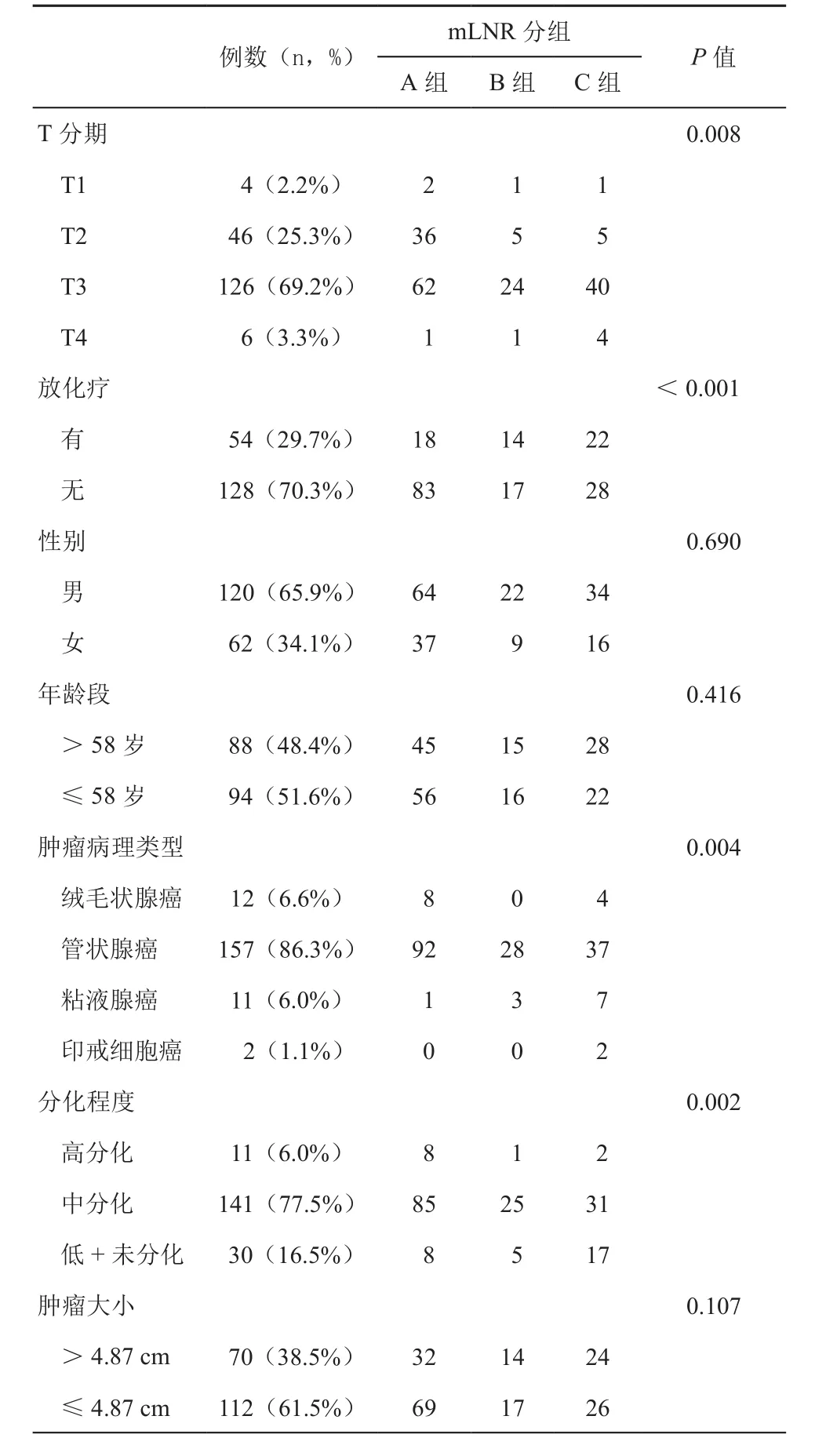
表2 直肠癌患者临床病理数据与mLNR的关系表

表3 结肠癌临床病理数据与mLNR的关系表
在本研究中,结直肠癌总体生存的单因素和多因素Cox回归分析显示,mLNR是患者独立预后因素之一(分割点0.14,P<0.001)。CRC患者单因素分析中,mLNR、性别、年龄、肿瘤病理类型与结直肠癌患者的预后有关;就直肠癌病例而言,单因素分析中,mLNR(P<0.001)和肿瘤病理类型与直肠癌患者的预后有关;在结肠癌病例单因素分析中,mLNR(P<0.001)和年龄与患者的预后有关。CRC患者的多因素Cox回归分析中,mLNR(分割点0.14,P<0.001)和年龄是患者预后的独立危险因素,随着患者mLNR的增加,预后明显变差(见表4)。就直肠癌病例而言,mLNR(分割点0.14,P<0.001)是患者预后唯一的独立危险因素(见表5)。就结肠癌患者来说,mLNR(分割点0.14,P<0.001)和年龄(P=0.002)是患者预后的独立危险因素(见表6)。CRC患者是否行术后放化疗并不是患者预后的危险因素。我们再校正了术后T分期、有无放化疗、性别、年龄、肿瘤病理类型、肿瘤分化程度和肿瘤大小等相关因素后发现,mLNR是CRC患者预后的独立危险因素之一,随着mLNR的上升,患者的预后变差。

图5 结直肠癌患者mLNR分组的总体生存曲线比较(P<0.001)

图6 直肠癌mLNR分组的总体生存曲线比较(P<0.001)

图7 结肠癌mLNR分组的总体生存曲线比较(P<0.001)

图8 结直肠癌患者pN分期总体生存曲线比较(P<0.001)
很多文献报道指出,相较于TNM分期的术后N分期,mLNR在评价患者预后方面更有优势[10,13,16-25]。虽然大部分文献报道都持正面观点,但mLNR是否比术后N分期更有优势尚存在争议。Leif Schiffmann等[26]在一项III期结肠癌的回顾性研究中指出,术后N分期和mLNR在评价预后方面并没有统计学差异,mLNR没有比术后N分期更有优势,没有必要用mLNR来替代术后N分期系统。在我们的研究中,我们将III期患者的mLNR的中位数作为分割点,A、B、C三组患者的5年总体生存率差异存在明显统计学意义(Log-rank检验,χ2=55.959,P<0.001,见图5)。就直肠癌患者和结肠癌患者来说,结论相似。使用术后N分期系统,所有的CRC病例中,三组患者的5年总体生存率分别约为84.3%、74.5%和47.1%(Log-rank检验,χ2=45.388,P<0.001,见图8)。直肠癌病例和结肠癌病例中,结论相似。从上面的分析可以看出,虽然使用mLNR分期和pN分期系统均能体现出CRC患者不同肿瘤分期间存在明显差异,但使用mLNR系统体现出来的差异更大(mLNR分期的χ2值更大)。究其原因,在术后N分期系统中,分期只考虑了患者术后的阳性淋巴结个数,而患者术后检获的淋巴结总数并没有考虑在内。而mLNR综合考虑了检获淋巴结总数和阳性淋巴结个数,能更准确反映肿瘤的确切分期,对于指导患者术后的治疗更加科学,也更具有参考价值。

图9 直肠癌pN分期总体生存曲线比较(P<0.001)
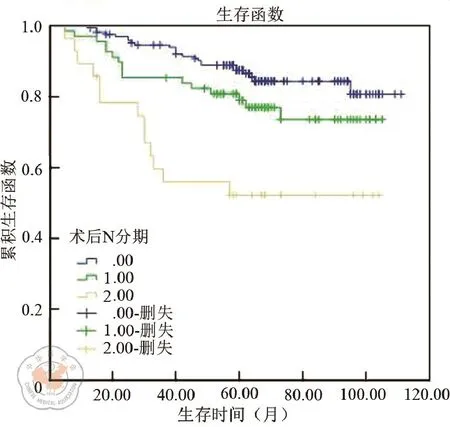
图10 结肠癌pN分期总体生存曲线比较(P<0.001)

表4 446例结直肠癌总体生存的单因素和多因素Cox分析表
然而,对于如何利用mLNR来进行结直肠癌临床分期,不同的研究者所使用的分割点并不一致。也正是因为没有统一的mLNR分割点,使得mLNR在临床上的应用受到了很大的限制。有学者使用统计学方法找出最佳分割点[10-11,26]。Rosenberg R等[10]在分析3026例CRC患者数据时使用统计学方法找出最佳的mLNR分割点(0.17、0.41和0.69)。Zhang等[11]也使用统计学方法找出最佳分割点(0.01,0.20和0.60)。Leif Schiffmann等[26]则是使用马尔科夫概率论来寻找最佳分割点(0.20)。而更多的研究则使用了四分位数间距或者中位数等认为的方法来确定分割点。因此得出的结论也并不一致。本研究中为了排除淋巴结检获数目小于12个导致的肿瘤分期迁移现象,只纳入检获淋巴结数目大于等于12个的CRC病例,采用III期病例的mLNR中位数作为分割点(0.14)。在未排除检获淋巴结数目小于12个的所有CRC患者(共838例,数据未列出),我们的分割点是0.19,这与Berger、Zhang和Leif Schiffmann的分割点无疑是非常相近的。

表5 直肠癌总体生存的单因素和多因素Cox分析表

表6 结肠癌总体生存的单因素和多因素Cox分析表
本研究中存在一些不足。首先,本研究没有将术前新辅助放化疗的病例纳入,因此,没能对新辅助放化疗的病例进行分析;其次,虽然mLNR在评价结直肠癌预后方面有优势,但相比于术后N分期,这个优势不是太明显,需要更大规模的研究来证实。
综上,mLNR是结直肠癌患者独立的预后因素,在临床分期上与术后N分期类似,但充分考虑了阳性淋巴结个数和检获淋巴结总数,因此显得更加科学,更有参考意义。而如何确定分割点来使mLNR更广泛地应用于临床则需要更多大规模多中心的临床研究。
参 考 文 献
[ 1 ] 康清杰, 向征. 结肠癌筛查和诊疗的研究进展. 重庆医学, 2015, (28): 4001-4003.
[ 2 ] Staib L, Link KH, Blatz A, et al. Surgery of colorectal cancer: surgical morbidity and five and ten-year results in 2400 patients--monoinstitutional experience. World J Surg. 2002; 26(1): 59-66.
[ 3 ] Fleming ID, Cooper JS, Henson DE, et al. AJCC Cancer Staging Manual. 5th ed. Philadelphia, PA: Lippincott, 1997.
[ 4 ] Sobin LH, Wittekind C. TNM Classification of Malignant Tumors. 5th ed. New York, NY: Wiley, 1997.
[ 5 ] Thomas M, Biswas S, Mohamed F, et al. Dukes C colorectal cancer: is the metastatic lymph node ratio important?. Int J Colorectal Dis, 2012, 27(3): 309-317.
[ 6 ] Ceelen W, Van Nieuwenhove Y, Pattyn P. Prognostic value of the lymph node ratio in stage III colorectal cancer: a systematic review. Ann Surg Oncol, 2010, 17(11): 2847-2855.
[ 7 ] Parsons HM, Tuttle TM, Kuntz KM, et al. Association Between Lymph Node Evaluation for Colon Cancer and Node Positivity Over the Past 20 Years. JAMA, 2011, 306(10): 1089-1097.
[ 8 ] Powell AG, Wallace R, McKee RF, et al. The relationship between tumour site, clinicopathological characteristics and cancer-specific survival in patients undergoing surgery for colorectal cancer. Colorectal Dis, 2012, 14(12): 1493-1499.
[ 9 ] Sjo OH, Merok MA, Svindland A, et al. Prognostic impact of lymph node harvest and lymph node ratio in patients with colon cancer. Dis Colon Rectum, 2012, 55(3): 307-315.
[ 10 ] Rosenberg R, Friederichs J, Schuster T, et al. Prognosis of patients with colorectal cancer is associated with lymph node ratio: a single-center analysis of 3, 026 patients over a 25-year time period. Ann Surg, 2008, 248(6): 968-978.
[ 11 ] Zhang J, Lv L, Ye Y, et al. Comparison of metastatic lymph node ratio staging system with the 7th AJCC system for colorectal cancer. J Cancer Res Clin Oncol, 2013, 139(11): 1947-1953.
[ 12 ] Lykke J, Roikjaer O, Jess P, et al. The relation between lymph node status and survival in Stage I-III colon cancer: results from a prospective nationwide cohort study. Colorectal Dis, 2013, 15(5): 559-565.
[ 13 ] Mariette C, Piessen G, Briez N, et al. The number of metastatic lymph nodes and the ratio between metastatic and examined lymph nodes are independent prognostic factors in esophageal cancer regardless of neoadjuvant chemoradiation or lymphadenectomy extent. Ann Surg, 2008, 247(2): 365-371.
[ 14 ] Berger AC, Sigurdson ER, LeVoyer T, et al. Colon cancer survival is associated with decreasing ratio of metastatic to examined lymph nodes. J Clin Oncol, 2005, 23(34): 8706-8712.
[ 15 ] De Ridder M, Vinh-Hung V, Van Nieuwenhove Y, et al. Prognostic value of the lymph node ratio in node positive colon cancer. Gut, 2006, 55(11): 1681.
[ 16 ] Evans MD, Barton K, Rees A, et al. The impact of surgeon and pathologist on lymph node retrieval in colorectal cancer and its impact on survival for patients with Dukes′ stage B disease. Colorectal Dis, 2008, 10(2): 157-164.
[ 17 ] Wong JH, Severino R, Honnebier MB, et al. Number of nodes examined and staging accuracy in colorectal carcinoma. J Clin Oncol, 1999, 17(9): 2896-2900.
[ 18 ] Feinstein AR, Sosin DM, Wells CK. The Will Rogers phenomenon. Stage migration and new diagnostic techniques as a source of misleading statistics for survival in cancer. N Engl J Med, 1985, 312(25): 1604-1608.
[ 19 ] Derwinger K, Carlsson G, Gustavsson B. A study of lymph node ratio as a prognostic marker in colon cancer. Eur J Surg Oncol, 2008, 34(7): 771-775.
[ 20 ] Vaccaro CA, Im V, Rossi GL, et al. Lymph node ratio as prognosis factor for colon cancer treated by colorectal surgeons. Dis Colon Rectum, 2009, 52(7): 1244-1250.
[ 21 ] Elias E, Deborah M, Walid F, et al. Lymph-node ratio is an independent prognostic factor in patients with stage III colorectal cancer: a retrospective study from the Middle East. World J Surg Oncol, 2012, 10(1): 63.
[ 22 ] Park IJ, Choi GS, Jun SH. Nodal stage of stage III colon cancer: the impact of metastatic lymph node ratio. J Surg Oncol, 2009, 100(3): 240-243.
[ 23 ] Moug SJ, Saldanha JD, McGregor JR, et al. Positive lymph node retrieval ratio optimises patient staging in colorectal cancer. Br J Cancer, 2009, 100(4): 1530-1533.
[ 24 ] Peng J, Xu Y, Guan Z, et al. Prognostic significance of the metastaticlymph node ratio in node-positive rectal cancer. Ann Surg Oncol, 2008, 15(11): 3118-3123.
[ 25 ] Wong KP, Poon JT, Fan JK, et al. Prognostic value of lymph node ratio in stage III colorectal cancer. Colorectal Dis, 2011, 13(10): 1116-1122.
[ 26 ] Schiffmann L, Eiken AK, Gock M, et al. Is the lymph node ratio superior to the Union for International Cancer Control (UICC) TNM system in prognosis of colon cancer?. World J Surg Oncol, 2013, 11(11): 140-149.
(本文编辑:杨明)
吴建海, 韩方海, 陈进忠. I~III期结直肠癌淋巴结转移比率与预后关系[J/CD]. 中华结直肠疾病电子杂志, 2016, 5(2): 138-147.
•论著•
Retrospective analysis of the relationship between metastatic lymph node ratio and survival in stage I~III colorectal cancer
Wu Jianhai1, Han Fanghai2, Chen Jinzhong1. 1The Endoscopy Center, the First Affiliated Hospital of Xiamen University, Fujian 361000, China; 2The Department of Gastrointestinal Surgery, the Second Affiliated Hospital of Sun Yat-sen University, Guangdong 510120, China Corresponding Author: Han Fanghai, Email: FH_han@163.com
【Abstract】Objective To retrospectively investigate the relationship between metastatic lymph node ratio and prognosis in stage I~III colorectal cancer. Methods The clinicopathologic data of 446 patients with stage I~III colorectal cancer treated with curative resection at gastrointestinopancreatic surgery department of the First Affiliated Hospital of Sun Yat-sen University was retrospectively analyzed. Factors including metastatic lymph node ratio, pT stage, chemoradiotherapy, gender, age, histological grade, histological type and tumor size were univariate and multivariate analyzed to investigate the correlated prognostic risk factors in colorectal cancer. Results Among the 446 colorectal cancer patients, the overall 5-year survival rates in NCCN stage I, II, III were 87.4%, 83.1%, 64.8% separately (P<0.001). For the rectal cancer subgroup, the overall 5-year survival rates in NCCN stage I, II, III were 86.5%, 73.7%, 56.2% separately (P<0.001). And for the colon cancer subgroup, the rates were 83.7%, 86.4% and 70.9% separately (P<0.001). When putting the patients into three groups according to the metastatic lymph node ratio (cutoffs 0, >0%~14%, >14%), we found an overall 5year survival rates of 81.8%, 77.7% and 57.2% separately (χ2=55.959, P<0.001) for the whole CRC patients. And the rates were 79.0%, 73.5% and 43.2% separately(χ2=26.332, P<0.001) for the rectal cancer subgroup and 87.1%, 80.8 and 55.5% separately (χ2=21.214, P<0.001) for the colon cancer subgroup. In univariate and multivariate analysis, metastatic lymph node ratio (mLNR) was found to be significantly associated with overall survival. The poor prognosis was associated with increasing mLNR. In the rectal cancer subgroup and colon cancer subgroup, similar results were achieved. mLNR is an independent prognostic factors for colorectal cancer. Conclusions Metastatic lymph node ratio (mLNR) is an independent prognostic factor of colorectal cancer patients. The mLNR classification in colorectal cancer is similar with the pN stage classification, but more precise, in the prognostic assessment.
【Key words】Colorectal neoplasms; Prognosis; Metastatic lymph node ratio
DOI:10.3877/cma.j.issn.2095-3224.2016.02.06
通信作者:韩方海,Email:FH_han@163.com
收稿日期:(2016-2-17)

