长江口泥螺群体遗传多样性的AFLP分析
杨 梅, 徐嘉伟, 王成辉, 张文驹(. 长江大学 教育部湿地生态与农业利用工程研究中心, 湖北 荆州 4005; . 复旦大学 教育部生物多样性与生态工程重点实验室, 上海 004; . 上海海洋大学 农业部水产种质资源与养殖生态重点开放实验室,上海 00090)
长江口泥螺群体遗传多样性的AFLP分析
杨 梅1, 徐嘉伟3, 王成辉3, 张文驹2
(1. 长江大学 教育部湿地生态与农业利用工程研究中心, 湖北 荆州 430025; 2. 复旦大学 教育部生物多样性与生态工程重点实验室, 上海 200433; 3. 上海海洋大学 农业部水产种质资源与养殖生态重点开放实验室,上海 200090)
本研究应用AFLP分子标记技术, 对我国长江口泥螺的4个群体(江苏启东, 崇明东滩, 九段沙湿地国家自然保护区和上海南汇)进行了遗传多样性分析。4对AFLP引物扩增得到577个位点, 启东、崇明、九段沙和南汇群体的多态率分别为78.2%、56.0%、58.4% 和57.9%。群体总基因多样性为0.2218,显示出较高的遗传多样性水平, 且96%以上的遗传变异存在于群体内, 群体间的遗传分化极微小(0.0000~0.0404)。群体间Nei’s遗传距离为0.0000~0.0124, 主要存在于江苏启东群体和其他3个群体之间。利用STRUCTURE分析群体隐性遗传结构, 结果表明长江口泥螺群体有3种遗传来源, 同时群体之间有强大的基因流。泥螺较强的扩散能力和海洋开放的环境可能是造成泥螺群体遗传同质性较高的主要原因。
泥螺; AFLP; 遗传多样性
[Foundation: The project was financially supported by open fund of Engineering research of ecology and agricultural use of wetland, ministry of education (KF201411)]
泥螺 Bullacta exarata(Philippi, 1848)隶属腹足纲、后腮亚纲的软体动物, 俗称“吐铁”, 为西太平洋沿岸半咸水滩涂的习见种, 广泛分布于我国南北沿海潮间带滩涂, 国外分布于日本和朝鲜[1]。泥螺是一种经济价值很高的滩涂贝类, 肉质细嫩鲜美, 营养丰富。泥螺也是一种对环境变化非常敏感的滩涂资源贝类, 可以作为滩涂环境污染长期潜在的指示生物[2-3]。近年来, 由于长江口滩涂长期被大规模围垦, 使垦区潮间带底栖动物的栖息丰度明显下降[4];同时, 过度的捕捞也使得泥螺野生种群数量严重下降[5]。因此, 对其进行保护生物学研究已十分迫切。遗传多样性是物种最重要的特性之一, 一定程度上反映了物种对复杂生存环境的适应能力和进化潜力,同时也是评价自然生物资源的重要依据[6]。目前, 我国学者对泥螺的种群生物学、生态学和毒理学等进行了比较系统的研究[7-9], 但尚无遗传多样性方面的报道。对泥螺遗传多样性分布的了解, 能为合理制定保护策略提供依据。
扩增片段长度多态性(amplified Fragment LengthPolymorphism, AFLP)是一种基于PCR 和RFLP基础上的DNA指纹技术[10], 具有快速、灵敏、重复性好, 多态性丰富及覆盖全基因组等特点,且可以在不了解研究对象的基因组序列情况下进行研究, 现已被广泛应用到种质鉴定、遗传结构分析等研究领域[11-12]。本研究首次利用AFLP分子标记技术对长江口的泥螺群体进行遗传多样性分析, 通过评价泥螺群体的遗传多样性水平及遗传结构, 以期揭示该地区泥螺种质及不同群体遗传分化情况, 为泥螺的种质资源保护和可持续利用提供依据。
1 材料和方法
1.1 实验材料
本实验所用的泥螺材料分别来自江苏启东(QD),上海崇明东滩(CM), 上海九段沙湿地国家自然保护区(JD)和上海南汇(NH)的4个群体, 取样点地理位置如图1。采集的泥螺样本清水漂洗后置于无水乙醇中, 4℃保存。
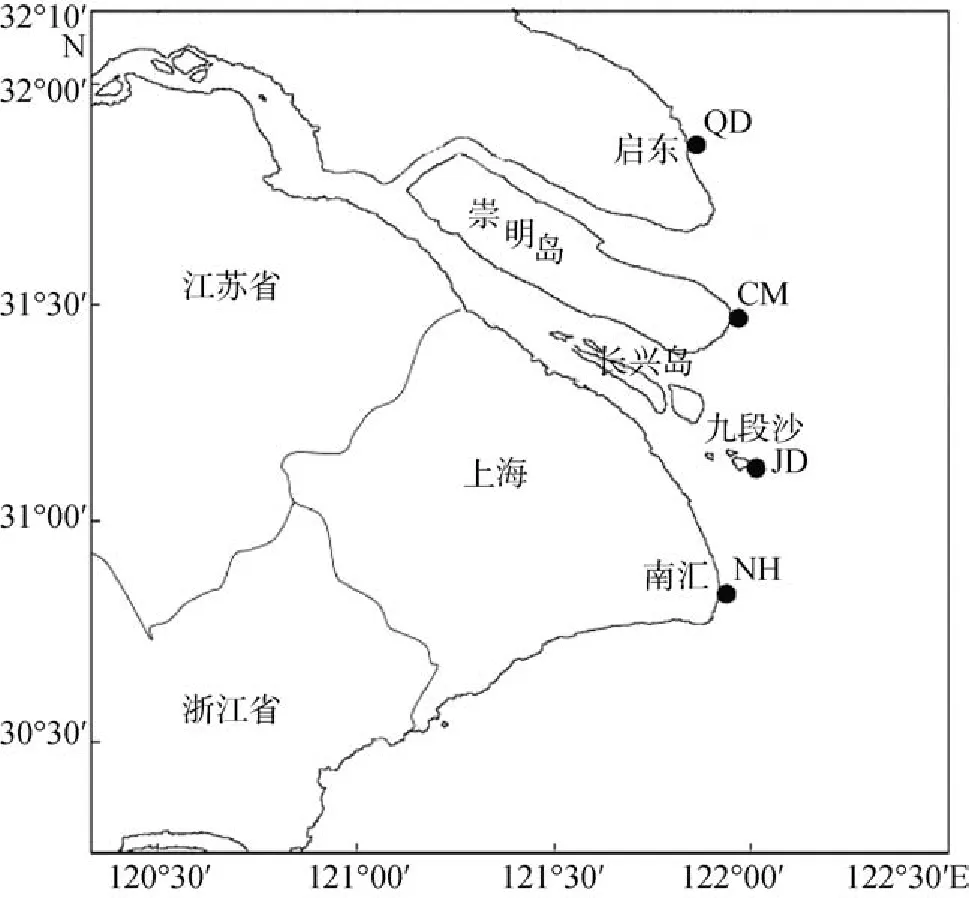
图1 长江口泥螺采样地点示意图Fig. 1 Sample sites of B. exarata along the Yangtze estuary
实验用的海洋动物总DNA提取试剂盒购自天根生化科技公司, EcoR I/ Mse I内切酶和T4DNA连接酶购自Fermentas公司, PCR扩增体系使用的引物、Taq DNA聚合酶、Buffer、MgCl2、dNTP购自上海生工公司, PCR产物检测使用的去离子甲酰胺(Hi-Di Formamide)及内标(GeneScan Liz-500)购自Applied Biosystems公司。
1.2 DNA提取和AFLP图谱构建
基因组DNA的提取采用海洋动物组织提取试剂盒, 提取方法参照Sambrook等《分子克隆指南》[13]。获得的DNA样品用1%琼脂糖凝胶电泳检测其纯度, 其中高质量的总DNA用于后续的AFLP反应; 利用DU640紫外分光光度仪测定DNA溶液浓度, 以双蒸水将总DNA稀释至10 ng/μL, 置–20℃保存备用。
根据预实验结果, 筛选出4对适用于泥螺的AFLP选择性扩增引物用于最后的选择性扩增, 它们是: HEX-E-AGG/M-CAT, HEX-E-AGG/M-CAA, HEXE-AGG/M-CAG, FAM-E-AAC/M-CAT, 其中EcoR I选择性引物带有FAM或HEX荧光标记。参照Vos 等[10]和Li-Cor公司AFLP Expression Analysis kit[14]的方法进行改良并构建AFLP图谱。选择性扩增产物在ABI3730测序仪上进行电泳, 所得光谱数据利用遗传图谱软件(Genemapper 3.7 software)进行50~500bp范围内的片段分析并生成01原始数据距阵(0表示片段无, 1表示片段有)。
1.3 数据统计分析
遗传多样性的计算方法是基于等位基因频率或基因型频率, 参数包括: 多态位点百分率(PLP), Nei’s基因多样性(Hj)和Bayesian估计值(hS)。其中,前两者参数通过AFLP surv 1.0软件[15]计算, 假设前提是非一致先验性分布(non-uniform prior distribution)和哈-温基因型比例(Hardy-Weinberg genotypic proportions); 同时, 作者也计算了总基因多样性(Ht)和群体内基因多样性(Hw)。此外, 基因多样性的Bayesian估计值(hS)利用Hickory 1.0 软件[16]计算,该统计方法不假设种群符合哈-温基因型比例。
遗传结构是指遗传变异在群体内和群体之间的分布型式, 通常以遗传分化水平来衡量。利用AFLP surv 1.0软件计算群体间遗传分化系数(Fst)。利用STRUCTURE 2.2软件[17], 将所有个体根据其遗传组分进行分类, 通过直接衡量所有个体的遗传信息从而得到隐性的遗传结构。预先设定的主要参数是: K(表示假定该群体有K种基因来源)=1~5; 等位基因频率混合相关模型, Burn-in period=30000, MCMC= 100000, 每个K值重复计算5runs。Evanno等[18]提出基于STRUCTRUE运算的Ln P(D)值, 根据ad hoc统计量ΔK值来选择最真实的遗传类型数目, 其计算公式为: ΔK= m[L(K+1)–2L(K)+L(K–1)]/S[L(K)]。其中m表示重复runs中的Ln P(D)的平均值, S表示Ln P(D)的方差; 研究同时认为最高的ΔK值所对应的K值即为真实的遗传类型数目。
2 结果与分析
从所选择出4对AFLP选择性引物共检测出577个扩增片段(50~500bp), 平均每对引物组合扩增出约144条带(所有个体带数总合)。其中, 多态片段为573条, 多态位点比例为99.3%。电泳结果示例图如图2, 只有清晰、噪音小的电泳图才用于下一步的片段分析, 并生成01距阵。
2.1 群体遗传多样性分析
采用群体遗传变异分析程序AFLP surv 1.0 对泥螺群体的遗传变异进行了分析, 从表1可以看出,来自江苏启东(QD)的群体多态位点比率最高(78.2%),其他3个群体(CM、JD、NH)的多态位点比率没有明显差异, 分别为56.0%、58.4%、57.9%; 4个泥螺群体的总基因多样性指数为0.2218, 群体基因多样性(Hj)也以启东群体(QD)最高(0.2612), 其他3个群体(CM、JD、NH)略低(0.1935 ~ 0.2063)。

图2 ABI3730测序仪电泳的得到的一个个体的扩增产物的峰图示例Fig. 2 Plot of electropherograms of one AFLP sample run on the ABI 3730
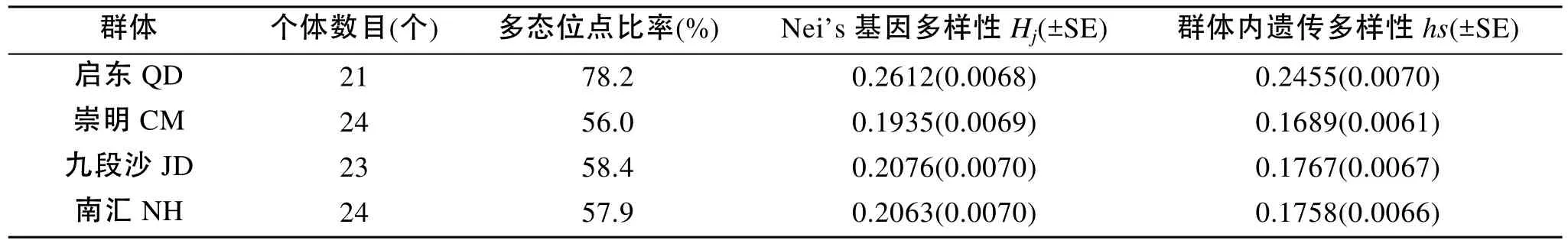
表1 泥螺4个群体的遗传多样性参数Tab. 1 Genetic diversity among populations of B. exarata
2.2 群体遗传结构
4个群体总的基因多样性(Ht)为0.2218, 其中群体内基因多样性(Hw)为0.2163, 暗示遗传变异主要存在于群体内。此结果可由遗传分化系数Fst得到进一步验证(表2), 群体之间最大Fst为0.0404, 表明96%以上的遗传变异存在于群体内。从表2可以看出,长江口南岸的3个群体崇明东滩(CM), 九段沙(JD)和南汇(NH)之间的遗传距离极小甚至没有, 分别为0.0030, 0.0042和0.0000, 而遗传距离主要存在于江苏启东(QD)群体和南岸3个群体之间(CM、JD、NH),分别为0.0102, 0.0124和0.016。
利用Evanno 等[18]的ΔK计算方法, 结果表明在K = 3时具有最大值, 表明长江口泥螺个体有3种遗传来源(图3, 不同颜色代表不同遗传类型)。其中, 来自启东QD的个体以一种遗传类型为主, 而崇明、九段沙和南汇群体以另一种遗传类型为主, 显示出长江口北岸的启东群体与南岸3个群体之间亲缘关系相对较远, 南岸崇明、九段沙和南汇3个群体之间分化极小; 同时, 部分个体的遗传组分是明显混合的,表明这些个体是群体之间基因交流的后代; 此外STRUCTURE分析还显示来自不同群体的部分个体遗传组成相似, 甚至存在遗传组成完全相同的个体(如图3箭头所示), 表明群体之间有较强的基因流。
3 讨论
3.1 长江口泥螺的遗传多样性水平

表2 成对遗传分化值(对角线上方)和Nei’s遗传距离(对角线下方)Tab. 2 Pairwise Fstbetween populations (above diagonal) and Nei’s genetic distance (below diagonal)
近年来, 国内学者采用随机扩增多态性(RAPD)、简单重复序列(SSR)、AFLP等分子标记对我国多种海洋贝类的野生群体进行了遗传多样性分析, 总体呈现出较丰富的遗传变异[19-22]。例如, 闫喜武等[21]的SSR分析揭示青岛、大连等菲律宾蛤仔群体具有较高的遗传多样性(观察杂合度为0.2383~ 0.4387); 张秀英等[22]利用SSR标记发现我国青岛和大连栉孔扇贝遗传多样性较高(观察杂合度分别为0.5100和0.4204), 群体间遗传分化较弱。本研究中,共利用4对AFLP引物对我国长江口泥螺群体进行了遗传结构分析, 结果显示, 与河口其他海洋动物AFLP分析相比, 长江口泥螺群体呈现出较丰富的遗传多样性(多态位点百分率为56.0%~78.2%, 基因多样性为0.1935~0.2612)。黄雷等[23]对长江中华绒螯蟹进行了AFLP分析, 其Nei’s基因多样性为0.1346,遗传变异主要存在于群体内; 葛家春等[24]通过对长江刀鲚的AFLP分析, 发现长江刀鲚具有丰富的遗传多样性(Nei’s基因多样性为0.2183); 潘英等[25]利用AFLP分子标记则发现管角螺的遗传多样性高达0.4766。尽管本研究表明长江口泥螺目前尚保持较高的遗传多样性, 但崔朝霞等[19]的研究同时指出, 长期人工繁殖、环境污染和不合理的捕捞方式已造成多种经济贝类的遗传多样性降低。

图3 STRUCTURE分析得到的隐性遗传结构图(K=3)Fig. 3 Cryptic genetic structures of four populations based on structure analysis (K=3)
3.2 长江口泥螺的遗传结构
遗传分化系数既是衡量遗传变异分布型式, 也是衡量群体再分效应的重要指标, 它表示因遗传漂变引起一个亚群的杂合度的降低程度。Fst的取值为0~1, 其中0表示完全随机交配, 无群体再分; 1表示极端再分, 即群体隔离。0.00~0.05: 群体分化程度较小; 0.05~0.15: 群体分化程度中等; 0.15~0.25: 群体分化程度较大; 0.25~1.00: 群体分化程度很大[26]。本实验结果表明, 长江口北岸启东群体(QD)与南岸3个群体(CM、JD和NH)有较小程度的分化(0.0365~ 0.0404), 但崇明东滩、九段沙和南汇3个群体更小(0.0000~0.0167), 接近随机交配群体, 且九段沙群体和南汇群体为完全随机交配群体。该结论得到STRUCTURE隐性遗传结构分析支持, 启东群体与南岸3个群体亲缘关系相对较远, 而南岸3个群体相似度极高, 分化很小。
基因流是影响群体遗传多样性和遗传结构的最重要的因素之一。本研究中, 长江口泥螺群体遗传多样性的维持与其繁育系统及不同地理位置的频繁的基因交流有关。泥螺繁殖期长, 自3月底到11月底的8个月中都能产卵, 且生长速度较快, 其雌雄同体、异体交配的繁殖特性也有助于其多样性水平的维持。此外, 泥螺生存的特殊环境有助于群体间的个体迁移。虽然泥螺成螺是营匍匐生活的, 自然情况下不易四处扩散, 但泥螺以胶状卵群的形式产出并形成受精卵, 卵群为圆球形、似水泡, 这种球形的卵群对海水产生的浮力, 在海水中半浮半沉, 随波逐流,四处扩散, 胚胎在移动过程中仍能够得到良好的发育, 这可能也是泥螺在我国南北沿海连续分布的原因之一[5]。本研究中, 启东的泥螺群体具有相对更高的遗传多样性且与其他3个群体相对分化较大, 这可能与其分布的地理位置有关。从地理上看, 该群体与东北方向的黄海和渤海的泥螺群体很可能会有基因交流。
此外, 长江口泥螺的散布范围、方向可能受长江口及其邻近海域的洋流方向的调节。5、6月和9、10月是泥螺产卵的两个高峰季节[4], 因此, 这个时期的潮流场很可能对不同地理分布的泥螺的迁移影响最大, 进而影响了泥螺的空间遗传结构。由于长江口及其邻近海域的潮波系统和物质交换是多种动力因子综合作用的结果, 十分复杂[27-28], 因此, 未来需要获取包括洋流、温度、盐度等数据来来辅助进行更深入的群体遗传结构研究。尽管如此, 本研究结果可以作为长江口泥螺遗传多样性和群体分化的基础信息, 并为水域开放系统中生物的遗传结构和扩散研究提供参考。
致谢: 本实验的样品在采集过程中得到唐仕敏先生的帮助,在此表示衷心的感谢。
[1] 蔡如星. 浙江动物志: 软体动物[M]. 杭州: 浙江科学技术出版社, 1991: 116-117.
Cai Ruxing. Fauna of Zhejiang: Mollusca[M]. Hangzhou: Zhejiang Science and Technology Publishing House, 1991: 116-117.
[2] 叶属峰, 陆健健. 长江口泥螺的种群特征及其生态学意义[J]. 长江流域资源与环境, 2001, 10(3): 216-222.
Ye Shufeng, Lu Jianjian. Characteristics and ecological significance of the developing population of Bullacta exarata (Philippi, 1848) in the Yangtze estuary, China[J]. Resources and Environment in the Yangtze Basin, 2001, 10(3): 216-222.
[3] 顾晓英, 尤仲杰, 王一农, 等. 泥螺Bullacta exarata生长生物学的初步研究[J]. 浙江水产学院学报, 1997, 16(1): 6-11.
Gu Xiaoying, You Zhongjie, Wang Yinong, et al. Preliminarily studies on the growth biology of Bullacta exarata[J]. Journal of Zhejiang College of Fisheries, 1997, 16(1): 6-11.
[4] 安传光, 赵云龙, 林凌, 等. 崇明岛潮间带夏季大型底栖动物多样性[J]. 生态学报, 2008, 28(2): 577-586.
An Cuan Guang, Zhao Yunlong, Lin Ling, et al. The biodiversity of marobenthos of intertidal zone of Chongming island in summer[J]. Acta Ecologica Sinica, 2008, 28(2): 577-586.
[5] 尤仲杰, 王一农, 徐海军. 泥螺Bullacta exarata (Philippi) 生态的初步观察[J]. 浙江水产学院学报, 1994, 13(4): 245-250.
You Zhongjie, Wang Yinong, Xu Haijun. A preliminary study on ecological habit of the mud sanil, Bullacta exarata[J]. Journal of Zhejiang College of Fisheries, 1994, 13(4): 245-250.
[6] 邹喻萍, 葛颂, 王晓东. 系统与进化植物学中的分子标记[M]. 北京: 科学出版社, 2001.
Zou Yuping, Ge Song, Wang Xiaodong. Molecular markers in plant systematic and evolution [M]. Beijing: Science Press, 2001.
[7] 尤仲杰, 陆彤霞, 王一农. 泥螺的繁殖生物学研究[J].热带海洋学报, 2003, 22(1): 30-35.
You Zhongjie, Lu Tongxia, Wang Yinong. Study on reproductive biology of tropical marine [J]. Bullacta Sinica, 2003, 22 (1): 30-35.
[8] 郑怀平. 泥螺行为与繁殖生物学特征的初步研究[J].海洋科学, 2003, 27(1): 69-71.
Zheng Huaiping. Preliminary study on characteristics of behavior and reproductive biology for Bullacta exarata (Philippi) [J]. Marine Sciences, 2003, 27(1): 69-71.
[9] 王一农, 尤仲杰, 黄来亚, 等. 高锰酸钾对泥螺(Bullacta exarata (Philippi))胚胎孵化及幼虫的毒理试验[J]. 海洋科学, 1997, (5): 3-5.
Wang Yinong, You Zhongjie, Huang Laiya, et al. Effects of KMnO4 on incubation and larva of Bullacta exarata (Philippi) [J]. Marine Sciences, 1997, (5): 3-5.
[10] Vos P, Hogers R, Bleeker M, et al. AFLP: a new technique for DNA fingerprinting [J]. Nucleic Acids Research, 1995, 23: 4407-4414.
[11] Meudt H M, Clarke A C. Almost Forgotten of Latest Practice? AFLP applications, analyses and advances[J]. Trends in Plant Science, 2007, 12: 106-117.
[12] Mueller U G, Wolfenbarger L L. AFLP genotyping and fingerprinting[J]. Trends in Ecology and Evolution, 1999, 4: 389-394.
[13] Sambrook J, Fritsch E F, Maniatis T. 分子克隆试验指南(第2版)[M]. 金东雁, 黎孟枫, 译. 北京: 科学出版社, 1995: 954-956.
Sambrook J, Fritsch E F, Maniatis T. Molecular cloning: a laboratory manual (Second Edition)[M]. Beijing: Science Press, 1995: 954-956.
[14] AFLP Expression Analysis kit [Z]. http: //www.licor.com
[15] Vekemans X. AFLP-SURV 1.0: A Program for Genetic Diversity Analysis with AFLP (and RAPD) Population Data [P]. Laboratoire de Genetique et Ecologic Vegetale, Unversite Libre de BruxeUes, Belgium, 2002.
[16] Holsinger K E, Lewis P O, Dey D K. A Bayesian approach to inferring population structure from dominant markers [J]. Molecular Ecology, 2002, 11: 1157-1164.
[17] Pritchard J K, Wen X Q, Falush D. Documentation for Structure software: Version 2.2[CP]. Department of Human Genetics and Department of Statistics, University of Chicago, USA.
[18] Evanno G, Regnaut S, Goudet J. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study [J]. Molecular Ecology, 2005, 14: 2611-2620.
[19] 崔朝霞, 张峘, 宋林生, 等. 中国重要海洋动物遗传多样性的研究进展[J]. 生物多样性, 2011, 19(6): 815-833.
Cui Zhaoxia Zhang Heng, Song Linsheng, et al. Genetic diversity of marine animals in China: a summary and prospectiveness[J]. Biodiversity Science, 2011, 19(6): 815-833.
[20] 吴彪, 梁超, 杨爱国, 等. 基于 SSR 标记的魁蚶(Scapharca broughtonii)不同群体遗传结构的分析[J].海洋与湖沼, 2012, 43(4): 863-869.
Wu Biao, Liang Chao, Yang Aiguo, et al. Genetic variation in different populations of Scapharca broughtonii scherenck inferred from microsatellite data[J]. Oceanologia et Limnologia Sinica, 2012, 43(4): 863-869.
[21] 闫喜武, 虞志飞, 秦艳杰, 等. 菲律宾蛤仔EST-SSRs标记开发及不同地理群体遗传多样性[J]. 生态学报, 2011, 31(15): 4190-4198.
Yan Xiwu, Yu Zhifei, Qin Yanjie, et al. Development of EST-SSRs markers and analysis of genetic diversities among different geographical populations of Manila clam Ruditapes philippinarum[J]. Acta Ecologica Sinica,2011, 31(15): 4190-4198.
[22] 张秀英, 张晓军, 赵翠, 等. 栉孔扇贝 BES-SSR的开发及遗传多样性分析[J]. 水产学报, 2012, 36(6): 816-823.
Zhang Xouying, Zhang Xiaojun, Zhao Cui, et al. The development of BAC-end sequence-based microsatellite markers and analysis on population genetic diversity in Zhikong scallop (Chlamys farreri)[J]. Journal of Fisheries of China, 2012, 36(6): 816-823.
[23] 黄雷, 王成辉, 李思发. 中华绒螯蟹长江天然群体遗传差异的AFLP初步分析[J]. 上海水产大学学报, 2008, 17(4): 385-389.
Huang Lei, Wang Chenghui, Li Sifa. Preliminary study on genetic variability in Chinese mitten crab (Eriocheir sinensis) from the Yangtze river by AFLP marker[J]. Journal of Shanghai Fisheries University, 2008, 17(4): 385-389.
[24] 葛家春, 曹廷, 陈婵娟, 等. 利用扩增片段长度多态性技术分析长江刀鲚的遗传多样性[J]. 南京大学学报(自然科学), 2008, 44(3): 332-336.
Ge Jiacun, Cao Ting, Chen Chanjuan, et al. Analysis of genetic diversity based on amplified fragment length polymorphism fingerprint of Coilia nasus from Yangtze River[J]. Journal of Nanjing University (Natural Sciences), 2008, 44(3): 332-336.
[25] 潘英, 慕翠敏, 李琪, 等. 管角螺遗传多样性的AFLP分析[J]. 中国海洋大学学报, 2013, 43(4): 58-62.
Pan Ying, Mu Cui men, Li Qi, et al. AFLP analysis revealed differences in genetic diversity of Hemifusus tuba[J]. Periodical of Ocean University of China, 2013, 43(4): 58-62.
[26] Freeland J R. Molecular Ecology [M]. John Wiley & Sons, Ltd, 2005: 114.
[27] 刘新成, 卢永金, 潘丽红, 等. 长江口和杭州湾潮流数值模拟及水体交换的定量研究[J]. 水动力学研究与进展, 2006, 21(2): 171-180.
Liu Xincheng, Lu Yongjin, Pan L H, et al. Tidal current numerical simulating and water exchange research in Yangtze Estuary and Hangzhou Bay[J]. Journal of Hydrodynamics, 2006, 21(2): 171-180.
[28] 吴晓丹, 宋金明, 李学刚. 长江口邻近海域水团特征与影响范围的季节变化[J]. 海洋科学, 2014, 38(12): 110-119.
Wu Xiaodan, Song Jinming, Li Xuegang. Seasonal variation of water mass characteristic and influence area in the Yangtze Estuary and its adjacent waters[J]. Marine Sciences, 2014, 38(12): 110-119.
(本文编辑: 梁德海)
Amplified fragment length polymorphism analysis of the genetic diversity of Bullacta exarata in the Yangtze estuary
YANG Mei1, XU Jia-wei3, WANG Cheng-hui3, ZHANG Wen-ju2
(1. Engineering Research Center of Ecology and Agricultural Use of Wetland, Ministry of Education, Yangtze University, Jingzhou 430025, China; 2. Key laboratory for Biodiversity Science and Ecological Engineering, Ministry of Education, Fudan University, Shanghai 200433, China; 3. Key Laboratory of Aquatic Genetic Resources and Aquacultural Ecosystem, Ministry of Agriculture, Shanghai Ocean University, Shanghai 200090, China)
Jul., 25, 2015
Bullacta exarata; amplified fragment length polymorphism; genetic diversity
In this study, the genetic diversity of Bullacta exarata from four populations (Qidong, Chongming Dongtan, Jiuduansha, and Nanhui) in the Yangtze estuary were investigated based on amplified fragment length polymorphism (AFLP) profiles. The four AFLP primer combinations produced 577 AFLP loci and the percent loci polymorphic values for QD, CM, JD, and NH were 78.2%, 56.0%, 58.4%, and 57.9%, respectively. The total gene diversity index was 0.2218, indicating a high level of genetic diversity and over 96% of the genetic variation was because of individuals within populations. Genetic differentiations among populations were very low (0.0000–0.0404) and the Nei’s genetic distance among four populations varied from 0.0000 to 0.0124. In addition, structure analysis indicated that B. exarata populations originated from three genetic groups and strong gene flow existed among populations. The ability of B. exarata to disperse in the open sea could be the cause of the slight genetic variation in the studied areas.
S963
A
1000-3096(2016)02-0020-06
10.11759/hykx20141018001
2014-10-18;
2015-10-12
长江大学湿地生态与农业利用教育部工程研究中心开放基金(KF201411)
杨梅(1981-), 女, 湖北省荆州人, 讲师, 博士, 主要研究方向为分子生态学, 电话: 0716-8066541, E-mail: myang@yangtzeu. edu.cn; 张文驹, 通信作者, 男, 教授, 研究方向: 分子生态学

