马链球菌马亚种IgG结合蛋白的原核表达和免疫原性
邵俊高,姜慧娇,常建新,张宝江,李善春,苏艳
新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052
马链球菌马亚种IgG结合蛋白的原核表达和免疫原性
邵俊高,姜慧娇,常建新,张宝江,李善春,苏艳
新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052
邵俊高, 姜慧娇, 常建新, 等. 马链球菌马亚种IgG结合蛋白的原核表达和免疫原性. 生物工程学报, 2016, 32(5): 577–583.
Shao JG, Jiang HJ, Chang JX, et al. Prokaryotic expression and immunogenicity of IgG-binding protein of Streptococcus equi subspecies equi. Chin J Biotech, 2016, 32(5): 577–583.
摘 要:为研究马链球菌马亚种IgG结合蛋白 (EAG) 免疫原性和保护力,评价其作为马链球菌疫苗抗原的价值。采用PCR法扩增马链球菌马亚种EAG基因,将测序正确的EAG扩增产物与原核表达载体pET-28a (+) 连接构建重组质粒,对转化后的大肠杆菌进行诱导表达,用诱导纯化后的重组蛋白作免疫原免疫小鼠,分析重组蛋白免疫小鼠后的抗体水平及对小鼠的免疫保护力。结果表明,诱导后可得到26 kDa的EAG重组蛋白,且该蛋白可与该菌阳性血清发生特异性反应。间接ELISA检测免疫小鼠的抗体效价可达1∶8 100,重组蛋白免疫后对小鼠保护力可达90%。该结果表明,表达的EAG蛋白具有良好的抗原性,可有效提高小鼠的体液免疫水平及免疫保护力。
关键词:马链球菌马亚种,EAG 蛋白,表达,免疫原性分析
Received: September 22, 2015; Accepted: January 8, 2016
Supported by: National Science and Technology Support Program (No. 2012BAD46B01).
国家科技支撑项目 (No. 2012BAD46B01) 资助。
马链球菌马亚种为C群链球菌属成员[1-3],引起马属动物的马腺疫 (Stangles)。该病具有高度接触感染性,主要症状为发热、上呼吸道黏膜发炎、颌下淋巴结肿胀化脓或急性死亡。该病呈世界性分布,几乎每年都要流行一次,不仅直接影响马匹的生长发育,还导致马匹的死亡,严重困扰养马业的发展。我国在20世纪70年代至80年代曾出现过多地暴发[4-5],该病在新疆主要马养殖区域发病率高,常呈现小暴发,已造成严重的经济损失。国内对马腺疫以药物治疗为主,临床治疗存在成本高、治疗效果差且易产生耐药性等问题,应用免疫方法预防该病已成为趋势。目前国外普遍采用灭活菌苗或减毒活菌疫苗进行免疫,但预防效果并不理想。
马链球菌马亚种表面有多种蛋白,IgG结合蛋白 (EAG)[6-7]是位于该菌表面可与血浆内IgG结合的一种蛋白,可非特异地结合IgG抗体的Fc端,影响其抗体活性。除与IgG结合外,该蛋白还能与α2巨球蛋白等结合。以往研究表明,该蛋白能够在马链球菌马亚种的粘附、抗调理吞噬以及在模拟宿主自身成分逃避免疫过程中发挥重要作用。Valentin等[8]发现,α2巨球蛋白在与C群链球菌的EAG结合后,通过抑制IgG的调理活性和吞噬作用进行免疫逃逸。Flock等[4]曾表达EAG蛋白部分片段,证实其可缓解该菌感染实验动物的疾病症状和减少菌的定殖数量。
为进一步研究和评价EAG蛋白在马腺疫免疫防治方面的潜力和作用,本研究通过克隆马链球菌马亚种EAG基因,选择与优化该蛋白的抗原表位基因,构建原核表达载体,在大肠杆菌中诱导表达EAG重组蛋白,并用纯化的EAG重组蛋白免疫小鼠,分析EAG免疫后的抗体水平及保护力,旨在探讨该重组蛋白免疫对小鼠体液免疫功能和免疫保护力的影响,为今后进一步研究EAG的功能和利用该蛋白进行马腺疫免疫预防奠定基础。
1 材料与方法
1.1菌种、试剂及实验动物
马链球菌马亚种新疆分离株XZ1由新疆农业大学动物医学学院微生物实验室鉴定并保存。原核表达载体pET-28a (+)、大肠杆菌Escherichia coli BL21 (DE3) 均为本实验室保存,重组质粒pMD19-T-EAG为本实验室构建并保存。
限制性内切酶BamHⅠ、XhoⅠ,DNA聚合酶,T4 DNA连接酶购自宝生物工程 (大连) 有限公司;Ni-NTA Resin购自TRANSGEN公司;HRP-IgG购自中杉金桥公司,其他试剂均为国产分析纯。
18−20g雌性昆明 (KM) 小鼠,购自新疆维吾尔自治区实验动物研究中心。
1.2PCR扩增
根据pMD19-T-EAG测序结果,用Oligo7.0设计1对原核表达引物。
F:5'-GTAGGATCC AGGGAAATCAATCAG CTGAGTGATGACTAC-3' (BamHⅠ酶切位点);
R:5'-TAACTCGAGTAGCCCAAACGCCGT CTACACCATTTTTATTAG-3' (XhoⅠ酶切位点)。
引物由生工生物工程 (上海) 股份有限公司合成。以pMD19-T-EAG质粒为模板,PCR反应条件:94 ℃预变性5 min;95 ℃变性30 s;56 ℃退火1 min;72 ℃延伸90 s,38个循环;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳鉴定。
1.3原核重组表达质粒的构建
将EAG基因用BamHⅠ和XhoⅠ双酶切后,与经相同酶切的pET-28a (+) 载体进行连接,获得重组表达质粒pET-28a-EAG。经PCR和酶切鉴定正确,送生工生物工程 (上海) 股份有限公司测序。
1.4重组蛋白的诱导表达、纯化
将鉴定正确的重组表达质粒转化大肠杆菌Escherichia coli BL21 (DE3) 感受态细胞中,筛选后接种至50 μg/mL卡那霉素的LB液体培养基中,37 ℃、200 r/min振荡培养至OD600达到0.4时,加入终浓度为1 mmol/L IPTG进行诱导。取10 µL样品进行SDS-PAGE电泳检测目的蛋白。收集的菌体经超声破碎后,利用Ni层析柱对重组蛋白进行纯化,–20 ℃保存备用。
1.5重组蛋白的Western blotting分析
将重组蛋白EAG各10 µL进行SDS-PAGE电泳后,湿法电转移至硝酸纤维素膜上 (300 mA,1 h),以兔抗马链球菌马亚种抗血清为一抗(1∶4 000),以HRP标记的山羊抗兔IgG (1∶10 000)作为二抗,使用DAB显色,水洗照相。
1.6重组蛋白免疫小鼠及小鼠血清抗体效价的检测
30只雌性KM小鼠随机分为3组,每组10只,分别为EAG重组蛋白免疫组 (EAG),马链球菌马亚种全菌免疫组 (S. equi) 和PBS对照组,按50 μg/只皮下注射免疫,免疫程序同上,进行2次免疫。首次免疫后第0天、第14天和第35天采血,分离血清–20 ℃保存备用。
采用间接ELISA法测定重组蛋白抗体水平。用菌体裂解液每孔100 µL包被酶标板,加入100 µL稀释的待检血清 (1∶4 000),以1∶8 000稀释的HRP标记山羊抗鼠IgG为二抗,TMB溶液显色,测OD450值。
1.7小鼠攻毒试验
首次免疫后第50天,取马链球菌马亚种接种于TH培养基,37 ℃培养,以109CFU (5 LD50),分别对EAG免疫组、全菌免疫组和PBS对照组各小鼠进行攻毒,攻毒后72 h内连续观察并记录小鼠死亡情况。
2 结果与分析
2.1EAG基因扩增
PCR扩增获得EAG基因,片段大小为645 bp左右,并且对照孔为阴性,获得目的基因片段。
2.2重组质粒pET-28a-EAG的双酶切鉴定
EAG基因的原核表达重组质粒pET-28a-EAG,经BamHⅠ与XhoⅠ酶切可得到大小正确的目的片段,表明重组质粒pET-28a-EAG构建成功。
2.3重组蛋白的诱导表达和纯化
重组蛋白经诱导表达后进行SDS-PAGE电泳,在26 kDa出现重组蛋白条带 (图1),与预期值相符,表明重组目的蛋白成功表达。
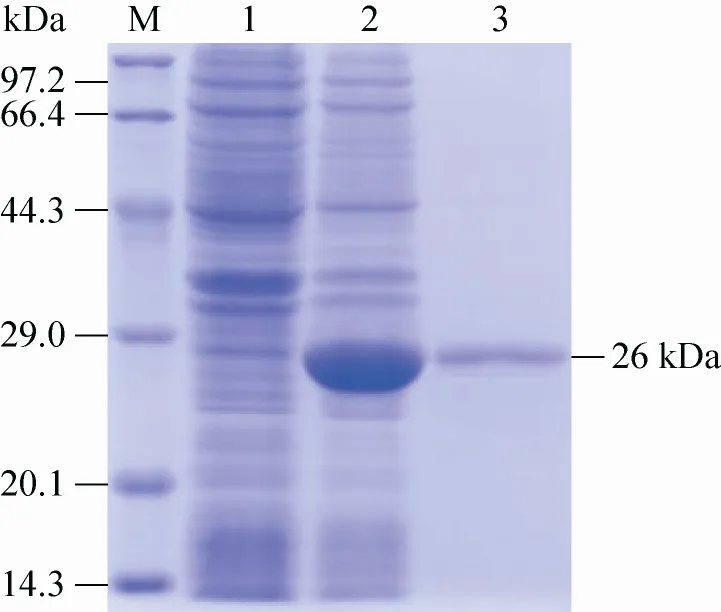
图1 重组蛋白EAG纯化结果Fig. 1 Purification result of the recombinant protein EAG. 1: products of uninduced recombinant bacteria pET-28a-EAG; 2: products of induced recombinant bacteria pET-28a-EAG; 3: purified product of recombinant protein EAG; M: molecular weight protein standards.
2.4重组蛋白的Western blotting分析结果
以马链球菌马亚种全菌免疫兔抗血清与重组EAG蛋白反应,Western blotting检测结果显示,EAG蛋白在26 kDa处出现条带 (图2),表明重组蛋白可以与全菌免疫兔血清发生特异性的反应。
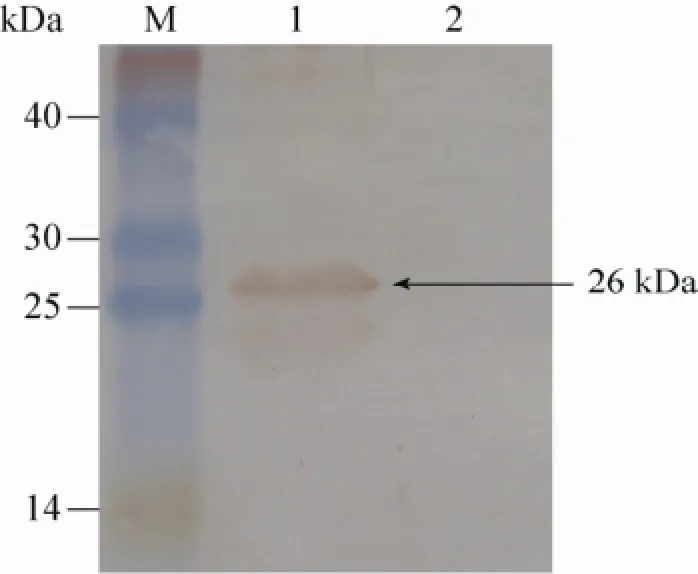
图2 重组蛋白的EAG Western blotting分析Fig. 2 Western blotting analysis of the EAG recombinant protein. 1: purified products of EAG recombinant protein; 2: products of recombinant bacteria pET-28a-EAG without induction; M: prestained protein molecular weight standards.
2.5免疫鼠抗血清的抗体水平变化及与马链球菌全菌的反应性
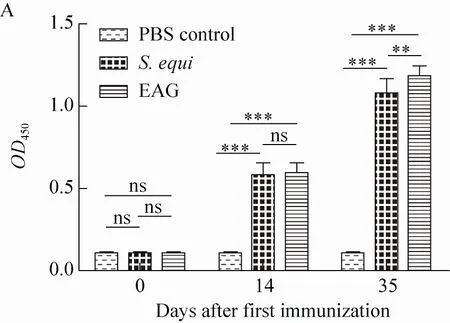
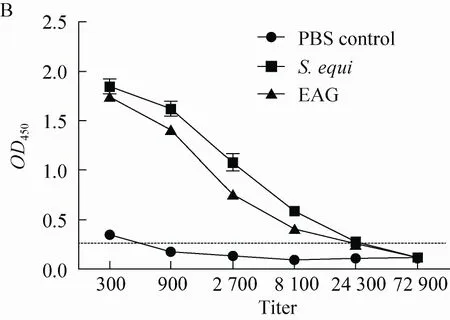
图3 免疫后小鼠抗血清的抗体水平变化 (A) 及抗体滴度检测结果 (B)Fig. 3 The antibody level change (A) and immune assay result of antibody titer of mice serum after immunization (B).
采用间接ELISA方法分别对2组首免前、首免后第14天和首免后第35天的小鼠免疫抗血清进行抗体效价的检测。与免疫前相比免疫组在免疫后抗体效价有明显提高,随着免疫时间推移,抗体效价逐渐上升,且在第二次免疫后抗体效价达到高峰 (图3A)。将免疫鼠血清按照1∶3稀释倍数进行梯度稀释后与包被的马链球菌马亚种菌体作用,检测免疫后抗体对菌体的识别结合能力。结果显示,EAG抗血清对全细菌的结合能力与对照组差异显著 (图3A) (P<0.05)。小鼠二免后对全菌的抗体滴度可达1∶8 100以上 (图3B)。
2.6免疫小鼠的免疫保护力
初次免疫后第50天,选取马链球菌马亚种分离株XZ1 (攻毒剂量5 LD50) 攻毒,取XZ1新鲜培养物腹腔注射6 h后,小鼠均出现活动减少、呼吸困难、精神萎靡等症状,12 h后,实验鼠食欲废绝、寒战、被毛粗糙、扎堆、行动困难僵硬,PBS对照组与灭活全菌组开始出现小鼠死亡,攻毒72 h后,对照组全部死亡,灭活全菌免疫组的保护率为60%,EAG免疫组的保护率为90% (图4)。EAG免疫组小鼠在攻毒48 h后,精神状态好转,开始饮食饮水。PBS对照组小鼠全部死亡。剖检可见3个试验组小鼠内脏器官都有不同程度的病变:EAG免疫组小鼠仅见肝脏和脾脏肿大,其他脏器无明显变化。灭活全菌组免疫组攻毒后,小鼠肝脏表面有出血点和坏死灶,脾脏肿大,充血。PBS对照组小鼠攻毒后,肺部充血,呈深红色;肝脏充血肿大,边缘有坏死;胃粘膜苍白,胃鼓气。脾脏肿大,有多处点状病灶和出血点。
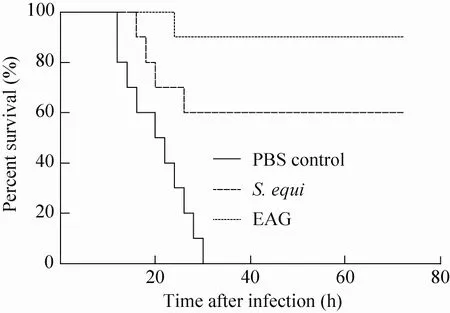
图4 小鼠攻毒保护力检测结果Fig. 4 Detection result of immunoprotective rate of mice after immunization.
3 讨论
马腺疫是引起马匹尤其是马驹呼吸道症状为主的重要疾病之一,该病不仅严重影响了马驹的正常发育,由其造成的继发感染还造成马驹死亡[9-11]。该病一直困扰着世界各国马产业的发展。随着新疆马养殖业的快速发展,该病日益引起重视[12]。
当前临床治疗马腺疫的主要方法是抗生素疗法[13],但目前发现化学药物、抗生素等对该病的治疗效果欠佳,且易于出现耐药性,不能使该病得到有效控制。目前,马腺疫链球菌全菌灭活苗和弱毒疫苗的保护作用不太理想[14],基因工程疫苗逐渐成为防治该病的研究热点[15-18]。
目前对马链球菌马亚种亚单位疫苗的研究多集中于SeM、FNEB等[19-22]表面蛋白,对其的研究结果表明马链球菌马亚种SeM蛋白免疫马匹后的保护力不够理想。FNEB蛋白是一种纤连蛋白结合蛋白,Flock等[4]报道FNEB蛋白免疫后可以产生特异性的抗体,但在进行攻毒实验时,其保护力也不佳[23-25]。
马链球菌马亚种EAG蛋白可与血浆中IgG 的Fc端结合,其在影响IgG抗体活性的同时,还可使马链球菌得以逃避机体免疫系统的识别,协助其定殖于宿主体内,导致感染的发生。Flock等[4]对EAG基因的部分片段 (34−262 aa)进行了克隆表达,并用19 kDa的表达产物对小鼠进行了免疫,证实了该表达产物在缓解疾病症状和减少菌的定殖方面具有一定效果,该研究结果表明此蛋白具有作为疫苗候选成分的潜力。
为进一步分析该蛋白的免疫原性和免疫保护力,探索其对防治该病的潜力,本研究中成功克隆了EAG基因,在对EAG蛋白进行了抗原分析的基础上选择优势抗原表位,构建了pET28a-EAG原核表达载体,经IPTG诱导表达,获得高纯度的EAG重组蛋白,表达蛋白的大小为26 kDa,表达抗原的片段和大小均不同于Flock等的研究[4]。2次免疫后抗体效价达到1∶8 100,免疫原性和特异性较好,对小鼠的保护力可达到90%。因为我们在免疫后抗体检测中所用的包被抗原是菌体抗原,全菌免疫组免疫后的抗体对该包被抗原的识别较好导致抗体效价较高,略高于蛋白免疫组的抗体效价。对比分析全菌灭活苗和纯化的EAG重组蛋白的免疫效果,因全菌灭活苗其抗原成分过于复杂,导致其有效免疫原的含量相对较低,加之在灭活后构象可能有变,因此免疫效果不如重组表达的EAG蛋白。我们的研究证明该EAG蛋白具有作为候选抗原的潜在价值,该结果为我们进一步研究其功能和探索其作为免疫原的潜力奠定了基础。
REFERENCES
[1] Su LK, Lu CP. Extraction of M protein of Streptococcus equi subspecies equi ATCC35246 strain. Anim Husb Vet Med, 2004, 36(1): 25–26 (in Chinese).苏良科, 陆承平. 马链球菌兽疫亚种ATCC35246株类M蛋白的提取. 畜牧与兽医, 2004, 36(1): 25–26.
[2] Kang LC, Chen XH, Zhong FG, et al. Isolation and identification of Streptococcus equi and vaccine development. Heilongjiang Anim Sci Vet Med, 2013, (5): 109–111 (in Chinese).康立超, 陈新华, 钟发刚, 等. 马腺疫链球菌的分离鉴定与疫苗的研制. 黑龙江畜牧兽医, 2013, (5): 109–111.
[3] Jacobs AA, Goovaerts D, Nuijten PJ, et al. Investigations towards an efficacious and safe strangles vaccine: submucosal vaccination with a live attenuated Streptococcus equi. Vet Rec, 2000, 147(20): 563–567.
[4] Flock M, Jacobsson K, Frykberg L, et al. Recombinant Streptococcus equi proteins protect mice in challenge experiments and induce immune response in horses. Infect Immun, 2004, 72(6): 3228–3236.
[5] Anzai T, Timoney JF, Kuwamoto Y, et al. In vivo pathogenicity and resistance to phagocytosis of Streptococcus equi strains with different levels of capsule expression. Vet Microbiol, 1999, 67(4): 277–286.
[6] Serhir B, Higgins R, Foiry B, et al. Detection of immunoglobulin-G-binding proteins in Streptococcus suis. J Gen Microbiol, 1993, 139(12): 2953–2958.
[7] Godehardt AW, Hammerschmidt S, Frank R, et al. Binding of α2-macroglobulin to GRAB (Protein G-related α2-macroglobulin-binding protein), an important virulence factor of group A Streptococci, is mediated by two charged motifs in the ΔA region. Biochem J, 2004, 381(3): 877–885.
[8] Valentin-Weigand P, Traore MY, Biobel H, et al. Role of cxe macroglobulin in phagocytosis of group A and C Streptococci. Fems Microbiol Lett, 1990, 70(3): 321–324.
[9] Cunningham MW. Pathogenesis of group A Streptococcal infections. Clin Microbiol Rev, 2000, 13(3): 470–511.
[10] Waller AS, Paillot R, Timoney JF. Streptococcus equi: a pathogen restricted to one host. J Med Microbiol, 2011, 60(9): 1231–1240.
[11] Mérant C, Sheoran A, Timoney JF. Association of Streptococcus equi with equine monocytes. Vet Immunol Immunop, 2011, 143(1/2): 83–86.
[12] Halimubieke HSM, Wulijiang HJK. Strangles and prevention and cure. Xinjiang Anim Husb, 2007, (4): 53–54 (in Chinese).哈力木别克·胡斯曼, 吾丽江· 胡吉克. 马腺疫及其防治. 新疆畜牧业, 2007, (4): 53–54.
[13] Guo JK, Wang XJ. Adenitis equorum. Chin J Anim Husb Vet, 2013, (10): 16–18 (in Chinese).郭纪珂, 王晓钧. 马腺疫. 畜牧兽医科技信息, 2013, (10): 16–18.
[14] Newton R, Waller AS, King A. Investigation of suspected adverse reactions following strangles vaccination in horses. Vet Rec, 2005, 156(9): 291–292.
[15] Robinson C, Heather Z, Slater J, et al. Vaccination with a live multi-gene deletion strain protects horses against virulent challenge with Streptococcus equi. Vaccine, 2015, 33(9): 1160–1167.
[16] Harms C, Mapes S, Akana N, et al. Detection of modified-live equine intranasal vaccine pathogens in adult horses using quantitative PCR. Vet Rec, 2014, 175(20): 510–510.
[17] Figueiredo L, Cadete A, Gonçalves LM, Corvo ML, Almeida AJ. Intranasal immunisation of mice against Streptococcus equi using positively charged nanoparticulate carrier systems. Vaccine,2012, 30(46): 6551–6558.
[18] Florindoa HF, Panditb S, Goncalves LMD, et al. New approach on the development of a mucosal vaccine against strangles: systemic and mucosal immune responses in a mouse model. Vaccine, 2009, 27(8): 1230–1241.
[19] Timoney JF, Artiushin SC, Boschwitz JS. Comparison of the sequences and functions of Streptococcus equi M-like proteins SeM and SzPSe. Infect Immun, 1997, 65(9): 3600–3605.
[20] Anzai T, Kuwamoto Y, Wada R, et al. Variation in the N-terminal region of an M-like protein of Streptococcus equi and evaluation of its potential as a tool in epidemiologic studies. Am J Vet Res, 2005, 66(12): 2167–2171.
[21] Galán JE, Timoney JF. Molecular analysis of the M protein of Streptococcus equi and cloning and expression of the M protein gene in Escherichia coli. Infect Immun, 1987, 55(12): 3181–3187.
[22] Timoney JF, Denegri R, Sheoran A, Forster N. Affects of N-terminal variation in the SeM protein of Streptococus equi on antibody and fibrinogen binding. Vaccine, 2010, 28(6): 1522–1527.
[23] Lindmark H, Nilsson M, Guss B. Comparison of the fibronectin-binding protein FNE from Streptococcus equi subspecies equi with FNZ from S. equi subspecies zooepidemicus reveals a major and conserved difference. Infect Immun, 2001, 69(5): 3159–3163.
[24] Guss B, Flock M, Frykberg L, et al. Getting to grips with strangles: an effective multi-component recombinant vaccine for the protection of horses from Streptococcus equi infection. PLoS Pathog, 2009, 5(9): e1000584, doi: 10. 1371/journal. ppat. 1000584.
[25] Meehan M, Lewis MJ, Byrne C, et al. Localization of the equine IgG-binding domain in the fibrinogen-binding protein (FgBP) of Streptococcus equi subsp. equi. Microbiology, 2009, 155(8): 2583–2592.
(本文责编 陈宏宇)
工业生物技术
Prokaryotic expression and immunogenicity of IgG-binding protein of Streptococcus equi subspecies equi
Jungao Shao, Huijiao Jiang, Jianxin Chang, Baojiang Zhang, Shanchun Li, and Yan Su
College of Veterinary Medicine, Xinjiang Agricultural University, Urumqi 830052, Xinjiang, China
Abstract:To analyze the immunogenicity and protective ability of recombinant IgG-binding protein (EAG) of Streptococcus equi subspecies equi and to evaluate its value when used as equine vaccine antigen, EAG gene was amplified by PCR and inserted into pET-28a vector. The EAG recombinant proteins were expressed and purified to immune mice. The serum antibody and challenge protection were tested. The purified recombinant protein of EAG was 26 kDa, and theprotein reacted specifically with positive serum of Streptococcus equi subspecies equi. The mice antibody level for EAG immunization group was 1∶8 100. The immunological protection result showed that the protection rate of the EAG recombinant protein was 90%. The results suggested that the EAG protein has good immunogenicity and immunological protection, and it can effectively increase the humoral immune response and immunological protection of mice.
Keywords:Streptococcus equi subspecies equi, EAG protein, expression, immunogenicity analysis
Corresponding author:Yan Su. Tel: +86-991-8762704; E-mail: 2006au@163.com

