动态观察强化胰岛素与常规胰岛素治疗对高血糖重症患者血清TNF-α、IL-1β、IL-6、IL-10变化及预后的影响
柳 学 李志莲 何楷然 甄享凡 刘新强 曾举浩 曾文新
[广东省人民医院(广东省医学科学院)急危重症医学部,广东 广州 510080]
·论著·
动态观察强化胰岛素与常规胰岛素治疗对高血糖重症患者血清TNF-α、IL-1β、IL-6、IL-10变化及预后的影响
柳 学 李志莲 何楷然 甄享凡 刘新强 曾举浩 曾文新*
[广东省人民医院(广东省医学科学院)急危重症医学部,广东 广州 510080]
目的:初步探讨强化胰岛素与常规胰岛素治疗对高血糖重症患者TNF-α、IL-1β、IL-6、IL-10变化及预后的影响。 方法:将广东省人民医院急诊重症监护室(ICU)2014年9月至2015年5月收治60例合并高血糖的重症患者(APACHE II评分>15)按HbA1C水平分为应激性高血糖组(SHG)(n=30)和糖尿病组(DM)(n=30),各组随机分为强化胰岛素治疗组(IIT)和常规胰岛素治疗组(CIT)。强化胰岛素组血糖控制在4.4~6.1 mmol/L,常规胰岛素治疗组血糖控制在8.3~10 mmol/L。比较各组治疗前后TNF-α、IL-1β、IL-6、IL-10水平,观察治疗28 d后患者死亡率。 结果:治疗前,SHG和DM患者TNF-α、IL-1β、IL-6、IL-10水平相较于正常对照组均显著升高,SHG患者TNF-α、IL-1β、IL-6水平明显高于DM患者,但IL-10水平DM患者显著高于SHG患者,差异有统计学意义(P<0.01)。治疗7 d后,DM和SHG患者中IIT组和CIT组炎症因子水平相较于治疗前均显著下降(P<0.01);DM患者IIT组和CIT组之间TNF-α、IL-1β、IL-6水平下降幅度无明显差异(P>0.05),但SHG患者IIT组TNF-α、IL-1β、IL-6水平下降幅度显著大于CIT组(P<0.05);DM和SHG患者中IL-10水平下降幅度IIT组均显著大于CIT组(P<0.05)。SHG患者IIT组TNF-α、IL-1β、IL-6水平下降幅度显著大于DM患者IIT组(P<0.01),但IL-10水平下降幅度差异无统计学意义(P>0.05)。SHG患者IIT组死亡率(1/16)低于CIT组(7/16)(P<0.05)。 结论:与DM重症患者比较,强化胰岛素治疗能更好地降低SHG重症患者的TNF-α、IL-1β、IL-6水平,这为重症患者血糖控制及改善预后提供理论依据。
强化胰岛素治疗;应激性高血糖;炎症因子;预后
重症患者的血糖控制与其预后密切相关。近年来若干临床研究发现,在重症监护室中,同样接受强化胰岛素治疗,单纯的应激性高血糖患者较糖尿病性高血糖患者获益更多。为何相同的胰岛素治疗及血糖控制范围,针对应激性和糖尿病性高血糖患者却有不同的获益,结局不同与其糖尿病史或机体本身应激状态关系如何,值得进一步探讨。重症患者,机体处于急性应激状态,大量炎症因子的级联释放,造成炎症反应失控、机体各脏器功能破坏,同时也导致胰岛素抵抗,与多种升血糖激素共同作用引发应激性高血糖。有糖尿病史的重症患者,除了上述应激状态的发生,还存在长期慢性高血糖的背景,其炎症反应程度是否不同于单纯应激性高血糖患者?强化胰岛素治疗对炎症因子的影响是否不同?目前此类相关报道较少。本研究对重症监护室内的高血糖患者分别进行标准的强化胰岛素治疗和常规胰岛素治疗,同时检测糖化血红蛋白以区分高血糖的原因,动态观察肿瘤坏死因子(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)等的变化,拟初步探讨强化胰岛素治疗对不同原因高血糖重症患者TNF-α、IL-1β、IL-6、IL-10的影响,为临床高血糖重症患者的血糖控制及改善预后提供理论依据。
1 资料与方法
1.1 研究对象
广东省人民医院急诊重症监护室(ICU)2014年9月至2015年5月收治的伴有血糖异常升高的重症患者60例。患者入选标准:①发病24 h内入住本院;②急性生理学及慢性健康状况评分(APACHE II评分)≥15分;③入院第1h内快速随机血糖检测≥11.1 mmol/L,同时检测糖化血红蛋白;④ICU内住院时间>7天;⑤排除年龄<18岁或慢性疾病终末期、孕妇、甲状腺功能亢进、贫血以及自身免疫性疾病长期使用激素等患者。本研究经广东省人民医院伦理委员会批准,所有患者知情并签署知情同意书。
1.2 研究方法
1.2.1 血糖控制及分组 根据患者入院后1 h内检测的糖化血红蛋白(HbA1c)值正常或≥6.5%,分为应激性高血糖(stress hyperglycaemia,SHG)组和糖尿病(diabetes mellitus,DM)组。按照随机数字表再将两组患者分别给予强化胰岛素治疗(intensive insulin therapy,IIT)和常规胰岛素治疗(conventional insulin therapy,CIT)。IIT组患者控制血糖于4.4~6.1 mmol/L水平;CIT组患者控制血糖于8.3~10 mmol/L水平。胰岛素调整方案具体如下:根据血糖初测值调整,血糖6.1~12.2 mmol/L,予2U静脉推注后,2U/h泵入维持;血糖12.2~15.9 mmol/L,予4U静脉推注,然后4U/h泵入维持;血糖15.9~33.3 mmol/L,予6U静脉推注,然后6U/h泵入维持;当血糖>33.3 mmol/L,予10U静脉推注,6U/h泵入维持。为避免低血糖的发生,患者均为每半小时至1小时监测指尖血糖,血糖水平控制相对稳定后,仍为每小时监测血糖1次。每组患者血糖均于24小时内调整达控制范围。
1.2.2 观察指标及实验方法 详细记录患者一般情况(包括性别、年龄、糖尿病史)、APACHE II评分、ICU期间低血糖发生情况以及28天存活等情况。分别抽取患者治疗前及治疗后1、3、5、7天静脉血各10 mL,3 000 r/min离心10min后分离血清,-80 ℃保存待检。酶联免疫吸附(ELISA)法检测患者血清标本TNF-α、IL-1β、IL-6、IL-10水平;健康志愿者20名仅抽取1次静脉血,测定值作为基础对照;使用同一批号试剂测定,试剂盒购自美国Cell Biolabs公司。
1.3 统计学处理

2 结 果
2.1 基本资料
60例患者中男性32例,女性28例,平均年龄(62.9±7.1)岁。原发病包括:感染性休克14例,急性重症胰腺炎9例,脑血管意外10例,糖尿病酮症酸中毒7例,重症肺炎10例,慢性阻塞性肺疾病急性发作4例,重型颅脑损伤4例,多发伤2例。其中糖尿病患者为28例,随机分入IIT组14例,CIT组14例;应激性高血糖患者32例,随机分入IIT组16例,CIT组16例。各组年龄、性别构成、APACHE评分、低血糖发生率、28天死亡率情况详见表1。糖尿病与应激性高血糖患者不同治疗组之间年龄、性别、APACHE II评分差异无统计学意义。
2.2 各组患者治疗前后炎症因子水平的变化
2.2.1 血清TNF-α 治疗前,应激性高血糖患者和糖尿病患者TNF-α水平分别为(40.07±7.55)、(24±7.75)pg/mL,相较于对照组(8±4.20)pg/mL水平,均显著升高(P<0.01和P<0.05),而且应激性高血糖患者升高明显高于糖尿病患者,差异有统计学意义(P<0.01)。通过胰岛素治疗,患者TNF-α水平逐渐下降;治疗7天后,TNF-α水平下降到最低水平,糖尿病患者IIT组和CIT组分别降低为(13.21±5.33)和(13.57±5.00)pg/mL,应激性高血糖患者IIT组和CIT组分别降低为(8.31±1.54) 和(18.44±6.28),相较于治疗前,差异均有统计学意义;糖尿病患者IIT组和CIT组TNF-α水平下降幅度无明显差异(P>0.05),应激性高血糖患者IIT组TNF-α水平下降幅度显著大于CIT组,差异有统计学意义(P<0.05),见图1。应激性高血糖患者IIT组TNF-α下降幅度显著大于糖尿病患者IIT组,差异有统计学意义(P<0.01),见图2。
2.2.2 血清IL-1β 治疗前,应激性高血糖患者和糖尿病患者IL-1β水平分别为(48.84±11.88)、(31.01±8.66)pg/mL,相较对照组(12.30±4.84)pg/mL水平,均显著升高(P<0.01),而且应激性高血糖患者升高明显高于糖尿病患者,差异有统计学意义(P<0.01)。治疗7天后,IL-1β水平下降到最低水平,糖尿病患者IIT组和CIT组分别降低为(14.71±5.25)和(15.93±5.30)pg/mL,应激性高血糖患者IIT组和CIT组分别降低为(13.63±6.57)和(34.06±5.04)pg/mL,相较于治疗前,差异均有统计学意义;糖尿病患者IIT组和CIT组IL-1β水平下降幅度无明显差异(P>0.05),应激性高血糖患者IIT组IL-1β水平下降幅度显著大于CIT组,差异有统计学意义(P<0.05),见图1。应激性高血糖患者IIT组IL-1β下降幅度显著大于糖尿病患者IIT组,差异有统计学意义(P<0.01),见图2。

表1 两组患者一般情况比较
2.2.3 血清IL-6 治疗前,应激性高血糖患者和糖尿病患者IL-6水平分别为(246.12±57.36)和(109.21±19.73)pg/mL,相较对照组(32.35±13.70)pg/mL水平,均显著升高(P<0.01),而且应激性高血糖患者升高明显高于糖尿病患者,差异有统计学意义(P<0.01)。治疗7天后,糖尿病患者IIT组和CIT组IL-6水平分别降低为(48.35±16.16)和(55.64±22.38)pg/mL,应激性高血糖患者IIT组和CIT组分别降低为(70.25±19.71)和(118.37±19.13)pg/mL,相较于治疗前,差异均有统计学意义;糖尿病患者IIT组和CIT组IL-6水平下降幅度无明显差异(P>0.05),应激性高血糖患者IIT组IL-6水平下降幅度显著大于CIT组,差异有统计学意义(P<0.05),见图1。应激性高血糖患者IIT组IL-6水平下降幅度显著大于糖尿病患者IIT组,差异有统计学意义(P<0.01),见图2。
2.2.4 血清IL-10 治疗前,应激性高血糖患者和糖尿病患者IL-10水平分别为(33.97±6.82)和(57.25±12.41)pg/mL,相较对照组(8.38±5.74)pg/mL水平,均显著升高(P<0.01),但不同于其它炎症因子,反而是糖尿病患者升高水平明显高于应激性高血糖患者,差异有统计学意义(P<0.01)。治疗7天后,糖尿病患者IIT组和CIT组IL-10水平分别降低为(11.79±3.07)和(29.57±9.78)pg/mL,应激性高血糖患者IIT组和CIT组分别降低为(8.13±1.68)和(21.75±2.41)pg/mL,相较于治疗前,差异均有统计学意义;糖尿病患者和应激性高血糖患者中IIT组IL-10水平下降幅度分别都显著大于CIT组,差异均有统计学意义(P<0.05),见图1。应激性高血糖患者IIT组IL-10水平下降幅度与糖尿病患者IIT组比较,差异无统计学意义(P>0.05),见图2。
2.3 各组患者低血糖事件和死亡率的比较
糖尿病及应激性高血糖患者无论CIT还是IIT组,无1例发生严重低血糖。糖尿病与应激性高血糖患者28天死亡率比较,差异无统计学意义(χ2=0.409,P=0.503)。糖尿病患者CIT与IIT组间死亡率比较差异无统计学意义(χ2=0.243,P=1.000);但应激性高血糖患者IIT组死亡率(1/16)低于CIT组(7/16),差异有统计学意义(χ2=6.000,P=0.037)。

353025201510TNF-α(pg/mL)0d1d3d4d7DM-IITDM-CIT时间(d)50403020100TNF-α(pg/mL)40353025201510IL-1β(pg/mL)IL-1β(pg/mL)6050403020100d1d3d4d7时间(d)0d1d3d4d7时间(d)0d1d3d4d7时间(d)0d1d3d4d7时间(d)0d1d3d4d7时间(d)0d1d3d4d7时间(d)0d1d3d4d7时间(d)DM-IITDM-CITDM-IITDM-CITIL-10(pg/mL)8060402040353025201510IL-1β(pg/mL)IL-6(pg/mL)30025020015010050IL-10(pg/mL)50403020100DM-IITSHG-IITSHG-IITSHG-IITSHG-IITSHG-IITSHG-IITSHG-IITSHG-IITSHG-IITP<0.05P<0.05P<0.05P<0.05
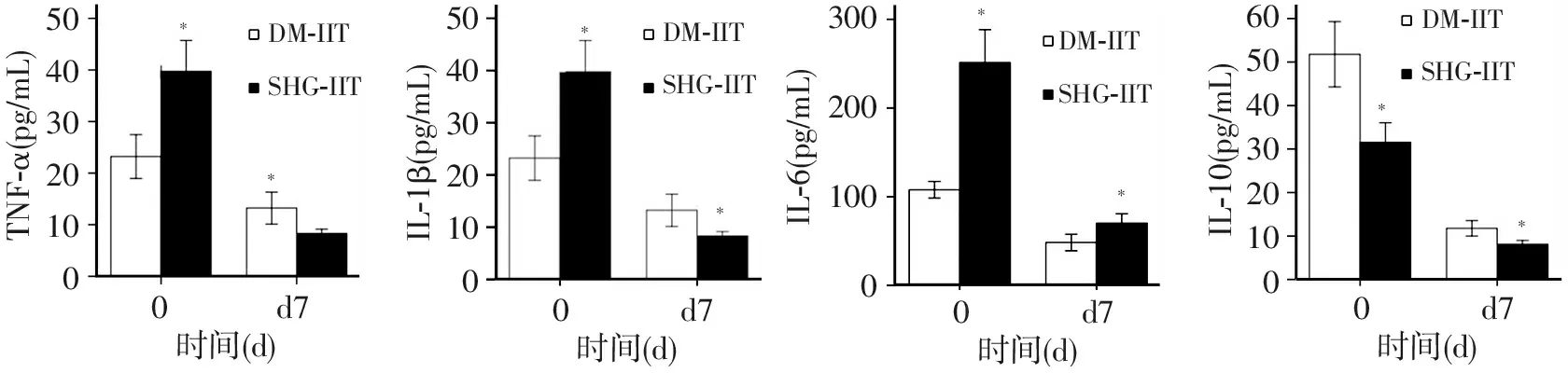
图1 糖尿病和应激性高血糖患者IIT和CIT组炎症因子的变化
图2 糖尿病与应激性高血糖患者强化胰岛素治疗炎症因子的比较
3 讨 论
重症患者常合并高血糖,高血糖是诱发和加重多种并发症并增加死亡率的独立危险因素[1,2]。2001年Van den Berhe等发现强化胰岛素治疗可降低ICU患者的死亡率和多种严重并发症的发生率[3],而2009年的NICE-SUGAR临床研究结果显示,强化血糖控制并未改善重症患者的预后,而且增加患者低血糖风险[4],这是否提示强化胰岛素治疗并非适合所有合并高血糖的重症患者?近年来大量临床研究发现合并高血糖的重症患者中,应激性高血糖的患者更能从强化胰岛素治疗中获益[5-12]。应激性高血糖的发生,是机体在应激因素或损伤因子(如感染、休克、手术、创伤、缺氧)等强烈刺激下出现的急性糖代谢紊乱的病理现象,其本质是炎症因子的大量释放,并与应激状态下升高的升血糖激素共同作用引起血糖升高,同时高血糖又进一步扩大机体炎症反应、加重炎症失控[13]。重症患者使用胰岛素治疗不仅在于迅速降糖,更重要的是能直接抑制NF-кB、AP-1等途径从而控制炎症因子起到抗炎作用[14],因而炎症状态的转归是重症患者获益于胰岛素治疗的重要机制。相对于单纯的应激性高血糖,有糖尿病史的重症患者还有慢性高血糖的背景,高血糖的持续存在使机体处于慢性炎症状态,两者在应激发生时的炎症变化以及对强化胰岛素治疗的不同反应,是本研究探讨的重点。
重症患者发生应激性高血糖时,机体处于急性炎症状态,TNF-α、IL-1β是急性期组织损伤的早期敏感指标,可以反映机体炎症反应的严重程度[15,16],其作为炎症级联反应的启动因子,通过AP-1和NF-кB等途径介导炎症因子的级联反应,诱发继发性促炎因子IL-6、IL-8等,介导炎症发生,损伤机体组织器官。随着炎症的进程,机体启动自我保护机制,炎症后期一系列抗炎因子(IL-2、IL-4、IL-10)释放,其中IL-10通过减少炎性介质及趋化因子的释放,抑制炎性细胞的增殖和迁移,起到抑制炎症及免疫调节作用[17]。
本研究中,应激性高血糖患者治疗前炎症因子TNF-α、IL-1β、IL-6水平都明显高于糖尿病组和对照组,提示在起病早期,应激性高血糖患者炎症反应程度较糖尿病组明显强烈。有基础研究发现[18-20],2型糖尿病大鼠或糖尿病患者外周血单核细胞在脂多糖LPS刺激后,分泌炎症因子(TNF-α、IL-1β、IL-6)的能力较正常炎症细胞显著降低,从细胞水平上解释了这一结果。随着胰岛素治疗的进行,治疗7天后应激性高血糖患者IIT组TNF-α、IL-1β、IL-6水平下降幅度较CIT组显著,提示合并应激性高血糖的重症患者,强化胰岛素治疗较常规胰岛素治疗对急性炎症状态有更好的抑制作用;而糖尿病患者强化胰岛素治疗7天后,同常规胰岛素治疗比较,TNF-α、IL-1β、IL-6水平下降幅度无明显差异,提示在合并糖尿病的重症患者强化胰岛素治疗对急性炎症因子的控制并未显示出较常规治疗有更明显的优势;而且应激性高血糖与糖尿病患者,两者都行强化胰岛素治疗,前者TNF-α、IL-1β、IL-6降低幅度明显大于后者,提示强化胰岛素治疗在应激性高血糖患者能更为有效的控制炎症反应的转归。糖尿病患者治疗前IL-10水平已较应激性高血糖患者及对照组明显升高,符合糖尿病患者存在慢性炎症学说[21]。治疗7天后,应激性高血糖患者强化治疗组IL-10水平较常规治疗组出现明显下降,同样,糖尿病患者强化胰岛素组IL-10水平也较常规治疗组出现明显下降,且降幅更为明显。 IL-10是抗炎因子,有研究[22]显示胰岛素可上调IL-10的表达,但本研究中发现其水平随促炎因子同时下降,考虑可能是强化胰岛素治疗发挥了其抗炎作用,原发性下调促炎因子水平,继而引起抗炎因子水平下降,是机体总体炎症反应消退的表现。糖尿病患者的慢性高血糖使机体处于慢性炎症状态,基础研究[23]发现2型糖尿病大鼠由于对慢性炎症状态的适应,其对急性炎症刺激的耐受性增强,因而糖尿病高血糖与急性炎症之间的恶性循环不如单纯应激性高血糖强烈,因此后者可能在胰岛素强化治疗中获益更多,也为本研究提供了病理生理机制的支持。
为了避免胰岛素强化治疗导致的低血糖发生,本研究自患者入院后即给予充分的重视。研究过程中,糖尿病及应激性高血糖患者胰岛素治疗无1例发生严重低血糖,避免了因低血糖导致的不良事件的发生。患者28天后随访结果显示,糖尿病患者与应激性高血糖患者死亡率无明显统计学差异,但应激性高血糖患者强化胰岛素治疗组死亡率明显低于常规治疗组,提示强化胰岛素治疗能改善应激性高血糖重症患者的预后。因局限于样本量较小,在死亡率上难以得出进一步准确的结论。近年较多研究[24-30]亦发现,合并应激性高血糖的重症患者发生临床不良结局的概率较糖尿病患者增高,与其对血糖波动耐受水平更低、急性炎症反应程度更加激烈、血糖关注程度不如糖尿病患者高等因素有关,因而对这类患者应该给予更多的重视和及早的干预。
胰岛素是目前重症高血糖患者达到并维持血糖控制的首选治疗措施,不同原因高血糖重症患者血糖控制目标尚无统一定论,但众多研究均倾向于单纯应激性高血糖患者应予以更为严格的血糖控制。本研究结果表明,采用强化胰岛素治疗将血糖严格控制在4.4~6.1 mmol/L水平,并严密监测杜绝低血糖发生,能更好的降低应激性高血糖重症患者TNF-α、IL-1β、IL-6水平,并改善其预后;而对于糖尿病性高血糖的重症患者,强化胰岛素治疗较常规胰岛素治疗患者获益不明显,血糖控制范围可予适当放宽。
[1] Krinsley JS. Association between hyperglycemia and increased hospital mortality in a heterogeneous population of critically ill patients [J]. Mayo Clin Proc 2003,78(12):1471-1478.
[2] Egi M,Bellomo R,Stachowski E,et al. Blood glucose concentration and outcome of critical illness:the impact of diabetes [J]. Crit Care Med 2008,36(8):2249-2255.
[3] Dungan KM,Braithwaite SS,Praiser JC.Stress hyperglycaemia [J].Lancet,2009,373(9677):1798-1807.
[4] Van den Berghe G,Wouters P,Weekers F,et al. Intensive insulin therapy in critically ill patients [J]. N Engl J Med,2001,345(19):1359-1367.
[5] The NICE-SUGAR Study Investigators. Intensive versus conventional glucose control in critically ill patients [J]. New Engl J Med,2009,360(13):1283-1297
[6] 胡耀敏,刘伟,陈雅文,等.内科重症监护病房住院患者高血糖 临床资料分析—上海仁济医院2002年至2009年资料回顾 [J].中华内分泌代谢杂志,2010,26(6):448-451.
[7] Graham BB,Keniston A,Gajic O,et al.Diabetes mellitus does not adversely affect outcomes from a critical illness [J].Crit Care Med,2010,38(1):16-24.
[8] Umpierrez GE,leases SD,Bazargan N,et al.Hyporglycemia:an independent marker of in hospital mortality in patients with undiagnosed diabetes [J].J Clin Endocrinol Metab,2002,87(3):978-982.
[9] Krinsley JS.Glycemie control,diabetic status,and mortality in a heterogeueous population of critically ill patients before and during the era of intensive glycemic management:six and one-half years experience at a university-affiliated community hospital[J].Semin Thorec Cardiovasc Surg,2006,18(4):317-325. [10] Whitcomb BW,Predhan EK,Pittas AG,et al.Impact of admission hyperglycemia on hospital mortality in various intensive care unit populations [J].Crit Care Med,2005,33(12):2772-2777.
[11] Wahab NN,Cowden E,Pearee NJ,et al.Is blood glucose an independent predictor of mortality in acute myocardial infarction in the thrombolytic era? [J]J Am Coil Cardiol,2002,40(10):1748-1754.
[12] Farrekhnia N,BjOrk E,Lindback J,et al.Blood glucose in acute stroke,different therapeutic targets for diabetic and non.diabetic patients? [J] Acto Neurol Scand,2005,112(12):81-87.
[13] Stollberger C,Exner I,Finstemr J,et al.Stroke in diabetic and non—diabetic patients: course and prognostic value of admission serum glucose [J].Ann Mad,2005,37(5):357-364.
[14] Dandona P,Chanim H,Bandyopadhyay A,et al.Insulin suppresses emtotoxln induced oxidative,nitrosative,and inflammatory stress in humans [J].Diabetes Care,2010,33(11):2416-2423.
[15] Aosasa S,Ono S,Mochiruki H,et al. Mechainism of the inhibitory effect of protease inhibitor on tumor necrosis factor alpha production of monocytes[J]. SHOCK,2001,15(2):101-105
[16] Pallua N,Low JF,von Heimburg D. Pathogenic role of interleukin-6 in the development of sepsis. Part II:significance of anti-interleukin-6 and anti-soluble interleukin-6 receptor-alpha antibodies in a standardized murine contact burn model [J]. Crit Care Med,2003,31(5):1495-1501
[17] Moore KW,de Waal Malefyt R,Coffman RL,et al. Interleukin-10 and the interleukin-10 receptor[J]. Annu Rev Immunol,2001,19:683-765.
[18] Zykova SN,Jenssen TG,Berdal M,et al.Altered cytokine and nitric oxide secretion in vitro by macrophages from diabetic type 11-like db/db mice[J].Diabetes,2000,49(9):145l-1458.
[19] El-Mabmoudy A,Shimlzu Y,Shilna T,et al.Maerophage-derived cytokine and nitric oxide profiles in type I and type II diabetes mellitus:effect ofthymoquinone [J].ActaDiabetol,2005,42(1):23-30.
[20] Zykova SN,Svartberg J,Seijelid R,et al.Release of TNF-alpha from in vitro—stimulated monoeytes is negatively associated with serum levels of apolipopmtein B in patients with type 2 diabetes [J].Scand J lmmunol,2004,60(5):535-542.
[21] Dinarello CA. Blocking interleukin-1β in acute and chronic autoinflammaotry diseases [J]. J Intern Med,2011,269(1):16-28.
[22] 于占科,何风田,许霖水,等. 胰岛素葡萄糖钾盐与胰岛素体外抗炎效果比较研究[J] .肠外与肠内营养,2008,15(4):193-196.[23] 韩亭亭,苏布德格日乐,胡耀敏.急性炎症状态下2型糖尿病大鼠的反应能力研究[J].上海交通大学学报,2012,32(1):9-13.
[24] Rady MY,Johnson DJ,Patel BM,et al.Influence of individual characteristics on outcome of glycemic control in intensive care unit patients with or without diabetes meilitus [J].Mayo Clin Proc,2005,80(12):1558-1567.
[25] Leonidou L,Mouzaki A,Michalaki M,et al.Cytokine production and hospital mortality in patients with sepsis-induced stress hypcrglycemia [J].J Infect,2007,55(4):340-346.
[26] Capes SE,Hunt D,Malmberg K,et al.Stress hyperglycaemia and increased risk of death after myocardial infarction in patients with and without diabetes:a systematic overview [J].Lancet,2000,355 (9206):773-778.
[27] Capes SE,Hunt D,Malmberg K,et al. Stress hyperglycemia and progaosis of stroke in nondiabetic and diabetic patients:a systematic overview[J].Stroke,2001,32(10):2426-2432.
[28] Van den Berghe c,Wilmer A,Hermans G,et al. Intensive insulin therapy in the medical ICU[J].N Eugl J Med,2006,354(5):449-46I.
[29] Van den Berghe G,Wouters PJ,Bouillon R,et al.Outcome benefit of intensive insulin therapy in the critically ill:insulin dose versns glycemic control[J].Crit Care Med,2003,31(2):359-366.
[30] Van den Berghe G,Wiimer A,Milants I,et al.Intensive insulin therapy in mixed medicsJ surgical intensive care units:benefit versus harm[J].Diabetes,2006,55(11):3151-3159.
Effects of intensive vs conventional insulin therapy on serum levels of TNF-α, IL-1β, IL-6, and IL-10 and prognosis in critically ill patients with hyperglycemia
LiuXue,LiZhilian,HeKairan,ZhenXianfan,LiuXinjiang,ZengJuhao,ZengXinwen*
[DepartmentofEmergencyandCriticalCare,GuangdongGeneralHospital(GuangdongAcademyofMedicalScience),Guangzhou510080,China]
*CorrespondingAuthor:Email:Zengwx@126.com
Objective:To investigate the effects of intensive vs conventional insulin therapy on serum levels of TNF-α, IL-1β, IL-6, and IL-10 and prognosis in critically ill patients with hyperglycemia.Methods: Included in this study were 60 critically ill patients with hyperglycemia , (APACHE II score>15) treated in Emergency ICU of Guangdong Provincial People's Hospital between September 2014 and May 2015. The subjects were divided into stress hyperglycemia group (SHG group,n=30) and diabetes mellitus (DM group,n=30) based on HbA1C level. Patients in each group were randomized to receive intensive insulin therapy (IIT) or conventional insulin therapy group (CIT). Blood glucose was controlled at 4.4~6.1mmol/L for patients on IIT and at 8.3~10 mmol/L for those on CIT. Before and after treatment, serum levels of TNF-α, IL-1β, IL-6, and IL-10 levels measured in each group. The 28-day mortality in the patients was also recorded.Results: Before treatment, SHG and DM patients had significantly higher levels of TNF-α, IL-1β, IL-6 and IL-10 compared with normal controls. SHG patients had significantly higher levels of TNF-α, IL-1β and IL-6 than the DM patients, but the IL-10 level was significantly higher in DM patients than in SHG patients, with statistical difference between groups (P<0.01). After 7d of treatment, DM and SHG patients, either on IIT or CIT, showed significantly decreased levels of inflammatory cytokines from baseline (P<0.01). Among the DM patients, there were no significant differences in reduction of TNF-α, IL-1β and IL- 6 levels from baseline between those on IIT and CIT (P>0.05). Among SHG patients, those on IIT showed significantly greater reduction of TNF-α, IL-1β and IL-6 levels from baseline than those on CIT (P<0.05). Patients on IIT, with either DM or SHG, showed significantly greater reduction of IL-10 level from baseline than those on CIT (P<0.05). SHG patients on IIT showed significantly greater reduction of TNF-α, IL-1β and IL-6 levels from baseline compared with DM patients on IIT (P<0.01), but the decline in the level of IL-10 did not differ between the both (P>0.05). The mortality in SHG patients on IIT (1/16) was lower than that in those on CIT (7/16) (P<0.05).Conclusion: Compared with critically ill patients with DM, those with SHG treated on IIT may show greater reduction in TNF-α, IL-1β and IL-6 levels. These findings provide a theoretical basis for glycemic control and prognosis improvement in critically ill patients.
intensive insulin therapy; stress hyperglycemia; inflammatory factors; prognosis
10.3969/j.issn.1008-1836.2016.03.002
广东省医学科学技术研究基金资助项目(A2014023)
R587.1
A
2095-9664(2016)03-0005-06
2016-03-10)
*通讯作者:Email:Zengwx@126.com

