甲磺酸伊马替尼片处方工艺研究
缪鹏飞+王丹
摘 要 目的:研究甲磺酸伊马替尼片的处方工艺。方法:以制剂的溶出曲线为指标,筛选甲磺酸伊马替尼片处方和制备工艺。结果:建立了以微晶纤维素、交联聚维酮和硬脂酸镁为辅料的处方及采用95%乙醇湿法制粒的工艺,制备的3批产品的有关物质、溶出度等指标与参比制剂具有相似性,制剂特性满足制剂质量一致性的要求。结论:甲磺酸伊马替尼片处方合理,工艺简单,易于工业化生产。
关键词 甲磺酸伊马替尼片 处方工艺 溶出曲线
中图分类号:R944.4; R979.19 文献标识码:A 文章编号:1006-1533(2016)11-0069-05
Formulation and technology for imatinib mesylate tablets
MIAO Pengfei*, WANG Dan
(Shanghai Parling Pharmatech Co. Ltd., Shanghai 201612, China)
ABSTRACT Objective: To optimize the formulation and technology for the preparation of imatinib mesylate tablets. Methods: The formulation and technology for the preparation of imatinib mesylate tablets was screened out based on the dissolution curve. Results: The formulation taking microcrystalline cellulose, polyvinylpolypyrrolidone, and magnesium stearate as excipients and the technology of wet granulation using 95% ethanol were established. The quality indicators such as the related substances, dissolution and so on detected from three batches of self-prepared preparations of imatinib mesylate tablets were similar to those of the reference Glivec and their characteristics could meet the requirements of the consistency of preparation quality. Conclusion: The formulation for the preparation of imatinib mesylate tablets is reasonable and the technology is simple and easy to be applied in industry.
KEY WORDS imatinib mesylate tablets; formulation and technology; dissolution profile
甲磺酸伊马替尼(imatinib mesylate)是瑞士诺华(Novartis)公司研发的酪氨酸激酶抑制剂类药物[1],于2001年5月获得美国FDA批准上市,其在美国、欧盟和日本等国获得孤儿药物地位,用于治疗α-干扰素治疗失败胚细胞危象病期、慢性病期、加速病期的骨髓性白血病患者。2002年FDA又批准增加该药的新适应证,即可用于不能手术切除或发生转移的恶性胃肠道间质肿瘤( GIST) 患者[2]。经广泛临床应用后它已获得医学界的高度评价,被誉为近年有重大突破的口服抗癌药物[3-4]。为了开发出与原研格列卫具有相同质量的甲磺酸伊马替尼片,本试验以瑞士诺华制药公司的甲磺酸伊马替尼片(格列卫)作为参比制剂,通过考察辅料与甲磺酸伊马替尼之间的相互作用,采用湿法制粒工艺,并通过不同pH溶出介质中溶出行为比较,改良了干法制粒带来的粉尘和片之间差异波动大的问题,筛选出适合工业化生产的简单易行的处方及工艺。
1 材料与方法
1.1 仪器与设备
HLSG-10高效混合制粒机(浙江明天机械有限公司);DHG-9203A电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);ZP-8高速压片机(上海信源制药机械有限公司);Waters e2695/2489高效液相色谱仪(美国W a t e r s公司);RCZ-8B智能溶出试验仪(上海黄海药检仪器有限公司);UV-8000S 紫外分光光度计(上海元析仪器有限公司)。
1.2 试药与试剂
甲磺酸伊马替尼原料(上海百灵医药科技有限公司),微晶纤维素(明台化工股份有限公司),交联聚维酮(美国国际特品公司),硬脂酸镁(湖州展望药业有限公司),欧巴代包衣粉(上海卡乐康包衣技术公司),甲磺酸伊马替尼片(瑞士诺华制药公司S0014),其余试剂为分析纯,水为纯化水。
1.3 处方与工艺
1.3.1 原辅料相容性试验
根据 《化学药物制剂研究的技术指导原则》 [5]中相容性研究方法,参考美国FDA官方网站诺华GLEEVEC(格列卫)使用说明书[6],结合本品的剂型特点,选用微晶纤维素、乳糖、交联聚维酮、硬脂酸镁、欧巴代包衣粉进行原辅料相容性试验。
1.3.2 处方
根据诺华GLEEVEC(格列卫)使用说明书[6],格列卫有0.1 g和0.4 g两种规格,0.1 g和0.4 g都是以伊马替尼计算的。本次研究设计0.1 g规格的产品,根据甲磺酸伊马替尼的分子量589.7和伊马替尼的分子量493.6计算,换算后每片应含甲磺酸伊马替尼119.47 mg(计算公式589.7/493.6×100 mg)。按照1 000片样品量进行制备,甲磺酸伊马替尼用量为119.47 g,并以不同比例的微晶纤维素、乳糖、交联聚维酮和硬脂酸镁为辅料进行处方筛选。
1.3.3 制备工艺
按照处方量称取甲磺酸伊马替尼、微晶纤维素和交联聚维酮,在高效混合制粒机中混合均匀,加入95%乙醇适量,制成颗粒,将湿颗粒在65 ℃烘箱中干燥,过20目筛网整粒,加入硬脂酸镁混合均匀,用9 mm圆冲压片。配制浓度12%的欧巴代包衣水溶液,按照理论包衣增重3%包衣。
1.4 检测方法
1.4.1 含量测定和有关物质检查
色谱条件:用十八烷基硅烷键合硅胶为填充剂[7-10];流动相A为辛烷磺酸钠溶液(取辛烷磺酸钠7.5 g,加水800 ml 使溶解,用10%磷酸溶液调pH至2.5,加水稀释至1 000 ml)-甲醇(420∶580);流动相B为辛烷磺酸钠溶液-甲醇(40∶960);进行线性梯度洗脱(表1),流速1.2 ml/min;检测波长268 nm[7,10];柱温40 ℃,进样量10 μl。伊马替尼峰相邻杂质峰的分离度应大于1.5,理论板数按伊马替尼峰计算不低于2 000。
供试品溶液:精密称取甲磺酸伊马替尼片细粉适量(约相当于伊马替尼30 mg),置50 ml容量瓶中,加入溶剂I(甲醇-0.1 mol/L盐酸的比例为6∶4)适量,超声30分钟使充分溶解,冷却至室温,并用溶剂I定容至刻度,摇匀,滤过,取续滤液作为供试品溶液。
对照品溶液:精密称取甲磺酸伊马替尼加对照品36 mg,置50 ml容量瓶中,加入溶剂I适量,充分振摇使其全部溶解,用溶剂I定容至刻度,摇匀,作为对照品溶液。
对照溶液:精密量取供试品溶液1 ml,置100 ml容量瓶中,加入溶剂I至刻度,摇匀,作为对照溶液。
含量测定:精密量取供试品溶液和对照品溶液10 μl注入液相色谱仪,记录色谱图,按外标法以峰面积计算含量。
有关物质检查:精密量取对照溶液和供试品溶液各10 μl,注入液相色谱仪,记录色谱图,供试品溶液色谱图中如有杂质峰,与对照溶液主峰面积比较,单个杂质峰面积不得大于0.1%,总杂质不得超过1.0%。
1.4.2 溶出度和溶出曲线测定
照溶出度测定法第二法测定[11] ,以0.1 mol/L盐酸溶液1 000 ml为溶出介质,转速为50 r/min,于15 min时取溶液适量用0.45 μm微孔滤膜过滤,精密量取续滤液2 ml用溶出介质稀释10倍,摇匀,作为溶出供试品溶液。精密称取甲磺酸伊马替尼对照品24 mg置于100 ml容量瓶,加溶出介质溶解并稀释定容,然后精密量取5 ml置于100 ml容量瓶制成每1 ml中约含12 μg甲磺酸伊马替尼的溶液,作为溶出对照品溶液。取上述两种溶液,照分光光度法[11]38-39,在264 nm波长处测定吸收度,计算每片的溶出量。
参考FDA溶出度数据库甲磺酸伊马替尼片溶出度检查法[12]和《普通口服固体制剂溶出曲线测定与比较指导原则》[13],分别采用pH 1.0的盐酸溶液、水、pH 4.5的醋酸盐缓冲液、pH 6.8的磷酸盐缓冲液作为溶出介质,于5、10、15、20、30 min取样10 ml(同时补充同温度、同体积的相同介质),测定各取样时间点的累积溶出量,绘制溶出曲线。
1.4.3 其他检测项目
按中国药典 2015 年版四部收载方法考察片剂的崩解时限和脆碎度[11]118-120。
2 结果
2.1 处方选择
样品在高温(60 ℃)、高湿(相对湿度92.5%,25 ℃)、光照(4 500±500)lx条件下放置10 d,经检测,高温和光照条件下的样品性状和有关物质无明显变化,在高湿条件下,样品均有吸湿增重及外观变黄现象,有关物质略有增加,但无显著变化。考察结果显示,在辅料存在下主药稳定,相容性良好,表明可选择微晶纤维素、交联聚维酮和硬脂酸镁作为本品的辅料。
经对各处方制成的片剂的测试表明,处方1的脆碎度较差,处方1、2的崩解时限较长,溶出度较低,处方3、4、5的外观、脆碎度良好;随崩解剂用量增加崩解时间变短,处方4的崩解时限和溶出度与参比制剂格列卫更接近(表2)。最终选择以1 000片计甲磺酸伊马替尼119.47 g、微晶纤维素61.53 g、交联聚维酮17.00 g和硬脂酸镁2.0 g为本品的处方,并用欧巴代包衣粉包衣。
2.2 制粒工艺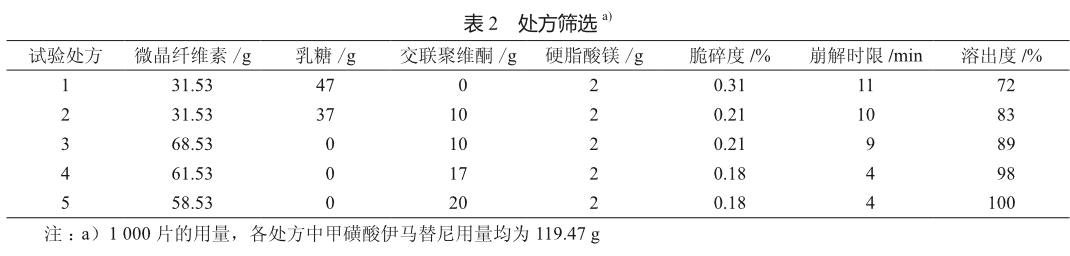

处方中甲磺酸伊马替尼占处方组成的57%,直接压片,颗粒流动性较差,为此,考虑采用干法和湿法两种不同的制粒工艺解决。通过对工艺过程以及颗粒的比较,干法制粒过程中粉尘较大,工业化生产存在风险,综合比较采用湿法制粒工艺更适合该产品。对湿法制粒的润湿剂纯化水和不同浓度的乙醇进行筛选,结果发现,采用纯化水作为润湿剂,甲磺酸伊马替尼与水混合黏性较高,制粒过程容易产生较大的黏块,干燥效率低,且影响后续整粒工艺和收率,颗粒变黄色;低浓度乙醇制粒过程较纯化水好,但仍然有黏团现象,颗粒有黄色斑点;95%乙醇制粒过程无黏团现象,干燥整粒无异常,颗粒颜色正常。最终处方选用95%乙醇作为润湿剂进行湿法制粒。
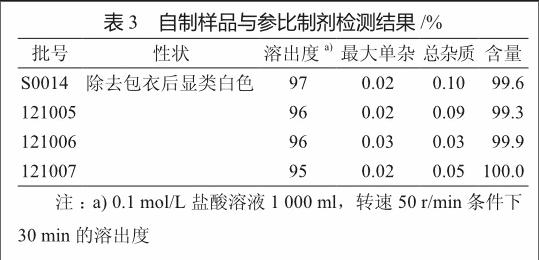
2.3 质量检测结果
按照最终拟定的处方工艺制备3批样品(批号121005,121006,121007),并与参比制剂进行对比评价(表3)。
2.4 溶出曲线
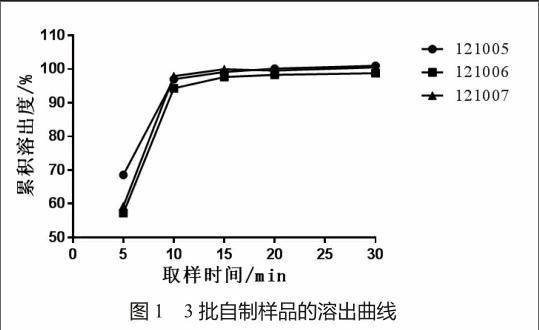
2.4.1 连续3批自制样品的溶出曲线比较
3批自制样品在0.1 mol/L盐酸溶液中的溶出曲线见图1。它们在不同时间点的溶出度相对偏差都小于10%,15 min时样品的实际溶出度达到95%以上。表明该处方工艺生产的不同批之间的溶出曲线重现性较好。
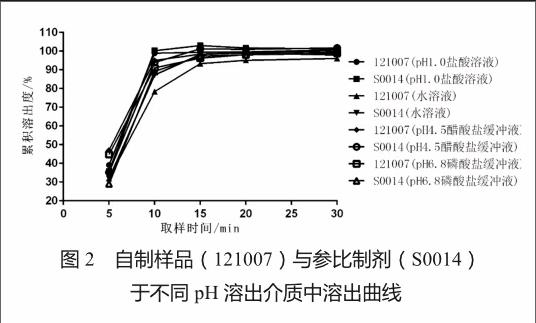
2.4.2 自制样品与参比制剂在不同溶出介质中的溶出曲线
对自制样品与参比制剂在4种不同pH溶出介质下的溶出曲线进行一致性比较[14],结果表明它们在15 min时的累积溶出度均大于85%,且溶出曲线相似(图2)。因此,两种制剂在不同pH的介质中,具有相似的体外溶出行为。
3 讨论
现有关于甲磺酸伊马替尼片采用干法制粒的报道[15],但干法制粒生产工艺有一定的缺陷,相对湿法制粒易产生粉尘,不利于生产者的健康。湿法制粒的研究文献采用5%淀粉浆作为粘合剂[16],由于甲磺酸伊马替尼有较强的吸湿性,用含水量高的粘合剂制软材时,粘合过程易产生团块,影响制粒和后续干燥整粒,原料容易变色。本试验处方以微晶纤维素为填充剂,同时它还兼有崩解剂的作用,交联聚维酮作为崩解剂,硬脂酸镁作为润滑剂,以95%乙醇作为润湿剂,改善了颗粒的流动性。
本试验工艺采用湿法制粒,相比较干法制粒多了一步干燥工序,虽然生产周期略有延长,能耗稍有增加,但制粒的粒度分布更均匀,压片时片重变化较小,生产出来的片剂之间的差异性小。对于仿制药来说,仿制产品与原研参比制剂溶出曲线的相似不仅是评价两者一致性的重要指标,亦是作为评价仿制药水平的重要依据。本试验处方工艺生产出来的三批样品比文献报道的检测结果更接近参比制剂,体外溶出度更相似,质量与原研制剂一致。证明本试验最终选择的处方合理,制备工艺易于操作,可以应用于工业化生产。
参考文献
[1] 丁倩倩, 陈勤奋. 甲磺酸伊马替尼的临床应用[J]. 上海医药, 2013, 34(3): 5-9.
[2] 郑斌, 危晴岚, 刘茂柏. 甲磺酸伊马替尼临床研究概况[J].海峡药学, 2006, 18(6): 78-80.
[3] 宋耕, 轩菡, 王年飞, 等. 甲磺酸伊马替尼的临床应用研究[J/OL]. 中华临床医师杂志(电子版), 2011, 5(24): 7348-7350 [2016-02-14]. http://med.wanfangdata.com.cn/Paper/ Detail?id=PeriodicalPaper_zhlcyszz201124034.
[4] 王春萌, 师英强, 傅红, 等. 甲磺酸伊马替尼治疗胃肠道间质瘤的疗效及安全性分析[J]. 中国癌症杂志, 2008, 18(11): 873-875.
[5] 国家食品药品监督管理总局药品审评中心. 化学药物制剂研究的技术指导原则[EB/OL]. (2007-08-23)[2016-03-07]. http://www.cde.org.cn/zdyz.do?method=largePage&id=2061.
[6] FDA. Label and Approval History[EB/OL]. [2016-03-07] http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index. cfm?fuseaction=Search.Label_ApprovalHistory#labelinfo.
[7] 赵海桥, 刘存领, 付健, 等. HPLC法测定甲磺酸伊马替尼片含量[J]. 齐鲁药事, 2012, 31(11): 646-647.
[8] 王棋, 宋锐, 费梦莹, 等. 梯度洗脱HPLC法测定甲磺酸伊马替尼含量及有关物质[J]. 海峡药学, 2012, 24(3): 58-60.
[9] 马芸, 张驰, 陈书峰, 等. HPLC法测定甲磺酸伊马替尼[J].华西药学杂志, 2013, 28(6): 626-628.
[10] 傅小勤, 陈保来, 仲艳, 等. HPLC -DAD法测定甲磺酸伊马替尼含量及有关物质[J]. 药物分析杂志, 2013, 33(12): 2135-2140.
[11] 国家药典委员会. 中华人民共和国药典2015年版四部[M].北京: 中国医药科技出版社, 2015: 121.
[12] Dissolution Methods-Printable List of All Drugs in the Database[EB/OL]. [2016-03-07]. http://www.accessdata.fda. gov/scripts/cder/dissolution/dsp_SearchResults.cfm.
[13] 国家食品药品监督管理总局. 普通口服固体制剂溶出测定与比较指导原则[EB/OL]. (2016-03-18)[2016-03-18]. http:// www.sda.gov.cn/WS01/CL0087/147583.html.
[14] 张启明, 谢沐风, 宁保明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009,40(12): 946-950, 955.
[15] 石药集团中奇制药技术(石家庄)有限公司. 一种甲磺酸伊马替尼组合物及其制备方法: 中国, CN102349874B[P]. 2012-02-15.
[16] 温伟添. 甲磺酸伊马替尼片处方及工艺的研究[J]. 海峡药学, 2014, 26(2): 27-28.

