羧甲基壳聚糖絮凝除藻研究
魏燕芳,王 琼
(1.华侨大学化工学院环境科学与工程系,福建 厦门 361021;2.华侨大学环境与资源技术研究所,福建 厦门 361021)
羧甲基壳聚糖絮凝除藻研究
魏燕芳1,王琼2
(1.华侨大学化工学院环境科学与工程系,福建 厦门 361021;2.华侨大学环境与资源技术研究所,福建 厦门 361021)
摘要:利用羧甲基壳聚糖为絮凝剂,分别对蛋白核小球藻、水华微囊藻、斜生栅藻进行絮凝实验。结果表明:羧甲基壳聚糖对小球藻最佳絮凝条件为:pH=6,藻浓度为9.0×106个/mL,静置时间为15min,转速为30rpm/min,羧甲基壳聚糖用量为100mg/L;对水华微囊藻最佳絮凝条件为:pH<4,藻浓度为5.1×105个/mL,静置时间为15min,转速为180rpm/min,羧甲基壳聚糖用量为125mg/L;对斜生栅藻最佳絮凝条件为:pH=6,藻浓度为12.4×106个/mL,静置时间为15min,转速为80rpm/min,羧甲基壳聚糖用量为100mg/L。
关键词:羧甲基壳聚糖;小球藻;水华微囊藻;斜生栅藻;絮凝实验
我国各类水体富营养化程度已经相当严重,水体中藻类的大量繁殖给饮用水生产带来诸多危害,去除水中藻类是给水工程中亟待解决的问题。人们研发各种杀藻、除藻剂用于藻类的处理,取得了一定的效果,但是杀藻剂有一定的残留毒性,且随着对藻毒素研究的深入,杀藻剂投加后藻毒素释放到水体的弊端也显现出来[1-5]。利用絮凝剂将藻类絮凝去除既方便,又可取得较好的效果,尤其是天然絮凝剂安全、无毒、不造成二次污染。天然絮凝剂中效果较好的是壳聚糖,对其絮凝除藻已有一定的研究[6-8]。壳聚糖只溶于酸性水溶液且易水解,且其絮凝物细小易碎,对固液分离不利。壳聚糖衍生物羧甲基壳聚糖作为新型的高分子絮凝剂,其絮凝速度远快于壳聚糖,且絮凝物不易破碎。目前,对羧甲基壳聚糖絮凝特性的研究,比较多地集中在对染料废水、水中重金属离子的去除等方面[9-11],关于将其应用于藻类的絮凝方面鲜有报道。本文通过在实验室自制羧甲基壳聚糖,然后将其用于淡水水华中常见的几种藻类(小球藻、水华微囊藻、斜生栅藻)的去除,初步探讨了絮凝除藻的最佳条件。
1材料与方法
1.1实验材料
实验藻种。蛋白核小球藻(Chlorellapyrenoidosa)、斜生栅藻(Scenedesmusobliquus)、水华微囊藻(Microcystisflos-aquae),购自中科院武汉水生生物研究所淡水藻种库,分别采用SE培养基(小球藻)、BG培养基(斜生栅藻和水华微囊藻)在光照强度4000lx,光暗比为12∶12的条件下进行培养。
絮凝剂。羧甲基壳聚糖参考文献[12]制备。
1.2实验方法
1.2.1藻类生长曲线的测定[13-15]
在各自的培养基和培养条件下,连续培养16d。每天监测藻液光密度、叶绿素a、对藻液进行计数,绘制生长曲线。
1.2.2标准曲线的绘制
藻个数与吸光度标线。将藻培养到对数生长期时离心收获,用自来水配成系列OD680藻液,并分别用血球计数板对藻细胞计数,重复3次,取得均值,得到藻个数与吸光度的关系,并绘制标准曲线。
叶绿素与吸光度标线。将藻培养到对数生长期时离心收获,用自来水配成系列OD680藻液,然后用0.45μm滤膜抽滤,按文献[16]计算叶绿素含量,得到吸光度与叶绿素含量的关系,并绘制标准曲线。
1.2.3絮凝实验及去除率的计算
采用烧杯试验,在烧杯中加入一定量配制好的并已经测量吸光度(A1)的藻悬液,加入所需量的絮凝剂羧甲基壳聚糖,用混凝搅拌器搅拌,在一定转速下搅拌5min,静置一定时间后,于液面下2cm处取样测定吸光度A2。
对藻液絮凝后去除率的计算公式如下:
去除率=(A1-A2)/A1*100%
式中:A1-絮凝前藻液在相应波长下的吸光度值;A2-絮凝后藻液在相应波长下的吸光度值。
2结果与讨论
2.1藻类的生长曲线
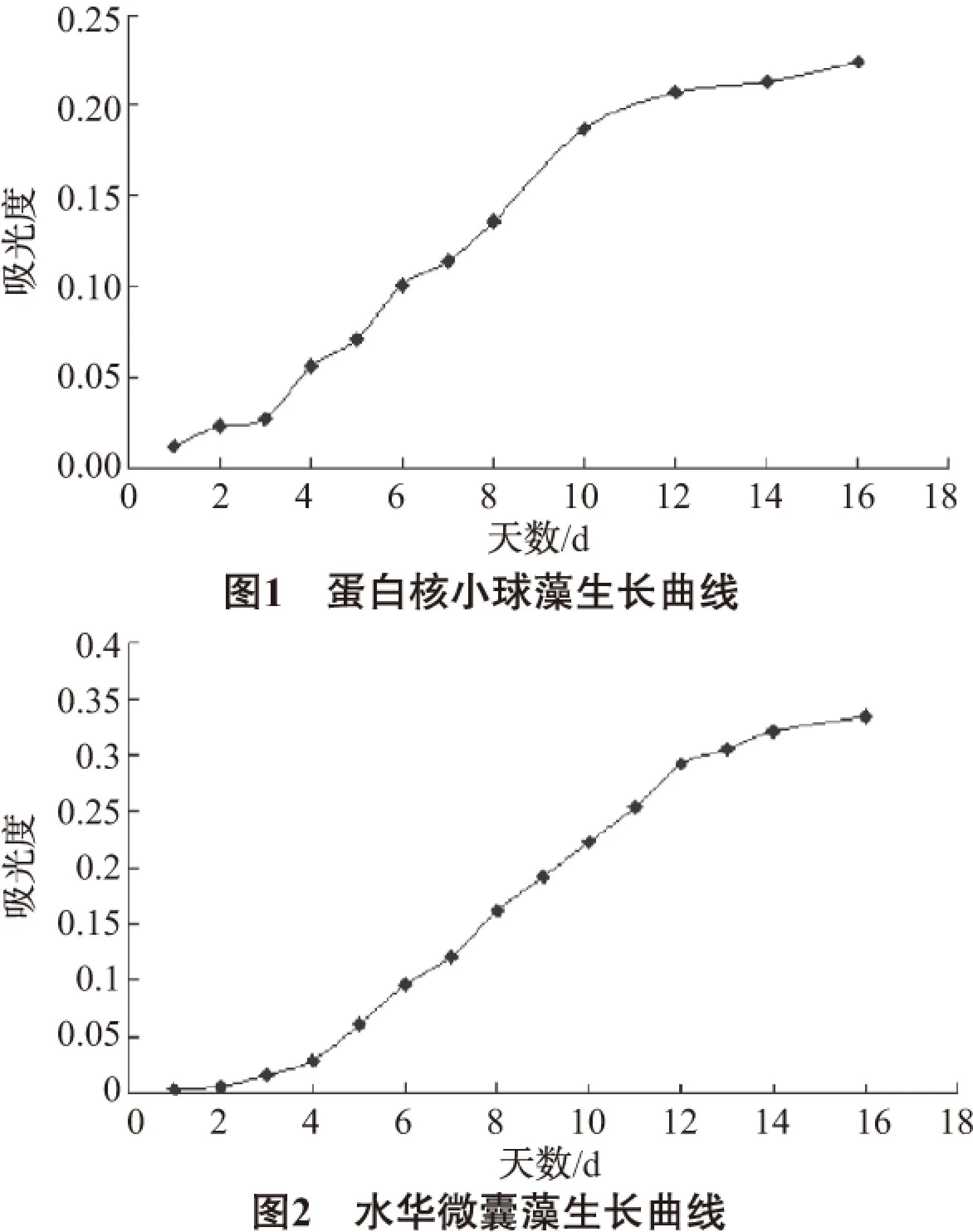
由图1~图3可以看出,在本实验条件下,对蛋白核小球藻来说,前3天藻细胞增殖缓慢,为迟缓期;此后藻细胞以几何级数增长,第12天达到最大值,这一阶段为对数期;第12天以后,藻类繁殖速度趋于减慢,进入稳定期。对水华微囊藻,前4天为迟缓期;此后藻细胞迅速增长,第14天达到最大值,这一阶段为对数期;第14天以后进入稳定期。斜生栅藻的迟缓期为前4天;对数期为第5天到第12天;此后进入稳定期。
2.2藻个数及叶绿素与吸光度的标线
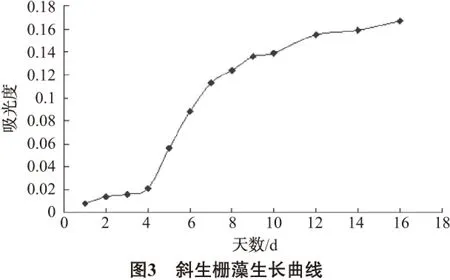
由图4~图6可以得出,每种藻的浓度与吸光度之间的线性关系较好,与文献[15]的结论较为一致,因此在后面的实验中可以用测得的吸光度大小表示藻浓度的大小。
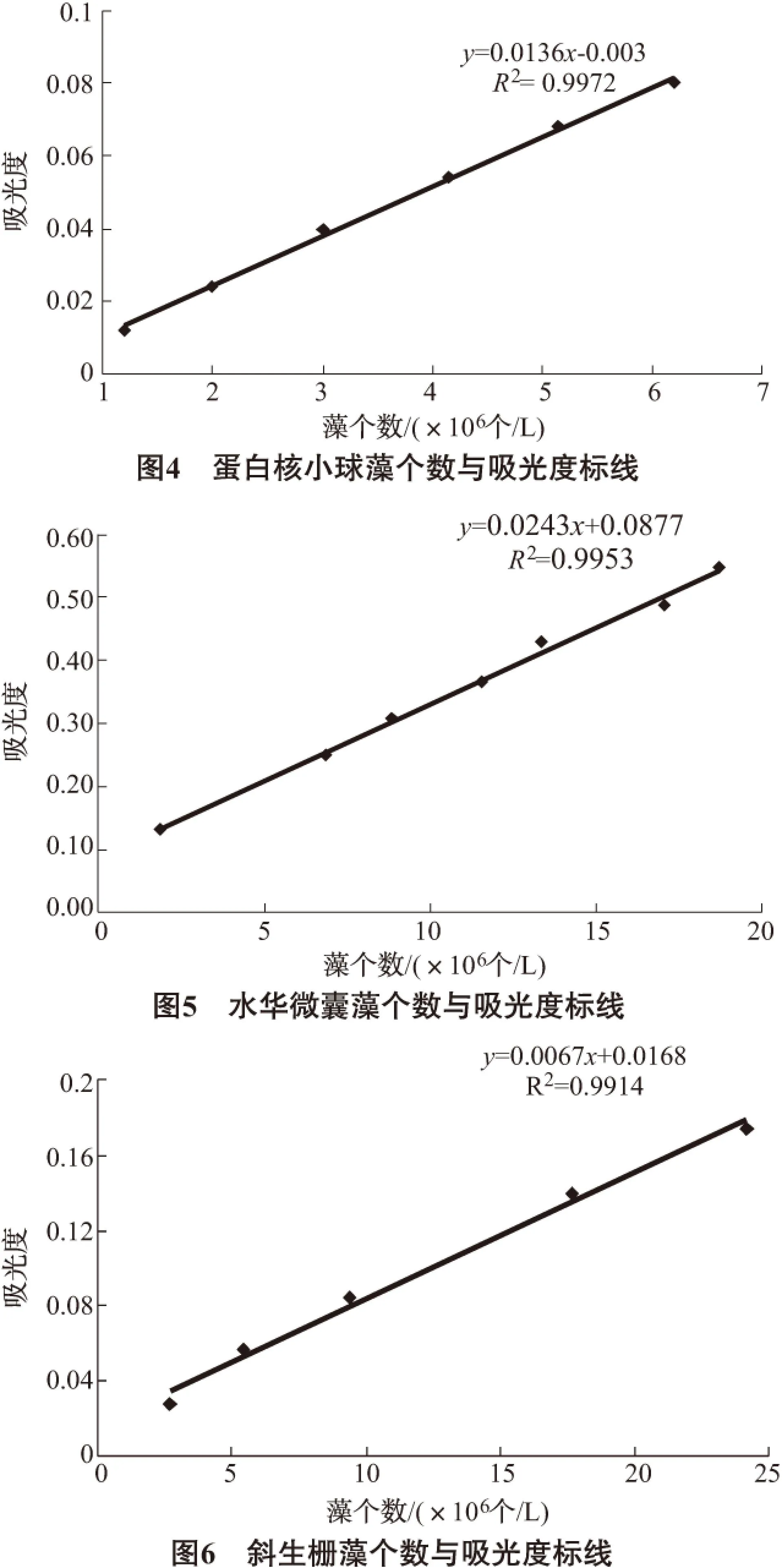
由图7~图9可知,3种藻的叶绿素浓度与吸光度之间有较好的线性关系。在下面的实验中我们可以通过测定藻液的吸光度得到藻液的叶绿素浓度。
2.3羧甲基壳聚糖对3种藻的絮凝作用
2.3.1静置时间对絮凝的影响
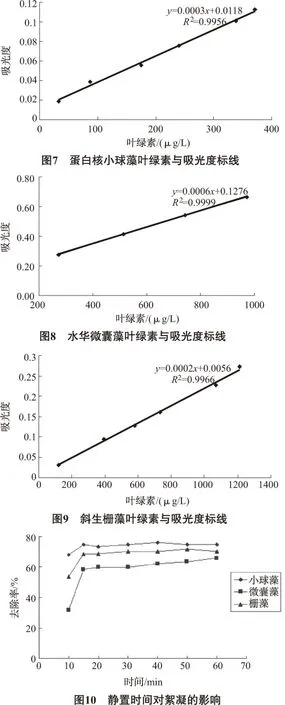
由图10可知,对这3种藻来说,经过羧甲基壳聚糖絮凝后的最佳静置时间都为15min,超过15min之后吸光度值变化幅度微弱。静置时间为5min时,上清液羧甲基壳聚糖只有部分沉降,不易准确测定。从10min开始可以测量吸光度,15min之后,吸光度并未发生明显变化,基本处于平缓趋势。后面的实验中静置时间都定为15min。
2.3.2藻液初始浓度对絮凝的影响
由图11可知,3种藻的去除率都随着吸光度的增加及藻细胞个数的增加而提高,达到最大值后又随着吸光度的增加而下降。这是因为,当藻细胞个数较少时,絮凝剂分子同藻细胞分子之间的碰撞几率减小,所以去除率下降;而当吸光度上升,藻细胞浓度太大时,因絮凝剂的量不够而影响絮凝效果,结果使去除率下降。对小球藻来说最佳去除率为当藻液吸光度为0.12(藻浓度为9.0×106个/mL),斜生栅藻的最佳去除率为吸光度0.1(藻浓度为12.4×106个/mL),水华微囊藻的最佳去除率为吸光度为0.1(藻浓度为5.1×105个/mL)。
2.3.3羧甲基壳聚糖的用量对絮凝的影响
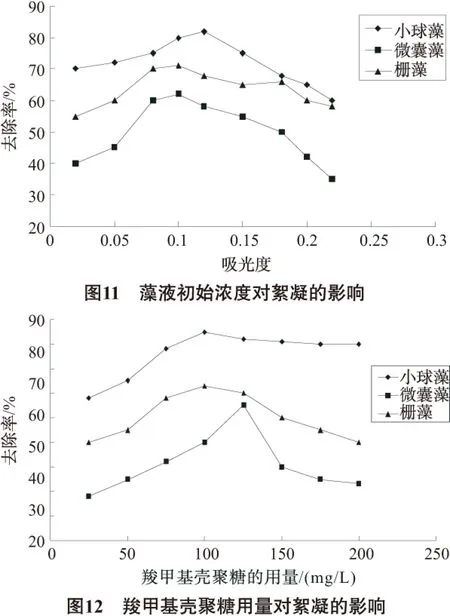
通常情况下,絮凝效果会随着絮凝剂的用量增加而增大。当絮凝剂的用量达到一定值时,出现最大值,此时进一步增加絮凝剂用量,絮凝效果基本不变,有时还会有所下降[17]。由图12可知,在实验条件下,羧甲基壳聚糖絮凝小球藻的最佳用量为100mg/L时,当絮凝剂用量进一步增大,去除率没有明显的改变。对斜生栅藻的最佳用量也100mg/L,当增加用量时去除率略有下降。对水华微囊藻,当羧甲基壳聚糖的用量为125mg/L时,去除率达到最大值,进一步增大用量,去除率下降。
2.3.4pH对絮凝的影响
pH对絮凝的影响是比较大的,pH值的改变不仅影响到絮凝剂的外表面电荷和絮凝体的形成,也影响到被絮凝物质的外表面电荷和形态。当pH处于碱性时(>9),羧甲基壳聚糖产生沉淀,且固液接触面较为浑浊,因此本实验讨论pH变化范围为1~9时对絮凝的影响。
由图13可知,当pH发生变化时,3种藻絮凝的情况有显著差异。绿藻门的小球藻和斜生栅藻去除率随pH的变化规律基本一致。小球藻在pH 6~7的范围内处理效果好;斜生栅藻在pH为6的时候处理效果最好。羧甲基壳聚糖表面带有大量氨基,在酸性弱酸性水体中主要以带正电荷的氨根离子形式存在,而小球藻和斜生栅藻细胞在pH为6的弱酸性环境中表面带负电荷,易与带正电荷的絮凝剂进行碰撞而发生异电中和,从而发生网捕和凝聚。而当溶液呈现碱性、弱碱性时,羧甲基壳聚糖表面所带氨根具有非离子或弱负电性,而且不会产生絮状沉淀,从而影响其与藻细胞的碰撞凝聚和吸附电中和作用,致使絮凝效能降低。
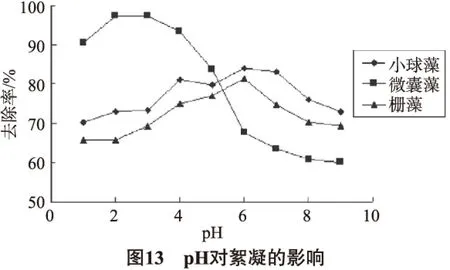
从图13中还可以看出,3种藻中水华微囊藻受到pH的影响最大。在pH<4的酸性条件下,去除率很高,几乎接近100%,远远超过了小球藻和斜生栅藻的去除率,随着pH的升高,去除率又迅速下降。造成这种现象的原因可能是因为相对于小球藻和斜生栅藻来说,水华微囊藻属于蓝藻门,细胞主要以群体形态存在,且胞外有胶被存在,在酸性环境中,胶被结构或电荷性质发生改变和带负电荷,更容易与羧甲基壳聚糖发生絮凝沉降;另一方面可能是因为酸性环境中,对微囊藻细胞存活不利,活性下降,容易聚集成团,因此更有利于发生絮凝沉淀。而随着pH由酸性变为中性至偏碱性的环境,更有利于微囊藻细胞存活[18],胞被电荷转为为中性,藻细胞活性增强,细胞彼此之间比较松散,密度下降而上浮不易发生絮凝沉淀,使去除率迅速下降。
2.3.5转速对絮凝的影响
通过对转速的调整,可以将聚合在一起的藻群体打碎,形成单一或几个藻细胞聚合的状态,并且破坏原有聚合状态的稳定,更有利于羧甲基壳聚糖与藻细胞通过静电中和、架桥网捕等方式絮凝。
由实验结果可知,小球藻最佳去除率在转速为30rpm/min左右,总体转速对小球藻没有很大的影响。可能是因为小球藻为单细胞,藻细胞分布较均匀,而絮凝剂羧甲基壳聚糖易溶于水,当将其加入小球藻液中,能很快起作用。当转速超过200rpm/min时,则使去除率下降。水华微囊藻的去除率随着转速的提高而增加,在转速较低时,絮凝剂与藻细胞不能充分接触,同时絮凝剂也分布不均匀,所以去除率较低;在转速为180rpm/min时去除率达到最大值,而后转速增大,易将大颗粒絮凝物搅碎,同时发生再悬浮,所以去除率下降。斜生栅藻的去除率随着转速增加而增大,当转速达到80 rpm/min时,栅藻的去除率达到最大值,此后随着转速的增大,变化不大,略有下降。

3结论
(1)对3种藻来讲,用羧甲基壳聚糖做为絮凝剂的最佳絮凝静置时间都为15min,最佳絮凝初始藻浓度分别为:小球藻(9.0×106个/mL)、斜生栅藻(12.4×106个/mL)、水华微囊藻(5.1×105个/mL);最佳絮凝剂用量为:小球藻和斜生栅藻都为100mg/L,水华微囊藻为125mg/L;最佳絮凝pH条件为:小球藻和斜生栅藻都为pH=6,水华微囊藻为pH<4;最佳转速分别为:小球藻30rpm/min、斜生栅藻80rpm/min、水华微囊藻180rpm/min。
(2)羧甲基壳聚糖经过水或者弱酸性溶液的溶解后,在其分子链上带上了大量的正电荷,成为一种阳离子型混凝剂,使得经羧甲基壳聚糖能通过粘结架桥作用以及压缩双电层作用絮凝藻细胞,同时由于其分子链上分布了大量的带正电荷的氨基极易同带负电荷的大部分藻细胞凝聚沉淀。羧甲基壳聚糖还可以通过对悬浮物起架桥网捕作用使其脱稳而沉降。总之,对不同的藻类,羧甲基壳聚糖可以通过不同的絮凝机理,达到除藻的作用。
参考文献:
[1]Roberti Daly, Lionel HO, Justin D,et al. Effect of chlorination on microcystis aeruginosa cell integrity and subsequent microcystin release and degradation[J].Environ Sci Technol, 2007,41(12) :4447-4453.
[2]Angeline K Y Lam, Ellie E Prepas. Chemical control of hepatotexic phytoplankton blooms: Implications for human health[J]. Water Research,1995,29(8):1845-1854.
[3]Gary J Jones, Philip T Orr. Release and degradation of microcystin following algicide treatment of a microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhabitation assay[J]. Water Research,1994,28(4):871-876.
[4]金丽娜,张维昊,郑利,等.滇池水环境中微囊藻毒素的生物降解[J].中国环境科学,2002,22(2):189-192.
[5]方晶云,马军,王立宁,等.臭氧预氧化对藻细胞及胞外分泌物消毒副产物生成势的影响[J].环境科学,2006,27(6):1127-1132.
[6]Ravi Divakaran,V N Sivasankara Pillai. Flocculation of algae using chitosan[J]. Journal of Applied Phycology, 2002,14(5):419-422.
[7]Hua Zou, Guang Pan, Hao Chen,et al. Removal of cyanobacterial blooms in Taihu Lake using local soils.Ⅱ.Effective removal of Microcysis aeruginosa using local soils and sediments modified by chitosan[J]. Environmental Pollution, 2006,141(2):201-205.
[8]柳丹,蔡冬清,王相勤,等.磁聚去除淡水藻华的研究[J].中国环境科学,2006,26(6):9-11.
[9]Zhong Cao, Yinghe He, Lixian Sun and Xueqiang Cao.Study on the Adsorption of Mixed Cd(Ⅱ) and Pb(Ⅱ) Ions by N,O-Carboxymethyl-Chitosan[J].Advanced Materials Research,2011(236-238):2523-2528.
[10]窛希元,张雨山,王静,等.羧甲基壳聚糖复合絮凝剂净化海水的试验研究[J].海洋环境科学,2011,30(4):496-498,503.
[11]毕韶丹,苏会东,沈春旭.羧甲基壳聚糖及复合絮凝剂对染料废水的脱色研究[J].环境保护科学,2009,35(4):64-66,110.
[12]唐振兴,钱俊青,石陆娥.羧甲基壳聚糖制备工艺的研究[J].化工技术与开发,2004,33,5(2):4-7.
[13]董正臻,董振芳,丁德文.快速测定藻类生物量的方法探讨[J].实验与技术,2004,28(11):1-2,5.
[14]黄美玲,何庆,黄建荣,等.小球藻生物量的快速测定技术研究[J].河北渔业,2010(4):1-3.
[15]沈萍萍,王朝晖,齐雨藻,等.光密度法测定微藻生物量[J].暨南大学学报:自然科学版,2001,22(3):115-119.
[16]张丽彬,王启山,徐新惠,等.乙醇法测定浮游植物叶绿素a 含量的讨论[J].中国环境监测, 2008,24(6): 9-10.
[17]郑必胜,蔡妙颜,郭祀远,等.壳聚糖在小球藻采收中的应用[J].海湖盐与化工,2003,32(1):7-9.
[18]张青田,王新华,林超,等.水体pH和铜绿微囊藻增殖的关系研究[J].水生态学杂志,2011,32(2):52-56.
Study on the Flocculation Removal of Algae by CarboxymethylChitosan
WEI Yan-fang1,WANG Qiong2
(1.Department of Environmental Science and Engineering, College of Chemical Engineering, Huaqiao University, Xiamen Fujian 361021,China)
Abstract:In this paper, carboxymethyl chitosan was used as flocculant to flocculate Chlorella pyrenoidosa, Microcystisflos-aquae and Scenedesmusobliquus to observe their best flocculation condition. The results showed that the optimal flocculation condition to Chlorella pyrenoidosa were as follows: pH was 6.Algae concentration was 9.0×106ind/ml.Resting time was 15min.Rotation rate was 30rpm/min.The dosage of carboxymethyl chitosan was 100mg/l. The optimum flocculation condition to Microcystisflos-aquae were as follows: pH was less than 4.Algae concentration was 5.1×105ind/ ml.Resting time was 15min.Rotation rate was 180rpm/min.The dosage of carboxymethyl chitosan was 125mg/l. The optimum flocculation condition to Scenedesmusobliquus were as follows: pH was 6.Algae concentration was 12.4×106ind/ ml.Resting time was 15min.Rotation rate was 80rpm/min.The dosage of carboxymethyl chitosan was100mg/l.
Key words:carboxymethyl chitosan; Chlorella pyrenoidosa;Microcystisflos-aquae; Scenedesmusobliquus;flocculation
收稿日期:2015-07-21
基金项目:福建省自然科学基金计划资助项目(2014J01049)。
作者简介:魏燕芳(1979-),女,讲师,主要从事环境污染治理研究工作。
中图分类号:X703
文献标志码:A
文章编号:1673-9655(2016)04-0067-05

