巴西蕉多酚氧化酶的基因克隆及序列分析
杨昭++何春兰++黄佳佳++黄国平++李芬芳++袁德保


摘 要:基于香蕉基因组的信息,利用电子克隆方法获得巴西蕉PPO基因,结合RT-PCR验证,并通过生物信息学软件对巴西蕉PPO进行序列分析。结果表明,成功获得编码巴西蕉PPO的新基因,序列长度为1 767bp,编码588个氨基酸(GenBank登录号:KF900300.1)。巴西蕉PPO基因与禾本科植物PPO基因有着较高的同源性,相似度在82%~85%,与蔷薇科鸡麻亲缘关系最近。巴西蕉PPO最有可能存在于叶绿体中,不具有信号肽,含有一个长度为47个氨基酸的叶绿体转运肽。巴西蕉PPO蛋白属于酪氨酸酶基因家族蛋白,具有酪氨酸酶超级家族、PPO1_DWL和PPO1_KFDV3个保守结构域。巴西蕉PPO分子量为65.6 KDa,等电点为6.32,为亲水性蛋白质。巴西蕉PPO二级结构中无规则卷曲占的比例最高为57.31%,成功预测得到巴西蕉PPO的三级结构模型。
关键词:巴西蕉;多酚氧化酶;基因组;电子克隆
中图分类号 Q785 文献标识码 A 文章编号 1007-7731(2016)11-0023-06
Cloning and Sequencing of the Brazilian Banana Polyphenol Oxidase
Yang Zhao1 et al.
(1Guangdong Food and Drug Vocational College,Guangzhou 510520,China)
Abstract:Based on the information about the banana genome,PPO gene of brazilian banana was cloned in silico,and validated by RT-PCR,and analyzed by bioinformatics software.New gene encoding brazilian banana PPO was successfully obtained,with sequence length of 1767bp,encoded a protein of 588 amino acids (GenBank accession number:KF900300.1).Brazilian banana PPO gene has a high homology with gramineae plant PPO gene,and their similarity was between 82%~85%.Furthermore,brazilian banana PPO gene had the closest relationship with the rhodotypos scandens of rosaceae PPO gene.Brazilian banana PPO was most likely to exist in the chloroplast,without a signal peptide,but containing a chloroplast transit peptide with length of 47 amino acids.Brazilian banana PPO protein belonged to tyrosinase protein gene family,with three conserved domains of tyrosine enzyme superfamily,PPO1_DWL and PPO1_KFDV.Brazilian banana PPO with molecular weight of 65.6 KDa and an isoelectric point of 6.32,was a hydrophilic protein.The secondary structure of brazilian banana PPO in the proportion of random coil accounted for up to 57.31%.And the tertiary structure of brazilian banana PPO was predicted successfully.
Key words:Brazilian banana;Polyphenol oxidase;Genome;In silico cloning
多酚氧化酶(PPO,polyphenol oxidase)具有加氧酶和脱氧酶2种活性,是广泛存在于动物、植物和真菌体内的一类与铜结合的金属蛋白酶[1]。PPO是引起果蔬酶促褐变的主要内源酶,广泛存在于植物体的各种组织中。在有氧条件下,PPO将果蔬中的多酚氧化酶氧化为醌类物质,醌类物质再聚合产生黑色素,从而引起果蔬褐变。如何抑制多酚氧化酶的活性,解决果蔬褐变问题,是国内外学者的研究热点[2-5]。
近年来,越来越多的科学家热衷于克隆植物PPO基因,用于基因结构及功能的研究,探究PPO的抑制机理,用于指导果蔬褐变控制。目前,已被克隆的植物PPO基因有茶叶[6]、梨[7]、苹果[8]等20多种植物组织。香蕉被联合国粮农组织定位为发展中国家的第四大粮食作物,是最大宗的热带亚热带水果,但其采后贮运损失严重,且深加工相对落后[9]。由多酚氧化酶引起的酶促褐变,是香蕉贮运保鲜及深加工中亟待解决的难题[10]。从分子水平研究香蕉PPO的基因结构和功能,是解决香蕉贮运保鲜及深加工中褐变问题的根本途径[11]。
然而,目前国内外对香蕉PPO基因的研究非常有限。Gooding等从威廉斯蕉中克隆得到4种不同的PPO cDNA片段,并且用特异性引物扩增得到1条 2 078bp的全长PPO基因,但该PPO序列却未在NCBI等数据库中登录[12]。Quansah等扩增得到Grand Nain香蕉PPO基因的部分序列,该基因编码141个氨基酸[13]。谭琳等利用电子克隆的方法获得1 602bp的香蕉PPO编码序列,并进行了生物信息学分析,但未对电子克隆的香蕉PPO进行RT-PCR验证[14]。二倍体香蕉DH-Pahang基因组的注释里至少有9个多酚氧化酶的信息[15],并且多个品种香蕉的PPO都被验证存在同工酶[16],所以香蕉PPO的基因序列存在多样性。
巴西蕉是中国市场上最为重要和种植广泛的香蕉品种[17],但目前未有对其基因进行克隆的研究报道。为了挖掘更多的香蕉PPO基因信息,探究其结构和功能,为研究PPO的抑制机理打下基础,本研究基于二倍体香蕉DH-Pahang基因组的信息,以巴西蕉为原材料,采用电子克隆的方法,结合RT-PCR及测序验证,并用生物信息学软件对验证的巴西蕉PPO进行序列分析,以期为进一步研究香蕉PPO的基因结构和功能奠定基础。
1 材料与方法
1.1 材料与试剂 巴西蕉(Musa acuminata L.AAA group CV.Brazilian)果实采摘于中国热带农业科学院海口实验站实验基地(福山实验基地),采收时果实成熟度约为绿熟。将果肉和果皮分离后,分别用液氮速冻,置于
-70℃冰箱保存。试剂为SuperRT cDNA Kit(CW0741),北京康为世纪生物科技有限公司。
1.2 主要仪器与设备 全自动高压灭菌锅,MLS-3780,日本SANYO公司;台式高速冷冻离心机,MultifugeX3R,德国Heraeus公司;PCR仪,Tpersonal 48,德国Biometra公司;凝胶成像系统,G:BOX/EF2,美国Syngene公司;核酸电泳仪,DYCP-31F,北京市六一仪器厂。
1.3 总RNA提取和cDNA合成 RNA常规提取方法参照Asif等的方法进行优化[18]。cDNA合成采用康为世纪公司的SuperRT cDNA第一链合成试剂盒。
1.4 巴西蕉PPO基因的电子克隆 从NCBI的核酸数据库检索香蕉PPO基因序列,挑选物种亲缘最近的基因序列作为探针,在NCBI数据库中进行香蕉EST数据库的Blast检索(Blast站点Database选择Expressed sequence tags),从中选取1个高度同源的EST序列在NCBI数据库中进行香蕉WGS数据库的Blast检索,找到同源性较高的contig。接着用FGENESH软件在线分析此contig,预测得到可能的香蕉PPO新基因序列。再用NCBI数据库中的Blastx工具验证此序列是不是PPO基因。最后在NCBI数据库中进行Blast验证其新颖性。
1.5 电子克隆巴西蕉PPO基因的RT-PCR验证 根据电子克隆巴西蕉PPO基因序列的性质,设计并合成特异性引物FP1(5′-tcgatcc tgttctcggcttc -3′)和RP1(5′-cgatggtgcggcttttattttcc-3′)。PCR反应体系为:2×ES Master Mix 12.5μL,FP1(10uM)1μL,RP1(10uM)1μL,以巴西蕉果肉RNA为模板合成的cDNA 2μL,RNase-Free Water 8.5μL。反应程序为:95℃预变性5min,94℃变性30s,55℃退火30s,72℃延伸30s,30个循环后72℃延伸5min。扩增结束后,取5μLPCR产物用1%琼脂糖凝胶电泳检测。将PCR产物切胶回收后连接到pMD19-T载体上,随后转化到大肠杆菌DH5α感受态细胞中。将PCR扩增验证筛选获得的阳性单菌落的菌液送往上海英骏生物技术有限公司测序。
1.6 巴西蕉PPO基因测序结果分析 利用ORF Finder工具对测序得到的巴西蕉PPO序列进行完整开放阅读框架的分析。将测序得到的CDS序列与电子克隆基因序列通过EBI网站的ClustalW2软件进行序列比对,检验序列的正确性。
1.7 巴西蕉PPO的序列分析 通过软件Mega5.02绘制巴西蕉PPO与其他物种PPO基因的MP进化树图谱(Maximum Parsimony Trees),采用Bootstrap检验法,1 000次重复。利用CBS网站上的软件Target P 1.1 Server通过预测氨基酸导肽形式来预测巴西蕉PPO的亚细胞定位。利用CBS网站上的软件SignalP 4.1和ChloroP 1.1 Server分别对其信号肽和导肽形式进行在线预测。利用NCBI的Conserved Domains数据库进行结构域分析及功能预测。利用EXPASY网站上的ProtParam工具对巴西蕉PPO进行一级结构分析。通过SOPM对巴西蕉PPO二级结构进行在线预测。通过同源建模服务器SWISS-MODEL(http://swissmodel.expasy.org/)对巴西蕉PPO三级结构进行预测,以自动建模模式(Automatic Modelling Mode)进行建模,利用RasMol软件查看预测结果。
2 结果与分析
2.1 巴西蕉PPO基因的电子克隆 从NCBI的核酸数据库检索得到50个与香蕉多酚氧化酶有关的基因序列,只有EU880277.1是Musa acuminata AAA Group Cavendish banana polyphenol oxidase mRNA的部分序列。由于所研究的巴西蕉是Cavendish香蕉的亚种,所以用此序列作为探针在NCNI数据库进行香蕉EST数据库的Blast检索,得到5个EST序列,只有ES436966.1与基因探针有96%的匹配率(图1)。将ES436966.1序列在NCBI数据库中进行香蕉WGS数据库的Blast检索,找到了2个contig_1794(CAIC01022631.1)和contig_1953(CAIC01022472.1)。序列比对显示contig_1794(CAIC01022631.1)长度为56 431bp,与ES436966.1在24 483~25 362有99%的一致性,表明新巴西蕉PPO基因可能存在于contig_1794(CAIC01022631.1)之中。用FGENESH软件在线分析contig_1794(CAIC01022631.1),获得3个可能的巴西蕉PPO基因CDS序列,分别记为NBPPO1、NBPPO2和NBPPO3。NBPPO1长度为1 746bp,编码581个氨基酸,存在于contig_1794(CAIC01022631.1)序列3 637~15 949bp,由18个外显子序列构成。NBPPO2长度为1 773bp,编码590个氨基酸,存在于contig_1794(CAIC01022631.1)序列23 550~25 322bp,由1个外显子序列构成。NBPPO3长度为1 809bp,编码602个氨基酸,存在于contig_1794(CAIC0 1022631.1)序列26 203~28 219bp,由2个外显子序列构成。NBPPO1、NBPPO2和NBPPO3序列通过Blasx检索后,只有NBPPO2序列能够检索到PPO同源蛋白,具有PPO1_DWL和PPO1_KFDV2个结构域,可以确定NBPPO2是巴西蕉PPO基因序列(图2)。NBPPO2通过Blast新颖性检测,NCBI数据库中未发现与NBPPO2完全一致的基因序列,可以判断NBPPO2是新的巴西蕉PPO基因。
BlastX结果
2.2 电子克隆巴西蕉PPO基因验证
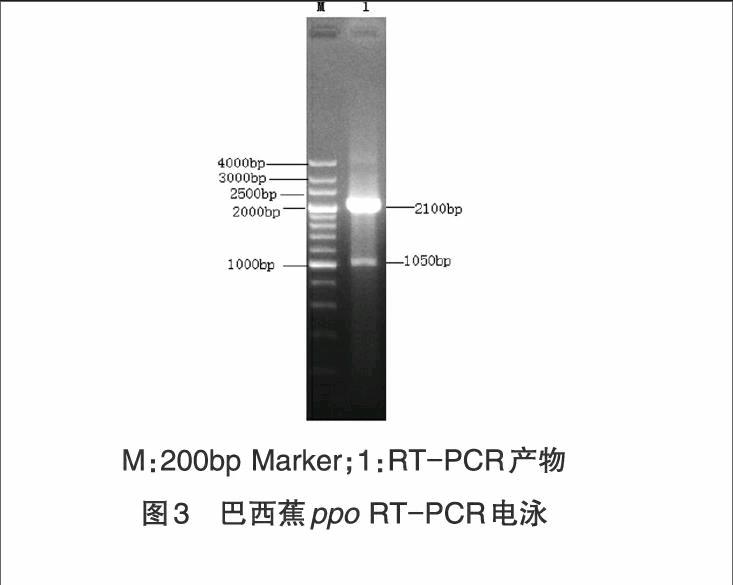
2.2.1 巴西蕉PPO基因的PCR扩增 以巴西蕉果肉总RNA为模板,合成cDNA第一链。然后以cDNA第一链为模板,用设计的特异性引物(FP1和RP1)进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测,得到了2 100bp和1 050bp的2个条带,且2 100bp条带比1 050条带片段更亮(图3)。2 100bp的条带与电子克隆得到的1 773bp的巴西蕉PPO基因大小接近。将2 100bp条带切胶回收连接转化,筛选获得的阳性单菌落的菌液送往上海英骏生物技术有限公司测序,3个阳性克隆测序得到一致的cDNA序列,序列长2 116bp。
2.2.2 巴西蕉PPO基因测序结果分析 通过ORF Finder工具对所获得的cDNA序列进行开放阅读框架分析,发现其有2个完整的阅读框架。较长的阅读框架位于第350~2 116位,序列长1 767bp,推测编码588个氨基酸。较短的阅读框架位于第470~2 116位,序列长1 647bp,推测编码533个氨基酸。在cDNA5′端第350位和第470位存在起始密码子ATG,3′端的2116处存在终止密码子TGA。测序得到巴西蕉PPO基因长的阅读框架记为BXPPO1。将测序得到的巴西蕉PPO的CDS序列BXPPO1与电子克隆得到的CDS序列NBPPO2比较发现,整个序列中只有16个碱基的差异,这些差异的来源与品种差异有关。BXPPO1全序列经NCBI数据库中的Blast工具查新确认后在GenBank中登录,登录号为:KF900300.1。表明利用电子克隆方法成功扩增得到巴西蕉PPO的CDS全长序列。
2.3 巴西蕉PPO基因序列分析
2.3.1 巴西蕉PPO基因同源性分析及进化树图谱的构建 用巴西蕉PPO的CDS序列在NCBI数据库中进行Blastn搜索同源序列,发现其与禾本科(除高秆野生稻外)植物相似度约在82%~85%,与蔷薇科(鸡麻)相似度约72%。巴西蕉PPO与这几个物种PPO的氨基酸序列比对表明,3个保守结构域中氨基酸序列比较保守,在保守区域之外,氨基酸序列差异较大。巴西蕉PPO基因进化树分析结果表明,巴西蕉PPO基因与蔷薇科和禾本科存在着相对较近的亲缘关系,但与蔷薇科鸡麻(DQ851219.1)亲缘关系最近(图4)。
图4 巴西蕉PPO与其他物种PPO进化树分析
2.3.2 巴西蕉PPO的亚细胞定位 通过CBS网站上的软件TargetP 1.1 Server预测蛋白N端导肽形式来预测蛋白质的亚细胞定位。预测结果(图5)显示导肽位点为cTP(叶绿体导肽)、mTP(线粒体导肽)、SP(信号肽)的可能分值分别为0.878、0.118和0.038,表明导肽位点为cTP(叶绿体导肽)的可能性最大,这也说明巴西蕉PPO存在于叶绿体的可能性最大。
2.3.3 巴西蕉PPO信号肽和转运肽的预测和分析 通过SignalP4.1软件对巴西蕉PPO信号肽进行预测,采用神经网络的方法,对信号肽切割位点的预测用Y-score maximum来判断,对分泌蛋白的预测用mean S-score来判断。如果mean S-score大于0.5,则预测为分泌蛋白,含有信号肽,小于0.5则没有信号肽。图6显示第21位的天冬氨酸残基(N)具有最高的原始剪切位点分值0.179,第6位的赖氨酸(K)残基具有最高的信号肽分值0.165,第21位的天冬氨酸残基(N)残基具有最高的综合剪切位点分值0.154,分值都低于平均分值0.5,因此巴西蕉PPO不具有信号肽。
由于对巴西蕉PPO的预测分析表明其存在于叶绿体的可能性最大,所以通过软件ChloroP 1.1 Server对其在叶绿体的转运肽进行了预测。图7显示巴西蕉PPO存在转运肽的可能性为0.549,大于0.5,因此认为巴西蕉PPO含有转运肽,长度为47个氨基酸。
2.3.4 巴西蕉PPO结构域分析及功能预测 利用NCBI的CDD(Conserved Domain Database)数据库,对巴西蕉PPO可能有的功能结构域进行预测的结果如图8。图8显示巴西蕉PPO蛋白属于酪氨酸酶基因家族蛋白,有一个酪氨酸酶超级家族(Tyrosinase superfamily)的保守结构域,分布在168~375位的氨基酸之间,还具有2个典型的PPO1_DWL 和PPO1_KFDV保守结构域,分布在第380~435位和第457~584位的氨基酸。
2.3.5 巴西蕉PPO一级结构分析 利用ProtParam软件对巴西蕉PPO一级结构分析如表1~表3所示,巴西蕉PPO分子式为C2952H4526N800O866S19,含有588个氨基酸,分子量为65688.3 Da,等电点(pI)为6.32。氨基酸含量表明,巴西蕉PPO中含量最高的氨基酸为亮氨酸(Leu),含有54个,占所有氨基酸含量的9.2%。其次为天冬氨酸(Asp)、脯氨酸(Pro)和天冬酰胺(Aln),分别含有49、47和46个,占所有氨基酸数目的8.3%、8.0%和7.8%。蛋白不稳定指数为40.92,表明其为不稳定蛋白。平均疏水性为-0.479,整条多肽链表现为亲水性,表明巴西蕉PPO为亲水性蛋白。
图9是通过同源建模服务器SWISS-MODEL对巴西蕉PPO三级结构进行的预测。同源模建(homology modeling)是目前最为成功且实用的蛋白质结构预测方法,当2个蛋白质的序列同源性高于35%时,通常认为它们的三维结构基本相同[20]。巴西蕉PPO三级结构是基于PPO原子结构2p3x的A链模建的,两者序列一致性达到63.53%,所以模建结果可以真实反映巴西蕉PPO的结构。
3 结果与讨论
基于二倍体香蕉DH-Pahang基因组的信息,本研究利用电子克隆方法得到巴西蕉PPO基因序列,通过RT-PCR方法克隆获得该基因,序列分析表明该基因是编码巴西蕉PPO的新基因,序列长度为1 767bp,编码588个氨基酸,并登录GenBank,登录号为:KF900300.1。通过各种生物信息学软件对巴西蕉PPO的核酸序列和氨基酸序列进行了生物信息学分析。结果表明:巴西蕉PPO基因与禾本科(除高杆野生稻外)植物PPO基因有着较高的同源性,相似度在82%~85%,与蔷薇科鸡麻(DQ851219.1)亲缘关系最近。巴西蕉PPO最有可能存在于叶绿体中,不具有信号肽,含有一个长度为47个氨基酸的叶绿体转运肽。巴西蕉PPO蛋白属于酪氨酸酶基因家族蛋白,具有酪氨酸酶超级家族、PPO1_DWL和PPO1_KFDV3个保守结构域。巴西蕉PPO分子式为C2952H4526N800O866S19,含有588个氨基酸,分子量为65 688.3Da,等电点为6.32,为亲水性蛋白质。巴西蕉PPO二级结构中无规则卷曲占的比例最高为57.31%,其次是α螺旋为22.11%,而延伸链和β折叠所占的比例低,分别只有16.84%和3.74%。并成功预测得到巴西蕉PPO的三级结构模型。
由于植物基因组较大,基因组结构复杂,目前只有很少的植物基因组序列被测定[21]。利用基因组信息进行功能基因电子克隆的报道更少,葡萄糖-6-磷酸脱氢酶(GenBank登录号:AY078072)和6-磷酸葡萄糖酸脱氢酶(GenBank登录号:AF486280)是利用水稻基因组信息进行电子克隆得到功能基因的少有报道[22]。随着基因组测序的发展,利用基因组信息进行电子克隆一定会成为功能基因克隆的重要方法。
本文利用二倍体香蕉DH-Pahang基因组的信息,采用电子克隆的方法,结合RT-PCR及测序验证,获得巴西蕉PPO的全长编码序列,利用生物信息学的方法对巴西蕉PPO基因的结构和功能进行分析,对蛋白质的各种性质进行预测,为深入研究香蕉PPO基因的结构和功能奠定了基础,为从根本上解决香蕉贮运保鲜及深加工中的褐变问题提供了理论支撑。
参考文献
[1]刘芳.苹果膜结合态多酚氧化酶分离纯化及性质研究[J].北京:中国农业大学,2015.
[2]周娅,张海德,李奕星,等.果糖-赖氨酸模型体系美拉德产物不同级分对抑制香蕉酶促褐变相关性质的影响[J].现代食品科技,2013(11):2653-2657.
[3]刘晓燕,马晓军.几种抑制剂对小麦多酚氧化酶活性抑制效果研究[J].中国粮油学报,2012,27(9):1-4.
[4]罗磊,周燕燕,朱文学,等.金银花多酚氧化酶特异性与抑制剂动力学研究[J].农业机械学报,2014,45(7):202-208.
[5]曹少谦,刘亮,杨震峰,等.几种抑制剂对水蜜桃多酚氧化酶的抑制效应[J].中国食品学报,2014,14(7):144-149.
[6]Wu Y L,Pan L P,Yu S L,et al.Cloning,microbial expression and structure-activity relationship of polyphenol oxidases from Camellia sinensis.[J].Journal of Biotechnology,2010,145(1):66-72.
[7]陈东生,王坤波,李勤,等.丰水梨多酚氧化酶基因的克隆与原核表达[J].茶叶科学,2015(1):17-23.
[8]马长青,柏素花,戴洪义.‘嘎拉苹果多酚氧化酶基因MdPPO的克隆与表达分析[J].植物生理学报,2013(8):803-810.
[9]夏勇开.中国香蕉生产技术的经济研究[D].海口:海南大学,2011.
[10]Laurie M D,Carl J S.Combined effect of high pressure,temperature and holding time on polyphenoloxidase and peroxidase activity in banana (Musa acuminata).Journal of the Science of Food and Agriculture,2000,80:719-724.
[11]袁德保,杨昭,李芬芳,等.香蕉多酚氧化酶的纯化、酶学性质及活性抑制的研究进展[J].食品科学,2013,34(19):330-335.
[12]Gooding P S,Colin B,Robinson S P.Molecular cloning and characterization of banana fruit polyphenol oxidase[J].Planta,2001,213:748-757.
[13]Quansah L.Molecular basis of catecholamine biosynthesis in banana fruit[D].Jerusalem:Hebrew University of Jerusalem,2009.
[4]谭琳,陈娇,李奕星,等.香蕉多酚氧化酶基因编码序列的电子克隆和生物信息学分析[J].广东农业科学,2013,40(24):112-116.
[15]D Hont A,Denoeud F,Aury J M,et al.The banana (Musa acuminata) genome and the evolution of monocotyledonous plants[J].Nature,2012,488(7410):213-217.
[16]Chitsuda C,Chockchai T.Partial purification and characterisation of banana [Musa (AAA Group) ‘Gros Michel]polyphenol oxidase[J].International Journal of Food Science and Technology,2009,(44):840-846.
[17]Chitsuda C,Chockchai T.Partial purification and characterisation of banana [Musa (AAA Group) ‘Gros Michel]polyphenol oxidase[J].International Journal of Food Science and Technology,2009,(44):840-846.
[18]Huang H,Zhu Q,Zhang Z,et al.Effect of oxalic acid on antibrowning of banana (Musa spp.AAA group,cv.‘Brazil) fruit during storage[J].Scientia Horticulturae,2013,160:208-212.
[19]Asif M H,Puneet D,Pravendra N.A simple procedure for isolation of high quality RNA from ripening banana fruit[J].Plant molecular biology reporter,2000,18(2):109-115.
[20]吴祖建,高芳銮,沈建国.生物信息学分析实践[M].北京:科学出版社,2010.
[21]施季森,王占军,陈金慧.木本植物全基因组测序研究进展[J].遗传,2012,34(2):145-156.
[22]黄骥.水稻功能基因的电子克隆与盐胁迫诱导cDNA文库的构建[D].南京:南京农业大学,2002.
(责编:张宏民)

