SCR 脱硝过程中细颗粒物排放特性
范红梅,张玉华,束航,张亚平,杨林军(东南大学 能源热转换及其过程测控教育部重点实验室,江苏 南京,210096)
SCR 脱硝过程中细颗粒物排放特性
范红梅,张玉华,束航,张亚平,杨林军
(东南大学 能源热转换及其过程测控教育部重点实验室,江苏 南京,210096)
摘要:为了减少选择性催化还原(SCR)脱硝过程中细颗粒物的形成,针对商用 V2O5-WO3/TiO2脱硝催化剂,采用电称低压冲击器(ELPI)、 PM10/PM2.5采样器、 X线衍射(XRD)、 高分辨率扫描电镜和能谱仪的联用技术(HRSEM/EDX)等对SCR脱硝反应器出口烟气中细颗粒粒径分布、形貌、元素及物相组成等进行测试分析。研究结果表明:SCR脱硝系统出口细颗粒物主要为亚微米级(dp<1μm)硫酸铵、硫酸氢铵,同时存在少量硅铝质颗粒;反应温度、NH3与NO的摩尔比(n(NH3)/n(NO))、SO2质量浓度、水蒸气体积分数增加时,细颗粒形成量与SO2氧化率之间存在显著的关联性,主要因为 SO2氧化成 SO3后,继而与 NH3和 H2O 生成硫酸铵、硫酸氢铵细颗粒;O2体积分数增加促使硅铝质颗粒的形成,但这些硅铝质颗粒物的生成与 SO2氧化量无关,因此 O2体积分数增加时,细颗粒形成量与 SO2氧化率之间相关性略差。降低 SO2的氧化率有助于降低亚微米级硫酸铵、硫酸氢铵细颗粒;控制 O2体积分数有助于减少硅铝质颗粒。
关键词:SCR;细颗粒物;排放特性;硅铝质颗粒;硫酸氢铵(硫酸铵)
由于选择性催化还原(SCR)烟气脱硝技术的日趋成熟和高的脱硝效率,SCR方法已成为国际上燃煤电站烟气脱硝的主流技术[1]。但在烟气脱硝的同时,催化剂可以使烟气中部分 SO2氧化成 SO3,SO3与 SCR脱硝过程中加入的氨反应生成硫酸铵或硫酸氢铵;在实际运行中发现,质量分数为30%的硫酸氢铵会在空预器内沉积,剩下的以气溶胶形态随烟气离开[2]。此外,硫酸铵在脱硝温度范围内主要呈干态粉末状[3],最终也以固态微粒形态随烟气离开。随烟气带出的硫酸铵或硫酸氢铵会导致出口烟气中的PM2.5浓度增加。杨林军[4]对国内某电厂的SCR反应器前后各放置一套电称低压冲击器(ELPI),对颗粒物进行同步在线测量,同时采集颗粒物,测试发现,经SCR脱硝装置后PM2.5浓度反而有所增加,大幅增加的颗粒物基本处于亚微米级。这表明SCR脱硝过程确实形成了大量的细颗粒物。燃煤电站现有静电除尘设备的除尘效率虽然可高达 99%以上,但对 PM2.5的捕获率较低,无法有效脱除SCR脱硝过程形成的细颗粒物。目前,国内对SCR催化剂性能的改进和反应操作条件的优化方面研究较多。但是,对脱硝过程中细颗粒物的形成以及排放特性却报道较少。为了从源头控制脱硝过程细颗粒物形成,很有必要对SCR脱硝过程中细颗粒物的排放特性进行探索,为此,本文作者展开相应的实验研究。
1 实验
1.1实验装置
图1所示为SCR脱硝实验系统示意图。SCR脱硝模拟实验装置主要由模拟烟气配制系统、催化反应系统、分析测试系统等组成;可进行不同烟气工况及操作条件下的实验,烟气量为1m3/h。模拟烟气主要由NO,NH3,SO2,O2和N2通过钢瓶气配制而成;模拟烟气经过减压、流量控制,再进入混合器、预热器,最后进入反应器。为减少副反应的发生,NH3在SCR反应器入口前加入,在反应器入口处设烟气导流板以确保NH3和烟气的均匀混合。模拟烟气中的水蒸气是将去离子水注入加热管路汽化来实现,通过调节微量注射泵的注射量来改变水蒸气添加量。
SCR脱硝反应在内径为50 mm、自制不锈钢多路固定床连续流动反应器中进行。反应器放置在可加热保温的箱体中,并由温度控制仪控制床层上、中和下部的温度。反应区温度由插入催化剂床层的热电偶测量。将质量为 50 g 的催化剂装入 SCR 反应器的内设托架上,为了防止催化剂的流失,对粉末状的催化剂用耐温石棉进行固定。在 N2气氛下加热至测试温度后,通入模拟烟气和还原剂 NH3;空速控制在20 000 h−1。

图1 SCR脱硝实验系统示意图Fig.1 Schematic diagram of SCR-DeNOx experimental system
1.2催化剂
实验所用催化剂为某电厂预留的蜂窝状催化剂单元,孔数为18×18个。在催化剂前端3~5Cm处截取1段,研磨至0.25~0.38 mm后,放置到模拟实验台的反应器中。催化剂的元素组成测试结果如表1所示。
1.3测试方法
烟气中 SO2,NOx和 O2体积分数采用德国 RBR公司生产的ECOM J2KN型烟气分析仪测量;烟气的温湿度采用芬兰 Vaisala 公司生产的 HMT337 型温湿度变送器测定。颗粒物样品由芬兰Dekati公司生产的PM10/PM2.5采样器采集。细颗粒物颗粒数浓度与粒径分布采用芬兰 Dekati 公司生产的电称低压冲击器(ELPI)实时在线测量。细颗粒物的形貌和元素组分采用Carl Zeiss Ultra Plus高分辨场发射扫描电子显微镜分析,该电镜配有Oxford X−MAX型能谱仪;细颗粒物相组成采用SmartLab™ X射线衍射仪测定。

表1 催化剂XRF测试结果(质量分数)Table1 XRF results ofCatalyst %
2 结果与讨论
2.1SCR脱硝系统出口细颗粒物的排放特性分析
SCR脱硝模拟实验的实验工况为:脱硝反应温度为350 ℃;氨氮比(n(NH3)与n(NO)物质的量比)为1.0;NO质量浓度500 mg/m3,SO2质量浓度2285 mg/m3,水蒸气体积分数为 8%,O2体积分数为 5%,N2为平衡气。图 2所示为脱硝反应系统进出口细颗粒物质量浓度在线测试结果。由于本文实验中SCR脱硝系统入口模拟气体采用钢瓶气配制而成,未添加颗粒物;因此,入口处几乎没有检测到细颗粒物,但脱硝系统出口细颗粒物的数量浓度达1×106个/cm3左右。这说明SCR脱硝反应过程或后续系统可形成大量颗粒物。
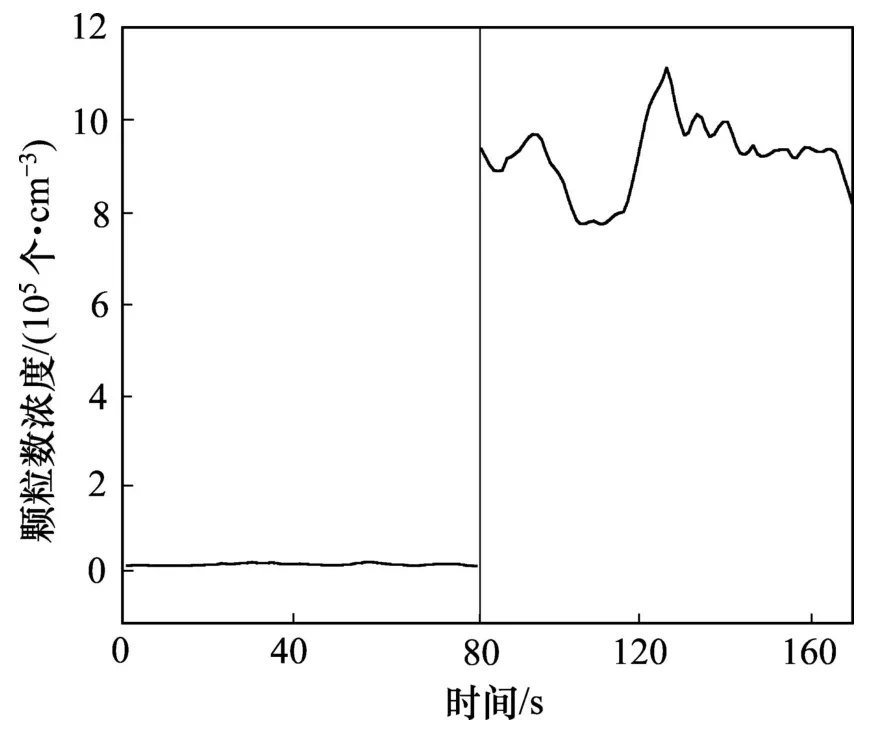
图2 SCR脱硝系统进出口细颗粒数浓度变化Fig.2Concentration of particleCount at inlet and outlet of SCR
图3所示为SCR脱硝装置出口细颗粒物数浓度分布测试结果,图3中Dp为粒径;dN/dlgDp为平均粒数浓度的微分。从图3可以看出:颗粒数粒径分布呈现单峰分布,峰值出现在 0.026~0.08 μm 范围。通常,颗粒物呈三模态分布,即粒径小于 0.08 μm 的爱根(Aitken)核模态、 粒径在0.08~2.00 μm之间的积聚模态(accumulation mode)和粒径大于 2.00 μm 的粗粒子模态(coarse particle mode)[5]。从图3还可以看出:脱硝系统出口细颗粒物主要是爱根核模态颗粒物。爱根核模态颗粒物主要由污染气体经过复杂的化学反应转化而成或由高温下排放的过饱和气态物质冷凝而成[6]。由此推断上述爱根核模态颗粒物很有可能是在 SCR脱硝过程或后续系统通过化学反应转化得到。

图3 SCR出口细颗粒物数浓度分布Fig.3 Size distribution of aerosols form SCR outlet
图4所示为脱硝装置出口细颗粒物的形貌及其相应的元素及物相组成。从图 4(a)和图 4(c)可知:大部分颗粒为硫酸铵和硫酸氢铵,这些硫酸盐的生成途径可能有2种:1)脱硝催化剂中的 V2O5促使 SO2催化氧化成SO3[7],继而进一步与NH3和H2O反应生成硫酸铵、硫酸氢铵细颗粒;硫酸铵熔点为 513 ℃[8],通常,在280 ℃以上开始分解,加热至355 ℃时,硫酸铵分解为氨和硫酸氢铵,加热到513 ℃以上完全分解成氨气、氮气、二氧化硫及水;硫酸氢铵则更易分解,其熔点为146.9 ℃,沸点为490 ℃[8];SCR脱硝反应温度大多在300~400℃,可以推测,在SCR脱硝过程中生成硫酸铵和硫酸氢铵的同时也进行着逆向的分解过程;2)SCR脱硝系统出口测得的部分硫酸铵、硫酸氢铵细颗粒也有可能来自于SO3与逃逸的NH3和H2O 在SCR脱硝装置后续系统发生反应形成的。
此外,从图 4(a)和图 4(b)可知:对比燃煤电厂排放主要颗粒的典型能谱图[9],可以判断少量粒径为2 μm左右光滑的椭球形颗粒属于硅铝质颗粒,其主要成分为 SiO2和 Al2O3[10]。这些硅铝质颗粒可能是脱硝催化剂中Al和Si等元素组分在SCR脱硝还原气氛下,通过气化、氧化、凝结等途径形成。氧化硅的气化行为十分复杂,有学者指出在高温条件下可能以 SiO2蒸气、SiO 或 SiS 的形式气化[10]。据文献[6]报道:当煤粉颗粒温度高于1600 K时,煤粒表面的碳氧化速率很快,导致煤粒内部的氧分压力很低,在煤粒内部形成局部还原气氛。此时,煤中矿物质热解产生的难熔性氧化物,如SiO2和Al2O3等,会通过化学反应生成易挥发的次氧化物(SiO,Al2O)。随着 Al2O 和 SiO 等气化产物的扩散,氧气体积分数逐渐增加,它们会重新被氧化,当超过饱和蒸气压时,均相成核就会发生,导致气溶胶的生成[11]。SiO2的气化量受很多因素的影响,其中主要影响因素有[12]:颗粒粒径大小、温度和压力、氧化性气氛还是还原性气氛等。虽脱硝反应温度远低于上述温度范围,但仍测到了硅铝质颗粒,分析原因可能有以下几点:1)由表1可以看出,催化剂除了 TiO2,WO3和 V2O5等主要成分外,还有 Al2O3和 SiO2等添加剂,而发生气化的物质正是 Al2O3和SiO2;2)元素的气化行为既取决于温度,也受局部气氛的影响,即还原性气氛有利于难熔氧化物的气化反应[13],因为催化剂颗粒表面每一个活性位上都吸附了NH3[14],即颗粒周围存在较强的局部还原气氛促使SiO2的气化;3)NAGELBERG等[15]通过热力学和动力学计算研究发现S对氧化硅气化具有重大影响,脱硝过程中模拟烟气中SO2质量浓度为2 285 mg/m3,因此也可能对 SiO2的气化起着重要的促进作用。QUANN 等[16]的研究结果发现,Al类似于Si,但是与Si相比,Al的挥发性比Si的更低。

图4 SCR脱硝系统出口颗粒形貌及其相应的元素及物相组成Fig.4EmissionCharacteristics of particle at out of SCR
2.2SCR脱硝系统出口细颗粒数浓度与 SO2氧化率之间的关系
利用 SCR 脱硝模拟实验系统,结合 SCR 脱硝的基本工艺过程,同时实验考察反应温度、氨氮比及烟气组分(SO2,O2和水蒸气含量)等对颗粒数排放浓度及SO2氧化率的影响,分析了细颗粒形成量与 SO2氧化率之间的关系;工况条件为:反应气体中 NO 质量浓度为500 mg/m3,SO2质量浓度为2 285 mg/m3,O2体积分数为5%,H2O体积分数为10%,氨氮比为1.0,反应温度为350℃;实验结果如图5~9所示。
从图5~9可以看出:随着反应温度、烟气组分等影响因素增加,SO2氧化成 SO3量的变化趋势与细颗粒数浓度的变化趋势基本一致,可以推测 SO2氧化为SO3后,很可能由以下的化学反应式生成与之相关的硫酸盐,具体反应式如下[17]。
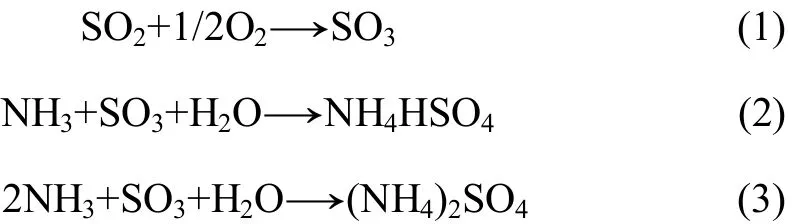
为了进一步证实这一结果,利用 SO3代替 SO2加入到反应器中,在反应器出口处进行了颗粒数浓度的测试实验,实验结果如图10所示。同时,对SO3质量浓度与单位体积颗粒数之间按最小二乘法进行相关性研究,线性回归结果如图11所示。根据线性拟合结果得到相关系数r=0.97137,经F检验,在0.01置信水平上 SO3质量浓度与单位体积颗粒物数目之间呈显著相关关系。这进一步验证这些细颗粒物的形成与 SO3质量浓度有关,即脱硝过程中 SO2氧化成 SO3后,在H2O和NH3存在的条件下,极易转变为与之相对应的硫酸铵盐颗粒。
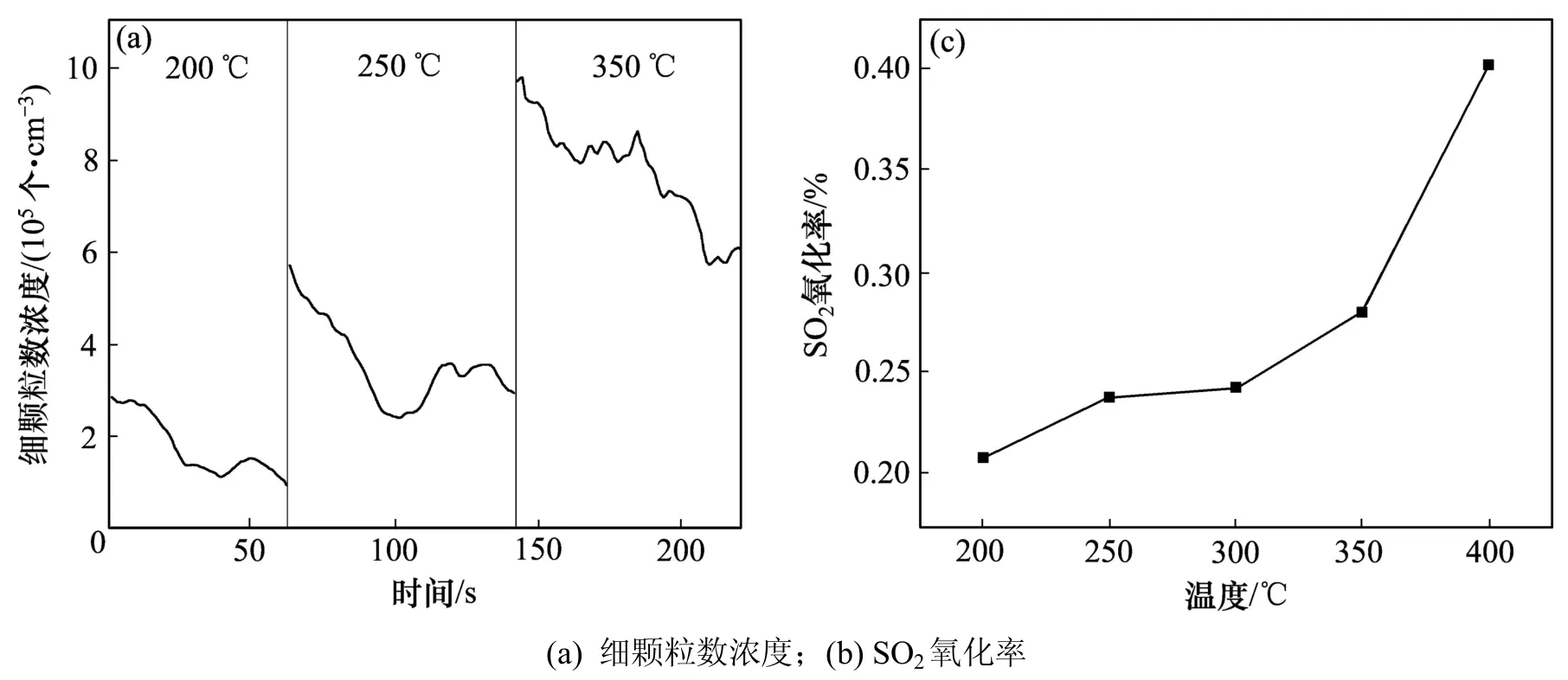
图5 温度对细颗粒数浓度和SO2氧化率的影响Fig.5 Effect of temperature on the numberConcentration of fine particles and SO2 oxidation rate

图6 SO2质量浓度对细颗粒数浓度和SO2氧化率的影响Fig.6 Effect of SO2 massConcentration on the numberConcentration of fine particles and SO2 oxidation rate
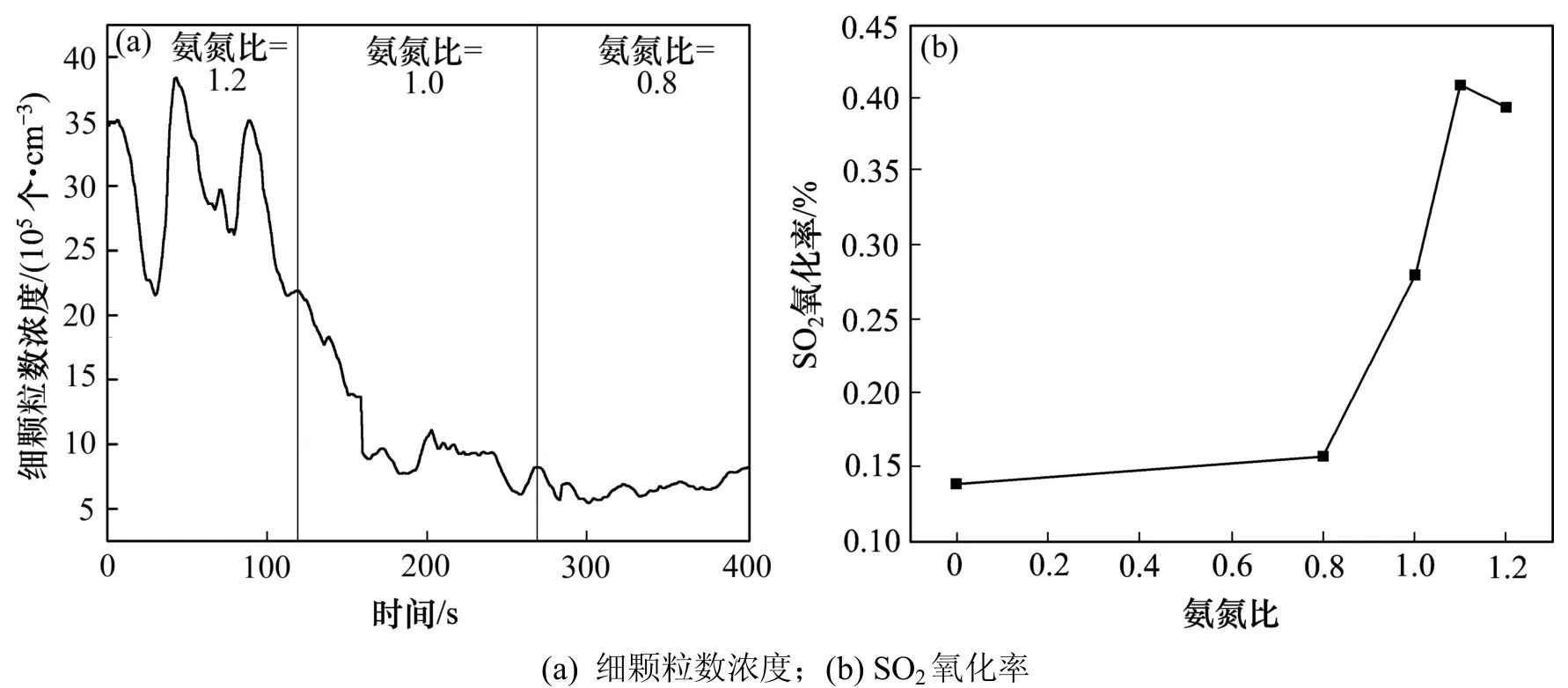
图7 氨氮比对细颗粒数浓度和SO2氧化率的影响Fig.7 Effect of molar ratio of NH3 to NO on the numberConcentration of fine particles and SO2 oxidation rate

图8 O2体积分数对细颗粒数浓度和SO2氧化率的影响Fig.8 Effect of O2 volume fraction on the numberConcentration of fine particles and SO2 oxidation rate
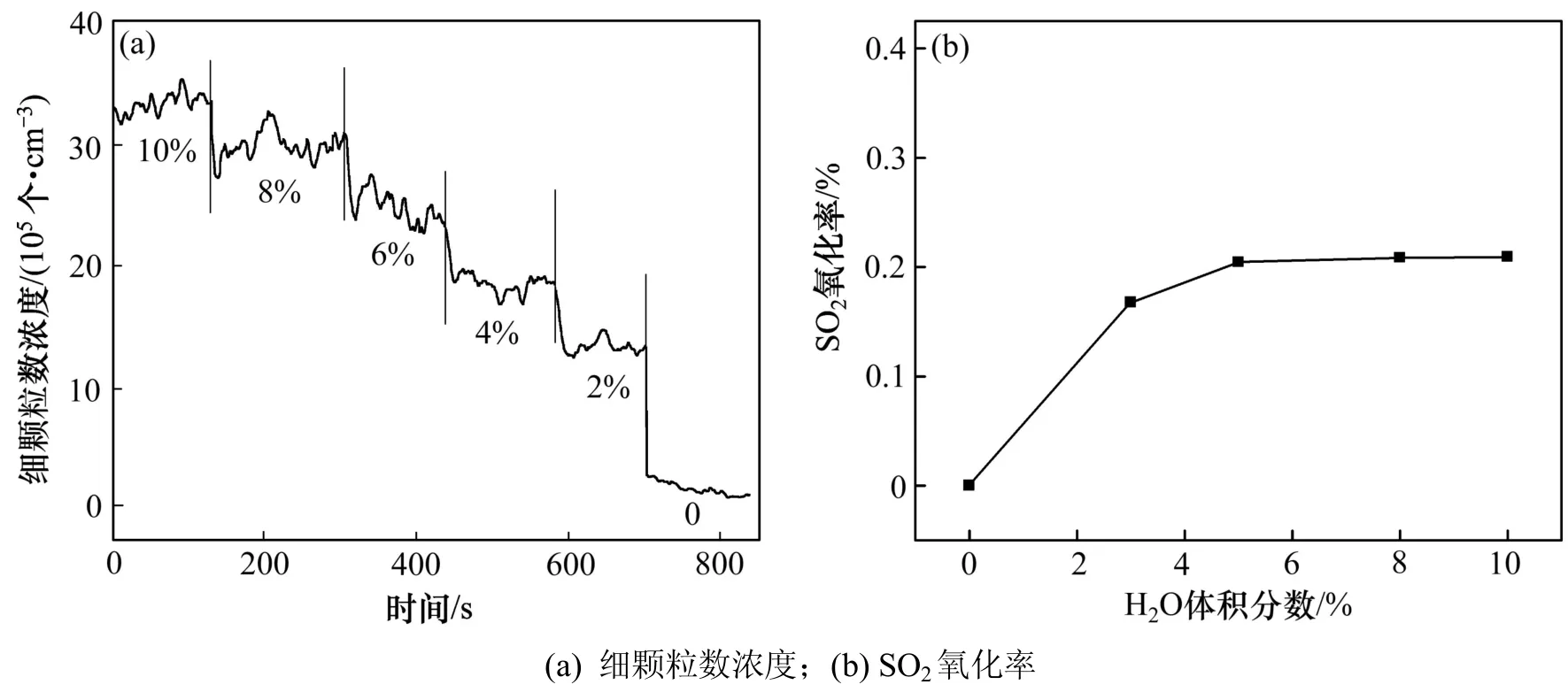
图9 水蒸气体积分数对细颗粒数浓度和SO2氧化率的影响Fig.9 Effect of H2O volume fraction on the numberConcentration of fine particles and SO2 oxidation rate
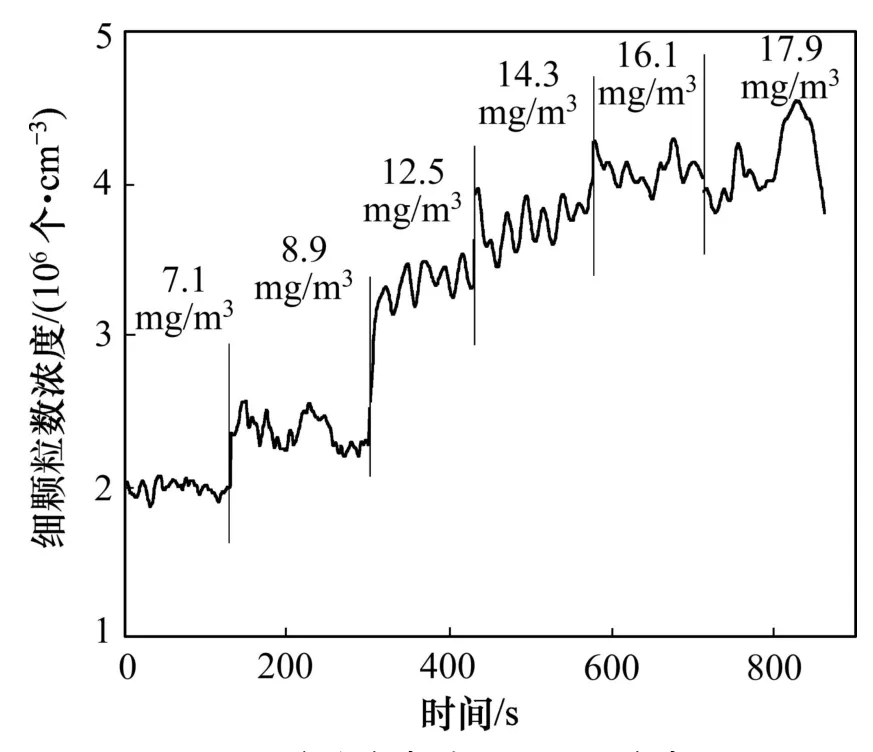
图10 SO3质量浓度对细颗粒数浓度的影响Fig.10 Effect of SO3 massConcentration on the numberConcentration of fine particles

图11 SO3质量浓度与细颗粒数浓度分布的相关性Fig.11 Relationship between of SO3 massConcentration and numberConcentration of fine particles
为了进一步量化不同影响因素下单位体积 SO2氧化量(质量浓度)与单位体积颗粒数之间的相关性(见图5~9),计算结果如表2 所示。由表2 可以看出:在实验工况下影响因素为温度(低于350℃)时,SO2氧化量与颗粒物平均浓度之间相关系数为0.909 60,经F检验,细颗粒物的生成量与 SO2氧化量之间呈显著相关关系。从图5(b)可知:随着温度的升高SO2的氧化率随之增加,同时在350 ℃时出现了拐点。SVACHULA[18]指出拐点的出现是由于在不同温度范围内,因不同的催化反应途径,导致 SO2转化速率的不同而引起的。当实验温度低于350℃时,温度与SO2反应速率之间遵循阿累尼乌斯(Arrhenius)方程,即 SO2氧化率与反应温度之间表现出一个精确的相关性[19]。SO2氧化成SO3后,在H2O和NH3存在的条件下,生成相应的硫酸铵盐细颗粒物。因此,低于350℃时,单位体积SO2氧化量(质量浓度)与细颗粒物的生成量(颗粒数浓度)随温度变化趋势一致(见图5)。

表2不同影响因素下SO2氧化量与颗粒数浓度之间相关性Table1 Correlation between quality of SO2-SO3-conversion and the numberConcentration of fine particles with different factors
当影响因素为 SO2质量浓度时,SO2氧化量与颗粒数浓度之间相关系数为0.90100,经F检验表明SO2氧化量与细颗粒数浓度随 SO2质量浓度变化趋势是一致的。SVACHULA等[18]指出由于活性位数量的限制,在低浓度范围内(SO2质量浓度低于1g/m3)时,SO2质量浓度的提高促进了 SO2转化率的提高,但当 SO2质量浓度很高时,催化剂模块中越来越多的活性位被占据,由于 SO2的反应速率远远小于扩散速率,越来越多的活性位被占据导致一些 SO2未参与反应直接穿过催化剂,因此随着 SO2质量浓度的增加,SO2氧化率降低;对比图 6(b),这一结论与本文实验结果一致。SO2转化率由式(4)计算得到[7],式中:α为 SO2转SO2化率;ρout(SO3)为 SCR 反应器出口 SO3质量浓度;ρin(SO3)为入口初始SO3质量浓度;ρin(SO2)为SCR反应器入口 SO2质量浓度;因子 0.8 是 SO2与 SO3的摩尔质量比。对图6(b)中的测点值采用式(4)计算后发现:随着 SO2质量浓度的增加,生成的 SO3质量浓度也随之增加(虽然是非线性趋势),对 比图6(a)可以看出随着 SO2质量浓度的增加,细颗粒物的浓度也随之增加,两者变化趋势是一致的。

当影响因素为氨氮比时,氨氮比与颗粒数浓度之间相关系数为 0.86188。从图 7可知:即使氨氮比小于1.0,基本不存在氨逃逸情况下,SCR 脱硝装置出口也检测到一定量的亚微米级细颗粒,这些细颗粒的形成可能伴随SCR脱硝过程同时进行的。DUNN等[19]指出当氨氮比<0.8 时,此时低浓度的 NH3对 SO2有较强的抑制性,阻止SO2在V2O5活性位上吸附/氧化。对比图 7(b)可以看出:这一结论与实验结果一致。此时只有少量 SO2吸附在未饱和的活性位上参与氧化反应,因此,相应地生成硫酸铵盐气溶胶颗粒也较少(见图7(a))。当0.8≤氨氮比≤1.1时,一部分没有占据酸性活性位的NH3则发生逃逸,与生成的SO3进一步反应生成硫酸铵盐,从而降低了 SO3气体的分压力,促使了正反应的发生(见式(1)~(3)),从而提高了 SO2的氧化率,与此同时硫酸铵盐气溶胶颗粒也显著增加(见图7(a))。当氨氮比>1.1时,在V2O5的活性位上NH3和SO2出现明显的竞争吸附,此时活性位完全被NH3占据[20],吸附的NH3阻止SO2向催化剂壁面扩散,导致 SO2无法转化成 SO3,因此 SO2氧化率骤然降低,同时硫酸铵盐气溶胶颗粒也随之下降(见图7(a))。以上分析可以看出:当影响因素为氨氮比时,单位体积SO3生成量(质量浓度)与颗粒物数浓度之间表现出较好的相关性。
当O2体积分数发生改变时,细颗粒物平均浓度与SO2氧化量之间相关性略弱(r=0.646 45),这说明了SCR反应中除了生成的SO3进一步转化成相对应的硫酸铵盐颗粒物外,随着O2体积分数的增加可能还生成了其他细颗粒物。SCHWAEMMLE 等[7]指出当 O2体积分数充足时(SO2体积分数约为 0.2%,O2体积分数为5%),O2的体积分数不是SO2氧化率的制约因素,即认为此时O2体积分数与SO2氧化率没有相关性;对比图 8(b)发现:这一结论与本文实验结果一致。从图8(a)可知:O2体积分数的增加,细颗粒的数量随之增加,可能因为催化剂中Al2O3和SiO2等添加剂,在高温和 NH3还原气氛下生成了 Al2O 和 SiO 等易挥发的次氧化物,随着反应过程中氧气体积分数逐渐增加,促使这些易挥发的次氧化物被氧化,形成了硅铝质颗粒,因此细颗粒也随之增加,但这些硅铝质颗粒物的生成与SO2氧化量无关。
当水蒸气含量(体积分数)发生改变时,细颗粒物平均浓度与 SO2氧化量之间相关系数为 0.929 48。德国 Engineers-VDI 协会指出反应过程中硫酸铵盐气溶胶的形成除了 SO3外,必须有水蒸气的存在,但由于SO3有很高的吸湿性,并且 SO3质量浓度很低,所以只需要少量的水蒸气[7]。从图 9(a)可知:当水蒸气体积分数为 0时也检测到了一些颗粒物,此时没有水蒸气的存在,所以这些颗粒物不可能是硫酸铵盐,很可能是硅铝质颗粒。SVACHULA 等[18]指出当水蒸气体积分数增加到 5%~15%时,水蒸气体积分数对 SO2的氧化率基本没有影响;对比图 9(b)可以看出,该结论与本文实验结果一致。对比图 9(a)和 9(b)可知:水蒸气体积分数增加到 5%~10%时 SO3的生成量几乎不再增加,但颗粒物的平均浓度却随之增加,根据式(2)~(3)推测,可能是随着水蒸气分压力的增加,在一定程度上促使了正反应的发生。
3 结论
1)SCR 脱硝系统出口检测到的细颗粒物主要为亚微米级硫酸铵和硫酸氢铵,同时存在少量硅铝质颗粒。
2)当反应温度、氨氮比、SO2质量浓度、水蒸气体积分数发生变化时,SO2氧化率随之发生变化,SO2氧化成SO3后,继而与NH3和H2O生成了硫酸铵、硫酸氢铵细颗粒,从而使得这些细颗粒数浓度与单位体积SO2氧化量之间呈强线性相关。
3)随着 O2体积分数增加,SCR 反应中除了生成的 SO3进一步转化成相对应的硫酸盐颗粒物外,高体积分数的O2会促进硅铝质颗粒的形成,这些硅铝质颗粒物的形成与SO2氧化量无关,因此当O2体积分数增加时,细颗数浓度与单位体积 SO2氧化量之间相关性减弱。
4)SCR脱硝过程中降低SO2的氧化率有助于降低亚微米级硫酸铵、硫酸氢铵细颗粒;控制O2体积分数有助于减少硅铝质颗粒的生成。
参考文献:
[1]张强.燃煤电站SCR烟气脱硝技术及工程应用[M].北京: 化学工业出版社,2007:12−13.ZHANG Qiang.Coal fired power plants SCR nitrogen oxidesControl and removal[M].Beijing:Chemical Industry Press,2007:12−13.
[2]马双忱,郭蒙,宋卉卉,等.选择性催化还原工艺中硫酸氢铵形成机理及影响因素[J].热力发电,2014,43(2): 75−78.MA Shuangchen,GUO Meng,SONG Huihui,et al.Formation mechanism and influencing factors of ammonium bisulfate during the selectiveCatalytic reduction process[J].Thermal power Generation,2014,43(2): 75−78.
[3]梁登科.脱硝过程伴生硫酸氢氨对于烟气灰颗粒性质影响的实验研究[D].济南: 山东大学能源与动力工程学院,2014: 6−7.LIANG Dengke.Experimental research on the effects to flue ash particlesCharacteristics of NH4HSO4generating during the denitrification process[D].Jinan: Shandong University.School of Energy and Power Engineering,2014: 6−7.
[4]杨林军.燃烧源细颗粒物污染控制技术[M].北京: 化学工业出版社,2011: 3−6.YANG Linjun.Combustion source of fine particulate matter pollutionControl technology[M].Beijing:Chemical Industry Press,2011: 3−6.
[5]WOLF M F,HIDY G M.Aerosols andClimate: anthropogenic emissions and trends for 50 year[J].Journal of Geophysical Research,1997,102(D10):11113−11121.
[6]于敦喜.燃煤细微颗粒物的模态识别及其形成机理[D].武汉:华中科技大学能源与动力工程学院,2007:11−13.YU Dunxi.Particle mode identification and formation mechanisms duringCoalCombustion[D].Wuhan: Huazhong University of Science and Technology.School of Energy and Power Engineering,2007:11−13.
[7]SCHWAEMMLE T,HEIDEL B,BRECHT K,et al.Study of the effect of newly developed mercury oxidationCatalysts on the DeNOx-activity and SO2-SO3-conversion[J].Fuel,2012,101:179−186.
[8]刘光启,马连湘,项曙光.化学化工物性数据手册[M].2版.北京: 化学工业出版社,2013: 777−802.LIU Guangqi,MA Lianxiang,XIANG Shuguang.Handbook ofChemical property data[M].2nd ed.Beijing:Chemical IndustryPress,2013: 777−802.
[9]郝吉明,段雷,易红宏,等.燃烧源可吸入颗粒物的物理化学特征[M].北京: 科学出版社,2008: 89−93.HAO Jiming,DUAN Lei,YI Honghong,et al.Physical andChemicalCharacteristics ofCombustion source of particulate matter[M].Beijing: Science Press,2008: 89−93.
[10]徐明厚,于敦喜,刘小伟.燃煤可吸入颗粒物的形成与排放[M].北京: 科学出版社,2009: 24−26.XU Minghou,YU Dunxi,LIU Xiaowei.Coal formation and emission of particulate matter[M].Beijing: Science Press,2009: 24−26.
[11]SCHICK H L.A thermodynamic analysis of the high temperature vaporization properties of silica[J].Chemical Reviews,1960,60(4): 331−362.
[12]ZEVENHOVEN R,KILPINEN P.Control of pollutants in flue gases and fuel gases[EB/OL].[2005−01−17].http://web.abo.fi/~rzevenho/gasbook.html.
[13]QUANN R J,NEVILLE M,JANGHORBANI M,et al.Mineral matter and trace-element vaporization in a laboratory pulverizedCoalCombustion system[J].Environmental Science Technology,1982,16(11): 776−781.
[14]OZKAN U S,CAI Y P,KUMTHEKAR M W.Investigation of the reaction pathways in selectiveCatalytic reduction of NO with NH3over V2O5catalysts: Isotopic labeling studies using18O2,15NH3,15NO and15N18 O[J].Journal ofCatalysis,1994,149(2): 390−403.
[15]NAGELBERG A S,MAR R W,CARLING R W.Calculation of the roal ofCoalConstituent elements on the enhanced vaporization of silica[J].High Temperature Science,1985,19(1): 3−16.
[16]QUANN R J,SAROFIM A F.Vaporization of refractory oxides during pulverizedCoalCombustion[J].Symposium(International)onCombustion,1982,19(1):1429−1440.
[17]BAEK B H,ANEJA V P.Measurement and analysis of the relationship between ammonia,acid gases,and fine particles in eastern northCarolina[J].Journal of the Air & Waste Management Association,2004,54(5): 623−633.
[18]SVACHULA J,ALEMANY L J,FERLAZZO N,et al.Oxidation of SO2to SO3over honeycomb DeNOxingCatalysts[J].Industrial & EngineeringChemistry Research,1993,32(5): 826−834.
[19]DUNN J P,STENGER H G,WACHS I E.Oxidation of sulfur dioxide over supported vanadiaCatalysts: molecular structure-reactivity relationships and reaction kinetics[J].Catalysis Today,1999,51: 301−318.
[20]ORSENIGOC,BERETTA A,FORZATTI P,et al.Theoretical and experimental study of the interaction between NOxreduction and SO2oxidation over DeNOx-SCRCatalysts[J],Catalysis.Today,1996,27(1/2):15−21.
(编辑 罗金花)
Characteristics of fine particulates emission from SCR reactor
FAN Hongmei,ZHANG Yuhua,SHU Hang,ZHANG Yaping,YANG Linjun
(Key Laboratory of Energy ThermalConversion andControl of Ministry of Education,Southeast University,Nanjing 210096,China)
Abstract:In order to reduce the fine particulates emission from SCR reactor,a study wasCarried out toCharacterize the particle size,distribution,morphology,elementCompositions andChemicalCompositions of aerosols in the exhaust of a SCR-DeNOxsystem withCommercial WO3-V2O5/TiO2catalysts using electrical low pressure impactor(ELPI),PM10/PM2.5samplers,X-ray diffraction,and high resolution scanning electron microscopy/energy dispersive analysis system of X-ray(HRSEM/EDX).The results show that the majority of fine particles(dp<1μm)are ammonium sulfate/bisulfate.The small amounts of alumino-silicate particles are detected at the same time.With the increase of temperature,molar ratio of NH3to NO,and the volume fraction of H2O and massConcentration of SO2,particleCount all significantlyContribute to theConversion between SO2and SO3.The main reason might be the oxidation of SO2to SO3with NH3which generated ammonium sulfate/bisulfate.Alumino-silicate particles yield is promoted by the increase of oxygen volume fraction,although they exerte no impact on SO2-SO3-conversion.So theConcentration of particleCount poorlyCorrelates with SO2-SO3-conversion.The reduction of SO2oxidation rateCan help decrease the production of ammonium sulfate/bisulfate while less O2can help decrease the production of alumino-silicate particles.
Key words:SCR; fine particulates; emissionCharacteristics; alumino-silicate particles; NH4HSO4and(NH4)2SO4
中图分类号:X701
文献标志码:A
文章编号:1672−7207(2016)01−0321−09
DOI:10.11817/j.issn.1672-7207.2016.01.044
收稿日期:2015−01−20;修回日期:2015−03−20
基金项目(Foundation item):国家重点基础研究发展规划(973 计划)项目(2013CB228505);国家自然科学基金资助项目(51576039)(Project(2013CB228505)supported by the National Basic Research Development Program(973 Program)ofChina; Project(51576039)supported by the National Natural Science Foundation ofChina)
通信作者:杨林军,博士,教授,博士生导师,从事大气污染控制研究;E-mail: ylj@seu.edu.cn

