沙棘叶中总黄酮提取纯化工艺研究
安 乐, 郁长治, 郭小娜*
(1.新疆医科大学第五附属医院,新疆乌鲁木齐 830011;2.新疆医科大学第一附属医院,新疆乌鲁木齐 830054)
沙棘叶中总黄酮提取纯化工艺研究
安 乐1, 郁长治2, 郭小娜2*
(1.新疆医科大学第五附属医院,新疆乌鲁木齐 830011;2.新疆医科大学第一附属医院,新疆乌鲁木齐 830054)
摘要[目的]建立沙棘叶中总黄酮的最佳提取纯化工艺。 [方法]采用正交设计试验,以高效液相色谱图中主要化学成分的峰面积为指标,考察提取温度、提取料液比、乙醇浓度对沙棘叶中总黄酮提取率的影响。[结果]确定沙棘叶中总黄酮的最佳提取条件为A3B2C2,即提取温度60 ℃、料液比1∶10(g∶mL)、乙醇浓度60%;固定超声功率60 Hz,时间30 min,连续提取2次。[结论]该提取工艺黄酮提取率高,质量易于控制,为沙棘中黄酮类成分的提取和测定提供依据。
关键词沙棘;总黄酮;提取工艺
沙棘又名醋柳、沙枣(Fructushippophae),为胡颓子科(Elaeagnaceae)植物,是公认的珍贵药食同源植物[1],主产于我国内蒙古、新疆、青海等地。沙棘不仅是理想的生态植物同时其中含有的各类化合物也具有很高的药用价值。沙棘是我国古代藏医、蒙医用来治病的常用药[2-3],具有活血散瘀、止咳祛痰、利肺养胃等功效。沙棘叶富含黄酮、有机酸、挥发油、萜类、氨基酸等多种成分[4-6]。目前研究较多的沙棘黄酮是沙棘中重要的活性成分,其在心血管疾病方面有突出作用,具有抗心肌缺血、抗心律失、抗血栓形成等作用,同时改善免疫系统,抗癌、抗氧化方面同样发挥重要作用[7]。近年来国内对沙棘果实的研究非常广泛,已经趋于成熟[8-9],但对沙棘叶及其他部位的开发利用还较为欠缺。笔者利用正交设计试验建立了沙棘叶中总黄酮的提取纯化工艺,以期为更充分地开发利用沙棘提供科学的依据。
1材料与方法
1.1材料
1.1.1研究对象。沙棘叶采自新疆农九师。
1.1.2主要仪器。安捷伦1100高效液相色谱仪;科导5200HP超声提取仪;赛多利斯211D电子分析天平。
1.1.3主要试剂。对照品有异鼠李素、槲皮素、山柰素,木犀草素购买自中国药品生物制品检定所。试验所用的乙腈、甲醇为色谱纯级别,水为双蒸水;盐酸、磷酸、乙醇及其他试剂均为分析纯级别。
1.2方法
1.2.1高效液相色谱分析条件。分析使用Waters C18色谱柱;高效液相检测波长为360 nm;柱温箱温度25 ℃;流动相由甲醇-乙腈-0.4 %磷酸组成,洗脱方式采用梯度洗脱(表1),运行时间 25 min,流动相流速1 mL/min,进样量 20 μL。
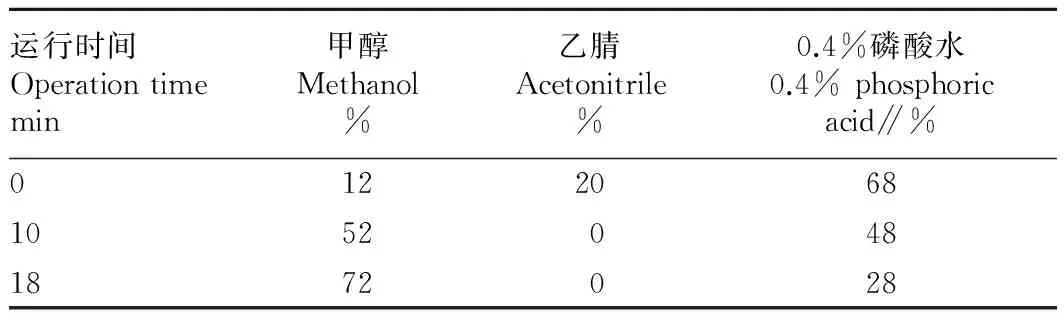
表1 HPLC梯度条件
1.2.2对照品溶液的配制。分别精密称取对照品异鼠李素20.00 mg、槲皮素14.95 mm、山奈素10.10 mg;以甲醇溶解稀释成浓度分别为80.00、59.80、40.40 g/mL的对照品储备溶液,备用。
1.2.3供试品溶液的配制。称取沙棘总黄酮提取物60 mg,加入甲醇30 mL、25% 盐酸5 mL置于50 mL锥形瓶中,将配置好的溶液于 90 ℃水浴中水解60 min后冷却备用。精密吸取水解后的溶液5 mL,用甲醇定容至10 mL容量瓶中,摇匀待测。
1.2.4标准曲线的绘制。分别精密移取“1.2.2”条件下的3种对照品溶液1、2、3、4、5、6、7、8 mL至10 mL的容量瓶中,加入甲醇稀释定容。在“1.2.1”色谱条件下进样20 μL,记录色谱图。以高效液相色谱图峰面积为纵坐标、对照品浓度为横坐标绘制标准曲线。
1.2.5正交试验设计。选取提取温度(A)、料液比(B)和乙醇浓度(C)为影响沙棘叶中总黄酮提取率的3个主要因素,各因素选取3个水平,采用L9(34)正交试验表(表2)设计试验;其他条件为超声提取功率60 Hz,提取时间30 min,连续提取2次。精确称取沙棘叶干粉20.0 g,加入正交设计中的不同溶剂系统,在其他提取条件平行不变的条件下操作,提取结果按“1.2.1”条件运行,以各组积分峰面积之和与样品质量的比值记作(A/m)为量化指标进行样品分析。
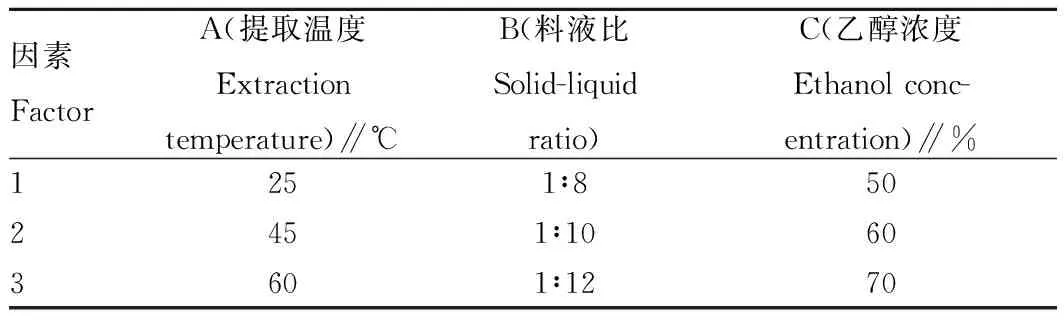
表2 正交试验因素水平
2结果与分析
2.1HPLC色谱条件由图1可见,在“1.2.1”色谱条件下,样品中各组分的色谱峰分离度良好,符合高效液相色谱定量分析的要求。
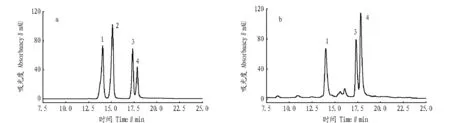
注:1为槲皮素;2为木犀草素;3为山柰素;4为异鼠李素。Note: 1. Quercetin; 2. Luteolin; 3. Kaemperfol; 4. Isorhamnetin.图1 混合对照品(a)和沙棘样品(b)色谱图Fig. 1 Chromatograms of mixed reference substances (a) and F. hippophae samples (b)
2.2线性关系的考察以峰面积为纵坐标、对照品浓度为横坐标绘制标准曲线,得到槲皮素、山柰素和异鼠李素的线性方程分别为Y=66.96X-5.99(r=0.999 5)、Y=50.11X-19.5(r=0.999 9)、Y=69.13X-39.5(r=0.999 9),表明它们分别在5.98~47.84、4.04~32.32、8.00~64.00 μg/mL浓度范围内呈良好的线性关系。
2.3正交试验由表3可知,影响沙棘叶中总黄酮提取率的因素主次顺序依次为A、C、B,且提取沙棘叶中总黄酮的最佳工艺条件为A3B1C2,即提取温度60 ℃、料液比为1∶8(g∶mL)、乙醇浓度60%;但在实际操作过程中干燥的沙棘叶粉末吸水性较大,影响提取的流动性,不利于循环超声提取,且方差分析可知,在P>0.1时,料液比对总黄酮的提取无显著性影响,综合分析考虑将料液比确定为1∶10。最终确定提取沙棘叶中总黄酮的最佳工艺条件为A3B2C2,即提取温度60 ℃、料液比为1∶10、乙醇浓度60%,其中超声功率60 Hz,时间30 min,连续提取2次。
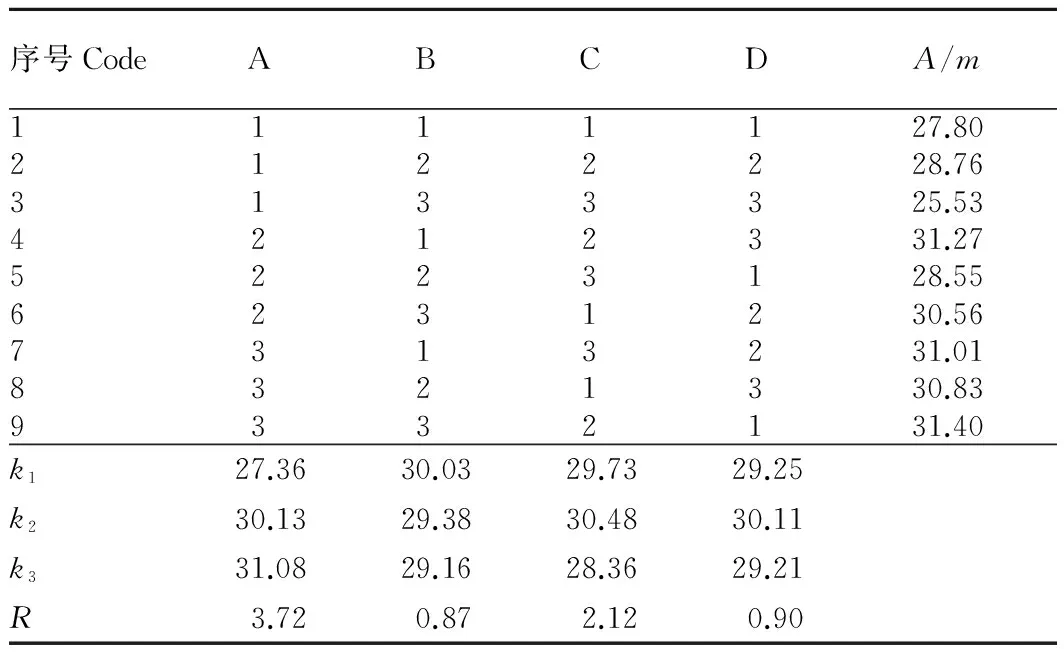
表3 正交试验结果分析
3结论
该研究以沙棘叶中的总黄酮峰面积为提取指标,分别考察了提取温度、乙醇浓度、料液比对提取效率的影响,并通过正交设计试验对提取方法进行了优化。结果表明,沙棘叶中总黄酮最佳工艺条件为提取温度60 ℃、料液比1∶10、乙醇浓度60%,超声功率60 Hz,时间30 min,连续提取2次。该提取工艺总黄酮提取率高且稳定,质量易于控制,为沙棘中黄酮类成分的提取和测定提供依据。
参考文献
[1] 赵志永,王东健,陈奇凌,等.沙棘果实各部位黄酮含量的测定分析[J].农产品加工,2015(6): 59-60.
[2] 金敬红,孙晓明,吴素玲.沙棘高效高值综合利用技术的研究[J].中国野生植物资源,2015(4):81-86.
[3] 南星梅,顾健.藏药五味沙棘口服液的制备工艺及药效学评价[J].西南民族大学学报(自然科学版),2014(5):701-705.
[4] 田景民,陈贵林.沙棘果渣总黄酮提取工艺响应面法优化与抗氧化活性研究[J].食品安全质量检测学报,2014(9):2813-2820.
[5] 郑京.沙棘叶中总黄酮的提取与测定[J].江苏化工,2008(1):36-38.
[6] 杨云裳,张应鹏,李春雷,等.沙棘汁中总黄酮提取及纯化研究[J].时珍国医国药,2011(3):570-571.
[7] 李利军,陈江梅,贺建超,等.沙棘果汁总黄酮含量测量不确定度的评定[J].西北大学学报,2010(6):1036-1040.
[8] 孙斌,瞿伟菁,张晓玲,等.高效液相色谱法测定沙棘籽渣中黄酮苷元含量[J].中国药学杂志,2005(2):139-141.
[9] 刘娟,杨艳丽.HPLC 法测定沙棘不同部位槲皮素和异鼠李素的含量[J].辽宁中医药大学学报,2010(6):16-17.
Extraction and Purification of Total Flavones from Leaves ofFructushippophae
AN Le1, YU Chang-zhi2, GUO Xiao-na2*
(1. The Fifth Teaching Hospital of Xinjiang Medical University, Urumqi, Xinjiang 830011; 2. The First Teaching Hospital of Xinjiang Medical University, Urumqi, Xinjiang 830054)
Abstract[Objective] To develop a method for extraction and purification of total flavones from leaves of Fructus hippophae. [Method] With HPLC peak area of major chemical compounds as the index, orthogonal test design was designed. Effects of extraction temperature, solid-liquid ratio and ethanol concentration on the extraction rate of flavones of F. hippophae were researched. [Result] The optimal extraction condition was A3B2C2, which was 60 ℃ extraction temperature, 1∶10 (g∶mL) solid-liquid ratio, 60% ethanol concentration, 60 Hz extraction power, 30 min extraction time and 2 extraction times. [Conclusion] This method is easy control and has high extraction rate of flavones, which provides the basis for extraction and detection of flavones from leaves of F. hippophae.
Key wordsFructus hippophae; Total flavones; Extraction
作者简介安乐(1987- ),女,回族,新疆乌鲁木齐人,药师,从事中药新剂型研究。*通讯作者,药师,硕士,从事药物新剂型研究。
收稿日期2016-03-08
中图分类号S 789
文献标识码A
文章编号0517-6611(2016)11-154-02

