炸药化合物的环境归宿及植物作用研究进展
袁 园
(上海依科绿色工程有限公司,上海 200433)
炸药化合物的环境归宿及植物作用研究进展
袁 园
(上海依科绿色工程有限公司,上海 200433)
摘要从炸药化合物的物理化学性质出发,讨论其环境迁移和降解能力,并重点讨论炸药化合物对植物毒性以及在植物体内的浓度与降解情况的研究进展。
关键词炸药类化合物;硝基芳烃;硝胺;硝酸酯;吸附;植物;植物修复
炸药除了应用于军事外,还应用于采矿、筑路、兴修水利、工程爆破、金属加工等方面。在炸药的生产、储运、使用过程中,不可避免地进入土壤和地下水中,对生态环境和人类健康造成潜在威胁。从分子结构上看,炸药化合物分为三大类,第1类是包含C-NO2基团的硝基芳烃,代表物质TNT(2,4,6-三硝基甲苯)和DNAN(2,4-二硝基苯甲醚),后者由于其更好的安全性,有望取代前者[1-2];第2类是包含N-NO2基团的硝胺化合物,代表物质RDX(环三亚甲基三硝胺,俗名“黑索今”)和HMX(环四亚甲基四硝胺,俗名 “奥克托今”);第3类是包含O-NO2基团的硝酸酯化合物,代表物质硝化甘油(三硝酸甘油酯)和PETN(季戊四醇四硝酸酯,俗名“太安”)[3- 4]。笔者回顾了近年来炸药化合物环境归宿与植物作用的相关研究进展,旨在为评估炸药污染物在环境中的潜在危害及制订有效的受污染场地的修复方案提供借鉴。
1炸药化合物的迁移能力
表1汇总了代表性炸药化合物的物理化学参数[1,5-12]。亨利常数(kH)是物质在空气和水中的平衡常数,炸药化合物蒸汽压和亨利常数较低,表示其不具有挥发性,从土壤或地下水挥发进入空气的迁移途径可忽略不计。
辛醇-水分配系数(Kow)用以初步判断化合物对有机质的亲和力;有机碳分配系数(Koc)表达了化合物对土壤的亲和力。TNT、DNAN及硝化甘油显示了中度水溶性,但土壤对硝基芳烃炸药和硝酸酯炸药有较强的吸附作用,从而限制其溶解于地下水,并随着地下水流迁移到更大场地范围。RDX、HMX有低的Kow值,表示其不易被土壤或生物吸附,低溶解度限制了该类污染物在地下水中的浓度。因此,各类炸药化合物的迁移能力较差。
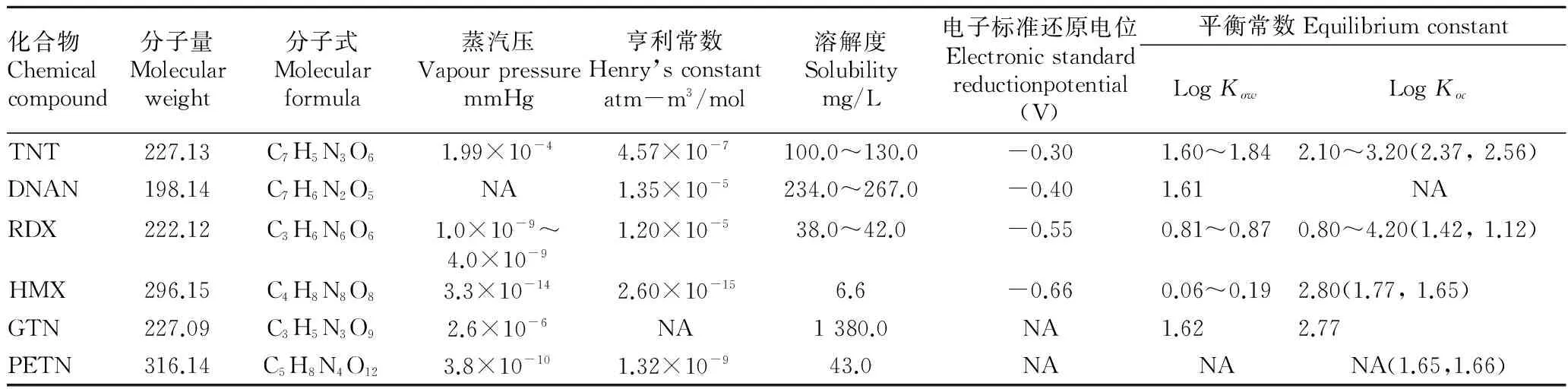
表1 炸药化合物的物理化学参数
注:LogKoc括号内数字来自于笔者对2种土壤进行的吸附试验。NA表示未检索到相关数据。
Note: LogKocdigit in the bracket came from the adsorption experiment on two soil types. NA indicated that the relevant data were not retrieved.

吸附试验表明,TNT的吸附等温线呈非线性,为Freudlich或Langmuir型等温线[15,17,19]。RDX吸附等温线在1~10 mg/L范围内呈线性[19],但在1~25 mg/L范围内呈非线性,Freudlich公式最好地模拟了该区段等温线型[17]。同样,Alavi等[18]用Freundlich型等温式表达了RDX(0.5~5.0 mg/L)、DNT(0.5~5.0 mg/L)、TNT(0.5~5.0 mg/L)及HMX(0.2~2.0 mg/L)在3种土壤上的吸附结果。
植物根系从地下吸取水分、营养,同时也吸取了土壤和地下水中的污染物。Kow常被用来判断植物对化合物的摄取能力,Kow过低,化合物难以通过根系的细胞膜组织;Kow过高,化合物极易被土壤和根系表面吸附,难以进入植物内部,通常认为logKow为1.0~3.5的化合物易被植物摄取。硝基苯环类炸药化合物和硝酸酯类炸药化合物的logKow位于上述区间内,而RDX的logKow接近1.0,HMX的Kow值较低,说明HMX较难被植物吸收。大量实验室研究结果和实地测试验证了包括陆生草本和木本植物、水生植物以及湿地植物在内的大量植物能吸收炸药化合物,从Kow值来判断,较难被植物摄取的HMX,也能够被植物吸收[5,20-24]。
2炸药化合物的降解能力
炸药属于高度被氧化的能量物质,在地下缺氧环境中,还原反应是关键的化学转化途径。电子标准还原电位可显示化合物的被还原能力,还原电位越高,化合物越易被降解[1]。从电子标准还原电位看,化合物被降解能力从大到小依次为TNT、DNAN、RDX、HMX,该预测结果与现有研究报道一致。从理论的角度来说,电子标准还原电位只能用于预测非生物作用的纯粹化学反应(如光解、还原性离子Fe2+等的还原作用)的难易程度,但是化合物在真实土壤中的降解是生物和化学机理共同作用的结果,难以区分是生物降解还是非生物降解。
大量研究结果显示,TNT在沉积物、土壤和水体中都能被快速降解,反应速率常数的量纲为小时到天[5,25-29]。高浓度TNT会抑制降解过程。就环境条件而言,碱性环境能快速引发TNT的碱催化水解[17]。在好氧和厌氧条件下,TNT都能转化为羟胺和胺衍生物,但在还原性环境(Eh=-150 mV)下,相比氧化性环境(Eh=+500 mV),TNT降解快。TNT虽然易于被降解,但难以被完全矿物化。关于TNT降解产物对生态的影响,学术界持两种截然相反的观点,一种观点认为,其不可逆地与土壤有机成分结合,减轻其生物危害性[30];另一观点认为,受TNT污染的土壤,放置一段时间后,具有更强的植物毒性,说明TNT降解产物有着更大或者至少与TNT近似的生物可给性[5,14,27]。关于DNAN的研究较少,DNAN在厌氧生物反应器中,转化为二氨基苯甲醚,该转化产物暴露于空气后,形成偶氮键聚合物[31]。4 μmol DNAN在有充足碳源和氮源的有氧土壤环境中,8 d内被完全转化,转化产物是2-氨基-4-硝基苯甲醚[2]。
硝铵类炸药相比硝基芳烃更为稳定,RDX能在水溶液中被缓慢光解[32],细菌和真菌能分解RDX,甚至能将部分RDX完全分解为CO2,细胞色素P450与生物降解过程相关[33]。HMX具有冠状分子结构,比RDX更为稳定,环境样品中几乎监测不到任何HMX的转化产物。HMX未被观察到会发生光解[5];当TNT和RDX在消失的同时,HMX始终保持不变[5,34]。Alavi等[18]使用2种不同土壤测试HMX、RDX和TNT的降解速率,原始浓度均为1.0 mg/L,结果显示:HMX、RDX和TNT的降解速率分别为0.006 6~0.017 0、0.008 0~0.140 0和1.860 0~2.380 0 d-1,该结果与电子标准还原电位建议的物质稳定性一致。
硝酸酯类炸药分子在化学结构上没有类似硝铵类炸药的稳定环状结构,因此硝酸酯类炸药化合物稳定性不如硝铵类炸药化合物。Rocheleau等[8,10]研究表明,硝化甘油相对易被生物降解,原始浓度为4.0~673.0 mg/kg的受污染土壤放置1个月后,残余浓度仅为原始浓度的0~40%。硝化甘油的降解产物二硝基甘油和一硝基甘油对植物毒性降低[8]。目前,关于PETN的报道较少,但根据PETN的结构推测,其稳定性要优于硝化甘油。
3炸药化合物的植物毒性
土壤的性质极大影响了植物对污染物的吸收,不同种类植物对炸药化合物的耐受能力也存在差异。大量试验数据显示,TNT的植物毒性阈值范围为1.4~311.0 mg/kg,且集中在30.0~50.0 mg/kg[7,25-27]。对于RDX和HMX,植物显示出巨大的耐受性。在28 d的暴露试验中,玉米(Zeamays)对RDX的最大耐受浓度为903.0 mg/kg[35];在55 d的暴露试验中,黑麦草(Loliumperenne)和苜蓿(Medicagosativa)能在RDX浓度为1 540.0 mg/kg的土壤中生长[36];在21 d的暴露试验中,土壤RDX浓度高达10 000.0 mg/kg,并未明显地抑制黑麦草生长[16]。水栽试验显示,植物组织中的RDX浓度高出水溶液浓度15倍,仍未表现出植物毒性[13];杂交杨树扦插在饱和HMX水溶液中,未发现毒性反应[6]。生菜(Lactucasativa)和大麦(Hordeumvugare)对硅质土壤和森林土壤中HMX的最大耐受浓度分别为3 320.0±1 019.0、1 866.0±438.0 mg/kg[26]。硝化甘油的植物毒性阈值范围为12.0~200.0 mg/kg,Alavi等[18]和Rocheleau等[27]采用相同的毒性试验方法考察了TNT和硝化甘油的植物毒性,结果表明:稗草(Echinochloacrus-galli)对TNT和硝化甘油的毒性敏感度接近,但苜蓿对TNT更为敏感。总体来说,相比硝基芳烃和硝胺类炸药化合物,硝酸酯类炸药化合物的研究数量较少,尚不足以支撑可靠的结论。
植物对炸药化合物的耐受性与单子叶和双子叶的植物分类不存在绝对性的对应关系。Siciliano等[37]研究表明,单子叶的雀麦草(Bromuserectus)、黑麦草和黄花草(Anthoxanthumodoratum)在16种草本植物中,对TNT的毒性反应最小。农作物中,单子叶的玉米对TNT不敏感[14],双子叶的菜豆(Phaseolusvulgaris)和单子叶的小麦(Triticumaestivum)有近似的TNT耐受性[25-27],而双子叶的水芹(Lepidium)、芜菁(Brassicarapa)、单子叶的韭菜(Alliumschoenoprasum)对TNT更敏感[26]。在对15种植物的RDX毒性筛选中,双子叶的白三叶草(Trifoliumrepens)和生菜的毒性反应最小,双子叶的向日葵(Helianthusannuus)和红豆草(Onobrychisviciifolia)对RDX最为敏感。总体说来,单子叶植物对炸药化合物的毒性反应要小于双子叶植物[38]。在农作物中,单子叶的玉米相对于单子叶的亚洲水稻(Oryzasativa)和小麦以及双子叶的黄豆(Glycinemax),有更好的RDX耐受力[35,39]。
4炸药化合物在植物体内的分布
放射性标记化合物常被用于跟踪化合物的环境分布和最终归宿。大量试验研究结果显示,TNT标记主要位于根部,但是放射性标记不是以TNT分子的形式存在,显示TNT进入植物后,已高度分解为极性更强的产物,且部分产物与植物细胞结合[24,28,30,34,39-40]。Vila等[39]研究表明,玉米、小麦、水稻和黄豆种植在TNT污染的土壤中42 d后,从地上部分植物体中只回收了不到25%的放射性碳[39]。木本植物杂交杨树(Populusdeltoidesxnigra,DN34)[30,34]、杂交柳树(Salixspec.,clone EW-20)和挪威云杉(Piceaabies)[40],对TNT的向上运输效率更低,只有3.3%~14.4% 的14C。Pennington等[14]对受TNT污染现场取样调查,在地上植物组织中未检测出任何TNT或已知的TNT降解中间产物,仅在部分根部检测出TNT以及其降解产物ADNT(一氨基二硝基甲苯)。
与TNT正相反,RDX和HMX累积在植物叶组织中[6,13,21,34,39],大部分放射性标记以RDX和HMX分子的形式被检测出[39],且随着时间的变化,比RDX极性更强的RDX降解物的含量呈逐步增加趋势[21]。但是没有任何HMX的降解产物被检测出,又一次证明了HMX是极稳定的化合物[5-6,16,34]。玉米、小麦、水稻和黄豆暴露于受RDX污染的土壤42 d,从植物地上部分回收了超过80.0%的放射性碳[39]。菜豆暴露于RDX 7 d后,在叶、茎、根14C的含量分别为69.0%、18.0% 和13.0%[21]。毛草芦苇(Scirpusatrovirens)暴露于RDX 112 d后,把植物地上部分平均分成顶部、中部和底部3部分,顶部茎的RDX浓度分别是中部和底部茎的2~8和6~30倍[41]。Thompson等[21]报道了7 d后60.0%的RDX累积在杂交杨树插条叶部;Yoon等[6]报道了30 d后70.0%和21.1%的HMX分布在叶部和老树干中;Moon等[34]报道了杨树插条同时暴露于3种混合炸药TNT、RDX及HMX 30 d后,在被植物吸入的放射性标记物中,64.1%的14C-RDX和57.9%的14C-HMX分布在叶部[34]。荧光成像技术(Phosphor Imager Autoradiography)显示,14C在叶的边缘及老叶子部位浓度更高,且集中于叶绿体周围和木质化组织内,提示RDX被植物运输入叶绿体或与葡糖基结合进入植物细胞结构(如细胞壁)[42]。
表2汇总了RDX和HMX在基质及植物体中的浓度,并计算了生物富集因子。由表2可知,在单子叶植物中,RDX和HMX在植物中的浓度范围分别为62.0~5 217.0和26.0~380.0 mg/kg,其中黑麦草的植物体浓度最高,说明其生物富集能力强[5,13,16,25,35-36,41,43]。对于双子叶草本植物,RDX和HMX在植物中的浓度范围分别为15.0~4 355.0和50.0~220.0 mg/kg,其中苜蓿的植物体浓度最高[5,13,35-36]。对于木本植物,活跃生长的杂交杨树插条插入RDX浓度为7.9~26.0 mg/L的水溶液7 d后,叶和干的RDX浓度分别为354.0~723.0和46.0~121.0 mg/kg[21]。基质浓度和暴露时间是植物体污染物浓度的两大重要影响因素。Chen等[35-36]证实了植物体污染物浓度与基质浓度存在明显的相关关系。在2个长期种植试验中,持续用含RDX 0.5~3.0 mg/L的水溶液毛草芦苇(Scirpusatrovirens)浇灌112 d[41],印度草(Sorghastrumnutans)种植在含RDX 30.3~85.0 mg/kg的土壤92 d[43],植物根和茎的RDX含量均随时间的延长而增加,同时在茎中能检测出RDX的降解产物MNX(六氢-1-亚硝基-3,5-二硝基-1,3,5-三嗪),其浓度也随时间的延长而增大。

表2 植物组织中硝铵类炸药化合物的浓度
除了外部环境因素外,植物生理特征是决定植物体污染物浓度的内因。草本植物和木本植物在解剖结构中存在差异,首先,木本植物的根系更为发达,对异生质进入木质部具有更大的抵制作用,同时对异生质的降解能力更强;其次,木本植物有更长的运输通道,树干和树枝有大量的木质素结构,具有吸附异生有机物的能力[44]。因此,可以预测木本植物中叶组织的污染物浓度低于草本植物地表组织的污染物浓度,同时木本植物体内污染物浓度达到相对稳定所需时间长于草本植物。
目前,对硝酸酯类炸药的研究较少,硝化甘油的归宿类似于TNT,很少能从植物地上部分中检测到[8,10]。
5炸药化合物在植物体内的降解
植物对有机污染物具有较强的降解能力,但植物和微生物对有机污染物的降解途径和降解产物不同,植物通过活化、结合和封存将其转化为对自身无害的物质,而微生物则是将有机污染物完全矿化。植物降解异生物质的过程类似于人体肝组织的代谢过程,首先植物酶催化反应,在异生有机物上增加功能基团(如羟基),从而增加了外来物的极性;然后植物细胞内的葡萄糖和氨基酸,和被活化的异生质结合,来进一步增加极性,降低外来物的毒性;最后这些异生物质以类似木质素的方式聚合并形成一种复杂的结构,被封存在植物细胞壁、液泡及外质体中。
TNT的植物降解路径示意图可参见文献[3,7,30,40]。大量体外组织培养液试验证实了植物对TNT的降解,50.0 mg/L TNT在大黄(Rheumpalmatum)组织培养液中6 h被完全降解[45]。TNT还原产物ADNT的浓度很低,甚至只有1.0%[30,45-46],取代ADNT的是大量未知代谢产物[30,40],这些未知物多种多样,极性很强,符合植物代谢机理的假说[7,46]。除了还原反应的代谢途径外,甲基氧化或苯环羟基化等氧化途径也被报道[45,47]。
RDX的植物降解路径示意可参见文献[3,7,32-33]。学术界广泛采用Van Aken等提出的3步RDX降解假说。第1步:将RDX还原为MNX(六氢-1-亚硝基-3,5-二硝基-1,3,5-三嗪)和DNX(六氢-1,3-二亚硝基-5-硝基-1,3,5-三嗪);第2步:RDX、MNX、DNX的环状结构被打破,形成只含1个碳原子的代谢产物,如甲醛CH2O和甲醇CH3OH,该反应只能在有光的条件下完成;第3步:只含1个碳原子的代谢产物被进一步矿物化[33]。虽然这个假说尚未完全被验证,但MNX被大量试验确认在植物组织中存在[16,34,36,41,43]。除了酶催化反应外,Just等[32]提出了植物光解反应假说,即进入叶子的紫外线能够直接光解RDX,同时光合作用中叶绿素可以将电子传递给RDX,从而还原RDX,为间接光解。目前,HMX的降解途径或降解产物鲜见报道。
PETN在大黄组织培养液中能被降解,消失速度比硝化甘油在同样培养液中更快[45,48],降解产物包括PETriN(季戊四醇三硝酸酯)、PEDN(季戊四醇二硝酸酯)、PEMN(季戊四醇一硝酸酯)和季戊四醇。PETN的植物降解路径示意图可参见文献[45]。
植物除了通过代谢作用直接降解有机污染物外,植物体内共生的细菌也能降解异生物质,以降低外来有机物对植物的毒性。一种从杂交杨树内分离得到的粉红色素共生菌能够以协同代谢的机理降解TNT、RDX和HMX,但炸药化合物不能作为该菌种生存的独立碳源或氮源[49]。
参考文献
[1] UCHIMIYA M,GORB L,ISAYEV O,et al.One-electron standard reduction potentials of nitroaromatic and cyclic nitramine explosives [J].Environmental pollution,2010,158(10):3048-3053.
[2] PERREAULT N N,MANNO D,HALASZ A,et al.Aerobic biotransformation of 2,4-dinitroanisole in soil and soilBacillussp.[J].Biodegradation,2012,23(2):287-295.
[3] RYLOTT E L,BRUCE N C.Plants disarm soil:Engineering plants for the phytoremediation of explosives [J].Trends in biotechnology,2009,27(2):73-81.
[4] HANNINK N K,ROSSER S J,BRUCE N C.Phytoremediation of explosives [J].Critical reviews in plant sciences,2002,21(5):511-538.
[5] GROOM C A,HALASZ A,PAQUET L,et al.Accumulation of HMX(Octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine)in indigenous and agricultural plants grown in HMX-contaminated anti-tank firing-range soil [J].Environmental science & technology,2001,36(1):112-118.
[6] YOON J M,OH B T,JUST C L,et al.Uptake and leaching of octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine by hybrid poplar trees [J].Environmental science and technology,2002,36(21):4649-4655.
[7] YOON J M,OLIVER D J,SHANKS J V.Plant transformation pathways of energetic materials(RDX,TNT,DNTs)[M]//EAGLESHAM A,BESSIN R,TRIGIANO R,et al.Agricultural biotechnology:Beyond food and energy to health and the environment.National agricultural biotechnology council report 17.New York:National Agricultural Biotechnology,2005.
[8] ROCHELEAU S,KUPERMAN R G,DODARD S G,et al.Phytotoxicity and uptake of nitroglycerin in a natural sandy loam soil [J].Science of the total environment,2011,409(24):5284-5291.
[9] SINGH S.Sensors-An effective approach for the detection of explosives [J].Journal of hazardous materials,2007,144(1/2):15-28.
[10] RIEFLER R G,MEDINA V F.Phytotreatment of propellant contamination [J].Chemosphere,2006,63(6):1054-1059.
[11] BODDU V M,ABBURI K,MALONEY S W,et al.Thermophysical properties of an insensitive munitions compound,2,4-dinitroanisole [J].Journal of chemical and engineering data,2008,53(5):1120-1125.
[12] HSDB.On-line Database[M].Washington,DC:National Library of Medicine,2010.
[13] PRICE R A,PENNINGTON J C,LARSON S L,et al.Uptake of RDX and TNT by agronomic plants [J].Soil and sediment contamination,2002,11(3):307-326.
[14] PENNINGTON J C,BRANNON J M.Environmental fate of explosives [J].Thermochimica acta,2002,384(1/2):163-172.
[15] DONTSOVA K M,HAYES C,PENNINGTON J C,et al.Sorption of high explosives to water-dispersible clay:Influence of organic carbon,aluminosilicate clay,and extractable iron [J].Journal of environmental quality,2009,38(4):1458-1465.
[16] ROCHELEAU S,LACHANCE B,KUPERMAN R G,et al.Toxicity and uptake of cyclic nitramine explosives in ryegrassLoliumperenne[J].Environmental pollution,2008,156(1):199-206.
[17] LARSON S L,MARTIN W A,ESCALON B L,et al.Dissolution,sorption,and kinetics involved in systems containing explosives,water,and soil [J].Environmental science and technology,2008,42(3):786-792.
[18] ALAVI G,CHUNG M,LICHWA J,et al.The fate and transport of RDX,HMX,TNT and DNT in the volcanic soils of Hawaii:A laboratory and modeling study [J].Journal of hazardous materials,2011,185(2/3):1600-1604.
[19] DONTSOVA K M,YOST S L,IMUNEK J,et al.Dissolution and transport of TNT,RDX,and composition B in saturated soil columns [J].Journal of environmental quality,2006,35(6):2043-2054.
[20] SCHOENMUTH B W,PESTEMER W.Dendroremediation of trinitrotoluene(TNT).Part 1:Literature overview and research concept [J].Environmental science and pollution research,2004,11(4):273-278.
[21] THOMPSON P L,RAMER L A,SCHNOOR J L.Hexahydro-1,3,5-trinitro-1,3,5-triazine translocation in poplar trees [J].Environmental toxicology and chemistry,1999,18(2):279-284.
[22] BHADRA R,WAYMENT D G,WILLIAMS R K,et al.Studies on plant-mediated fate of the explosives RDX and HMX [J].Chemosphere,2001,44(5):1259-1264.
[23] THOMPSON P T,RAMER L A,GUFFEY A P,et al.Decreased transpiration in poplar trees exposed to 2,4,6- trinitrotoluene [J].Environmental toxicology and chemistry,1998,17(5):902-906.
[24] ADAMIA G,GHOGHOBERIDZE M,GRAVES D,et al.Absorption,distribution,and transformation of TNT in higher plants [J].Ecotoxicology and environmental safety,2006,64(2):136-145.
[25] BEST E P H,TATEM H E,GETER K N,et al.Effects,uptake,and fate of 2,4,6-trinitrotoluene aged in soil in plants and worms [J].Environmental toxicology and chemistry,2008,27(12):2539-2547.
[26] ROBIDOUX P Y,BARDAI G,PAQUET L,et al.Phytotoxicity of 2,4,6-trinitrotoluene(TNT)and octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine(HMX)in spiked artificial and natural forest soils [J].Archives of environmental contamination and toxicology,2003,44(2):198-209.
[27] ROCHELEAU S,KUPERMAN R G,MARTEL M,et al.Phytotoxicity of nitroaromatic energetic compounds freshly amended or weathered and aged in sandy loam soil [J].Chemosphere,2006,62(4):545-558.
[28] DURINGER J M,MORRIE CRAIG A,SMITH D J,et al.Uptake and transformation of soil [14C]-trinitrotoluene by cool-season grasses [J].Environmental science & technology,2010,44(16):6325-6330.
[29] CONDER J M,LA POINT T W,LOTUFO G R,et al.Nondestructive,minimal-disturbance,direct-burial solid-phase microextraction fiber technique for measuring TNT in sediment [J].Environmental science and technology,2003,37(8):1625-1632.
[30] THOMPSON P L,RAMER L A,SCHNOOR J L.Uptake and transformation of TNT by hybrid poplar trees [J].Environmental science & technology,1998,32(7):975-980.
[31] PLATTEN W E,BAILEY D,SUIDAN M T,et al.Biological transformation pathways of 2,4-dinitro anisole and N-methyl paranitro aniline in anaerobic fluidized-bed bioreactors [J].Chemosphere,2010,81(9):1131-1136.
[32] JUST C L,SCHNOOR J L.Phytophotolysis of hexahydro-1,3,5-trinitro-1,3,5-triazine(RDX)in leaves of reed canary grass [J].Environmental science & technology,2003,38(1):290-295.
[33] VAN AKEN B,YOON J M,JUST C L,et al.Metabolism and mineralization of hexahydro-1,3,5-trinitro-1,3,5-triazine inside poplar tissues(Populusdeltoides×nigraDN-34)[J].Environmental science & technology,2004,38(17):4572-4579.
[34] JONG MOON Y,VAN AKEN B,SCHNOOR J L.Leaching of contaminated leaves following uptake and phytoremediation of RDX,HMX,and TNT by poplar [J].International journal of phytoremediation,2006,8(1):81-94.
[35] CHEN D,LIU Z L,BANWART W.Concentration-dependent RDX uptake and remediation by crop plants [J].Environmental science and pollution research,2011,18(6):908-917.
[36] BEST E P H,GETER K N,TATEM H E,et al.Effects,transfer,and fate of RDX from aged soil in plants and worms [J].Chemosphere,2006,62(4):616-625.
[37] SICILIANO S D,GREER C W.Plant-bacterial combinations to phytoremediate soil contaminated with high concentrations of 2,4,6-trinitrotoluene [J].Journal of environmental quality,2000,29(1):311-316.
[38] WINFIELD L E,RODGER J H,D'SURNEY S J.The responses of selected terrestrial plants to short(<12 days)and long term(2,4 and 6 weeks)hexahydro-1,3,5-trinitro-1,3,5-triazine(RDX)exposure.Part I:Growth and developmental effects [J].Ecotoxicology,2004,13(4):335-347.
[39] VILA M,LORBER-PASCAL S,LAURENT F.Fate of RDX and TNT in agronomic plants [J].Environmental pollution,2007,148(1):148-154.
[40] SCHOENMUTH B,PESTEMER W.Dendroremediation of trinitrotoluene(TNT)Part 2:Fate of radio-labelled TNT in trees [J].Environmental science and pollution research,2004,11(5):331-339.
[41] SAMEERA SANKA B E.Uptake,distribution,and fate of RDX and MNX in dark green bulrush plants [D].Lubbock:Texas Tech University,2009.
[42] BRENTNER L B,MUKHERJI S T,WALSH S A,et al.Localization of hexahydro-1,3,5-trinitro-1,3,5-triazine(RDX)and 2,4,6-trinitrotoluene(TNT)in poplar and switchgrass plants using phosphor imager autoradiography [J].Environmental pollution,2010,158(2):470-475.
[43] BEST E P H,SMITH J C,RINGELBERG D B.Phytoremediation of composition-B derived TNT and RDX in herbaceous plant-vegetated and bare lysimeters[R].2009.
[44] TRAPP S,MIGLIORANZA K S B,MOSB K H.Sorption of lipophilic organic compounds to wood and implications for their environmental fate [J].Environmental science and technology,2001,35(8):1561-1566.
[46] BHADRA R,WAYMENT D G,HUGHES J B,et al.Confirmation of conjugation processes during TNT metabolism by axenic plant roots [J].Environmental science & technology,1998,33(3):446-452.
[47] BHADRA R,SPANGGORD R J,WAYMENT D G,et al.Characterization of oxidation products of TNT metabolism in aquatic phytoremediation systems ofMyriophyllumaquaticum[J].Environmental science & technology,1999,33(19):3354-3361.
[48] PODLIPN R,FIALOV Z,VANK T.Degradation of nitroesters by plant tissue cultures [J].Journal of hazardous materials,2010,184(1/2/3):591-596.
[49] VAN AKEN B,YOON J M,SCHNOOR J L.Biodegradation of nitro-substituted explosives 2,4,6-trinitrotoluene,hexahydro-1,3,5-trinitro-1,3,5-triazine,and octahydro-1,3,5,7-tetranitro-1,3,5-tetrazocine by a phytosymbioticMethylobacteriumsp.associated with poplar tissues(Populusdeltoides× nigra DN34)[J].Applied and environmental microbiology,2004,70(1):508-517.
Research Progress of the Environmental Fate of Explosive Compounds and Its Plant Function
YUAN Yuan
(Shanghai YIKE Green Engineering Co., Ltd., Shanghai 200433)
AbstractStarting from the physico-chemical properties of explosive compounds, we discussed its environmental transport and degradation potential. Research progress of the phytotoxicity of explosive compounds was emphatically discussed, as well as the concentration and degradation situation of explosive compounds in plant.
Key wordsExplosive compounds; Nitroaromatics; Nitramines; Nitrate esters; Absorption; Plant; Phytoremediation
作者简介袁园(1975-),女,上海人,工程师,博士,从事水处理及地下污染治理研究。
收稿日期2016-03-02
中图分类号S 181
文献标识码A
文章编号0517-6611(2016)11-079-05

