喀斯特小流域石灰土硫同位素组成特征及环境指示意义
张 伟, 张丽丽
(1. 贵州师范学院 地理与旅游学院, 贵州 贵阳 550018; 2. 中国科学院 地球化学研究所 环境地球化学国家重点实验室, 贵州贵阳 550081; 3. 中国科学院大学, 北京 100049)
0 引 言
以贵州为中心的岩溶地区是世界上最为典型的喀斯特地区, 同时也是酸沉降严重的地区[1], 大量高硫煤燃烧释放的 SO2氧化形成的硫酸是大气降水中主要的致酸物质[2]。近年来对位于典型喀斯特山区贵州普定县境内的监测显示, SO42–的硫湿沉降通量为 50~60 kg/(公顷·年), 这个范围与西欧和北美20世纪90年代酸沉降达到峰值时的硫沉降通量相当[3–4]。长期硫沉降导致土壤积累过量的硫酸盐, 这可能刺激植被和土壤生物对 SO42–的同化还原进而增加土壤有机硫含量[5–6], 同时也可能刺激微生物驱动的SO42–异化还原反应, 使得SO42–被还原形成还原态的硫化物。另一方面, 酸沉降下 SO42–淋溶程度会加大, SO42–淋溶伴随着土壤中碱性阳离子的流失,导致土壤酸化[7–8], 这会降低土壤质量, 影响地表水化学组成并最终加剧喀斯特地表生态系统的脆弱性。
石灰土是西南喀斯特山区碳酸盐岩基岩风化形成的主要土壤类型, 但已有研究多关注西南地区地带性土壤黄壤对酸沉降的环境响应, 如土壤 pH值和有机质储库及形态的变化[9–11], 目前对酸沉降下石灰土硫的生物地球化学迁移转化过程及其环境效应的关注是不足的。土壤硫同位素组成主要受硫源的硫同位素组成以及硫在循环转化过程中的同位素分馏控制, 蕴含丰富的土壤硫循环的信息[12–13]。因此, 硫同位素示踪作为研究土壤含硫物质迁移转化及其环境影响的手段而得到广泛应用[14–17]。本研究选择贵州普定陈旗和后寨河典型喀斯特小流域石灰土为代表, 通过对石灰土各形态硫含量及其硫同位素组成深度变化特征的分析, 阐明石灰土硫的迁移转化过程及其对酸沉降的响应, 以期加深对喀斯特地区土壤硫循环的认识, 为喀斯特石漠化生境恢复和治理提供基础科学依据。
1 材料与方法
1.1 研究区与样品采集
研究区位于贵州省普定县陈旗(26°15′33.90″N,105°46′38.41″E, 海拔 1324 m)和后寨河(26°16′59.56″N,105°40′47.36″E, 海拔 1159 m)小流域境内。普定县年均气温15.1 , ℃多年平均降水量1378 mm。研究区内具有典型的喀斯特峰丛洼地地貌特征, 坡地坡度多在 25°以上, 坡地土壤主要以黄色石灰土为主,土壤黏着性差且浅薄, 土层厚度一般不超过 60 cm,具备良好的区域代表性。样品采集时间为2013年6月, 选择研究区内自然坡地, 并选取坡地上小地形和植被类型相对均一的位置挖取土壤剖面, 剖面以10 cm间隔取样, 每个剖面从下至上采集样品, 以减少样品间的交叉污染。每个剖面采集约5个样品。样品采集后立即放入便携式冰箱 4 ℃保存, 所有样品经冷冻干燥处理, 并分别研磨过10目筛和100目筛供后续实验分析。采样具体情况见图1和表1。
1.2 实验部分
1.2.1 石灰土有机碳、黏粒、pH值和含水量测定
样品经盐酸处理后用 PE2400元素分析仪(PerkinElmer, USA)测定有机碳含量[18], 测试精度优于0.1%。利用筛分和静水沉降相结合的方法对石灰土颗粒组成进行分级, 确定黏粒(< 2 μm)含量分数[19]。用无CO2去离子水作浸提剂测定pH值, 浸提剂与石灰土的比例为2.5∶1。含水量用烘干法测定[6]。
1.2.2 石灰土各形态硫含量及硫同位素组成的测定
总硫含量用艾氏卡熔融 BaSO4重量法测定, 土壤总硫含量测定的BaSO4沉淀进一步用于总硫同位素分析[5,20]。用 0.016 mol/L KH2PO4溶液浸提[21],过滤后用离子色谱(DIONEX ICS-90)测定含量,测试精度优于0.01。随后, 滤液里加入10% BaCl2溶液生成BaSO4沉淀, 用于测定的硫同位素组成。
总还原态硫(Total Reducing Sulfur, TRS)用一步提取法浸提[22–23]。提取之后, 称重过的样品在三口烧瓶中用 HCl-CrCl2溶液处理, 土样中的还原态硫化物(主要是黄铁矿硫(FeS2-S))转化成 Ag2S,TRS含量用重量法分析, 随后 Ag2S沉淀用于 TRS同位素组成的测定[24]。

图1 贵州省安顺市普定县石灰土采样点位置图Fig.1 Map showing the location of the limestone soil sampling sites at Puding County, Guizhou Province

表1 普定县石灰土剖面采样情况Table 1 Field descriptions of the limestone soil profiles collected at Puding County
总硫含量减去硫酸盐态硫含量-S)和 TRS含量得到有机硫含量和TRS提取后的样品用与提取总硫同样的艾氏卡熔融BaSO4法测定有机硫的硫同位素组成[23]。硫同位素比值用连续流同位素质谱仪(CF-IRMS)测定, 所用标样为 GBW04414和GBW04415, 其分析结果用相对于国际标准CDT的δ34S表示, 每个样品至少平行测定两次, 测试精度优于±0.2‰。
2 结果与讨论
2.1 石灰土pH值、有机碳、C/S比、黏粒和水分含量
石灰土pH值、有机碳、C/S比、黏粒和水分含量的深度分布如图2所示。石灰土不同深度pH值介于7.0~7.3之间, 后寨河剖面pH值略高于陈旗剖面,pH值沿剖面深度加深变化不大。石灰土不同深度有机碳含量(质量分数)介于 2.6%~7.1%之间, 两个小流域剖面同一深度有机碳含量比例相差不大, 且均随着剖面深度加深急剧降低。石灰土不同深度 C/S比值介于 83.7~123.7之间, 两个小流域石灰土剖面同一深度 C/S比值相差不大, 且均随着剖面深度加深逐渐降低, 这与剖面不同深度有机质输入和矿化有关[2]。石灰土不同深度黏粒含量(质量分数)介于29.2%~33.4%之间, 两个小流域剖面同一深度黏粒含量比例相差不大, 且均随着剖面深度加深而有增加的趋势。石灰土不同深度水分含量(质量分数)介于28.7%~38.3%之间, 两个小流域剖面同一深度水分含量比例相差不大, 且均随着剖面深度加深而有降低的趋势。
2.2 石灰土各形态硫含量
石灰土总硫、-S、TRS和有机硫含量深度分布见图3。
在所采样剖面的各个深度, 有机硫都是石灰土硫的主要形态, 有机硫含量占总硫含量的 83.3%~93.1%。总体来看, 剖面表层有机硫占总硫比例较高,深层比例降低, 这主要是有机硫矿化的结果[25]。-S 和 TRS含量占总硫含量的比例较小, 分别介于 4.2%~7.3%和 1.9%~8.2%之间。剖面表层-S含量较高, 中层及底层-S含量逐渐降低, 而TRS含量有所增加, 这可能与异化还原有关。剖面中层至底层-S和TRS含量占总硫含量的比例有增加的趋势, 这一方面是上层淋溶迁移的结果, 另一方面是异化还原生成TRS有关, 也与有机硫持续矿化导致其含量降低有关。
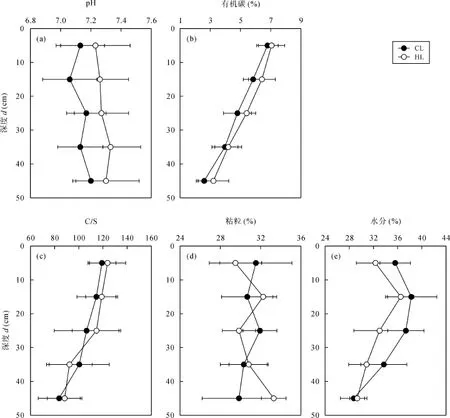
图2 石灰土剖面pH值、有机碳、C/S比、黏粒和水分含量的深度分布Fig. 2 Changes in soil pH value, organic carbon content, C/S ratio, clay content, and soil water content with increasing depth in limestone soil profiles数据点代表同一小流域采样的剖面所有相同深度样品的平均值。CL表示陈旗小流域石灰土; HL表示后寨河小流域石灰土。误差表示数据平均值的标准偏差。
2.3 有机硫形成与矿化
是生物同化吸收硫元素的主要形态[6], 形成的有机硫化物与的硫同位素比值相差不大,即生物同化吸收形成有机硫化物的过程基本不发生同位素分馏[26]。因此, 石灰土剖面表层与有机硫的δ34S值基本一致(图4)。
石灰土剖面中有机硫是土壤硫的主要形态, 从图3和图4可以看出, 随着剖面深度加深, 总硫和有机硫含量逐渐降低, 而总硫和有机硫的δ34S值逐渐增大, 底层土较表层土明显富集34S, 类似的现象在中欧一些地区土壤中也有发现[17,27], 这与有机硫的持续矿化有关。Normanet al.[28]对森林土壤的研究表明, 土壤有机硫的主要组分碳键硫的矿化及其产物有机硫酸盐的水解淋溶导致矿化剩余的碳键硫富集34S。Nováket al.[17]的研究也证明土壤剖面中有机硫组分的δ34S值随剖面深度加深而增大与有机硫(主要是碳键硫)的持续矿化有关。本研究石灰土剖面有机硫的持续矿化导致有机硫的含量随剖面深度加深而降低,但有机硫的δ34S值随剖面深度加深而增大(图 5)。
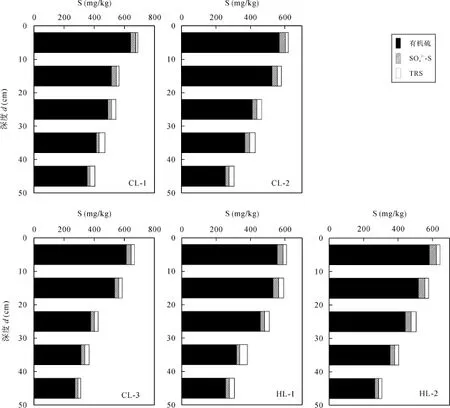
图3 石灰土硫含量的深度分布特征(总硫 = 有机硫 + -S + TRS)Fig.3 Depth distribution characteristics of sulfur contents in limestone soil profiles (Total sulfur equals to organic sulfur+-S+ TRS)
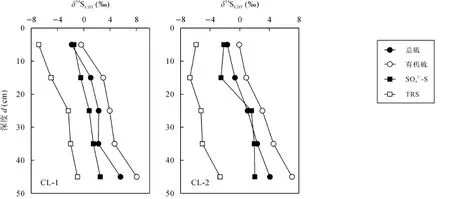

图4 石灰土剖面不同形态硫δ34S组成的深度分布特征Fig.4 Depth distribution characteristics of δ34S ratios of different sulfur forms in limestone soil profiles
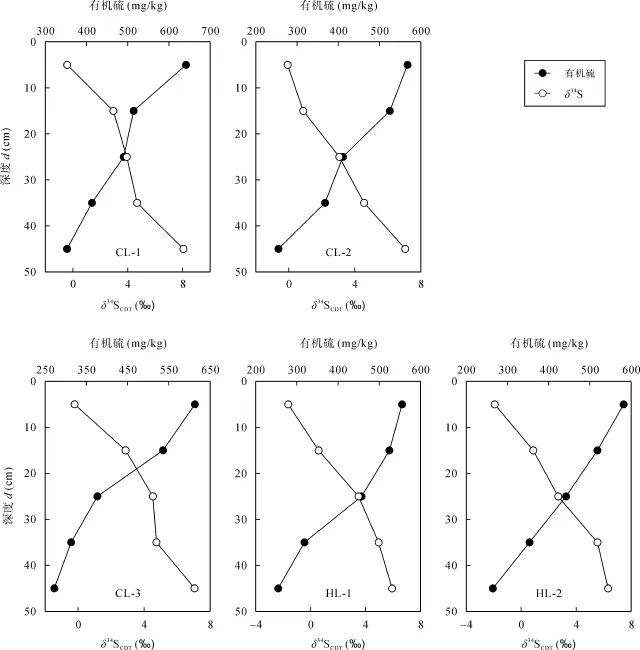
图5 石灰土剖面有机硫含量与有机硫δ34S组成的深度分布特征Fig.5 Depth distribution characteristics of organic sulfur contents and δ34S ratios of organic sulfur in limestone soil profiles
2.4 异化硫酸盐还原与TRS形成
石灰土剖面中生物同化吸收后剩余的可能在硫酸盐还原菌的作用下发生异化还原反应生成TRS[13,22]。研究表明,异化还原形成的TRS与相比, 明显亏损34S, 随着异化还原反应的持续进行,和TRS的δ34S值均随着反应的进行而逐渐增大[13,29]。本研究中, 相比石灰土中其他硫形态, TRS的δ34S值是最低的, 介于–6.86‰~–0.71‰之间(图4), TRS的δ34S值变化趋势是随剖面深度加深而增大, 但总是低于同层的δ34S值。图6和图7显示了S含量与的δ34S值以及TRS含量与TRS的δ34S值在石灰土剖面中的深度变化。从图6和图7可以看出,-S含量随剖面深度加深逐渐降低, 而TRS含量以及和TRS的δ34S值随剖面深度加深逐渐增大, 这指示石灰土剖面中发生的异化还原作用, 以及 TRS是异化还原反应的主要产物。在硫沉降条件下,石灰土可看作开放的环境系统, 来自大气沉降的不断取代被生物利用的那部分在持续的硫沉降、的异化还原反应以及在剖面中的淋溶的共同作用下,的δ34S值和 TRS的δ34S值之间的差异随剖面深度加深可能变化不大,这解释了石灰土剖面中的δ34S值和TRS的δ34S值随剖面深度加深而平行增大的现象(图4)。

图6 石灰土剖面-S含量及其δ34S组成的深度分布特征Fig.6 Depth distribution characteristics of-S contents and δ34S ratios o-S in limestone soil profiles
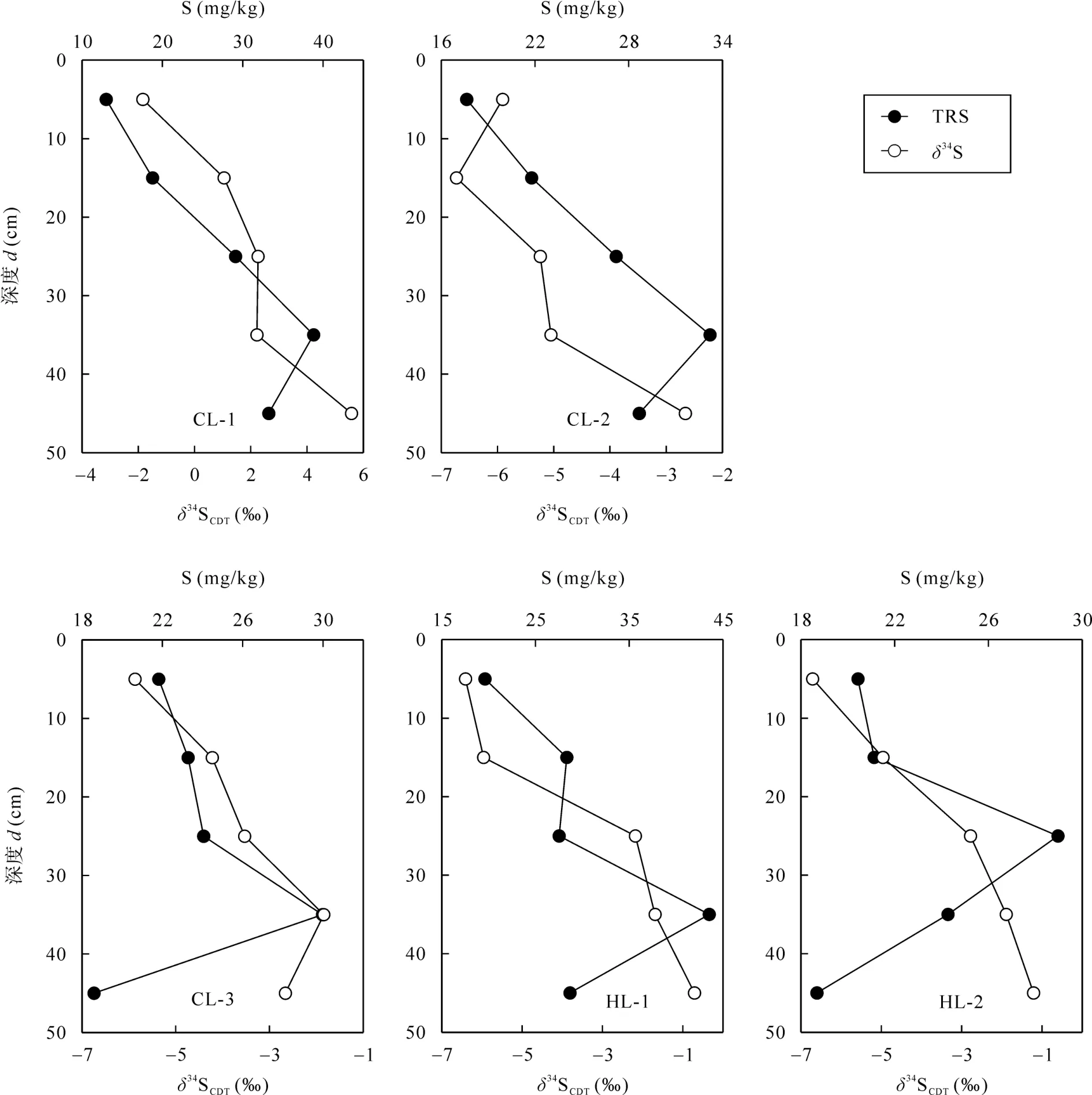
图7 石灰土剖面TRS含量及其δ34S组成的深度分布特征Fig.7 Depth distribution characteristics of TRS contents and δ34S ratios of TRS in limestone soil profiles
土壤中的异化还原反应的发生主要是厌氧的硫酸盐还原菌驱动的。石灰土中存在厌氧的生境可能与以下因素有关。首先, 石灰土样品采集时间为 6月末, 时值当地雨季, 以潮湿阴雨的天气为主。剖面表层样品的采集深度为从土壤表层向下约5 cm, 石灰土样品相对湿度较大(如图1所示)。雨季潮湿阴雨的天气条件可能导致石灰土剖面表层以下深度形成厌氧的生境条件, 使得厌氧的硫酸盐还原菌驱动的异化还原反应得以发生。其次, 研究表明, 某些硫酸盐还原菌(如脱硫微菌属)不是严格厌氧的细菌[30–31], 这可能也导致石灰土中不具备严格厌氧条件的生境中发生的异化还原反应, 尽管可能反应进行的速率不大。最后, 一些硫酸盐还原菌可以通过不同的方式制造缺氧甚至厌氧的小生境, 例如形成金属硫化物的聚合物颗粒[32–33], 这些颗粒通常形成于有机物颗粒附近, 在这个小生境内由于有机质的氧化分解而导致溶解氧被快速利用消耗掉[34]。在喀斯特小流域相对潮湿的石灰土中, 腐烂的植被根系和枯枝落叶残体可以提供有机质氧化分解的生境条件, 则可能在有机质快速分解的局部小生境内存在异化还原反应。综合来看,的δ34S值和TRS的δ34S值之间明显的差异以及两者随剖面加深而平行增大说明了石灰土中存在硫酸盐还原菌驱动的异化还原反应。石灰土剖面中有机碳和的含量随剖面加深而逐渐降低, 这可能导致剖面底层较低的异化还原速率, 进而导致TRS含量降低[35]。
2.5 迁移
石灰土剖面表层的δ34S值均为负值, 陈旗与后寨河小流域石灰土表层的δ34S值相差不多, 分别介于–2.15‰~ –1.34‰和–2.94‰~ –2.64‰之间, 这与普定大气降水的δ34S组成较为接近[3], 指示两个小流域有相同的大气沉降硫源。大气沉降输入的经历了同化吸收和异化还原之后,的吸附/解吸和淋溶过程是影响在石灰土剖面中分布的主要因素。土壤环境中的吸附/解吸主要受土壤pH值的影响[36]。石灰土剖面不同深度pH值均高于 7.0, 同时, 与黄壤相比, 石灰土中黏粒含量较低[3], 因此, 石灰土中的吸附基本是可以忽略的[36]。因此, 石灰土中经生物滞留(同化吸收形成有机硫和异化还原形成 TRS)后剩余的部分通过淋溶迁移进入地下水, 或者, 短暂滞留在剖面中的被解吸下来的先前吸附的所替代,导致在石灰土剖面中形成一个稳定的向下迁移的通量, 而由于异化还原反应的持续进行,导致的δ34S值随剖面加深而逐渐增大。因此,的生物滞留和淋溶迁移导致石灰土剖面中-S含量随剖面加深逐渐降低, 但的δ34S值随剖面加深逐渐增大(图6)。
2.6 石灰土酸化阶段
根据Prietzelet al.[36]关于土壤酸化的三阶段理论, 结合石灰土 pH值和黏粒含量等基本参数特征,本研究中陈旗和后寨河小流域石灰土剖面属于土壤酸化的第一个阶段。石灰土剖面不同深度平均 pH值均大于7.0, 并且黏粒含量也较低。较高的pH值和较低的黏粒含量不利于吸附。因此, 酸沉降输入的主要以有机硫和 TRS的形式滞留在石灰土, 生物滞留后剩余的大部分经淋溶迁移出土壤剖面。持续进行的的生物滞留和淋溶使得-S含量随剖面加深而降低, 但的δ34S值随剖面加深而增大。在石灰土剖面中的淋溶迁移会导致等当量的碱性阳离子迁移出土壤剖面, 但目前来看, 由于石灰土中丰富的钙镁元素含量,的迁移并没有导致石灰土 pH 值明显的降低[37], 石灰土处于土壤酸化的第一个阶段, 即没有酸化。
3 结 论
有机硫是石灰土主要的硫形态, 随剖面深度加深总硫和有机硫的δ34S值逐渐增大, 而其含量降低,这与有机硫持续矿化有关。相比其他硫形态, TRS具有最低的δ34S值, 同时,和TRS的δ34S值随剖面深度加深而平行地增大指示了石灰土中存在异化还原过程, 并且 TRS是主要产物。高 pH值和较低的黏粒含量不利于吸附,经生物滞留后剩余的部分主要通过淋溶而迁移出石灰土剖面。目前来看, 由于含有丰富的钙镁含量, 酸沉降下伴随淋溶迁移的碱性阳离子的淋失并没有引起土壤pH值的显著降低。但值得关注的是, 酸沉降输入的主要以有机硫形态滞留在石灰土中,吸附不是主要的硫滞留方式, 则在硫的年沉降速率大幅降低之后, 在较长时期内, 石灰土中有机硫的矿化可能释放大量的进入地表和地下水体, 由此引发的诸如土壤物理化学性质变化和水体化学组成改变等相关的环境效应值得关注。
:
[1] 刘丛强, 蒋颖魁, 陶发祥, 赟郎超, 李思亮. 西南喀斯特流域碳酸盐岩的硫酸侵蚀与碳循环[J]. 地球化学, 2008, 37(4):404–414.Liu Cong-qiang, Jiang Ying-kui, Tao Fa-xiang, Lang Yun-chao, Li Si-liang. Chemical weathering of carbonate rocks by sulfuric acid and the carbon cycling in Southwest China [J]. Geochimica, 2008, 37(4): 404–414 (in Chinese with English abstract).
[2] Wang Z Y, Zhang X S, Zhang Y, Wang Z, Mulder J. Accumulation of different sulfur fractions in Chinese forest soil under acid deposition [J]. J Environ Monitor, 2011, 13: 2463–2470.
[3] Zhang W, Liu C Q, Wang Z L, Zhang L L, Luo X Q. Speciation and isotopic composition of sulfur in limestone soil and yellow soil in karst areas, southwest China: Implications for different responses to acid deposition [J]. J Environ Qual,2014, 43: 809–819.
[4] Larssen T, Lydersen E, Tang D, He Y, Gao J X, Liu H Y, Seip H M, Vogt R D, Mulder J, Shao M, Wang Y H, Shang H,Zhang X S, Solberg S, Aas W, Økland T, Eilertsen O, Angell V,Liu Q R, Zhao D W, Xiang R J, Xiao J S, Luo J H. Acid rain in China [J].Environ Sci Technol, 2006, 40: 418–425.
[5] Alewell C, Novák M. Spotting zones of dissimilatory sulfate reduction in a forested catchment: The34S-35S approach [J].Environ Pollut, 2001, 112: 369–377.
[6] Likens G E, Driscoll C T, Buso D C, Mitchell M J, Lovett G M, Bailey S W, Siccama T G, Reiners W A, Alewell C. The biogeochemistry of sulfur at Hubbard Brook [J]. Biogeochemistry, 2002, 60: 235–316.
[7] Kirchner J W, Lydersen E. Base cation depletion and potential long-term acidif i cation of Norwegian catchments [J]. Environ Sci Technol, 1995, 29: 1953–1960.
[8] Driscoll C T, Driscoll K M, Mitchell M J, Raynal D J. Effects of acidic deposition on forest and aquatic ecosystems in New York State [J]. Environ Pollut, 2003, 123: 327–336.
[9] Guo J, Vogt R D, Zhang X, Zhang Y, Seip H M, Xiao J, Tang H. Aluminum mobilization from acidic forest soils in Leigongshan area, Southwestern China: Laboratory and field study [J]. Arch Environ Con Tox, 2006, 51: 321–328.
[10] Larssen T, Xiong J L, Vogt R D, Seip H M, Liao B, Zhao D.Studies of soils, soil water and stream water at a small catchment near Guiyang, China [J]. Water Air Soil Poll, 1998, 101:137–162.
[11] Liao B, Larssen T, Seip H M. Response of five Chinese forest soils to acidic inputs: batch experiment [J]. Geoderma, 1998,86: 295–316.
[12] 张伟, 刘丛强, 李晓东, 刘涛泽, 张丽丽. 喀斯特坡地土壤硫同位素变化指示的土壤硫循环[J]. 环境科学, 2010, 31(2):415–422.Zhang Wei, Liu Cong-qiang, Li Xiao-dong, Liu Tao-ze, Zhang Li-li. Sulfur istopic ratios indicating sulfur cycling in slope soils of karst areas [J]. Environ Sci, 2010, 31(2): 415-422 (in Chinese with English abstract).
[13] Krouse H R, Grinenko V A. Stable isotopes: Natural and anthropogenic sulphur in the environment [M]. England: John Wiley, 1991: 1–440.
[14] Kang P G, Mitchell M J, Mayer B, Campbell J L. Isotopic evidence for determining the sources of dissolved organic sulfur in a forested catchment [J]. Environ Sci Technol, 2014,48: 11259–11267.
[15] Zhao F Z, Knights J S, Hu Z Y, McGrath S P. Stable sulfur isotope ratios indicates long-term changes in sulfur deposition in the broadbalk experiments since 1845[J]. J Environ Qual,2003, 32: 33–39.
[16] Mörth C M, Torssander P, Kjønnas O J, Stunaes A O, Moldan F, Giesler R. Mineralization of organic sulfur delays recovery from anthropogenic acidification [J]. Environ Sci Technol,2005, 39: 5234–5240.
[17] Novák M, Kirchner J W, Fottova D, Prěchová E, Jăckvoá I,Krám P, Hruška J. Isotopic evidence for processes of sulfur retention/release in 13 forested catchments spanning a strong pollution gradient (Czech Republic, central Europe) [J]. Global Biogeochem Cy, 2005, 19(4): doi: 10.1029/ 2004GB002396.
[18] Midwood A J, Boutton T W. Soil carbonate decomposition by acid has little effect onδ13C of organic matter [J]. Soil Biol Biochem, 1998, 30: 1301–1307.
[19] Zhu S F, Liu C Q, Vertical patterns of stable carbon isotope in soils and particle-size fractions of karst areas, Southwest China [J]. Environ Earth Sci, 2006, 50: 1119–1127.
[20] Backlund K, Boman A, Fröjdö S, Ǻström M. An analytical procedure for determination of sulfur species and isotopes in boreal acid sulfate soils and sediments [J]. Agr Food Sci, 2005,14: 70–82.
[21] Prietzel J, Mayer B, Krouse H R, Rehfuess K E, Fritz P.Transformation of simulated wet sulfate deposition in forest soils assessed by a core experiment using stable sulfur isotopes [J]. Water Air Soil Poll, 1995, 79: 243–260.
[22] Fossing H, Jørgensen B B. Measurement of bacterial sulfate reduction in sediments: Evaluation of a single-step chromium reduction method [J]. Biogeochemistry, 1989, 8: 205–222.
[23] Bates A L, Spiker E C, Orem W H, Burnett W C. Speciation and isotopic composition of sulfur in sediments from Jellyfish Lake, Palau [J]. Chem Geol, 1993, 106: 63–76.
[24] Hall G E M, Pelchat J-C, Loop J. Separation and recovery of various sulphur species in sedimentary rocks for stable sulphur isotopic determination [J]. Chem Geol, 1988, 67: 35–45.
[25] Stevenson F J, Cole M A. Cycles of Soil: Carbon, Nitrogen,Phosphorus, Sulfur, Micronutrients [M]. 2nd ed. New York:John Wiley, 1999: 330–365.
[26] Novák M, Bottrell S H, Prechova E. Sulfur isotope inventories of atmospheric deposition, spruce forest floor and living Sphagnum along a NW-SE transect across Europe [J]. Biogeochemistry, 2001, 53: 23–50.
[27] Novák M, Buzek F, Harrison A F, Přechová E, Jačková I, Fottová D. Similarity between C, N and S stable isotope prof i les in European spruce forest soils: Implications for the use ofδ34S as a tracer [J]. Appl Geochem, 2003, 18: 765–779.
[28] Norman A L, Giesemann A, Krouse H R, Jäger H J. Sulphur isotope fractionation during sulphur mineralization: Results of an incubation-extraction experiment with a Black Forest soil [J].Soil Biol Biochem, 2002, 34: 1425–1438.
[29] Orr W L, White C M. Geochemistry of sulfur in fossil fuels[M]//Tuttle M L, Rice A C, Goldhaber M B. Geochemistry of Organic and Inorganic Sulfur in Ancient and Modern Lacustrine Environments: Case Studies of Fresh-Water and Saline Lakes. Washington D C: America Chemical Society, Syrup Ser,1990: 114–148.
[30] Teske A, Wawer C, Muyzer G, Ramsing N B. Distribution of sulfate-reducing bacteria in a Stratif i ed Fjord (Mariager Fjord,Denmark) as evaluated by most-probable-number counts and denaturing gradient gel electrophoresis of PCR-amplif i ed ribosomal DNA fragments [J]. Appl Environ Microbiol, 1996,62: 1405–1415.
[31] Jonkers H M, Koh I O, Behrend P. Muyzer G, de Beer D.Aerobic organic carbon mineralization by sulfate-reducing bacteria in the oxygen-saturated photic zone of a hypersaline microbial mat [J]. Microbial Ecol, 2005, 49: 291–300.
[32] Fukui M, Takii S. Survival of sulfate-reducing bacteria in oxic surface sediment of a seawater lake [J].FEMS Microbiol Lett,1990, 73: 317–322.
[33] Berthelin J. Developments in geochemistry[M]//Furusaka C,Nagatsuka N, Ishikuri S. Survival of Sulfate Reducing Bacteria in Oxic Layers of paddy soils. Amsterdam: Elsevier, 1991:259–264.
[34] Wind T, Conrad R. Sulfur compounds, potential turnover of sulfate and thiosulfate, and numbers of sulfate-reducing bacteria in planted and unplanted paddy soil [J]. FEMS Microbiol Ecol, 1995, 18: 257–266.
[35] Castro H F, Wiliams N H, Ogram A. Phylogeny of sulfate- reducing bacteria [J]. FEMS Microbiol Ecol, 2000, 31: 1–9.
[36] Prietzel J, Mayer B, Legge A H. Cumulative impact of 40 years of industrial sulfur emissions on a forest soil in west-central Alberta (Canada) [J]. Environ Pollut, 2004, 132:129–144.
[37] Larssen T, Duan L, Mulder J. Deposition and leaching of sulfur, nitrogen and calcium in four forested catchments in China:Implications for acidification [J]. Environ Sci Technol, 2011,45: 1192–1198.

