马索罗酚对实验性自身免疫性脑脊髓炎小鼠Th1/Th2细胞炎症因子平衡的影响
张彦博 王高宁 孔鹏 王梁 郭力 李彬
马索罗酚对实验性自身免疫性脑脊髓炎小鼠Th1/Th2细胞炎症因子平衡的影响
张彦博王高宁孔鹏王梁郭力李彬
050000河北医科大学第二医院神经内科 河北省神经病学重点实验室
摘要:目的探讨马索罗酚对实验性自身免疫性脑脊髓炎(EAE)小鼠白细胞介素-4(IL-4)、IL-12、干扰素-γ(IFN-γ)表达的调节作用。方法将8~10周雌性C57BL/6小鼠54只随机分成对照组、模型组、治疗组。每组再随机均分为发病后10 d及20 d亚组,每亚组9只。采用皮下注射髓鞘少突胶质细胞糖蛋白35-55(MOG35-55)多肽0.1 mL诱导EAE模型。自发病当天起,治疗组小鼠给予马索罗酚10 mg/(kg·d)治疗,模型组及对照组给予等量5%二甲基亚砜(DMSO)10 mL/(kg·d)处理。比较3组小鼠临床症状评分。应用实时定量PCR检测小鼠脊髓和脾组织中IL-4、IL-12、IFN-γ mRNA表达水平。应用ELISA检测脑组织中IL-4、IL-12、IFN-γ蛋白表达水平。结果与模型组比较,治疗组小鼠临床症状较减轻(P<0.05)。与模型组相比,治疗组小鼠10 d时脊髓和脾组织IL-12、IFN-γ mRNA表达水平降低(P<0.05),IL-4 mRNA水平增高(P<0.05),脑组织IL-12、IFN-γ蛋白水平降低(P<0.05),IL-4蛋白水平增高(P<0.05);与模型组相比,治疗组20 d时脊髓组织IL-12、IFN-γ mRNA表达水平降低(P<0.05),脑组织IFN-γ含量降低(P<0.05)。结论马索罗酚可能通过降低脑、脊髓及脾组织中IL-12、IFN-γ表达,增加IL-4表达,调节Th1/Th2细胞炎症因子平衡,进而改善EAE小鼠疾病严重程度。
关键词:马索罗酚;脑脊髓炎,自身免疫性,实验性;白细胞介素4;白细胞介素12;干扰素Ⅱ型
多发性硬化(multiple sclerosis,MS)是一种发生在脑和脊髓的以炎症反应、髓鞘脱失和轴索损伤为特征的自身免疫性疾病[1]。目前已有大量有关MS/实验性自身免疫性脑脊髓炎(EAE)发病机制的研究证明髓鞘激活的CD4+T细胞产生不同种类的促炎症及抗炎症因子,两者之间的变化决定了MS/EAE严重程度及病程[2-3]。马索罗酚(NDGA)是石炭酸灌木绿叶中提取的一种酚类化合物。既往研究表明NDGA通过调节Nrf2/Keap1/ARE通路参与抗氧化反应,具有促进肿瘤细胞凋亡和抗肿瘤作用,已应用于肿瘤治疗。此外,其在中枢系统变性疾病如阿尔茨海默病、帕金森综合征,以及缺血再灌注损伤等疾病中均具有保护作用[4]。本实验通过构建C57BL/6小鼠EAE模型,观察NDGA是否通过纠正Th1/Th2型细胞因子失衡以缓解EAE病情。
1材料和方法
1.1动物近交系SPF级雌性C57BL/6小鼠共54只,8~10周龄,体重18~20 g,购自北京维通利华实验动物公司。将小鼠随机分成对照组、模型组和治疗组。依据EAE模型达到发病高峰期(发病后10 d)及缓解期(发病后20 d)的时间[5],将各组再随机分为发病后10 d组及20 d组,各亚组为9只。
1.2主要试剂和材料 NDGA购自百灵威科技有限公司;髓鞘少突胶质细胞糖蛋白35-55(MOG35-55)购自西安霖肽生物科技有限公司;完全福氏佐剂购自美国Sigma公司;百日咳毒素购自ENZO corporation;结核菌素H37Ra,购自美国DIFICO corporation;All-in-OneTMFirst-Strand cDNA Synthesis Kit试剂盒以及All-in-OneTMqPCR Mix试剂盒购自复能基因公司;小鼠干扰素-γ(IFN-γ)、白细胞介素-4(IL-4)、IL-12定量分析酶联免疫检测试剂盒购自中国上海巧伊生物科技有限公司;实时定量PCR引物由赛百盛公司合成,序列如下:IFN-γ:上游5′-AGTGGCATAGATGTGGAAGAAAAGA-3′,下游5′-TCAGGTGTGATTCAATGACGCTTAT-3′;IL-12:上游5′-GGTGTCTTAGCCAGTCCCGA-3′,下游5′-GGTTTGGTCCCGTGTGATGT-3′;IL-4:上游5′-TCGTCTGTAGGGCTTCCAAGGTGCT-3′,下游5′-GTGGACTTGGACTCATTCATGGTGC-3′。
1.3方法
1.3.1EAE动物模型建立:按参考文献[5]方法制作EAE模型,给予小鼠皮下注射5 mg/mL MOG35-55多肽0.1 mL诱导EAE模型,对照组以相同方法给予等量生理盐水。以小鼠weaver评分≥1分为造模成功[6]。治疗组自发病(记为第0天)起给予腹腔注射NDGA溶液(1 mg NDGA溶于1 mL 5% DMSO)10 mg/(kg·d),模型组于发病起、对照组自EAE造模半数动物发病起给予同等体积5%DMSO 10 mL/(kg·d)处理。
1.3.2临床症状评分标准:于免疫当天起每天对小鼠称重并进行神经功能评分,神经功能评分采用weaver(15分)法[6],评分标准如下:尾巴:无症状0分,张力减低或远端瘫痪1分,全瘫2分;四肢:无症状0分,步态不稳1分,肢体轻瘫、行走时肢体拖曳2分,肢体全瘫,行走时肢体外翻3分。计算各部位评分总和,如小鼠死亡时计为15分。计算各组小鼠每天平均临床症状评分。
1.3.3组织取材:于注射NDGA或DMSO后10 d、20 d从各组随机取9只小鼠,置冰盘上迅速取脑、脊髓、脾,置液氮速冻,转移至-80℃冰箱备用。其中4只小鼠用于脊髓及脾组织细胞因子mRNA检测,5只小鼠用于脑组织细胞因子蛋白检测。
1.3.4实时荧光定量PCR检测mRNA表达水平:取小鼠脊髓及脾组织,用Trizol提取每个样本的总RNA,All-in-OneTMFirst-Strand cDNA Synthesis Kit 试剂盒反转录合成cDNA,根据All-in-OneTMqPCR Mix试剂盒说明书进行实时定量PCR 检测IL-4、IL-12、IFN-γ mRNA表达水平。GAPDH作为内参。扩增条件为:95℃预变性10 min;95℃变性10 s、58℃退火30 s、72℃延伸30 s,重复45个循环。70℃至95℃绘制熔解曲线。根据目的基因与内参基因的Ct 差值,计算IL-4、IL-12、IFN-γ mRNA相对表达量。
1.3.5ELISA方法检测蛋白表达水平:取小鼠脑组织,采用4℃混有蛋白酶抑制剂的0.1% PBS溶液制备10%脑组织匀浆液,并置4℃以2655g离心10 min。取上清液,按定量分析酶联免疫检测试剂盒说明书检测IL-4、IL-12、IFN-γ蛋白浓度。
1.4统计学处理 采用SPSS19.0进行数据分析,采用Shapiro-Wilk法对数据进行正态性检验,采用Levene法对数据进行方差齐性检验。计量资料以均数±标准差表示,多组均数组间比较应用单因素ANOVA分析,两两比较采用SNK-q检验。检验水准α=0.05。
2结果
2.1临床症状评分比较 模型组及治疗组小鼠免疫后全部发病,平均发病潜伏期分别为模型组(11.33±1.00)d,治疗组(11.44±1.23)d。主要临床症状表现为精神不振、体重下降、尾部远端无力下垂,伴有皮毛暗淡、食欲下降。模型组小鼠症状逐渐加重,出现步态不稳、后肢瘫痪、大小便失禁,严重者累及双前肢,进入缓解期后症状较前好转,肢体无力较前减轻,但仍遗留尾部及双后肢瘫痪。治疗组小鼠症状较EAE模型组轻,无累及前肢及大小便失禁者,恢复期仅遗留尾部瘫痪症状。对照组小鼠体重渐增,反应灵敏,尾部有张力。具体临床症状评分比较见图1。
2.2脊髓及脾组织IL-4、IL-12、IFN-γ mRNA表达发病10 d时,与对照组相比,模型组脊髓及脾组织IL-12、IFN-γ mRNA水平增高(P<0.05),IL-4 mRNA水平降低(P<0.05);与模型组相比,治疗组IL-12、IFN-γ mRNA水平降低(P<0.05),IL-4 mRNA水平增高(P<0.05)。发病20 d时,与对照组相比,模型组脊髓组织中IL-12、IFN-γ水平增高(P<0.05);与模型组相比,治疗组IL-12、IFN-γ水平降低(P<0.05)。具体结果见表1、2。
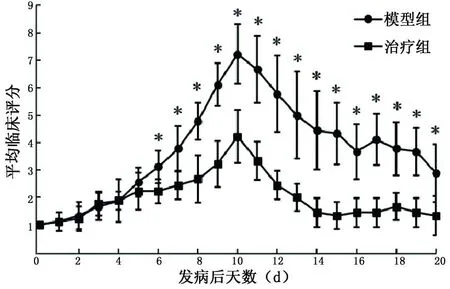
与模型组相比,*P<0.05
图1各组小鼠发病后不同时间weaver评分比较
2.3脑组织IL-4、IL-12、IFN-γ蛋白浓度测定 具体结果见表3。发病10 d时,与对照组对比,模型组脑组织IL-12、IFN-γ蛋白水平增高(P<0.05),IL-4蛋白水平降低(P<0.05);与模型组相比,治疗组IL-12、IFN-γ蛋白水平降低(P<0.05),IL-4蛋白水平增高(P<0.05)。发病20 d时,与对照组对比,模型组IFN-γ蛋白水平增高(P<0.05);与模型组相比,治疗组IFN-γ蛋白水平降低(P<0.05)。

表 1 实时定量PCR检测各组小鼠脊髓组织细胞炎症因子表达比较±s,n=4)
注:对照组相比,aP<0.05;与模型组相比,bP<0.05。表2、3同

表 2 实时定量PCR检测各组小鼠脾组织细胞炎症因子±s,n=4)
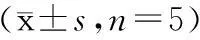
表 3 ELISA法检测各组小鼠脑组织细胞炎症因子蛋白水平比较
3讨论
EAE是一种由髓鞘特殊蛋白诱发的自身免疫疾病,主要特征为脱髓鞘和轴索破坏[7]。EAE 在病理生理及病程上模拟了人类MS疾病过程,已经成为研究MS的标准模型。本研究应用EAE模型探讨干预药物NDGA对EAE病程的影响及其在病理生理中可能的治疗机制。
NDGA具有抗炎、抗氧化双重作用。前者主要通过调节Nrf2/Keap1/ARE通路实现[8]。在对硫唑嘌呤诱发的肾病模型研究中,NDGA能够上调转化生长因子-β(TGF-β)的表达,从而改善肾功能,减少蛋白尿,通过调节免疫反应实现其抗炎功能[9]。在中枢神经系统病变研究中,NDGA能中断阿尔兹海默病中神经变性通路,减少淀粉样肽β神经毒性作用,发挥保护作用[10]。多项研究表明NDGA具有神经保护功能[11],提示NDGA在EAE中具有治疗潜能。
本实验应用NDGA干预EAE小鼠研究发现,治疗组小鼠症状评分明显减轻,表明NDGA可以改善EAE小鼠病情,对EAE产生保护作用;进一步通过实时定量PCR及ELISA实验方法对比两组小鼠IFN-γ、IL-12及IL-4 mRNA和蛋白表达水平结果显示,在发病急性期,与模型组相比,治疗组小鼠体内脊髓和脾组织炎症因子IL-12、IFN-γ mRNA水平降低,IL-4 mRNA水平增高,脑组织中IL-12、IFN-γ蛋白水平降低,IL-4蛋白水平增高;在缓解期,与模型组相比,治疗组脊髓组织IL-12、IFN-γ mRNA水平降低,脑组织中IFN-γ蛋白水平降低。在EAE病程中,初始T细胞在遇到抗原后,在不同条件下分化成不同类型的效应细胞亚群——Th1细胞及Th2细胞。IL-12是激活和促进Th1细胞成熟中重要的细胞因子,通过激活Th1细胞实现致炎作用[12]。当细胞环境中富集了IL-12和/或IFN-γ时,初始T细胞在转录因子T-bet驱动下分化成为Th1细胞,并且分泌IL-2、IL-12、IFN-γ、TNF-α等炎症因子,促进炎症反应[13]。IFN-γ是Th1细胞分泌的具有突出致炎作用的细胞因子。IFN-γ可以通过JAK12/STAT1通路促进信号转导,上调抗原呈递中的重要分子,如MHCⅡ和共刺激因子CD80和CD86,增强抗原递呈细胞功能,从而在MS中起到促进炎症反应作用[14-16]。相反,抗炎症因子IL-4在治疗组较模型组表达增高。IL-4在EAE中可上调转录因子GATA3和Stat6,促进初始T细胞向Th2细胞分化[17-18],分泌IL-4、IL-5、IL-10、IL-13等抗炎性细胞因子,抑制MS中的炎症反应[19-20]。
本实验发现应用NDGA干预显著下调了Th1型细胞因子IL-12、IFN-γ表达,上调了Th2型抗炎因子IL-4表达,提示NDGA可能是通过纠正Th1/Th2细胞因子失衡,并影响初始T细胞分化,从而改善EAE疾病严重程度。
参考文献:
[1]Miller E. Multiple sclerosis[J]. Adv Exp Med Biol, 2012, 724:222-238.
[2]李晓玲, 张博, 于春梅, 等. Th17/Treg细胞在复发缓解型多发性硬化中的表达[J]. 中国神经免疫学和神经病学杂志, 2015, 22(03):153-155.
[3]Kutzelnigg A, Lassmann H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases[J]. Handb Clin Neurol, 2014, 122: 15-58.
[4]Hernández-Damián J, Andérica-Romero AC, Pedraza-Chaverri J. Paradoxical cellular effects and biological role of the multifaceted compound nordihydroguaiaretic acid[J].Arch Pharm (Weinheim), 2014, 347(10): 685-697.
[5]Li B, Wei C, Jia L, et al. Sulforaphane ameliorates the development of experimental autoimmune encephalomyelitis by antagonizing oxidative stress and Th17-related inflammation in mice[J]. Exp Neurol, 2013, 250(4):239-249.
[6]Andrew W, Angelika GS, Robert K, et al. An elevated matrixmetalloproteinase (MMP) in an animal model of multiple sclerosis is protective by affecting Th1/Th2 polarization[J]. FASEB J,2005,19(12):1668-1670.
[7]Lebar R, Voisin GA. Use of water-soluble-adjuvant fraction from “Mycobacteriumsmegmatis” with encephalitogenic basic protein to induce autoimmune experimental allergic encephalomyelitis in guinea pigs (author’s transl) [J]. Ann Immunol (Paris), 1974,125(6):911-916.
[8]Soto-Acosta R, Bautista-Carbajal P, Syed GH, et al. Nordihydroguaiaretic acid (NDGA) inhibits replication and viral morphogenesis of dengue virus.[J]. Antiviral Res, 2014, 109(9):132-140.
[9]Lee DW, Kwak IS, Lee SB, et al. Effects of celecoxib and nordihydroguaiaretic acid on puromycinaminonucleoside-induced nephrosis in the rat[J]. J Korean Med Sci, 2009, 24(Suppl 1): S183-S188.
[10]Rojo AI, Medina-Campos ON, Rada P, et al. Signaling pathways activated by the phytochemical nordihydroguaiaretic acid contribute to a Keap1-independent regulation of Nrf2 stability: role of glycogen synthase kinase-3[J]. Free Radic Biol Med, 2012, 52(2): 473-487.
[11]Xue H, Zhang XY, Liu J M, et al. NDGA reduces secondary damage after spinal cord injury in rats via anti-inflammatory effects[J]. Brain Res, 2013, 1516(26):83-92.
[12]Yamamoto K, Shibata F, Miura O, et al. Physical interaction between interleukin-12 receptor β 2 subunit and Jak2 tyrosine kinase: Jak2 associates with cytoplasmic membrane-proximal region of interleukin-12 receptor β2 via amino-terminus[J]. Biochem Biophys Res Commun, 1999, 257(2): 400-404.
[13]Szabo SJ, Kim ST, Costa GL, et al. A novel transcription factor, T-bet, directs Th1 lineage commitment[J]. Cell, 2000, 100(6): 655-669.
[14]曹芳, 付锦. 对比干扰素β与醋酸格拉默治疗多发性硬化的新进展[J]. 中国神经免疫学和神经病学杂志, 2014,21(6):419-422.
[15]Briscoe J, Guschin D, Rogers NC, et al. JAKs, STATs and signal transduction in response to the interferons and other cytokines [and discussion] [J]. Philos Trans R SocLond B BiolSci, 1996, 351(1336): 167-171.
[16]Hashioka S, Klegeris A, Qing H, et al. STAT3 inhibitors attenuate interferon-γ-induced neurotoxicity and inflammatory molecule production by human astrocytes[J]. Neurobiol Dis, 2011, 41(2): 299-307.
[17]Zhou M, Ouyang W. The function role of GATA-3 in Th1 and Th2 differentiation[J]. Immunol Res, 2003, 28(1): 25-37.
[18]徐雁. 多发性硬化的生物学标记物[J]. 中国神经免疫学和神经病学杂志, 2013, 20(2):82-84.
[19]Gregory GD, Raju SS, Winandy S, et al. Mast cell IL-4 expression is regulated by Ikaros and influences encephalitogenic Th1 responses in EAE[J]. J Clin Invest, 2006, 116(5): 1327-1336.
[20]许贤豪. 多发性硬化及相关疾病研究的若干热点和挑战[J]. 中国神经免疫学和神经病学杂志, 2013, 20(2):77-78.
(本文编辑:时秋宽)
Effects of nordihydroguaiaretic acid on Th1/Th2 cytokine balance in experimental autoimmune encephalomyelitis mice
ZHANGYanbo,WANGGaoning,KONGPeng,WANGLiang,GUOLi,LIBin*.
*DepartmentofNeurology,theSecondHospitalofHebeiMedicalUniversity,KeyLaboratoryofHebeiNeurology,ShijiazhuangHebei050000,ChinaCorresponding author: LI Bin, Email:Jack511@163.com
ABSTRACT:ObjectiveTo explore the regulation effect of nordihydroguaiaretic acid(NDGA) on interleukin-4(IL-4), interleukin-12(IL-12) and interferon-gamma(IFN-γ) levels in experimental autoimmune encephalomyelitis (EAE) mice. MethodsFifty-four female C57BL/6 mice were randomly divided into 3 groups: the control, EAE and treatment groups. Each group was divided into 10 day and 20 day subgroups according to the onset time. There were 9 mice in each subgroup. In the EAE and treatment group, the EAE models were induced with 0.1 mL myelin oligodendrocyte glycoprotein35-55(MOG35-55)(5 mg/mL) by subcutaneous injection. Normal saline was used in the control group. The clinical scores of the mice were recorded and analyzed. For treatment, daily injection of NDGA at dose of 10 mg/(kg·d) was initiated on the day when clinical scores of mice≥1. The EAE group and the control groups were given 5% dimethyl sulphoxide(DMSO) at the dose of 10 mL/(kg·d). Clinical symptom scores of the three groups were compared. IL-4, IL-12, IFN-γ mRNA levels in the spinal cord and spleen were detected by qRT-PCR, and IL-4, IL-12, IFN-γ protein expression in the brain was detected by ELISA.ResultsCompared with the EAE group, the clinical score in the treatment group declined (P<0.05). Compared with the EAE group, the expression levels of IL-12, IFN-γ mRNA decreased in the spinal cord and spleen and IL-4 mRNA increased in the treatment group (P<0.05), the expression of IL-12 and IFN-γ in the brain decreased and IL-4 increased in the treatment group at 10 d(P<0.05).Compared with the EAE group, the expression levels of IL-12, IFN-γ in spinal cord decreased in the treatment group (P<0.05), and the expression level of IFN-γ in brain decreased at 20 d(P<0.05).ConclusionsNDGA attenuates disease severity by down-regulating the expression levels of IL-12 and IFN-γ and up-regulating IL-4 in the spinal cord, spleen and brain of EAE mice.
Key words:nordihydroguaiaretic acid; encephalomyelitis, autoimmune, experimental; interleukin-4; interleukin-6; interferon type Ⅱ
doi:10.3969/j.issn.1006-2963.2016.01.003
基金项目:国家自然科学基金资助项目(81100884)
通讯作者:李彬,Email:Jack511@163.com
中图分类号:R744.5+1
文献标识码:A
文章编号:1006-2963 (2016)01-0009-05
(收稿日期:2015-08-10)

