亚胺基咪唑离子液体合成及其铑配合物催化烯烃硅氢加成反应
厉嘉云,陈 锋,彭家建,白 赢,肖文军
(杭州师范大学有机硅化学及材料技术教育部重点实验室,浙江 杭州 311121)
亚胺基咪唑离子液体合成及其铑配合物催化烯烃硅氢加成反应
厉嘉云,陈锋,彭家建,白赢,肖文军
(杭州师范大学有机硅化学及材料技术教育部重点实验室,浙江 杭州 311121)
摘要:设计合成了一系列含亚胺氮配体-铑金属催化剂,并将其应用于硅氢加成反应中.结果表明,[Rh(cod)Cl]2-1a催化体系具有很高的催化活性与β选择性.
关键词:硅氢加成;含氮配体;铑金属催化剂
氮配位过渡金属配合物在硅氢加成的应用研究越来越深入,已经引起研究者广泛的兴趣,合成新颖、简单、可操作性强、具有高选择性氮配位过渡金属配合物是当今研究的重要方向[1-3].氮配体的设计则是氮配位金属配合物合成的关键部分,设计合理的含氮配体必将会促进氮配位的过渡金属配合物在硅氢加成反应的应用[4-7].
本文设计合成了一系列含亚胺结构的氮配体,它们与[Rh(cod)Cl]2配位在催化烯烃的硅氢加成反应中得到了很高的催化活性与选择性.
1实验部分
1.1主要实验方法
二氯甲烷与甲苯都经过氢化钙除水.苯乙烯用5%的氢氧化钠溶液清洗,并用无水硫酸钠干燥,过滤之后进行减压蒸馏.含氮配体及铑配合物都参照Frøseth的方法[3]合成.
1.2各种含氮配体的合成
1.2.11a~4a的合成

图1 含氮配体结构式Fig. 1 Geometric structure of nitrogen-containing ligands
1a~4a(结构式见图1)的合成方法类似,以1a的合成(图2)为例,主要实验步骤如下.
将苯甲酰氯0.02 mol(2 mL)注射到含2,6-二异丙基苯胺0.01 mol(1.8 mL)及30 mL无水二氯甲烷的两口瓶回流装置中,室温条件下无水无氧反应4 h后,减压蒸馏除去溶剂得到略带紫色的无色固体,乙醇重结晶,得到白色晶体,产率85%.取白色晶体0.01 mol(2.81 g)与5 mL二氯亚砜及30 mL无水二氯甲烷,无水无氧室温条件下反应24 h后,110 ℃常压蒸馏除去溶剂及未反应完全的二氯亚砜,蒸馏后的产物用正戊烷洗涤3次,每次15 mL,洗液旋干得到淡黄色的液体[1-2],产率90%.取0.012 mol(0.1 mL)N-甲基咪唑、0.01 mol(3 g)黄色液体及30 mL无水甲苯放于史莱克瓶中,在室温、无水无氧条件下反应36 h,所得混合溶液进行抽滤,得到的固体用乙醚洗涤数次,用正己烷与二氯甲烷混合溶剂重结晶,得到白色晶体1a(3-(1-苯基亚胺基-2,6-二异丙基苯基)-1-甲基咪唑鎓氯化物)[3],收率65%.1H NMR (400 MHz, CDCl3)δ: 10.14(s,1H,NCHN), 8.18(s,1H,NCHCHN near-N-Me),7.98(1H,NCHCHN near imine),7.55~7.40(m, 5H, Ph-H), 7.11(m,3H,aryl-H of DIPP),4.42(s,3H,NCH3),2.81(m,2H,CHMe2),1.28(d,J= 6.8 Hz, 6H, CHMe2).13C NMR(131 MHz,CDCl3) δ: 140.2(cipso,Ph),137.7(Co-DiPP),138.9(NCN),124.9(NCCN near N-Me),123.3(Cm,DiPP),119.3(NCCN near imine),37.7(NCH3),24.8(CHMe2),13.6(CHMe2). IR(cm-1,KBr):1 673,1 648,1 534.

图2 亚胺配体1a~4a的合成线路Fig. 2 Synthesis of 1a~4a
2a:3-(1-苯基亚胺基-2, 4, 6-三甲基苯基)-1-甲基咪唑鎓氯化物,收率 75%.1H NMR (400 MHz,CDCl3)δ:10.19(s,1H,NCHN),7.96~7.93(m,1H,NCHCHN),7.80(brs,1H,NCHCHN),7.45~7.32(m,5H,Ph-H),6.94(s,2H,Dep-H),3.78(s,3H,NCH3),2.34(t,J=6.8 Hz, 9H,3Me).13C NMR (CDCl3)δ:137,123.4,122.8(NCHN),140.6,138.8(Ph-CH),130.7(Ph-CH),122.2(Ph-CH),129.3(Dep-CH),128.3(Dep-CH),123.4(NCHCHN),122.6(NCHCHN),37.5(NCH3),21.8(CH3),13.6(CH3). IR(cm-1,CH2Cl2):1 675(imine),1 638,1 515.
3a:3-(1-苯基亚胺基-对甲基苯基)-1-异丙基咪唑鎓氯化物,收率81%.1H NMR(400 MHz,CDCl3)δ:10.25(s,1H,NCHN),8.13~7.97(m,1H,NCHCHN),7.76(brs,1H,NCHCHN),7.45~7.34(m,5H,Ph-H),7.58(s,2H,Dep-H),1.62(s,6H,N-CHMe2),5.48~5.45(m,1H,N-CHMe2),7.88(s,2H,Dep-H),2.19(s,3H,Dep-CH3).13C NMR(CDCl3)δ:140.8,142.4,138.9(NCHN),133.6,131.1(Ph-CH),128.5(Ph-CH),128.2(Ph-CH),131.3(Dep-CH),123.3(Dep-CH),125.0(NCHCHN),119.6(NCHCHN),37.6(NHCHMe2), 22.6(NHCHMe2).IR(cm-1,CH2Cl2):1 673(imine), 1 639,1 515.
4a:3-(1-苯基亚胺基-2,6-二甲基苯基)-1-甲基咪唑鎓氯化物,收率90%.1H NMR (400 MHz,CDCl3)δ:10.01(s,1H,NCHN),8.01~7.97(m,1H,NCHCHN),7.88(brs,1H,NCHCHN),7.55~7.30(m,5H,Ph-H),6.88(s,3H,Dep-H),4.30(s,3H,NCH3),1.96(s,6H,Dep-Me).13C NMR(CDCl3)δ:147.8,142.4,138.9(NCHN),132.6,132.1(Ph-CH),129.5(Ph-CH),129.2(Ph-CH),126.3(Dep-CH),125.3(Dep-CH),125.0(NCHCHN),119.6(NCHCHN),37.6(NCH3),24.8(CH2CH3),13.6(CH2CH3). IR(cm-1,CH2Cl2):1 670(imine), 1 641,1 505.
1.2.25a的合成
配体5a的合成步骤(图3)如下:在干燥的两口瓶加入2.49 g(30 mmol)N-甲基咪唑与2.82 g 1, 2-二溴乙烷.加入20 mL乙腈为溶剂,在80 ℃回流3 d.所得产物过滤,固体用四氢呋喃洗涤3次,每次10 mL,所得固体60 ℃真空干燥,得到无色晶体5a[5].

图3 配体5a的合成线路Fig. 3 Synthesis of 5a
5a:1, 2-二[N-(N’-甲基咪唑)]乙烷盐,收率47%.1H NMR(400 MHz,acetone-d6)δ:2.05(t,J= 7.4H,4H),4.01(s,6H),4.41(s,4H),7.66(t,J= 2.2H,2H),7.68(t,J= 2.2H,2H),8.86(s,2H).13C NMR(131 MHz,acetone-d6) δ: 26.7,35.9,49.0,122.6,124.2,136.7.
1.3氮配位-铑配合物催化硅氢加成反应
用Frøseth等的方法[3]合成氮配位-铑配合物,将制备得到的含氮配体-铑配合物作为硅氢加成反应的催化剂,用于催化烯烃的硅氢加成反应(图4).在90 ℃下,向10 mL的反应瓶中加入40 mmol 烯烃、44 mmol 三乙氧基硅烷和一定量含亚胺结构类配体-铑配合物催化体系,继续搅拌6 h,然后停止反应,待其降到室温.
催化后产物用GC9800型气相色谱仪分析,确定烯烃的转化率和产物选择性,填充柱的规格是SE-30 m×2.5 mm×0.25 μm,氢气为载气,流速:1 mL/min;柱升温程序:初温50 ℃,维持1 min,以10 ℃/min 升至100 ℃,然后以25 ℃/min 升至250 ℃,进样口温度为250 ℃.分析结果由2010型色谱数据处理软件按面积归一化法计算.所有结果均为3次独立实验的平均值.

图4 烯烃的硅氢加成反应Fig. 4 Hydrosilylation reaction of alkenes
1.4合成讨论
实验中合成了一系列含氮化合物(1a~5a),其中1a~4a为席夫碱类含氮化合物,5a为咪唑类含氮化合物.对反应产物(1a~5a)结构进行了核磁和红外表征,其表征结果与理论结果相符.
2含氮配体-铑配合物催化烯烃和三乙氧基硅烷反应的研究
2.1温度对催化苯乙烯和三乙氧基硅烷反应的影响
表1显示了反应温度对含氮配体-[Rh(cod) Cl]2催化体系催化苯乙烯与三乙(氧)基氢硅烷硅氢加成反应的影响.以[Rh(cod) Cl]2-1a催化体系为例,研究发现,当反应温度为90 ℃时,催化剂体系有极高的苯乙烯转化率和β加成物的选择性,当反应温度高于90 ℃,苯乙烯的转化率随反应温度升高而提高,但是β加成产物的选择性随温度降低而降低.最佳的反应温度在90 ℃.

表1 温度对催化苯乙烯和三乙氧基硅烷反应的影响
反应条件:苯乙烯4 mmol,三乙氧氢硅烷4.4 mmol,催化剂[Rh(cod) Cl]2-1a 0.32 mol%,90 ℃,6 h.
2.2不同催化用量对苯乙烯与三乙氧基硅烷反应的影响
催化剂铑化合物的用量对苯乙烯和三乙(氧)基氢硅烷硅氢加成反应的影响见表2.可以发现,当催化剂Rh的催化用量为苯乙烯摩尔用量的0.32%时,催化体系[Rh(cod) Cl]2-1a表现出极高的催化活性与β加成物的选择性.由此,笔者确认催化体系所用的最佳催化条件为90 ℃,催化剂Rh的催化用量为苯乙烯摩尔用量的0.32%.

表2 不同催化用量的[Rh(cod) Cl]2-1a催化体系对硅氢加成反应的影响
反应条件:苯乙烯4 mmol,三乙氧基硅烷4.4 mmol,催化剂[Rh(cod) Cl]2-1a, 90 ℃,6 h.
2.3不同氮配位铑配合物在烯烃硅氢加成反应的应用研究
由表3数据证明,1a,2a,4a分别与[Rh(cod)Cl]2形成的催化体系,在烯烃硅氢加成反应中有极高的β选择性和苯乙烯的转化率.这可能与亚胺结构连接氮原子的苯环上的取代基有关,2,6的取代基影响作用大于4位的取代基.而不含亚胺结构的5a与[Rh(cod)Cl]2形成的催化体系催化三乙基硅烷与苯乙烯的硅氢加成反应得到比较低的催化活性及选择性.这可能与亚胺结构与[Rh(cod)Cl]2更易配位有关系.
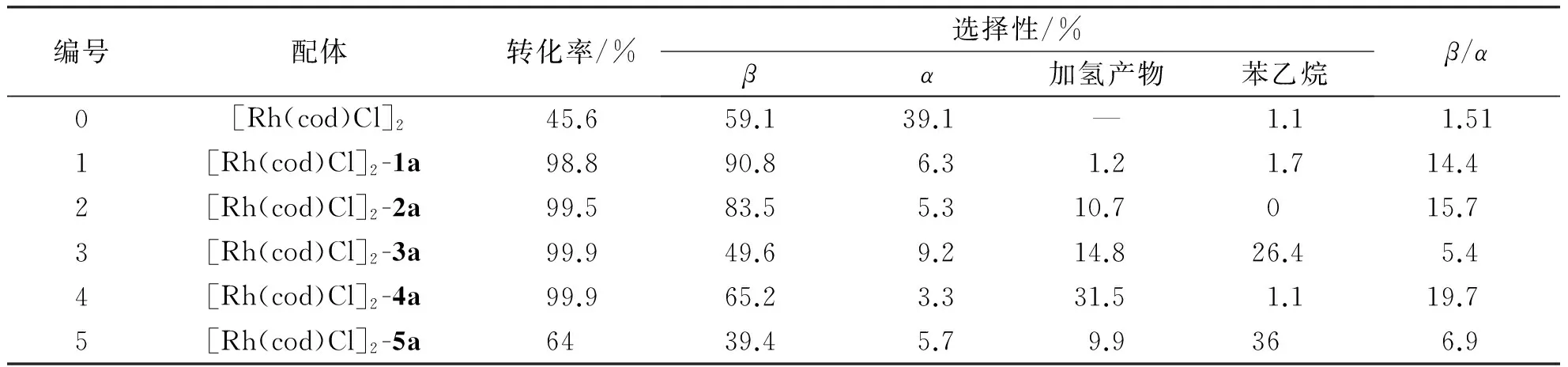
表3 不同配体对三乙基硅烷与苯乙烯的催化活性研究
反应条件:苯乙烯4 mmol,三乙氧基硅氢烷4.4 mmol,催化剂0.32 mol%(根据苯乙烯的用量),90 ℃,6 h.
2.4含不同取代基的苯乙烯与三乙氧基硅烷的应用研究
本研究测试了含氮配体-[Rh(cod) Cl]2催化含不同取代基的苯乙烯与三乙氧基氢硅烷的硅氢加成反应,结果见表4.以[Rh(cod)Cl]2-1a催化体系为例,当苯乙烯苯环上含有不同取代基团,苯乙烯苯环上的取代基会抑制产物向生成高效β产物方向移动,不利于β产物的生成.
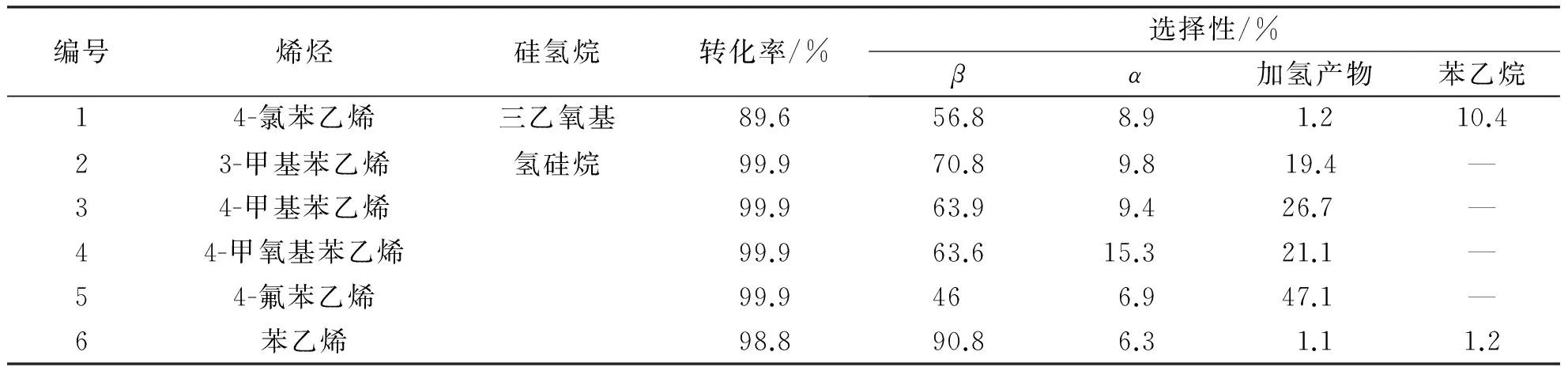
表4 含不同烯烃与三乙氧基硅烷的影响
反应条件:苯乙烯4.0 mmol,三乙氧基硅烷4.4 mmol,催化剂[Rh(cod) Cl]2-1a 0.32 mol%(相对苯乙烯),90 ℃,6 h.
2.5催化不同硅烷与苯乙烯的硅氢加成反应的应用研究
表5研究了含氮配体-[Rh(cod)Cl]2催化苯乙烯与含不同取代基的含氢硅烷的硅氢加成反应.以[Rh(cod)Cl]2-1a催化体系为例,三乙基硅氢烷或者三乙氧基硅氢烷与苯乙烯的硅氢加成反应有极高的催化活性与β选择性,尤其是催化三乙基硅烷与苯乙烯的硅氢加成反应有很高的催化活性与较高的β选择性,这可能与硅烷的烷基取代基有关.
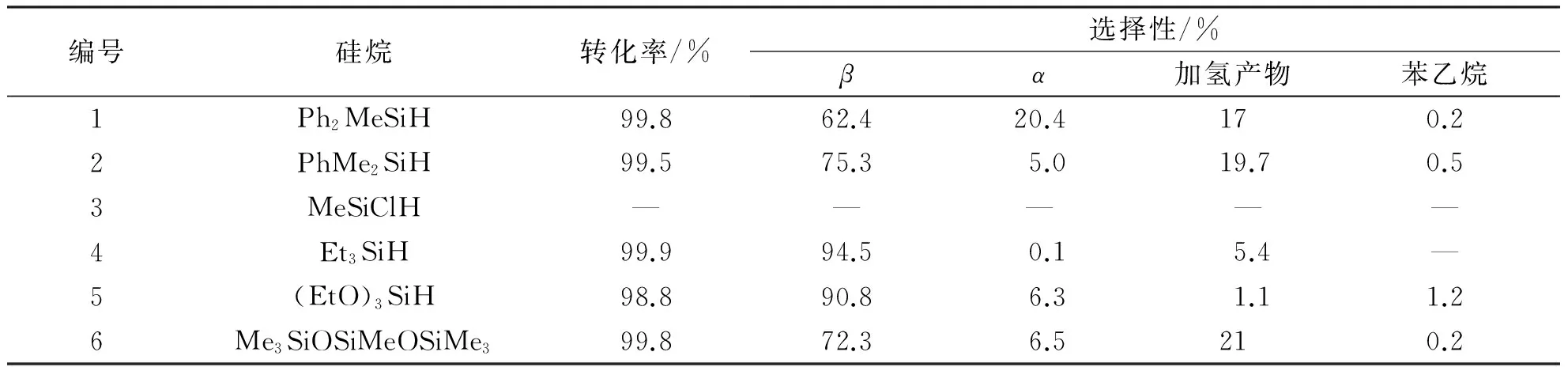
表5 催化不同硅烷与苯乙烯的硅氢加成反应的应用研究
反应条件:苯乙烯4.0 mmol,硅烷4.4 mmol,催化剂[Rh(cod) Cl]2-1a 0.32 mol%(相对苯乙烯),6 h.
3结论
研究表明,90 ℃、0.32%催化用量(相对于苯乙烯的量)的催化体系是催化硅氢加成反应的最佳催化条件.含有亚胺结构的铑配合物的催化活性普遍比无亚胺铑配合物的催化活性高. [Rh(cod) Cl]2-1a催化体系具有很高的催化活性与β选择性,研究价值较高.研究结果同时表明,亚胺结构中2,6位含取代基有助于提高烯烃硅氢加成反应中β加成产物的选择性.
参考文献:
[1] ROSENBERG M L, LANGSETH E, KRIVOKAPIC A, et al. Investigation of ligand steric effects on a highlycis-selective Rh(I) cyclopropanation catalyst[J]. New J Chem,2011,35(10):2306-2313.
[2] SASAMORI T, MATSUMOTO T, TOKITOH N. Synthesis of rhodium-carbonyl complexes bearing a novel P,N-chelating ligand of Schiff-base type[J]. Polyhedron,2010,29(1):425-433.
[3] FR∅SETH M, NETLAND K A, R∅MMING C, et al. Synthesis and characterization of novel Pd(II) and Pt(II) complexes with 5-ring chelating iminoylcarbene ligands[J]. J Organomet Chem,2005,690(24/25):6125-6132.
[4] GUO X Q, WANG Y N, WANG D, et al. Palladium, iridium and ruthenium complexes with acyclic imino-N-heterocyclic carbenes and their application in aqua-phase Suzuki-Miyaura cross-coupling reaction and transfer hydrogenation[J]. Dalton Trans,2012,41(48):14557-14567.
[5] LEE M, NIU Z B, SLEBODNICK C, et al. Structure and properties of N,N-alkylene Bis(N′-alkylimidazolium) salts[J]. J Phys Chem B,2010,114(21):7312-7319.
[6] FR∅SETH M, NETLAND K A, TÖRNROOS K W, et al. Synthesis and characterization of novel Pd(II) complexes with chelating and non-chelating heterocyclic iminocarbene ligands[J]. Dalton Trans,2005(9):1664-1674.
[7] STEINER G, KRAJETE A, KOPACKA H, et al. [1,2]-Rearrangement of imino-N-heterocyclic carbene:synthesis and structures of chelating iminoimidazole Pd and Ni complexes[J]. Eur J Inorg Chem,2004(14):2827-2836.
Effect of Amino Imidazole Ionic Liquid on the Rhodium Catalyzed Hydrosilylation of Alkene
LI Jiayun, CHEN Feng, PENG Jiajian, BAI Ying, XIAO Wenjun
(Key Laboratory of Organosilicon Chemistry and Material Technology of Ministry of Education, Hangzhou Normal University,Hangzhou 311121, China)
Abstract:As well as transition a series of Rh catalyst containing amino nitrogen ligands was synthesized and applied into hydrosilylation reaction. The results showed that [Rh(cod)Cl]2-1a exhibited excellent catalytic activity and β selectivity.
Key words:hydrosilylation; nitrogen-containing ligands; Rh catalyst
收稿日期:2016-03-21
基金项目:国家自然科学青年基金项目(21303034,21203049);浙江省自然科学基金项目(LY14B030007).
通信作者:彭家建(1966—),男,研究员,主要从事绿色催化研究.E-mail:jjpeng@hznu.edu.cn
doi:10.3969/j.issn.1674-232X.2016.03.001
中图分类号:TQ426.6
文献标志码:A
文章编号:1674-232X(2016)03-0225-05

