活性污泥耐盐降解邻氯苯酚特性及群落结构分析
吴志明, 孙志远, 李 辉, 刘勇弟
(华东理工大学资源与环境工程学院,上海 200237)
活性污泥耐盐降解邻氯苯酚特性及群落结构分析
吴志明,孙志远,李辉,刘勇弟
(华东理工大学资源与环境工程学院,上海 200237)
摘要:采用SBR反应器驯化中度嗜盐菌为主的活性污泥,高效处理高盐邻氯苯酚(2-CP)废水。不同盐度的驯化结果表明,当NaCl质量浓度为10~80 g/L时,2-CP和COD的去除率均达到91%。当NaCl质量浓度为80 g/L,2-CP质量浓度在1 000 mg/L以上时,去除率可以维持在98%,反应器达到最佳处理效果。在此条件下,活性污泥胞外聚合物(EPS)的含量最高达到142.6 mg/g。随着盐度升高,EPS中的多糖含量也随之增加。采用显微镜和扫描电镜(SEM)观察,发现在高盐条件下,活性污泥中大部分微生物呈现球状,且菌群有自发聚集的趋势。16S rRNA基因文库分析表明,产碱杆菌是污泥中的优势菌群,它属于变形菌门。PCR扩增和测序分析2-CP降解途径的关键酶基因,发现羟化酶、氯代邻苯二酚1,2-双加氧酶和氯代邻苯二酚2,3-双加氧酶同时存在于活性污泥系统中,表明该活性污泥可能具有多样的2-CP降解途径。
关键词:高盐废水; 邻氯苯酚; 活性污泥; 中度嗜盐菌; 降解途径
许多行业如肉类罐头、蔬菜罐头、橄榄油制造厂、石油、石油化学产品、农产品、海产品加工、酸洗、干酪加工不仅会产生高盐废水,还会排放各种不同的有机物[1-2]。酚类化合物在橄榄油制造厂、制革厂、炼油厂、造纸厂等高盐废水中是普遍的污染物,质量浓度从几毫克每升到数百毫克每升[3-6]。使用传统的物理、化学、物理化学方法,如吸附法、离子交换法、液-液萃取法、化学氧化法以及高级氧化工艺虽能有效去除氯酚,但是这些方法耗费高,也可能产生有害的副产物而危害环境[7-8]。生物法较之物理法和化学法有着经济、高效的优点,可以实现氯酚类物质的无害化处理[9]。但是,高盐会极大地抑制氯酚类物质的生物降解,会影响微生物细胞的代谢速率[10]。Moussavi等[11]在缺氧反应器降解邻氯苯酚研究中发现,当NaCl质量浓度从20 g/L上升到40 g/L时,邻氯苯酚的平均去除率迅速从99%降低到10%以下。Alva等[12]发现NaCl质量浓度在25~150 g/L范围内苯酚降解中间产物顺-顺-粘康酸会有少量的累积。所以,利用传统微生物处理高盐有机废水存在一些困难,通过驯化培养出中度嗜盐菌或者直接投加中度嗜盐菌将是切之可行的方法[13-15]。Moussavi等[16]在好氧颗粒活性污泥(SBR)反应器中通过驯化耐盐或者嗜盐的微生物菌群实现了在高达8%的盐度下对1 000 mg/L苯酚的去除率达到了99%左右。近年来研究者们通过固定化细胞(颗粒化技术)或者生物膜技术都实现了邻氯苯酚或者苯酚的有效去除[11,17],但是生物膜法对于生物膜厚度、溶解氧浓度以及pH的控制是实际运行中的难题[18],而且好氧颗粒曝气耗费高,同时高强度的曝气也会使氯酚更多地挥发进入大气[11]。而活性污泥SBR作为一种悬浮培养系统,它的优势就在于其更好的可控性和操作性,可以通过调节水力停留时间(HRT)实现氯酚类物质的无害化处理以及改善污泥的沉降性能[19-20]。因此,应用活性污泥SBR法处理含高盐度氯酚废水仍然存在着优势。
本文主要探究了不同盐度下活性污泥对邻氯苯酚的降解特性,分析不同盐度下微生物的好氧呼吸速率及活性变化,同时研究污泥胞外聚合物EPS在不同盐度下的分泌特性,尤其是EPS中多糖和蛋白质的含量变化,结合污泥在高盐环境中的微生物相特征,揭示活性污泥应对高盐环境的生理特性。利用16S rRNA分子生物学手段分析耐盐降解邻氯苯酚的中度嗜盐菌群的群落结构,并通过检测邻氯苯酚降解的相关酶基因,阐明该菌群对邻氯苯酚的代谢途径。
1材料与方法
1.1SBR实验装置
本文活性污泥(SBR)的有效容积为2 L,系统采用鼓风曝气,以黏砂块作为曝气头,压缩空气由曝气泵提供,空气流量为2 L/min。反应器温度(28±2) ℃。初始SBR周期T=12 h,进水2 min,曝气656 min,沉降30 min,排水2 min,闲置30 min。每周期进水800 mL,排水800 mL,即容积交换率为40%。初始水力停留时间(HRT)为30 h(HRT等于操作周期时间与容积交换率的比值[21])。本文定义每12 h为一个操作单元,每一个操作单元根据实际邻氯苯酚(2-CP)及COD降解情况,确定是否进水或者排水,灵活控制操作周期。SBR完成一次循环的时间代表一个操作周期。如SBR一个操作周期T=36 h,即包含3个操作单元,那么只在第1个操作单元初始进水,排水只在第3个操作单元污泥沉降30 min后进行。每个操作单元曝气时间固定为656 min,污泥沉降30 min后取10 mL水样测定2-CP及COD,随后闲置30 min左右直到重新开始曝气。
1.2SBR反应器启动
本文活性污泥来自上海高桥石油石化二厂生化池的剩余污泥。初始接种污泥440 mL,污泥质量浓度6.0 g/L。污泥沉降比(SV30)为55%,污泥体积指数(SVI)为92 mL/g。经过3 d空曝去除污泥中本底有机物,开始向SBR进水。模拟废水主要成分为葡萄糖0~1.0 g/L,KH2PO41.35 g/L,K2HPO4·H2O 2.16 g/L,NH4Cl 0.20 g/L,MgSO4·7H2O 0.13 g/L,每升模拟废水中加入1 mL的微量元素[22]。
首先在不加NaCl的情况下,进水葡萄糖质量浓度固定为0.4 g/L,2-CP质量浓度依次经过50,100,200,300,400,500 mg/L逐步升高,对污泥进行了约38 d的连续驯化。此驯化过程每隔12 h测定出水中的2-CP,当连续2个操作周期以上2-CP的去除率达到88%以上时就开始升高2-CP质量浓度,若多个操作周期未达到88%以上的2-CP去除率,则可适当增加操作周期。在SBR高盐运行阶段也按照此方法确定操作周期。经过此驯化后,污泥质量浓度增加到6.5 g/L,污泥SV30略有升高达到60%左右。稳定驯化结果表明,邻氯苯酚最多需要36 h就可达88%以上的去除率,而COD去除率也在87%以上。
1.3SBR运行参数
前期经过不同2-CP质量浓度(50~500 mg/L)进行驯化后,开始逐步提高SBR反应器中NaCl的质量浓度(10~80 g/L),每一个盐度下2-CP质量浓度从125~1 000 mg/L逐步升高,进水葡萄糖质量浓度固定为1 000 mg/L,主要的实验参数变化如表1所示。
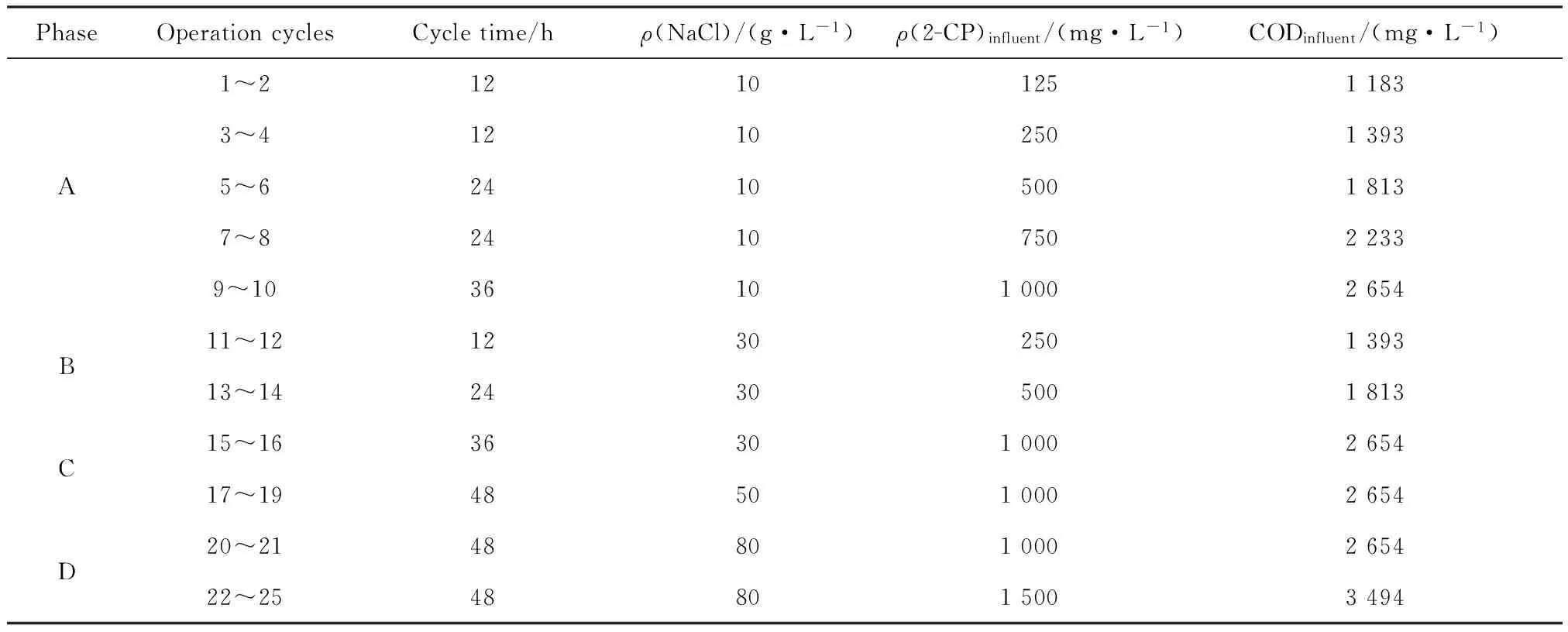
表1 SBR反应器高盐驯化阶段运行参数
1.4分析方法
COD测定方法参照国家监测标准[23],2-CP水样的测定采用液相色谱法。色谱柱采用C18柱,流动相采用甲醇和水,其中甲醇体积分数为57%,流动相流速1 mL/min,使用紫外UV检测器,检测波长为280 nm。好氧呼吸速率测定采用自制耗氧速率测定仪,通过线性拟和得到溶解氧DO的变化速率,斜率即为耗氧速率[24]。比耗氧速率SOUR可由耗氧速率和MLVSS的比值得到,单位mg/(g·h)。EPS的提取采用超声+甲酰胺+NaOH的组合方法[25-26],EPS中多糖PS的测定采用经典方法苯酚硫酸法[27],蛋白质PN的测定采用考马斯亮蓝G250显色法[28]。污泥的显微结构采用尼康ECLIPSE 80i荧光显微镜显微照相观察,表面形态采用日立HITACHI S3400N扫描电镜观察。
1.5污泥群落结构分析
污泥DNA提取采用美国Qbiogene公司的FastDNA SPIN Kit for Soil试剂盒,细菌16S扩增选用通用引物,27F(5’-AGAGTTTGATCCTGGC-TCAG-3’),1492R (5′-TACGGCTACCTTGTTA-CGACTT-3’)[29],PCR扩增反应体系及扩增条件参考课题组前期应用的方法[30]。PCR扩增产物经纯化回收后进行T/A克隆,克隆载体为pMD18-T,挑取阳性克隆子送到铂尚生物技术(上海)有限公司测序。
1.6邻氯苯酚降解相关酶基因的扩增
目的基因PCR扩增引物采用苯酚降解途径涉及的相关酶基因即羟化酶、苯酚1,2-双加氧酶,苯酚2,3-双加氧酶三大功能基因的简并性引物[30]。扩增产物连接到PMD18-T(Takara)载体上,每个平板挑5个单克隆利用M13引物进行PCR产物验证。对于验证结果为阳性的单克隆,经酶连接产物转化后铺制平板,每个平板送3个克隆到铂尚基因有限公司进行测序。测序结果在NCBI网站进行BLAST比对。
2结果与讨论
2.1不同盐度下2-CP及COD的去除率
高盐污泥驯化阶段,NaCl质量浓度初始值为10 g/L,进水2-CP质量浓度为125 mg/L,此时进水COD为1 183 mg/L。为了较好地控制操作周期时间,本阶段每个操作单元即每隔12 h取水样测定出水剩余2-CP质量浓度,当2-CP降解完全后测定出水COD,2-CP和COD的去除率如图1和图2所示。

图1 高盐条件下2-CP的去除

图2 高盐条件下COD的去除
在A阶段,当NaCl质量浓度为10 g/L时,进水2-CP质量浓度从125~1 000 mg/L逐渐升高。对于2-CP的去除在3个操作单元内即可完成,最多需要36 h即可实现2-CP的完全去除,COD的去除率也在92%~99%。当NaCl质量浓度增加到30 g/L时,即到达B阶段,进水2-CP的质量浓度从250~1 000 mg/L逐渐升高。此阶段活性污泥在36 h内也实现了2-CP的基本完全降解,COD去除率在91%~94%。上述结果说明,在NaCl质量浓度小于50 g/L之前,从污泥对2-CP和COD的降解情况来看,盐度对污泥的抑制作用并不明显。
对比A阶段和B阶段的驯化结果可以看出,当NaCl质量浓度从10 g/L升高到30 g/L时,若进水2-CP质量浓度相同时,在相同的操作单元时间内总是能将2-CP完全去除。比如进水2-CP质量浓度同样是500 mg/L时,只需2个操作单元即24 h内就能将2-CP降解完全。但是,COD的去除率在较高盐度下有所下降。由图2可以看出,在相同进水2-CP条件下,B阶段的出水COD比A阶段的要高,其出水COD在100 mg/L以上。
当NaCl质量浓度增加到50 g/L时,即代表C阶段。只考察进水2-CP质量浓度1 000 mg/L时2-CP及COD降解情况。每隔12 h测定2-CP的质量浓度,发现运行36 h后2-CP的去除率达到了86%,此时反应器中2-CP的质量浓度为140 mg/L,出水COD则高达480 mg/L左右,COD去除率为82%(未在图中显示)。为使出水2-CP及COD降低,此阶段操作周期延长到48 h,在第17个到第19个操作周期测定出水2-CP及COD,结果表明48 h 内2-CP能够完全降解,COD的去除率也达到了95%以上。
通过以上驯化过程,将下一阶段的操作周期时间调整为48 h。为了使SBR反应器更好地去除2-CP以及降解COD,后续驯化培养过程将灵活地改变操作周期。若经过多个周期后,出水中的2-CP或者COD质量浓度仍较高,可考虑适当调整周期时间,以实现2-CP和COD的完全降解。
继续增加NaCl质量浓度到80 g/L,如图1和图2所示的D阶段,进水2-CP质量浓度仍为1 000 mg/L。此阶段2-CP在48 h的去除率达到98%以上;同时测定反应器48 h后的出水COD,结果表明COD的去除率也达到了94%左右,此时出水COD为160 mg/L。可以看出,在48 h的操作周期内,对于此条件下的2-CP和COD保持着较高的去除率。当NaCl质量浓度仍为80 g/L,进水2-CP质量浓度继续提高到1 500 mg/L时,发现在48 h的一个操作周期时间内2-CP和COD的去除率都达到了98%以上,而且出水COD降低到了40 mg/L以下。此条件下2-CP和COD的去除率已经基本一致,经过48 h的反应已基本实现2-CP的完全去除,且不再有中间产物的累积。
2.2不同NaCl质量浓度下污泥呼吸速率的变化
表2对比了不同的NaCl质量浓度和2-CP质量浓度下活性污泥的外源好氧呼吸速率SOUR,即每个操作周期的初始SOUR值。当NaCl质量浓度达到50 g/L,进水葡萄糖和2-CP质量浓度都为1 000 mg/L时,SOUR相比其他条件下的测定值最大,为9.79 mg/(g·h)。李玲玲等[31]研究了NaCl质量浓度对活性污泥中微生物利用葡萄糖进行代谢的活性影响,表明当NaCl质量浓度小于30 g/L时,污泥的SOUR值仍较高,在10 mg/(g·h)以上。而当NaCl质量浓度升高到50 g/L时,污泥的SOUR值降低到了5.83 mg/(g·h)。相比之下,本研究驯化后的活性污泥在NaCl质量浓度50 g/L下的SOUR值比NaCl质量浓度30 g/L下的高,反映了污泥较好的耐盐活性。但是,当NaCl质量浓度升高到80 g/L,2-CP质量浓度上升到1 500 mg/L时,SOUR下降到1.39 mg/(g·h),说明此时高浓度的2-CP和高盐已经较大程度地抑制了污泥的活性。虽然在随后的降解过程中发现,2-CP和COD在48 h的操作周期内去除率仍可以达到98%以上,但是由于瞬时冲击负荷的影响,污泥的好氧呼吸速率受到明显抑制。

表2 2-CP和NaCl质量浓度不同时的SOUR值
2.3不同NaCl质量浓度下胞外聚合物EPS的变化规律
众多研究已经证实,胞外聚合物(EPS)富含许多高分子类物质,包含多糖、蛋白质、核酸、脂类、糖醛酸、腐殖酸等[32]。EPS在细胞表面聚集,有助于污泥絮体三维凝胶网状结构的形成,这样一种结构是由EPS的各种组分通过氢键结合和多价阳离子架桥的复杂交互作用形成的。EPS不仅使污泥细胞聚集强化污泥絮体的稳定性,而且也为细胞抵御不利的外界环境提供了保护层[33]。这些物质中,只有多糖是胞外合成的,而蛋白质、脂类物质和核酸都是从胞内分泌出来的或是细胞消解时释放出来的[34]。研究表明,EPS呈流变性的双层结构,包含松散附着型EPS (Loosely Bound EPS,LB-EPS)和紧密黏附型EPS(Tightly Bound EPS,TB-EPS)[34-35]。其中,TB-EPS与细胞结合紧密,相对稳定地附着于细胞壁外;而LB-EPS为可向周围扩散的无明显边缘黏液层,较为疏松,密度小,具有流变性。由于多糖和蛋白质的空间分布不同,不同的提取方法影响了EPS提取的实际含量。两者的提取方法上的主要区别在于,LB-EPS需要较为温和的方法提取。一般研究者提取的EPS都是TB-EPS或者总EPS。本文采用碱法和超声结合的方法提取的EPS属于TB-EPS。对处于不同时期驯化稳定的活性污泥胞外聚合物EPS的测定分析如表3所示。
大部分研究表明污泥EPS组分以蛋白(PN)、多糖(PS)为主。表3中数据显示,不同时期提取的污泥样品EPS中的蛋白(PN)含量变化不明显,高盐条件下的PN含量略有升高,从最初的11.44 mg/g升高到了17.72 mg/g,之后在进水2-CP质量浓度继续升高到1 500 mg/L时又略微降低,PN含量为15.95 mg/g。但是,EPS中的多糖(PS)含量却有明显的变化。随着NaCl质量浓度以及进水2-CP质量浓度的升高,PS含量从最初的NaCl质量浓度10 g/L条件下的16.43 mg/g,逐步上升到了NaCl质量浓度为80 g/L下的142.61 mg/g,随后,当进水氯酚质量浓度变为1 500 mg/L时,PS含量又有所降低,其值为94.56 mg/g。EPS总量上,从初始的27.87 mg/g升高到160.33 mg/g,之后又下降到110.51 mg/g。当系统NaCl质量浓度从10 g/L升高到80 g/L时,除了EPS含量的升高,PS/PN的比值也在增加,在NaCl质量浓度为80 g/L时PS的含量达到了PN的8.05倍。Wang等[34]的研究发现,当盐度从0.5%升高到6%时,在缺氧-好氧SBR反应器中以葡萄糖为降解基质的活性污泥的TB-EPS的含量从18.6 mg/g升高到74.5 mg/g,而其中mPS/mPN的比值从0.34增加到了0.71。可见,本文在含有高质量浓度2-CP的高盐环境下,EPS中的PS大量分泌,并且占据主导作用,mPS/mPN的比值有明显变化。
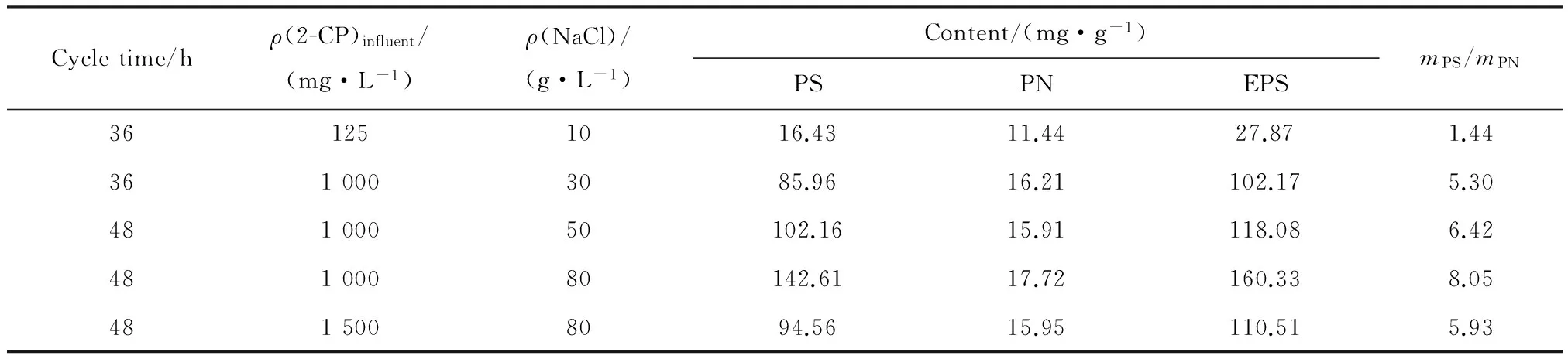
表3 不同NaCl质量浓度下EPS的含量
2.4高盐降解2-CP活性污泥的生物相观察
如图3所示,在高盐驯化前后对污泥的显微形态观察发现,污泥在驯化前后有了明显的变化。图3(a)示出了高盐驯化初始污泥A阶段的显微形态,可以看到在高盐驯化初期,污泥絮体分散均匀。经过高盐驯化后,发现污泥已经发生了聚集。图3(b)示出了活性污泥D阶段的显微结构图。从图中可看出,污泥已经聚集成群,污泥絮体中间有了明显的界限,说明在高盐条件下污泥有自发聚集的能力。如2.3节所述,在高盐以及高质量浓度2-CP的环境下,污泥中的微生物会分泌更多的EPS尤其是多糖PS来抵抗不利环境。因此污泥絮体的自发聚集可能是源于胞外聚合物在高盐环境中的大量分泌导致。已有的研究表明,mPS/mPN的比值决定污泥絮体的紧密状态。EPS中的成分既含有疏水性成分如脂类和蛋白质,又含有多糖等亲水性物质。因此这两者的比值决定着污泥的表面性质。正因为EPS的作用,污泥中的微生物才得以聚集,共同承担降解污染物以及维持污泥系统良好的沉降性能。

图3 污泥显微形态
对NaCl质量浓度为80 g/L,进水2-CP质量浓度为1 500 mg/L时驯化稳定的污泥取样做电镜扫描,其表面形态如图4所示。从电镜扫描结果来看,污泥中球状结构的细菌占据优势,并且紧密地聚集在一起,进一步说明了污泥在抵抗外界不利环境中,能够自发凝聚,从而改变污泥整体的沉降特性。Li等[35]的研究表明EPS的分泌是细胞凝聚的必要条件,EPS对污泥的絮凝和沉降发挥着重要的作用,EPS更多的分泌有助于克服微生物细胞间的静电斥力使得细胞凝聚。

图4 活性污泥电镜表面形态图
2.5高盐降解2-CP活性污泥的群落结构
为研究在高盐环境降解2-CP的活性污泥的微生物群落结构变化,本文将高盐驯化末端提取到的污泥DNA,通过16S rRNA进行PCR扩增,扩增产物通过克隆、测序以及序列比对后,构建克隆文库,通过系统发育树分析污泥群落结构组成。
共随机挑取了33个克隆子,经过菌落PCR后发现有3个为假阳性,选择其中30个阳性克隆子进行测序。将得到的正反测序序列结果,利用ChromasPro拼接,拼接好的序列在NCBI网站上利用BLAST和GenBank核酸数据库进行比对分析,査找相似度最高的序列,确定序列代表的菌种类型。选取能代表各菌属的3个菌株构建系统发育树,得到的菌株鉴定结果见表4。

表4 富集菌群的16S rRNA克隆文库结果
通过Mothur 软件对序列OUT进行分类,再利用ClustalW对齐选取的所有相似序列,最后用MEGA 6.06软件构建NJ系统发育树,设置自展值(Bootstrap)为1 000次来评估进化树的可信度,计算完毕后自动生成系统发育树,如图5所示。从进化树分析,这些序列分布在Alphaproteobacteria 类群(α-变形菌类)、Betaproteobacteria 类群(β-变形菌类)和Actinobacteridae类群(放线菌类)3个类群中。其中,属于Betaproteobacteria类群的微生物在丰度上具有较大优势,占整个克隆文库的90%。OUT-5与Rhodococcussp.P14的相似度达到95%,Rhodococcussp.P14是由原油污染的沉积物中分离得到的,该菌株能够降解多种多环芳烃和脂肪烃[36]。OUT-4与ShinellafuscastrainADC-27A的相似度为99%,ShinellafuscastrainADC-27A是从降解蒽的活性污泥中分离得到的菌株[37]。OUT-3与Achromobactersp.BR3的相似度为99%,该菌株是在拥有降解某种药物能力的膜生物反应器MBR中分离得到的,属于无色杆菌属。OTU-2与Alcaligenesfaecalisstrain N05的相似度为99%,该菌株是分离自根际土壤具有固氮功能的产碱杆菌属,占整个克隆文库的66.7%,是富集菌群的最优势菌株。

图5 富集菌群的16S rRNA系统发育树
综合以上分析,可知本研究的菌群结构,优势菌属为产碱杆菌属,其中Alcaligenesfaecalisstrain N05是富集菌群中最优势的菌株,该菌属也是常见的2-CP降解菌属,如Alcaligenessp.A7-2和AlcaligenesxylosoxidansJH1都是属于降解2-CP的产碱杆菌[38-39]。
2.6高盐降解2-CP相关酶基因检测
本文调研了2-CP的好氧降解途径,在此基础上选择SRB运行末端,也就是NaCl质量浓度为80 g/L,2-CP进水质量浓度1 500 mg/L时驯化稳定后的污泥样品,以该污泥样品提取到的DNA为模板,并利用1.6节所述3对简并性引物对相关酶基因进行扩增、测序,图6示出了OCPH、OCP-C12O、OCP-C23O基因PCR产物(图中分别为1,2,3)的检测结果。对PCR扩增的产物测序后,将结果提交Genebank,提交的序列号分别为KR269847、KR269848和KR269849。对产物的序列BLAST比对结果如表5所示。
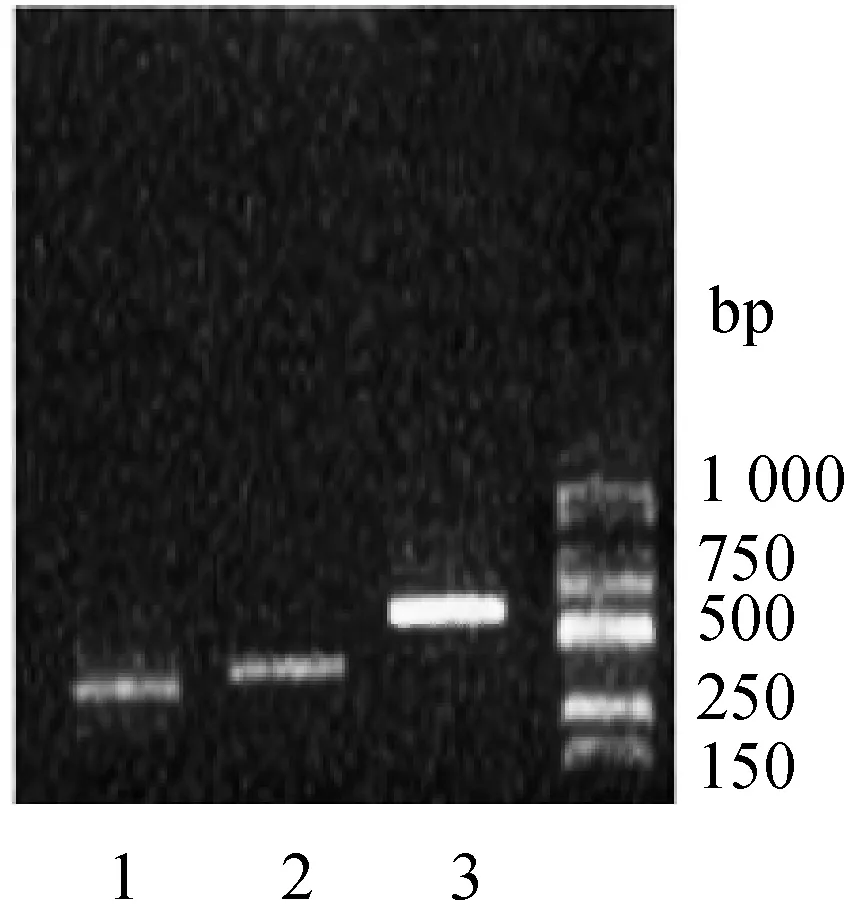
图6 功能基因PCR扩增产物电泳图
比对结果表明(表5),2-CP羟化酶基因与课题组前期培养的高盐苯酚降解基因的相似度为85%[30],这也说明2-CP的降解首先是通过羟化酶即单加氧酶的作用,羟基化形成对应的氯代邻苯二酚。如前所述,氯代邻苯二酚的开环可能发生在邻位或者是间位。序列比对结果显示,OCP-C12O的调控基因与Paracoccussp.FLY-8的相似度为86%,该菌株是降解丁草胺(除草剂)的土壤中分离得到的,具有邻苯二酚1,2-双加氧酶基因。OCP-C23O与假单胞菌属PseudomonasstutzeriCCUG 29243的相似度为71%,该菌由海洋沉积物中分离得到,具有邻苯二酚2,3-双加氧酶基因并且能够降解萘[40]。该污泥菌群的功能基因鉴定结果显示同时存在两种降解途径,表明了在高盐环境降解2-CP的途径多样性的存在。结合已有的文献推测2-CP可能的降解途径如图7所示。首先,2-CP在单氧酶的催化作用下发生羟基化,形成3-氯邻苯二酚,然后3-氯邻苯二酚分别在3-氯邻苯二酚1,2-双加氧酶和3-氯邻苯二酚2,3-双加氧酶的作用下发生邻位开环生成2-氯-顺-顺-己二烯二酸或者间位开环生成3-氯-2-羟基-粘康酸半醛,最后都进入三羧酸循环降解完全。

表5 邻氯苯酚降解基因序列比对结果
对于污泥菌群降解途径的研究,Alan Farrell等[41]利用恶臭假单胞菌Pseudomonasputida CP1投加入某种具有间位降解2-氯酚能力的混合菌群,发现整个菌群对2-氯酚的代谢途径发生了改变,从间位开环变成了邻位开环脱氯。由于菌群结构的多样性,可能在降解氯酚类难降解物质时,会诱导产生多种代谢途径。虽然在某些特定条件下菌群只显示出一些主要的降解途径,但是有研究者指出其中仍然包含多种与降解相关的多样性基因,是这些基因共同作用的结果[42]。本文的研究也说明了降解途径具有多样性。

图7 通过3-CC途径降解2-CP的邻位开环和间位开环途径
3结论
在NaCl质量浓度小于50 g/L的条件下,污泥在36 h内可以完全去除2-CP,对COD的去除达到92%以上。当NaCl质量浓度升高到50 g/L,2-CP质量浓度为1 000 mg/L时,污泥在36 h内2-CP和COD的去除率分别为86%以及82%,出水COD仍高达480 mg/L左右。液相色谱检测证明中间产物存在一定的累积。通过延长操作周期时间至48 h,可使2-CP完全降解,COD去除率达到95%左右,同时对污泥的好氧呼吸速率SOUR测定结果表明,此时污泥活性较高,SOUR值为9.79 mg/(g·h)。当NaCl质量浓度升高到80 g/L时,污泥活性受到了较大的抑制,SOUR值降低到1.39 mg/(g·h)。
高盐条件下EPS中的PN含量变化不明显,PS含量以及mPS/mPN的比值随NaCl质量浓度升高而增加。当NaCl质量浓度为80 g/L,2-CP质量浓度为1 000 mg/L时,活性污泥胞外聚合物(EPS)的含量高达142.6 mg/g,此时多糖PS的含量是蛋白质PN的8.05倍。对高盐2-CP驯化稳定的污泥进行显微形态以及扫描电镜观察,表明菌群在高盐条件下有自发聚集的能力,菌群结构紧密,球状菌占据优势。群落结构分析表明,污泥中菌群的优势菌属为产碱杆菌,Alcaligenesfaecalisstrain N05是富集菌群中最优势的菌株。
功能基因检测结果表明,污泥在高盐环境中降解2-CP的降解途径可能存在邻位开环和间位开环两种途径,其中参与代谢的酶主要是羟化酶、氯代邻苯二酚1,2-双加氧酶和氯代邻苯二酚2,3-双加氧酶,污泥中微生物对邻氯苯酚的降解途径具有多样性。
参考文献:
[1]LEFEBVRE O,MOLETTA R.Treatment of organic pollution in industrial saline wastewater:A literature review[J].Water Research,2006,40(20):3671-3682.
[2]LIU W,HOWELL J A,ARNOT T C,etal.A novel extractive membrane bioreactor for treating biorefractory organic pollutants in the presence of high concentrations of inorganics:application to a synthetic acidic effluent containing high concentrations of chlorophenol and salt[J].Journal of Membrane Science,2001,181(1):127-140.
[3]EDALATMANESH M,MEHRVAR M,DHIB R.Optimization of phenol degradation in a combined photochemical-biological wastewater treatment system[J].Chemical Engineering Research and Design,2008,86(11):1243-1252.
[4]MOUSSAVI G,MAHMOUDI M,BARIKBIN B.Biological removal of phenol from strong wastewaters using a novel MSBR[J].Water Research,2009,43(5):1295-1302.
[5]CHIAIESE P,PALOMBA F,TATINO F,etal.Engineered tobacco and microalgae secreting the fungal laccase POXA1b reduce phenol content in olive oil mill wastewater[J].Enzyme and Microbial Technology,2011,49(6):540-546.
[6]EROL NALBUR B,ALKAN U.The inhibitory effects of 2-CP and 2,4-DCP containing effluents on sequencing batch reactors[J].International Biodeterioration & Biodegradation,2007,60(3):178-188.
[7]TU Yuting,XIONG Ya,TIAN Shuanghong,etal.Catalytic wet air oxidation of 2-chlorophenol over sewage sludge-derived carbon-based catalysts[J].Journal of Hazardous Materials,2014,276:88-96.
[8]VALLEJO M,SAN ROMAN M F,ORTIZ I,etal.The critical role of the operating conditions on the fenton oxidation of 2-chlorophenol:Assessment of PCDD/FS formation[J].Journal of Hazardous Materials,2014,279:579-585.
[9]ARORA P K,BAE H.Bacterial degradation of chlorophenols and their derivatives[J].Microbial Cell Factories,2014,13:13-31.
[10]VEENAGAYATHRI K,VASUDEVAN N.Degradation of 4-chlorophenol by a moderately halophilic bacterial consortium under saline conditions[J].British Microbiology Research Journal,2013,3(4):513-524.
[11]MOUSSAVI G,GHODRATI S,MOHSENI-BANDPEIA.The biodegradation and COD removal of 2-chlorophenol in a granular anoxic baffled reactor[J].Journal of Biotechnology,2014,184:111-117.
[12]ALVA V A,PEYTON B M.Phenol and catechol biodegradation by the haloalkaliphileHalomonascampisalis:influence of PH and salinity[J].Environmental Science & Technology,2003,37(19):4397-4402.
[13]ABOU-ELELA S I,KAMEL M M,FAWZY M E.Biological treatment of saline wastewater using a salt-tolerant microorganism[J].Desalination,2010,250(1):1-5.
[14]ZHUANG Xuliang,HAN Zhen,BAI Zhihui,etal.Progress in decontamination by halophilic microorganisms in saline wastewater and soil[J].Environmental Pollution,2010,158(5):1119-1126.
[15]WOOLARD C R,IRVINE R L.Treatment of hypersaline wastewater in the sequencing batch reactor[J].Water Research,1995,29(4):1159-1168.
[16]MOUSSAVI G,BARIKBIN B,MAHMOUDI M.The removal of high concentrations of phenol from saline wastewater using aerobic granular SBR[J].Chemical Engineering Journal,2010,158(3):498-504.
[17]RAMOS A F,GOMEZ M A,HONTORIA E,etal.Biological nitrogen and phenol removal from saline industrial wastewater by submerged fixed-film reactor[J].Journal of Hazardous Materials,2007,142(1):175-183.
[18]KARGI F,KONYA I.COD,para-chlorophenol and toxicity removal from para-chlorophenol containing synthetic wastewater in an activated sludge unit[J].Journal of Hazardous Materials,2006,132(2):226-231.
[19]KARGI F,KONYA I.Para-Chlorophenol containing synthetic wastewater treatment in an activated sludge unit:Effects of hydraulic residence time[J].Journal of Environmental Management,2007,84(1):20-26.
[20]PETRIE B,MCADAM E J,LESTER J N,etal.Assessing potential modifications to the activated sludge process to improve simultaneous removal of a diverse range of micropollutants[J].Water Research,2014,62(10):180-192.
[21]MORGENROTH E,SHERDEN T,VAN LOOSDRECHT M C M,etal.Aerobic granular sludge in a sequencing batch reactor[J].Water Research,1997,31(12):3191-3194.
[22]JIANG Helong,TAY J H,MASZENAN A M,etal.Enhanced phenol biodegradation and aerobic granulation by two coaggregating bacterial strains[J].Environmental Science & Technology,2006,40(19):6137-6142.
[23]王心芳,魏复盛,齐文启.水和废水监测分析方法[M].北京:中国环境出版社,2002:216-219.
[24]刘昕,张继伟,朱书全,等.利用呼吸速率在线测定活性污泥浓度[J].工业水处理,2007,27(11):62-64.
[25]ADAV S S,LEE D J.Extraction of extracellular polymeric substances from aerobic granule with compact interior structure[J].Journal of Hazardous Materials,2008,154(1):1120-1126.
[26]LIU H,FANG H H.Extraction of extracellular polymeric substances (EPS) of sludges[J].Journal of Biotechnology,2002,95(3):249-256.
[27]DUBOIS M,GILLES K A,HAMILTON J K,etal.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[28]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[29]WEISBURG W G,BARNS S M,PELLETIER D A,etal.16S ribosomal DNA amplification for phylogenetic study[J].Journal of Bacteriology,1991,173(2):697-703.
[30]WANG Yufeng,WANG Xiaoli,LI Hui,etal.Treatment of high salinity phenol-laden wastewater using a sequencing batch reactor containing halophilic bacterial community[J].International Biodeterioration & Biodegradation,2014,93:138-144.
[31]李玲玲.高盐度废水生物处理特性研究[D].山东 青岛:中国海洋大学,2006.
[32]MCSWAIN B S,IRVINE R L,HAUSNER M,etal.Composition and distribution of extracellular polymeric substances in aerobic flocs and granular sludge[J].Applied and Environmental Microbiology,2005,71(2):1051-1057.
[33]LIN Hongjun,ZHANG Meijia,WANG Fangyuan,etal.A critical review of extracellular polymeric substances (EPSS) in membrane bioreactors:Characteristics,roles in membrane fouling and control strategies[J].Journal of Membrane Science,2014,460:110-125.
[34]WANG Zichao,GAO Mengchun,WANG Zhe,etal.Effect of salinity on extracellular polymeric substances of activated sludge from an anoxic-aerobic sequencing batch reactor[J].Chemosphere,2013,93(11):2789-2795.
[35]LI Xiaoyan,YANG Shufang.Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation,sedimentation and dewaterability of activated sludge[J].Water Research,2007,41(5):1022-1030.
[36]SONG Xiaohui,XU Yan,LI Gangmin,etal.Isolation,characterization ofRhodococcusSP.P14 capable of degrading high-molecular-weight polycyclic aromatic hydrocarbons and aliphatic hydrocarbons[J].Marine Pollution Bulletin,2011,62(10):2122-2128.
[37]NTOUGIAS S,MELIDIS P,NAVROZIDOU E,etal.Diversity and efficiency of anthracene-degrading bacteria isolated from a denitrifying activated sludge system treating municipal wastewater[J].International Biodeterioration & Biodegradation,2015,97:151-158.
[38]MENKE B,REHM H J.Degradation of mixtures of monochlorophenols and phenol as substrates for free and immobilized cells ofAlcaligenessp.A7-2[J].Applied Microbiology and Biotechnology,1992,37(5):655-661.
[39]HOLLENDER J,HOPP J,DOTTW.Cooxidation of chloro-and methylphenols byAlcaligenesXylosoxidansJH1[J].World Journal of Microbiology and Biotechnology,2000,16(5):445-450.
[40]BRUNET-GALMÉS I,BUSQUETS A,PEA A,etal.Complete genome sequence of the naphthalene-degrading bacteriumPseudomonasStutzeriAN10 (CCUG 29243)[J].Journal of Bacteriology,2012,194(23):6642-6643.
[41]ALAN FARRELL B Q.The enhancement of 2-chlorophenol degradation by a mixed microbial community when augmented withPseudomonasPutidaCP1[J].Water Research,2002,36(10):2443-2450.
[42]MERIMAA M,HEINARU E,LIIVAK M,etal.Grouping of phenol hydroxylase and catechol 2,3-dioxygenase genes among phenol- and p-cresol-degradingpseudomonasspecies and biotypes[J].Archives of Microbiology,2006,186(4):287-296.
Aerobic Activated Sludge Treatment of High-Salinity Chlorophenolic Wastewater and Community Structure Analysis
WU Zhi-ming,SUN Zhi-yuan,LI Hui,LIU Yong-di
(School of Resource and Environmental Engineering,East China University of Science and Technology,Shanghai 200237,China)
Abstract:The activated sludge dominated by moderately halophilic bacteria were acclimated using SBR reactor,which used to remove the 2-chlorophenol (2-CP) efficiently from wastewater.When the mass concentration of NaCl was between 10 g/L and 80 g/L,the removal rates of both 2-CP and COD reached 91%.When the mass concentration of NaCl was 80 g/L and the 2-CP mass concentration was above 1 000 mg/L,the removal rate of 2-CP could maintain at 98%,in which the SBR reactor achieved the best treatment effect.The concentration of extracellular polymers (EPS) of activated sludge reached the highest amount of 142.6 mg/g at this operation condition.With the increase of salinity,the amount of polysaccharide in EPS increased.As observed by using microscope and scanning electron microscopy (SEM),most of the microorganisms appeared pellets and the microbial community had a tendency to gather spontaneously under the high salinity condition.16S rRNA gene clone library analysis showed that the dominated bacterial population in the activated sludge was Alcaligenes faecalis which belonged to Proteobacteria.PCR and sequence analysis of the key enzyme gene in 2-CP degradation showed that hydroxylase,chlorinated catechol 1,2-dioxygenase and chlorinated catechol 2,3-dioxygenase co-existed in the activated sludge system,which indicated the diverse 2-CP degradation pathway.
Key words:hypersaline wastewater; 2-chlorophenol (ortho-chlorophenol); activated sludge; moderately halophilic bacteria; degradation pathway
收稿日期:2015-05-27
基金项目:国家自然科学基金(51378208,41273109,41003031);中央高校基本科研业务费(222201313008,WB1314002)
作者简介:吴志明(1989-),男,福建人,硕士生,主要从事化工废水生物处理研究。E-mail:wuzhiming2010@126.com 通信联系人:刘勇弟,E-mail:ydliu@ecust.edu.cn
文章编号:1006-3080(2016)02-0200-10
DOI:10.14135/j.cnki.1006-3080.2016.02.008
中图分类号:X522
文献标志码:A

