不同代次羊驼皮肤黑素细胞TYR基因表达变化的研究
白 瑞,程志学,于志慧,尹志红,范瑞文,庞全海,董常生(山西农业大学动物科技学院,山西太谷030801)
不同代次羊驼皮肤黑素细胞TYR基因表达变化的研究
白瑞,程志学,于志慧,尹志红,范瑞文,庞全海,董常生
(山西农业大学动物科技学院,山西太谷030801)
摘要:为了探讨TYR基因在体外培养的羊驼皮肤黑素细胞不同代次间表达变化差异,根据GenBank中已发现的序列(EU293064)设计引物和探针,以羊驼皮肤黑素细胞的RNA为模板,采用QRT-PCR TaqMan探针法研究羊驼酪氨酸酶基因在不同代次间羊驼皮肤黑素细胞中mRNA表达量.结果表明,经过内参基因校正后,第10代羊驼黑素细胞中TYR基因的相对表达量是第3代细胞相对表达量的25倍(P<0.01),第10代细胞与第5代细胞表达差异不明显(P>0.05)。表明TYR基因表达量的差异与羊驼皮肤黑素细胞传代可能存在一定的相关性。
关键词:羊驼皮肤黑素细胞;TYR基因;QRT-PCR TaqMan探针法;基因表达水平
哺乳动物机体中,黑素大多分布在皮肤、毛囊以及眼睛等处。在细胞中,黑素是由黑素细胞胞浆当中的黑素小体产生,其黑素有两种类型,一种为真黑素,一种为褐黑素[1]。动物与人的皮肤毛发色素沉着决定于其所含真黑色素与褐黑色素的相对数量[2-3]。大量的研究表明,黑素细胞内黑色素的生物合成是一个由酪氨酸酶(Tyrosinase,TYR)催化体内酪氨酸羟化而启动的一系列生化反应[4-6]。TYR是黑素合成过程中的关键酶,具有酪氨酸羟化酶和多巴氧化2种活性[7]。由于酪氨酸酶在黑素细胞中生成黑色素发挥很关键的功能,因此研究羊驼皮肤黑素细胞系中酪氨酸的表达有助于我们进一步研究羊驼皮肤颜色和毛发颜色。这项研究说明,研究羊驼皮肤黑素细胞模型是有价值的,进一步表明在羊驼皮肤黑素细胞上利用RNAi技术研究酪氨酸酶和其他毛色基因的功能是具有深远的意义。
1 材料与方法
1.1细胞培养及样本羊驼黑素细胞由羊驼生物工程实验室保存,细胞样本分别取第3代、5代、第10代羊驼皮肤黑素细胞,同时培养72 h后,PBS清洗细胞3次,提取总RNA。
1.2主要试剂和仪器羊驼皮肤黑色素细胞培养基(由羊驼生物工程实验室配置)、TRIZol、SuperScrip III First-strand(18080-051)、Platinum Taq酶(5 U/ μL)(11304-029)、探针合成、dNTP(BF6901B)、10×PCR Buffer、超纯水均购自Invitrogen公司;上下游引物(10 μmol/L)由上海英骏生物技术有限公司合成;实时荧光定量PCR仪(Bio-Rad公司);BIO-RAD凝胶成像系统(Bio-Rad公司);DL-CJ-1ND医用型超净工作台等。
1.3方法
1.3.1羊驼皮肤黑素细胞总RNA提取和反转录cDNA分别取传代培养的第3代、第5代、第10代黑素细胞,并用TRIZol提取总RNA,分别取1 μL,用核酸蛋白测定仪测定A260nm/A280nm、A260nm/A230nm的吸光度值,并计算其浓度。然后用1%琼脂糖凝胶电泳检测RNA质量。10 μL反应体系中含5×PrimeScriptTMBuffer 2 μL,PrimeScriptTMRT Enzyme Mix 10.5 μL,Oligo dt Primer 25 pmol/L,随机引物50 pmol/L,Total RNA 1 μL,DEPC水加至10 μL。上述成分混匀后置于PCR仪器中,反应条件:37℃15 min,85℃5 s;4℃保存。
1.3.2TYR基因引物设计参照GenBank公布的TYR基因序列,应用Premier 5.0设计引物。为了检测各RNA样品完整性和反转录效率之间的差别,将待测样品中的持家基因18S rRNA设为内参。引物和探针都由北京奥科鼎盛生物科技有限公司合成。引物探针详细资料见表1和表2。

表1 实时荧光定量PCR中所用的引物序列

表2 实时荧光定量PCR中所用的探针序列
1.3.3标准曲线的建立和目的基因定量将羊驼皮肤黑素细胞的总RNA反转录成cDNA并以2倍梯度稀释,相对浓度为20、2-2、2-4、2-6、2-8,以其为实时PCR扩增模板,羊驼皮肤黑素细胞的cDNA浓度在536~658 ng/L之间,按照筛选好的QRT-PCR反应体系条件进行扩增。反应完成后,软件自动导出扩增动力学曲线、溶解曲线和循环阈值,反应结束后生成标准曲线,借助软件分析导出内标基因和目的基因标准曲线方程、扩增效率R2以及直线方程系数(斜率),并分析两者斜率之差。且样本重复的Ct值之间差异小于1个循环,说明目的基因和内参基因的扩增效率相同,就可以通过△△Ct法进行相对定量[4-5]。△Ct(第3代细胞)= Ct(目的基因)-Ct(内参基因),△Ct(第5代细胞)= Ct(目的基因)-Ct(内参基因),△Ct(第10代细胞)= Ct(目的基因)-Ct(内参基因),△△Ct=△Ct(第n代细胞目的基因)-△Ct(第n代细胞内参基因),TYR基因的相对表达水平= 2-△△CT。
试验中各个标准均做3个重复,另加3个无模板的阴性对照,反应结束后进行自动熔解曲线分析,根据标准曲线和荧光曲线的Ct值计算定量结果。QRT-PCR反应体系: cDNA模板1 μL,10× PCR Buffe2.5 μL,镁离子(25 mmol/L)2 μL,dNTPs (25 mmol/L)0.2 μL,上下游探针(10 μmol/L)各0.5 μL,Taq酶0.3 μL,灭菌蒸馏水加至25 μL。反应条件:95℃预变性10 s,95℃5 s,59℃20 s,72℃10 s,40个循环,95℃1 min,55℃30 s,95℃30 s。
1.3.4数据分析及处理用Excel软件对试验数据进行统计分析,结果用平均值±标准差(Means± SD)表示,并使用SPSS13.0软件进行ANOVA分析,其中TYR基因表达量结果均经相应持家基因18S rRNA表达量校正。
2 结果
2.1羊驼皮肤黑素细胞RNA的完整性、产率和纯度细胞总RNA经提取纯化后通过1.0%琼脂糖凝胶电泳进行快速分析(15V/cm),从图1中可见,总RNA有明显的3条带(5S、18S和28S),表明提取和纯化效果较好。利用核酸/蛋白浓度测定仪对RNA样品进行浓度及纯度的检测结果显示:OD260/OD280的比值在1.8~2.1之间,可以进行后续的荧光定量PCR反应。
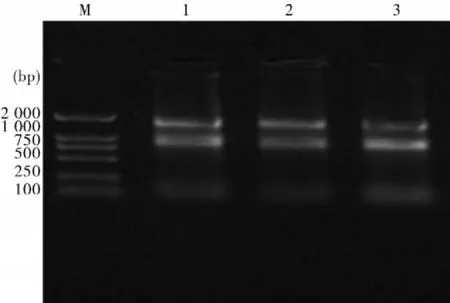
图1 羊驼皮肤黑素细胞体外培养第3代、第5代、第10代细胞总RNA琼脂糖凝胶电泳图
2.2标准曲线的建立本试验对目的基因TYR与内参基因建立标准曲线。图2中显示,直线斜率分别是0.041,表明18S rRNA与TYR基因扩增反应效率一致,2-ΔΔCT相对定量方法适合于本试验。

图2 2-ΔΔCT方法的确定
2.3qRT-PCR扩增目的基因产物的鉴定目的基因和内参基因经过荧光定量PCR扩增后,2%琼脂糖凝胶电泳,第3代、第5代、第10代细胞TYR和18S rRNA,分别是108 bp和158 bp的片段,确定为是所需的目的基因,图3。

图3 TYR和18S rRNA基因琼脂糖凝胶电泳图M:DNA标准分子量DL-2 000;1:第3代细胞TYR基因扩增产物;2:第5代细胞TYR基因扩增产物;3:第10代细胞TYR基因扩增产物;4:内参18SrRNA基因扩增产物
2.4目的基因TYR和内参基因18S rRNA扩增曲线本试验内参基因选用18SrRNA,进行TYR基因和18S rRNA基因探针定量和扩增分析,见图4。其目的基因TYR和内参基因18S rRNA扩增曲线基线平直,“S”形曲线良好,拐点清楚。

图4 TYR和18S rRNA的扩增曲线A:TYR基因扩增曲线;B:18S rRNA扩增曲线
2.5不同代次间TYR基因mRNA表达的变化量
试验结果表明,随这羊驼皮肤黑素细胞在体外培养传代次数的增加,TYR表达量是逐渐增加的,TYR在第10代细胞中表达量较高,与第10代和5代细胞表达差异不显著(P>0.05),而在第5代较第3代细胞中表达高,他们之间的表达差异级显著(P<0.01)(图5)。

图5 目的基因mRNA表达结果
3 讨论
3.1关于实时荧光定量TaqMan探针法QRT-PCR 是PCR技术中的一种高灵敏度核酸定量技术,包括SYBR-Green、FRET探针、TaqMan探针、分子信标等手段[8]。其中SYBR Green为非特异性法,其原理是SYBR Green荧光染料可与双链DNA结合,两者相连后其荧光强度是游离状态下的10~100倍,可被荧光PCR仪检捕捉到荧光信号[9]。此方法优势是能监测任何dsDNA的扩增,而且不需要探针,检测方法也较为简便,成本也较为低廉。但缺点是特异性较差,容易受引物二聚体影响[10]。TaqMan探针法备受研究人员青睐,主要是它具有较高序列特异性,并适合检测低拷贝模板。其原理是用双标记荧光探针与扩增片断结合,在探针5′端和3′端各有一个荧光基团和淬灭荧光基团,在Taq酶5′端有外切酶活性水解探针,利用此探针可使荧光基团与淬灭荧光基团分离从而发射荧光,这样反应体系中荧光的强度与系统中真正扩增产物的分子数量相一致[8]。其荧光强度则是系统中发射荧光分子量的总和,即反应系统中每扩增一条DNA双链,就产生一个发射荧光分子,所以反应体系中的荧光强度与PCR扩增产物数量相等。
由于本研究在NCBI上检索到的羊驼TYR基因只有122 bp大小的片段,因此对本实验造成了一定的难度,在短序列上设计引物,用SYBR Green法不能十分准确的完成不同代次细胞见TYR基因的表达量的检测,因此我们选用更具有特异性强的TaqMan探针法在研究该基因的表达量。
3.2不同代次间TYR表达变化量的探讨据我们的研究,参照前人在细胞传代上生物学特性以及细胞内酶变化量的研究,我们得到羊驼皮肤黑素细胞体外培养与其它类型的细胞一样,都有原代培养期、传代培养期及衰退期。传代旺盛的细胞,通常核型为二倍体,保留着原组织的生物学特征。长期传代的细胞,将逐渐失去二倍体,使得细胞生长变缓、衰退、甚至于死亡[11]。
在本课题先前的研究中,羊驼皮肤黑素细胞的原代和传代细胞其形态结构并无明显差异,传代至15代后细胞体积增大,细胞质内颗粒物质增加,核分裂相减少,透射电镜观察细胞内粗面内质网减少,线粒体变形,此变化都是细胞衰老的早期表现。
由于羊驼皮肤黑素细胞至今还没有人研究,目前在细胞系中的各种和毛色相关的基因变化量尚不是很清楚。而TYR作为黑素细胞内黑素生成过程中一个重要的基因。TYR表达变化量是反映黑素细胞合成黑色素颗粒能力的重要指标。在本试验中,前10代的细胞具有较高的TYR表达,随着代次的增加细胞内合成黑素颗粒增多,其生物特性稳定。提示选用10代以内的羊驼皮肤黑素细胞,为羊驼毛色基因的研究提供了细胞模型。
因此,我们对不同代次间TYR基因的表达量的研究,给了我们一个初步认识羊驼皮肤黑素细胞的特性。建立羊驼皮肤黑素细胞系,其目的是建立一个皮肤色素细胞模型,在这个平台上来研究羊驼毛色基因的功能和作用机理,为我们进一步探究羊驼毛色色素沉积和改变毛色奠定一个理论基础。
4 小结
根据NCBI上登录的酪氨酸酶基因122 bp的已知序列设计荧光定量引物和TaqMan探针,采用QRT-PCR TaqMan探针法研究羊驼酪氨酸酶基因在不同代次间羊驼皮肤黑素细胞中mRNA表达量,以寻找合适的细胞代数酪氨酸酶基因表达量最高,结果得出,TYR基因在第10代羊驼皮肤黑素细胞中的基因表达量经内参基因校正后相对于前面传代的第3代细胞表达量的25倍,相对于第5代细胞表达量的20倍以上,第10代细胞与第5代细胞表达差异不明显。在后续研究羊驼毛色基因中可以选取10代前的细胞进行基因功能研究。
参考文献:
[1]王秋枫.酪氨酸酶相关蛋白家族[J].中国美容医学.2003,24 (1):100-103.
[2]Costin G E,Hearing V J.Human skin pigmentation: melanocytes modulate skin color in response to stress[J].FASEB J.2007,21(4)976-994.
[3]伍革民,彭光旭.动物黑色素研究进展[J].甘肃畜牧兽医.2005 (1):39-41.
[4]Costin G E,Valencia J C,Vieira W D,et al.Tyrosinase processing and intracellular trafficking is disrupted in mouse primary melanocytes carrying the underwhite(uw)mutation. A model for oculocutaneous albinism(OCA)type 4[J].J Cell Sci.2003,116(15):3203-3212.
[5]李文,邓卫东,毛华明.乌骨绵羊和黑色素的研究进展[J].家畜生态学报.2007,28(3):1-5.
[6]张瑞娜,范瑞文,程志学,等.CDK5对羊驼皮肤黑色素细胞TYR和MITF mRNA表达的调节[J].畜牧兽医学报.
[7]张俊珍,董常生,范瑞文,等.哺乳动物毛色形成研究进展[J].动物医学进展.2006,27(增):65-68.
[8]沈勤,陈梦玲,沈爱国,等.NIDD基因TaqMan探针的制备及其在实时荧光定量PCR方法中的应用.江苏大学学报(医学版)[J].2006,6(3):185-188.
[9]高莉,董常生.羊驼酪氨酸酶基因家族的研究[D].山西农业大学.2008.
[10]陈英剑,胡成进,赵苗青.SYBR Green实时荧光定量PCR技术平台的建立[J].实用医药杂志,2004,21(11):997-999.
[11]Bellows C G,Pei W,Heersche J N.Number,frequency,self-renewal,and expansion of osteoprogenitor cells(CFU-O)in subcultured female rat vertebral cell populations[J].Wound Repair Regen.2004,12(6):657-667.
Expression Level Analysis of TYR Genein Alpaca Skin Melanocytewith Different Passage
BAI Rui,CHENG Zhi-xue,YU Zhi-hui,YIN Zhi-hong,FAN Rui-wen,PANG Quan-hai,DONG Chang-sheng
(College of Animal Science and Veterinary Medicine,Shanxi Agricultural University,Taigu 030801,China)
Abstract:This study explores TYR gene expression profiles in vitro cultured alpaca melanocyte with different passage.According to the sequence in Genank(EU293064),a pair of specific primers and probes were designed and the relative expression level of TYR gene in different passages for alpaca melanocytes was analyzed using QRT-PCR TaqMan probe method and SPSS13.0 software.The results showed that the relative gene expression level of TYR in the 10thgeneration of alpaca melanocytes was 25 times of that in the 3rdgeneration of alpaca skin melanocytes(P<0.01),Expressional intensity of TYR gene in the 10thand 5thgenerations of alpaca melanocytes had no significant difference(P>0.05).Our results suggest that the gene expression level of alpaca TYR may be related to the alpaca skin melanocytes with different passages.
Key words:Alpaca skin melanocyte;TYR gene;QRT-PCR TaqMan probe method;Gene expression level Corresponding author:DONG Chang-sheng
中图分类号:S829.9
文献标志码:A
文章编号:0529- 6005(2016)03- 0006- 04
收稿日期:2014-12-31
基金项目:国家自然科学基金项目(30972223;31272628)
作者简介:白瑞(1981-)男,讲师,博士,主要从事羊驼毛色基因功能和动物病理学方面的研究,E-mail:chinabairui@163.com
通讯作者:董常生:E-mail:cs_dong@sxau.edu.cn

