重组人血小板生成素及白介素-11应用于白血病化疗所致血小板减少症的系统评价
串俊兰,谭佳于,唐 梅,吕 晶
(四川省医学科学院·四川省人民医院药学部,四川 成都 610072)
重组人血小板生成素及白介素-11应用于白血病化疗所致血小板减少症的系统评价
串俊兰,谭佳于,唐 梅,吕 晶
(四川省医学科学院·四川省人民医院药学部,四川 成都 610072)
目的 评价重组人血小板生成素(rhTPO)及重组人白细胞介素-11(rhIL-11)应用于白血病化疗后血小板减少症的有效性与安全性。方法 采用循证医学的方法,计算机检索中国知网(1997~2015年1月)、万方数据资源系统(1977~2015年1月)、中国科技期刊数据库(1989~2015年1月),收集rhTPO和rhIL-11治疗白血病化疗后血小板减少症的所有平行对照试验。结果 共纳入7篇文献。与rhIL-11组相比,rhTPO能增加白血病患者恢复血小板的最高值,缩短白血病患者化疗后血小板≤50×109/L的持续时间,缩短白血病患者化疗后恢复至血小板≥75×109/L的时间(均P< 0.00001); rhTPO组不良反应发生率更低[RR 0.19,95% CI(0.12~0.31),P< 0.00001]。但rhTPO组和rhIL-11组患者化疗后血小板的最低值及rhTPO组和rhIL-11组恢复至血小板≥100×109/L的时间无明显差异。结论 在治疗白血病化疗后血小板减少症方面,与rhIL-11组相比,rhTPO能够增加血小板恢复的最高值、缩短血小板≤50×109/L的持续时间和恢复至血小板≥75×109/L的时间,并减少不良反应的发生。但二者对改善化疗后血小板的最低值和使患者恢复至血小板≥100×109/L的时间方面差异无统计学意义。然而,目前的临床试验设计存在不足,需要设计完善的大样本随机对照试验进行验证。
重组人血小板生成素;白介素-11;白血病;血小板减少
肿瘤化疗引起的骨髓抑制,尤其是对巨核细胞产生抑制和杀伤作用,导致外周血中血小板计数降低,是引起严重感染及出血的重要原因。血小板减少症是临床常见的化疗药物剂量限制性毒性反应,迫使临床医生降低化疗药物剂量,延迟化疗甚至终止化疗。目前,针对化疗后重度血小板减少,多采用血小板混悬液预防性输注,减少出血危险。然而,血小板保存时间短、来源紧张,反复输注血小板可增加输血反应和输血相关性传染病的风险,反复多次输注血小板产生抗体导致的异体免疫反应等问题也日益突出。目前,只有重组人促血小板生成素(recombinant human thrombopoietin,rhTPO)和重组人白细胞介素-11(recombinant human interleukin-11,rhIL-11)被我国食品药品监督管理局批准用于化疗所致的血小板减少症。rhTPo是高特异性的血小板刺激因子,直接作用于骨髓造血干细胞,对巨核细胞生成的各阶段均有刺激作用。rhIL-11由人类骨髓基质细胞成纤维细胞及间质细胞分泌产生,rhIL-11可以使外周血小板数目增多,同时使网织红细胞和白细胞数目增加。但这两种血小板因子在治疗白血病化疗所致的血小板减少症中究竟孰优孰劣尚缺乏相关证据的系统评价。本研究对rhTPO及rhIL-11治疗白血病化疗后血小板减少症的临床疗效和安全性进行系统评价,并结合临床实际,评价rhTPO的应用价值。
1 资料与方法
1.1 纳入标准
1.1.1 文献类型 国内所有比较rhTPO和rhIL-11两种药物治疗白血病化疗所致血小板减少的平行对照试验,中文文献。
1.1.2 患者类型 白血病诊断均符合《血液病诊断及疗效标准》[1],年龄和性别不限。
1.1.3 干预措施 试验组:rhTPO,15000 U/d。对照组:rhIL-11,1.5 mg/d。
1.1.4 结局指标 ①化疗后血小板最低值;②化疗后血小板恢复的最高值;③化疗后血小板≤50×109/L的持续时间;④化疗后血小板恢复至≥75×109/L的时间;⑤化疗后血小板恢复至≥100×109/L的时间;⑥安全指标为不良反应发生率。
1.2 检索策略 资料来源:中国知网(1997~2015年1月)、万方数据资源系统(1977~2015年1月)、中国科技期刊数据库(1989~2015年1月)。主题词:重组人血小板生成素、血小板减少。
1.3 资料提取 制定文献信息记录表,对文献信息进行采集。查找获取纳入评价的文献全文,由2名评价员按照规范的评价方法独立评价。评价员逐篇阅读初选文献,填写文献信息记录表。提取的文献信息包括文献题目、作者、文献发表时间、患者年龄、体重、男女比例、肿瘤类型、研究方法、干预措施、给药剂量、给药时机、结局指标、随机方法、是否采用分配隐藏、是否采用盲法、是否进行随访、有无失访和退出以及评价人等。1.4 质量评价 文献质量评价按Jadad改良法制定的量表进行评价[2]。具体方法如下:随机序列的产生恰当为2分,不清楚为1分,不恰当为0分;分配隐藏恰当为2分,不清楚为1分,不恰当为0分;盲法恰当为2分,不清楚为1分,不恰当为0分;撤出与退出,描述了为1分,未描述为0分。记分为1~7分,1~3分为低质量研究,4~7分为高质量研究。如发生分歧通过讨论或由第3位研究者协助解决。
1.5 统计学方法 采用Cochrane协作网提供的RevMan5.2.4软件进行Meta分析。对纳入的研究进行异质性(临床异质性和方法学异质性)分析。采用卡方检验分析各研究间的统计学异质性,以P= 0.1为检验水平,同时根据I2判断异质性的大小,I2≤25%为低度异质性,25%~50%为中度异质性,≥50%则为高异质性[3]。如果出现统计学上的异质性,但临床上提示存在同质性,可进行合并,应用随机效应模型进行Meta分析;若异质性过大导致不能合并则采用描述性分析;如异质性源于低质量研究,则进行敏感性分析。潜在的发表偏倚采用漏斗图进行分析。计量资料采用加权均数差值(WMD)作为疗效分析统计量;计数资料以相对危险度(RR)作为疗效分析统计量,二者均以95%Cl表示。
2 结果
2.1 检索结果 共检索出425篇相关文献,其中中国知网(138篇)、万方数据资源系统(164篇)、中国科技期刊数据库(123篇)。经过初步检索和筛选,共收集到7篇[4~10]已发表的有关rhTPO和rhIL-11用于治疗白血病化疗所致的血小板减少的平行研究。
2.2 纳入研究的特征和质量评价 本试验纳入的7篇RCT中,1项研究[10]Jadad改良法评分>3分,具体描述了随机序列产生的方法,未使用盲法。其中3篇[4,6,8]对试验组和对照组的基线情况进行了比较和统计学分析,两组患者的基线情况具有可比性。其余文献都采用随机方法,但未描述具体方法,也均未报道分配隐藏情况和盲法,文献质量评价结果见表1。

表1 纳入研究的特征和质量评价
①化疗后血小板最低值;②化疗后血小板恢复的最高值;③化疗后血小板≤50×109/L的持续时间;④化疗后血小板≥75×109/L的时间;⑤化疗后血小板恢复至≥100×109/L的时间;⑥不良反应发生率
2.3 Meta分析结果
2.3.1 化疗后血小板最低值 共有5项研究比较了化疗后rhTPO组和rhIL-11组血小板的最低值,见图1。rhTPO组共有157名患者,rhIL-11组共有154名患者。异质性检验P= 0.002,I2=77%,研究高异质性,可能与给药时机不一致有关。Meta分析结果提示,rhTPO组和rhIL-11组之间差异无统计学意义[WMD 1.60,95% Cl(-1.99~4.83),P= 0.26]。表明rhTPO和rhIL-11对改善两组患者在化疗后血小板的最低值没有明显差异。

图1 rhTPO组和rhIL-11组血小板最低值的Meta分析
2.3.2 化疗后血小板恢复的最高值 共有6项研究比较了化疗后rhTPO组和rhIL-11组血小板的最高值,见图2。rhTPO组共有183名患者,rhIL-11组共有180名患者。异质性检验P= 0.40,I2=2%,研究低异质性。Meta分析的结果提示rhTPO组的血小板最高值比rhIL-11组更大,两组之间差异有统计学意义[WMD 46.41,95% Cl(32.02~60.81),P< 0.00001]。表明rhTPO能改善白血病患者化疗后血小板的最高值。

图2 rhTPO组和rhIL-11组化疗后血小板最高值的Meta分析
2.3.3 化疗后血小板≤50×109/L的持续时间 共有6项研究比较了化疗后rhTPO组和rhIL-11组患者血小板≤50×109/L的持续时间,见图3。rhTPO组共有183名患者,rhIL-11组共有180名患者。异质性检验P= 0.09,I2=47%,研究有一定的异质性,但程度较低。Meta分析结果提示rhTPO组患者血小板≤50×109/L的持续时间比rhIL-11组患者的更短,两组之间差异有统计学意义[WMD-2.35,95% Cl(-2.68~-2.02),P< 0.00001]。表明rhTPO能缩短白血病患者化疗后血小板≤50×109/L的持续时间。
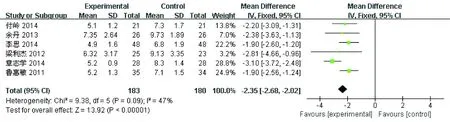
图3 rhTPO组和rhIL-11组血小板≦50×109/L的持续时间的Meta分析
2.3.4 化疗后血小板恢复至≥75×109/L的时间 共有4项研究比较了化疗后rhTPO组和rhIL-11组患者恢复至血小板≥75×109/L的时间,见图4。rhTPO组共有132名患者,rhIL-11组共有131名患者。异质性检验P= 0.32,I2=15%,研究异质性低。Meta分析结果提示rhTPO组患者恢复至血小板≥75×109/L的时间比rhIL-11组患者的更短,两组之间差异有统计学意义[WMD-5.81,95% Cl(-6.66~-4.96),P< 0.00001]。表明rhTPO能缩短白血病患者化疗后恢复至血小板≥75×109/L的时间。
2.3.5 化疗后血小板恢复至≥100×109/L的时间
共有5项研究比较了化疗后rhTPO组和rhIL-11组患者恢复至血小板≥100×109/L的时间,见图5。rhTPO组共有145名患者,rhIL-11组共有142名患者。异质性检验P< 0.00001,I2=97%,研究异质性高,可能与患者停药的时间不一致有关,有的患者血小板计数≥100×109/L时停药,有的患者比给药前上升50×109/L时停药。采用随机效应模型进行Meta分析结果提示,rhTPO组患者恢复至血小板≥100×109/L的时间与rhIL-11组患者之间差异无统计学意义[WMD-4.41,95% Cl(-10.24~-1.42),P= 0.14]。这表明,rhTPO与rhIL-11使白血病患者化疗后恢复至血小板≥100×109/L方面差异无统计学意义。

图5 rhTPO组和rhIL-11组血小板恢复至≥100×109/L的时间的Meta分析
2.3.6 不良反应发生率 共6项研究比较了化疗后rhTPO组和rhIL-11组不良反应发生率,见图6。rhTPO组共181名患者,rhIL-11组共180名患者。异质性检验P= 0.34,I2=12%,研究异质性低。Meta分析结果提示两组间差异有统计学意义[RR 0.19,95% Cl(0.12~0.31),P< 0.00001]。与rhIL-11相比,rhTPO不良反应发生率更低。
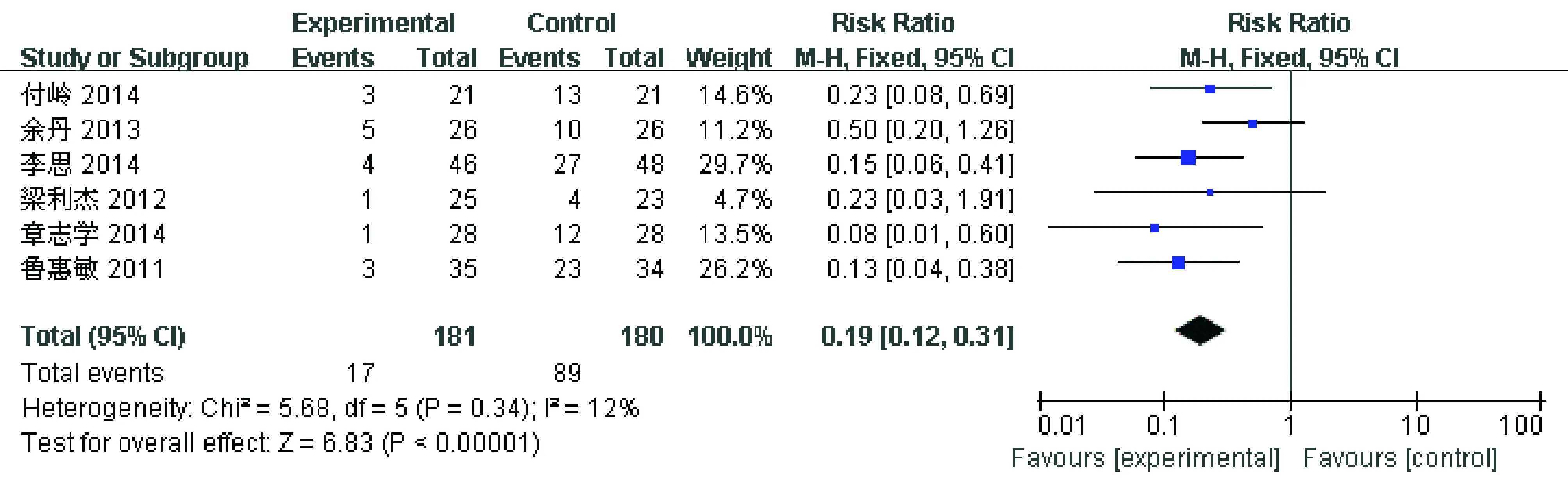
图6 rhTPO组和rhIL-11组不良反应发生率的Meta分析
3 讨论
对于白血病患者来说,化疗所致的血小板减少症常常导致医生降低化疗药物剂量、延迟化疗甚至终止化疗。目前,针对化疗后重度血小板减少,除了进行血小板输注外,只有rhTPO和rhIL-11可以用于此症。目前已有多个临床试验对rhTPO和rhIL-11用于白血病化疗引起的血小板减少症的疗效和不良反应进行比较。由于研究之间存在异质性,并且试验样本量小,难以得出一致可信的结论。本文就rhTPO和rhIL-11用于白血病化疗引起的血小板减少症的平行试验进行系统分析,结果显示,rhTPO能够增加血小板恢复的最高值、缩短血小板≤50×109/L的持续时间,缩短血小板恢复至≥75×109/L的时间,并减少不良反应的发生。但rhTPO与rhIL-11对改善两组患者在化疗后血小板的最低值和使患者恢复至血小板≥100×109/L的时间方面差异无统计学意义。
本系统分析中,临床研究的给药时机存在不一致的情况。7项研究中,其中3项研究的给药时机为血小板计数≤30×109/L或<30×109/L,1项研究为血小板计数≤40×109/L,1项研究为血小板计数≤40×109/L,另外有1项研究未提及给药时机。同时,患者停药的时间也不同,有的患者血小板计数≥100×109/L时停药,有的患者比给药前上升50×109/L时停药。因此,纳入研究的标准不同可能会引起临床异质性,从而会对得出的结论产生影响。
本试验纳入的7篇RCT在设计方面存在一些缺陷,所有文献均提及采用随机方法进行试验,但仅有1篇文献对随机方法进行了描述,其余6篇文献提及但未描述;所有文献均未对分配隐藏、盲法、失访和退出进行描述;其中只有3篇文献对rhTPO组和rhIL-11组的基线情况进行了比较和统计学分析,而其余4篇文献没有进行患者的基线情况比较。由于试验设计方面存在缺陷,因此试验结果可能会受到影响,因此需要谨慎对待这些文献的研究结果。
本系统分析显示,rhTPO与rhIL-11用于治疗白血病化疗所致的血小板减少症,rhTPO略有优势。随着rhTPO和rhIL-11在临床使用的增多,希望有更多设计完善的随机对照试验能更新、补充系统评价的结果。
[1] 张之南,沈悌.血液病诊断及疗效标准[M].第3版.北京:科学出版社,2008.
[2] Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary[J].Control Clin Trials,1996,17(1):1-12.
[3] Higgins JP,Thompson SG.Quantifying heterogeneity in a meta-analysis[J].Stat Med,2002,21(11):1539-1558.
[4] 章志学,肖牛明,肖小芳,等.重组人促血小板生成素治疗急性白血病化疗后血小板减少的效果观察[J].中国当代医药,2014,21(28):91-93.
[5] 余丹,张念,程辉,等.重组人促血小板生成素治疗急性白血病化疗后血小板减少症的疗效[J].实用临床医药杂志,2013,17(17):113-115.
[6] 王子峰.重组人血小板生成素联合白介素-11治疗白血病化疗后血小板减少症的临床效果对比[J].临床研究,2013,20(25):63-64.
[7] 李思,洪珞咖,展昭民,等.重组人血小板生成素与白介素-11治疗急性白血病化疗后血小板减少96例的疗效对比观察[J].航空航天医学杂志,2014,25(4):433-434.
[8] 付岭,张涛,刘金梅,等.重组人血小板生成素与白介素-11治疗白血病化疗后血小板减少症的疗效比较[J].临床军医杂志,2014,42(3):240-242.
[9] 鲁惠敏,鲁会卿,王景昌.重组人血小板生成素与与白介素-11治疗白血病化疗后血小板减少症的疗效比较[J].中国临床药理学杂志,2011,27(2):86-88.
[10]梁利杰,游晓英,郭树霞.重组人血小板生成素治疗恶性血液病化疗后血小板减少的临床观察[J].医药论坛杂志,2012,33(3):86-88.
Meta-analysis of recombinant human thromobopoietin and recombinant human interleukin-11 in the treatment of chemotherapy induced thrombocytopenia
CHUAN Jun-lan,TAN Jia-yu,TANG Mei,LV Jing
(Department of Pharmacy,Sichuan Academy of Medical Science & Sichuan Provincial People’s Hospital,Chengdu 610072,China)
LVJing
Objective To assess the effectiveness and the safety of recombinant human thromobopoietin(rhTPO)and recombinant human interleukin-11(rhIL-11)in the treatment of chemotherapy induced thrombocytopenia.Methods Computer retrieval was conducted to search for randomized controlled studies in which rhTPO was compared with rhIL-11 in chemotherapy induced thrombocytopenia in CNKI(1997 to January,2015),WANFANG DATA(1977 to January,2015),and CSTJ(1989 to January,2015).The results were analyzed by using RevMan5.2.4 software according to the methods of evidence based medicine.Results A total of 7 literatures were included.Compared with rhIL-11,rhTPO could further increase the maximum value of blood platelet,shorten the time interval of blood platelet less than 50×109/L and the time for blood platelet elevating above 75×109/L(allP< 0.00001).In addition,the incidence of adverse drug reactions was low in rhTPO group(RR=0.19,95% Cl =0.12 ~ 0.31,P< 0.00001).However,there was no significant difference in the improvement of minimum value of blood platelet after chemotherapy and in the duration of platelet recovery ≥100×109/L between the two drugs.Conclusion The rhTPO can improve maximum platelet count recovery,shorten the duration of platelet count ≦ 50×109/L,speed up platelet recovery ≥ 75×109/L and indirectly reduce ADR in the treatment of chemotherapy induced thrombocytopenia when compared with rhIL-11.However,large-scale trials with perfect design are needed to confirm the results since there are insufficient designs in all the current clinical trials.
Recombinant human thromobopoietin(rhTPO); Recombinant human interleukin-11(rhIL-11); Leukemia; Thrombocytopenia
吕 晶
R551.3
A
1672-6170(2016)01-0110-05
2015-06-09;
2015-09-30)

