依鲁替尼胶囊处方的筛选研究
安日明(上海交通大学药学院,上海200240)
依鲁替尼胶囊处方的筛选研究
安日明
(上海交通大学药学院,上海200240)
摘要:目的:对依鲁替尼胶囊的处方进行筛选,获得合适的辅料用量。方法:采用正交设计法分别考查崩解剂、表面活性剂和润滑剂,以溶出度为主要考查指标。结果:辅料中影响胶囊溶出度的主要因素是十二烷基硫酸钠,最优处方组成为交联羧甲基纤维素钠13.2mg,十二烷基硫酸钠13.2mg,硬脂酸镁1.8mg。结论:采用本处方可生产出符合质量要求的产品。
关键词:依鲁替尼胶囊;处方筛选;正交试验设计
依鲁替尼(Ibrutinib),商品名Imbruvica,由Pharmacyclics公司和杨森制药共同研制,是第一个获美国食品药品管理局(FDA)批准上市的口服布鲁顿酪氨酸激酶(Bruton′s Tyrosine Kinase,BTK)抑制剂。依鲁替尼作为MCL和CLL治疗药物先后于2013年11月和2014年2月获得FDA批准。2015年1月,FDA批准其扩大至一种罕见的非霍奇金淋巴瘤- Waldenstrom巨球蛋白血症(WM)的治疗,成为首个治疗该疾病的药物[1]。
1 仪器和材料
1.1仪器
CP 224C电子天平(美国奥豪斯公司);SYH- 20三维运动混合机(南京范群干燥设备厂);GL 2- 25型干法制粒机(张家港市开创机械制造有限公司);BT- 1000粉体综合特性测试仪(丹东百特仪器有限公司);NJP- 2- 200C全自动胶囊填充机(瑞安市天宏制药机械有限公司);ZRS- 8L智能溶出试验仪(天津市天大天发科技有限公司);岛津LC- 2010Cht高效液相色谱仪(岛津仪器有限公司);LS- POP(6)激光粒度仪(珠海欧美克公司)。
1.2材料
依鲁替尼(上海升德医药科技有限公司);微晶纤维素101(FMC公司);交联羧甲基纤维素钠(安徽山河药用辅料有限公司);十二烷基硫酸钠(安徽山河药用辅料有限公司);硬脂酸镁(湖州展望药业股份有限公司);明胶空心胶囊(广东开平金亿胶囊有限公司);依鲁替尼胶囊(Pharmacyclics公司)。
2 实验方法、结果及讨论
2.1处方设计
通过文献检索获得原研药处方信息,即依鲁替尼胶囊组成为:依鲁替尼、微晶纤维素、交联羧甲基纤维素钠、十二烷基硫酸钠和硬脂酸镁[2]。其中依鲁替尼难溶于水,呈pH依赖性溶解[3]。因此,处方筛选主要考查对溶出度影响较大的崩解剂、表面活性剂及润滑剂的用量。以微晶纤维素量进行调节,使胶囊的填充量(胶囊内容物量)固定,即优选出以交联羧甲基纤维素钠(A)、十二烷基硫酸钠(B)、硬脂酸镁(C)为考查对象,采用L9(34)正交试验设计法对以上三因素在不同水平下进行筛选优化[4],考查因素及水平见表1。
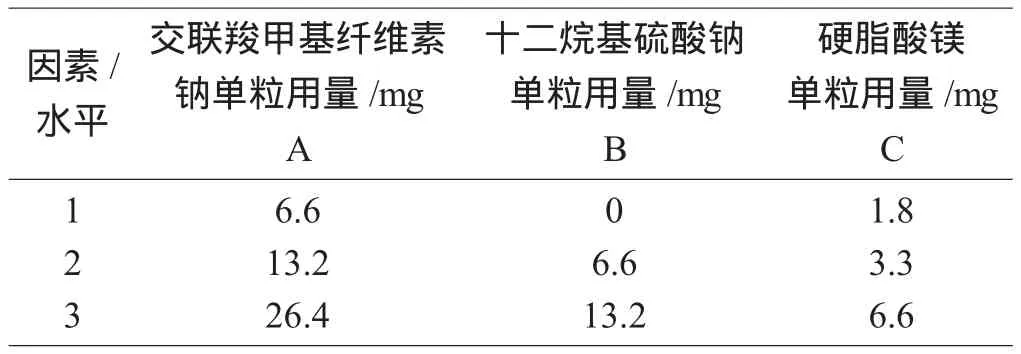
表1 考查因素及水平
2.2依鲁替尼胶囊制备
分别称取处方量的依鲁替尼、微晶纤维素、十二烷基硫酸钠和1/2处方量的交联羧甲基纤维素钠及硬脂酸镁,混合均匀后干法制粒,再加入剩余1/2处方量的交联羧甲基纤维素钠及硬脂酸镁,混合均匀后检测含量,按检测含量计算装量,进行胶囊充填。
2.3溶出度的测定及评价
分别称取本品,按照溶出度测定法(中国药典2015年版四部通则0931第二法,使用沉降篮),以0.3%十二烷基硫酸钠水溶液900mL为溶出介质,经转速为75转/min,45min溶出,取溶液适量过滤,取滤液作为供试品溶液。另精密称取依鲁替尼对照品适量,加入乙腈-水(60∶40)溶解,用溶出介质稀释制成每1mL中约含0.15mg的溶液,摇匀后作为对照溶液。
按照含量测定的方法测定并计算出每粒胶囊中依鲁替尼的溶出量。限度均为标示量的80%。
正交设计的各水平组合处方样品均按以上溶出度方法测定,正交试验结果见表2。
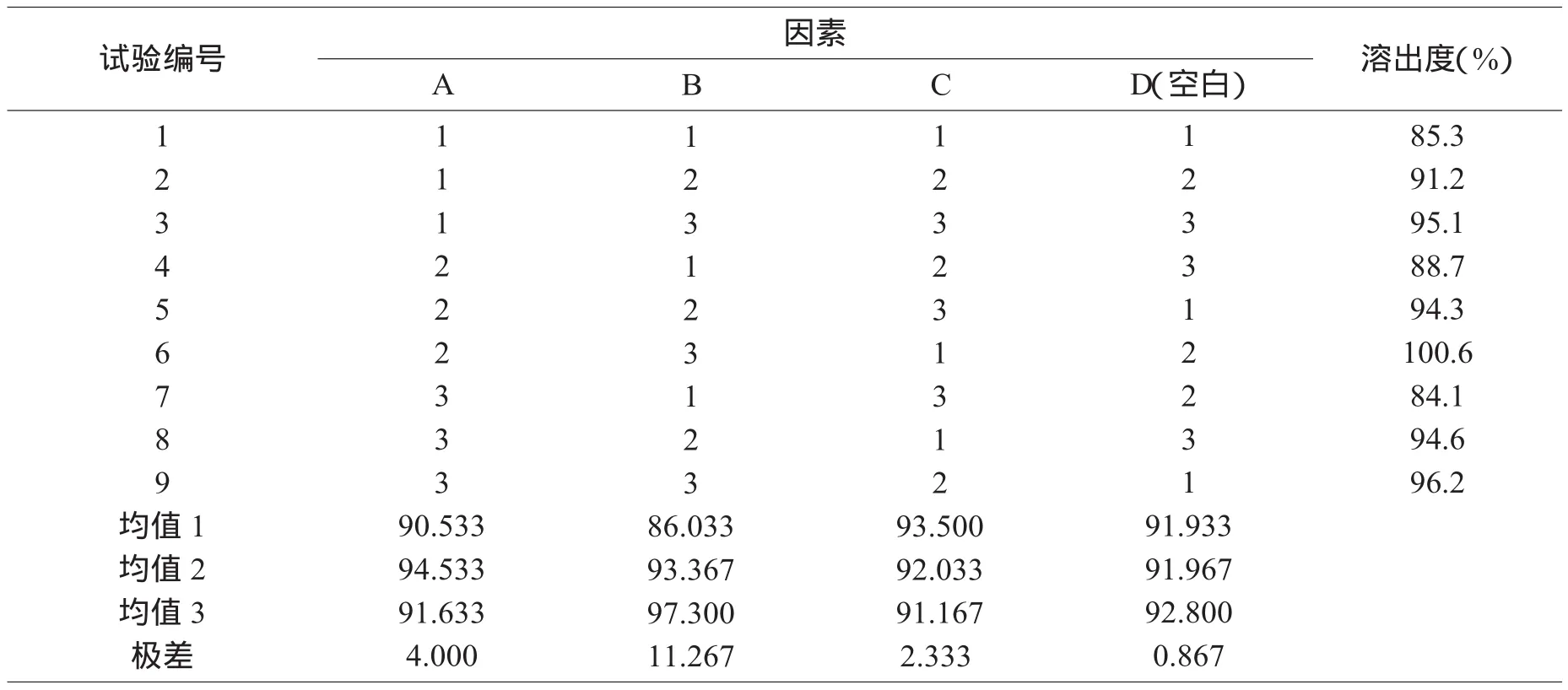
表2 正交试验设计方案及结果
从直观分析可以得出各因素的影响程度:B因素>A因素>C因素,其中十二烷基硫酸钠影响最大,其次是交联羧甲基纤维素钠,硬脂酸镁影响最小,最佳处方为A2B3C1。
方差分析结果见表3。
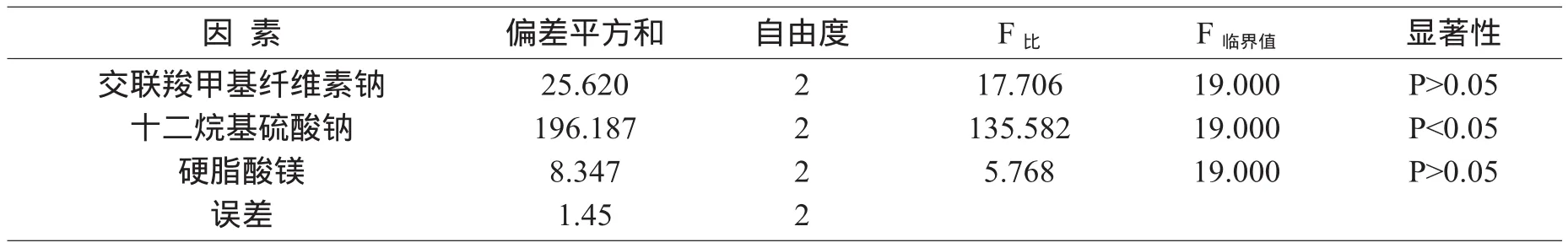
表3 方差分析结果
从方差分析可以看出,影响溶出度的程度为B因素>C因素>A因素,B因素具有显著性影响,C因素、A因素的影响无显著性意义,确定最佳处方为A2B3C1。
从表2、表3的分析可知,直观分析与方差分析结果基本一致。综合考虑填充、成本等因素,最终确定最优处方为A2B3C1,即依鲁替尼140g、微晶纤维素161.8g、交联羧甲基纤维素钠13.2g、十二烷基硫酸钠13.2g、硬脂酸镁l.8g,组成1000粒胶囊的内容量。
2.4溶出行为考查
按上述最佳处方A2B3C1制备样品,分别考查其在0.1mol/L盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液和0.3%十二烷基硫酸钠水溶液这四种溶出介质中的溶出行为,并与原研品进行溶出行为比对。由累积溶出数据(表4)及溶出曲线(图1)可知,自制品及原研品在四种溶出介质中的溶出行为均相似。
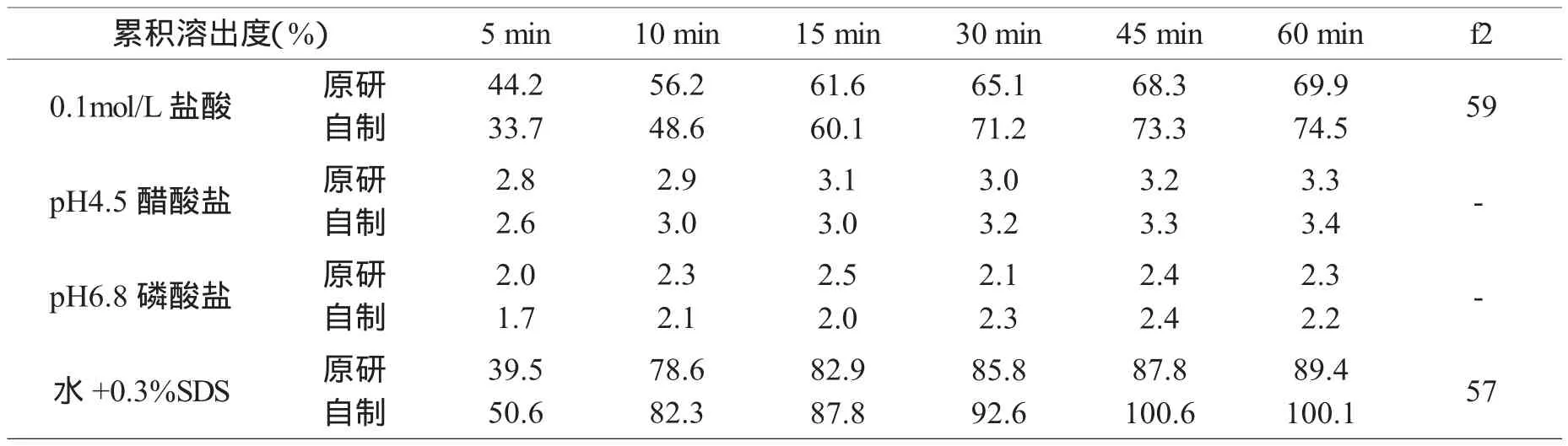
表4 原研品和自制品在各种介质中的累积溶出度
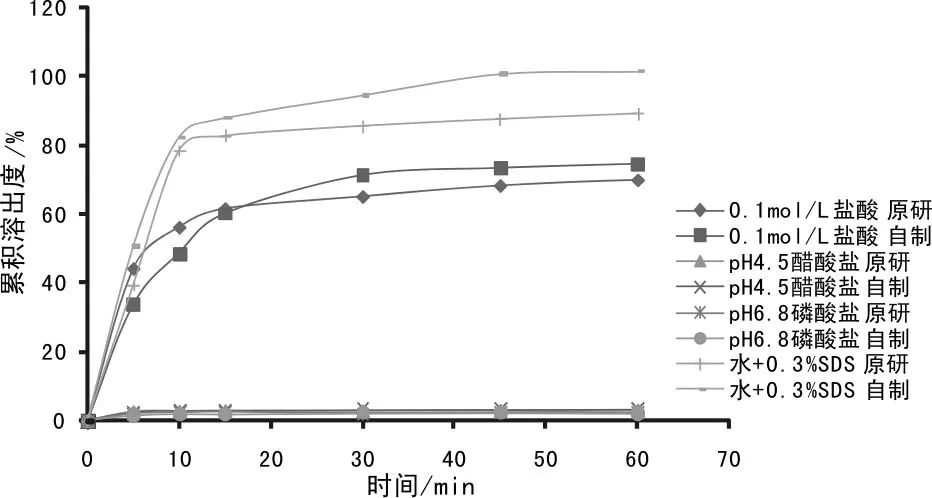
图1 原研品和自制品在四种介质中溶出曲线图
3 结论
按正交设计试验筛选关键辅料,以溶出度为关键评价质量指标开展研究,结果显示:表面活性剂十二烷基硫酸钠对主成分溶出的影响最大,故应添加合适的十二烷基硫酸钠用量。该用量均低于美国FDA非活性成分数据库的辅料最大安全用量[5]。用筛选得出的处方制备样品,在多种不同pH溶出介质中均与原研品溶出行为相似。本处方工艺稳定可控,适合工业化生产。
参考文献
[1]王彦明,钟武,周辛波.口服布鲁顿酪氨酸激酶抑制剂——依鲁替尼[J].临床药物治疗杂志,2015,13(4):27- 30.
[2]FDA批准的Pharmacyclics公司和杨森公司的依鲁替尼胶囊(商品名:Imbruvica)说明书.
[3]FDA依鲁替尼胶囊临床药理学和生物药剂学审评文件第36 页.
[4]张宇红,于艳玲,刘力.盐酸雷诺嗪缓释片的处方设计及体外释放[J].中国医院药学杂志,2011,31(23):16- 22.
[5]http://www.accessdata.fda.gov/scripts/cder/iig/index.cfm.□
Study on Screening of Ibrutinib Capsules Formulation
AN Ri-ming
(College of Pharmacy,Shanghai communications University,Shanghai 200240,China)
Abstract:Objective:To get the appropriate amout of excipients,screen the formulation of ibrutinib capsules.Methods:Orthogonal method was performed in order to choose suitable disintegrant,surfactant,lubricant by using dissolution as indexes.Results:The experimental results indicated sodium lauryl sulfate was the chief factor of influencing dissolution of ibrutinib capsules.The optimum formulation was composed of croscarmellose sodium 13.2mg,sodium lauryl sulfate 13.2mg,magnesiumstearate 1.8mg. Conclusion:The optimumformulation are reliable.
Key words:ibrutinib capsules;formulation screening;orthogonal experiment design
doi:10.3969/j.issn.1008- 553X.2016.03.005
中图分类号:R733.4
文献标识码:A
文章编号:1008- 553X(2016)03- 0013- 03
收稿日期:2016- 01- 12
作者简介:安日明(1982-),男,毕业于北京化工大学,工程师,从事药物研发工作,13524635169,anriming689@163.com。

