不同生物质来源生物炭对Pb(Ⅱ)的吸附特性
林 宁,张 晗,贾珍珍,黄仁龙,舒月红(华南师范大学化学与环境学院,广州510006)
不同生物质来源生物炭对Pb(Ⅱ)的吸附特性
林宁,张晗,贾珍珍,黄仁龙,舒月红*
(华南师范大学化学与环境学院,广州510006)
摘要:以水稻秸秆、小麦秸秆、荔枝树枝为原料,在300、400、500、600℃下制备生物炭,并表征其理化性质,考察热解温度、初始pH、矿物组分等因素对生物炭吸附Pb(Ⅱ)的影响。结果表明,不同热解温度对水稻和小麦秸秆炭吸附Pb(Ⅱ)的影响很小,而荔枝树枝生物炭对Pb(Ⅱ)的吸附量随热解温度升高而显著增大。在pH3.0~6.0的范围内,三种生物炭对溶液中Pb(Ⅱ)的吸附量呈上升趋势;在25℃时,三种生物炭的等温吸附曲线符合Freundlich吸附模型,荔枝树枝生物炭对Pb(Ⅱ)的吸附效果最佳。三种生物炭吸附Pb(Ⅱ)的主导机制可能是其与矿物组分的共沉淀作用,而荔枝树枝生物炭还可能存在Pb(Ⅱ)与-OH、-COOH之间的离子交换作用,C=C键中的π电子在吸附过程中也有一定的贡献。
关键词:秸秆;荔枝树枝;生物炭;Pb(Ⅱ);吸附
林宁,张晗,贾珍珍,等.不同生物质来源生物炭对Pb(Ⅱ)的吸附特性[J].农业环境科学学报, 2016, 35(5):992-998.
LIN Ning, ZHANG Han, JIA Zhen-zhen, et al. Adsorption of Pb(Ⅱ)by biochars derived from three types of biomass[J]. Journal of Agro-Environment Science, 2016, 35(5): 992-998.
生物炭(Biochar)是由生物质(如农林废弃物、动物粪便和污泥等)在完全或部分缺氧情况下经热解产生的高度芳构化的碳质材料[1-2]。近年来,生物炭主要用于固碳、提升土壤肥力和农作物增产,同时由于其具有较高的pH、较大的孔隙度以及丰富的含氧官能团[3],对水、土壤或沉积物中重金属亦有较好的吸附固定作用[4]。因此,生物炭作为一类新型环境功能材料引起广泛关注。
我国铅污染已严重危害到农业生产及人体健康,据不完全统计,我国向环境中排放铅的量高达3.5万t·a-1[5]。目前已有不少学者利用秸秆作为原料制备生物炭,研究其对Pb(Ⅱ)的吸附行为,然而关于秸秆生物炭对Pb(Ⅱ)的具体吸附机理尚不明确。例如:李瑞月等[6]认为,小麦和水稻秸秆热解过程中产生大量碳酸盐、磷酸盐等无机矿物组分对Pb(Ⅱ)的吸附起了重要的作用;安增莉等[7]的研究指出,水稻秸秆主要通过表面含氧官能团的络合作用去除溶液中Pb(Ⅱ)。除此之外,由于不同原料制备的生物质炭的孔隙结构、CEC、表面官能团等理化特性存在一定的差异,进而可能影响对Pb(Ⅱ)的吸附能力和机制。如动物粪便制备的生物炭比表面积较低(<6 m2·g-1),但其灰分含量高,含有大量的磷酸盐和碳酸盐[8],其吸附机制主要为溶液中重金属离子与灰分中的可溶性盐组分形成了沉淀。竹炭、果壳炭、木屑炭等生物炭具有丰富的孔隙结构、较高的比表面积(200~400 m2·g-1),同时含有多种含氧官能团,但其灰分低、阳离子交换量也较低[9],其吸附性能可能与孔结构和表面化学结构相关[10]。目前,关于木质类生物炭的结构及其对Pb(Ⅱ)吸附特性的研究仍较少。
我国是一个农业大国,水稻、小麦等秸秆每年总产量达7.3×108t[11],而这些生物质资源的利用率很低,目前仅为33%,其中大部分被作为废弃物焚烧掉,不仅造成了自然资源的浪费,而且加剧了人类生存环境污染。荔枝作为我国的原产水果,主要分布在华南地区,种植总面积约60万hm2,每年修剪下来的果木残枝量约6.5×105t[12]。本文选择水稻秸秆、小麦秸秆、荔枝树枝三种生物质作为原料,研究了不同热解温度、不同pH值条件下生物炭对重金属Pb(Ⅱ)的吸附特性,并比较木质类生物炭与秸秆类生物炭之间理化性质的差异及其对Pb(Ⅱ)可能存在的不同吸附机制,以期为生物质的资源化利用以及重金属污染土壤的修复提供基础数据。
1 材料与方法
1.1生物炭制备
水稻秸秆、荔枝树枝取自广东省潮州市,小麦秸秆取自安徽省六安市。生物炭的制备采用限氧裂解法[13],于300、400、500、600℃在气氛保护箱式电炉(QSXL-1016,杭州卓驰)中炭化2 h,整个热解过程持续通入100 mL·min-1的N2,冷却至室温后取出,研磨过100目筛,储存于干燥器中备用。由水稻秸秆、荔枝树枝、小麦秸秆于不同热解温度制备得到的生物炭分别记为RSBX、LCBX、WHBX(X为热解温度)。
称取一定量生物炭(RSB600、LCB600、WHB600)于塑料离心管中,以10 mL酸:1 g生物炭的比例加入1 mol·L-1盐酸于室温下振荡30 min,离心弃去上清液,重复3次;再用1 mol·L-1盐酸与1 mol·L-1氢氟酸的混合酸液以同样的方法处理3次。最后用去离子水反复清洗生物炭至滤液呈中性,于60℃烘箱过夜烘干,得到脱表面矿物的生物炭材料,记为RSB600-DA、LCB600-DA及WHB600-DA(其中DA表示去灰分de-ashed)。
1.2生物炭表征
生物炭的产率为制备前后的质量比,灰分由灼烧法测定得到,CEC的测定采用氯化钡-硫酸强制交换法[14]。生物炭pH值用pH计测定,炭水比为1:15(W/ V)[15],零电荷点(PZC)采用质量滴定法测定[16-17]。
利用元素分析仪(MicroCube,德国Elementar)测定生物炭中C、H、N和O元素的含量。采用比表面及孔径分析仪(ASAP 2020,美国Micromeritics Instrument)对生物炭的比表面积及孔径进行测定。生物炭样品与光谱纯KBr充分研磨混合并压片后,于傅里叶变换红外光谱(FTIR)仪(EQUINOX55,德国Bruker)上分析测定,扫描区域为4000~500 cm-1。采用X射线粉末衍射仪(D8-ADVANCE,日本BRUKERAXS)分析生物炭的矿物组分。
1.3批量吸附实验
吸附实验在(25±0.5)℃避光、250 r·min-1水平振荡条件下进行。Pb(Ⅱ)溶液由硝酸铅(优级纯)与超纯水配制而成,以0.01 mol·L-1的NaNO3为背景液。吸附剂添加量为0.08 g样品/40 mL硝酸铅溶液,溶液pH用0.01 mol·L-1HNO3和NaOH溶液调节。
热解温度对吸附的影响:称取一定量300、400、500、600℃下制备的生物炭样品于50 mL离心管中,加入一定Pb(Ⅱ)溶液,平衡吸附24 h[预实验表明,24 h内,Pb(Ⅱ)在不同生物炭上的吸附已完全达到吸附平衡,以下吸附实验均选择24 h作为平衡时间]。溶液初始pH值为5.5,悬液经离心过滤,用火焰原子吸收光谱仪(AAS986,北京普析)测定滤液中Pb(Ⅱ)浓度。
pH值对吸附的影响:在25℃,Pb(Ⅱ)初始浓度为200 mg·L-1,调节溶液pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0,平衡吸附24h后,测定溶液中Pb(Ⅱ)的剩余浓度。
等温吸附实验:根据热解温度的影响实验结果,选取吸附容量较大的RSB600、LCB600、WHB600三种生物炭,配制浓度为100、200、300、400、500、600、700、800、900、1000 mg·L-1的Pb(Ⅱ)溶液,溶液pH值为5.5,研究其在不同Pb(Ⅱ)浓度下对Pb(Ⅱ)的吸附特性。平衡吸附24 h后测定,计算出25℃下生物炭对Pb(Ⅱ)的平衡吸附量Qe(mg·g-1)。
吸附等温线分别用Langmuir模型(1)和Freundlich模型(2)拟合,公式如下:


式中:Ce为平衡浓度,mg·L-1;Qe和Qm分别为平衡吸附量和最大吸附量,mg·g-1;KL(mg·L-1)和KF[(mg·g-1)· (mg·L-1)-n]分别是Langmuir和Freundlich模型参数;n 为Freundlich常数。
矿物组分对吸附的影响:选用RSB600、LCB600、WHB600及RSB600-DA、LCB600-DA、WHB600-DA六个样品。Pb(Ⅱ)初始浓度为200 mg·L-1,溶液初始pH5.5,恒温振荡24 h后过滤,测定溶液中Pb(Ⅱ)的剩余浓度,对比其吸附Pb(Ⅱ)的能力差异。
2 结果与讨论
2.1生物炭性质表征
生物炭产率、灰分、pH、PZC、CEC及比表面积列于表1。产率大小依次为LCB600>RSB600>WHB600,表明木质类生物炭的产率高于秸秆类生物炭。这与Demirbas[18]的研究结果类似,他发现橄榄核生物炭的产率高于玉米棒和茶渣生物炭,主要原因在于橄榄核中木质素含量较高。比表面积的大小为LCB600>WHB600>RSB600。这是由于荔枝树枝含有较多的木质素,孔隙结构细腻多为毛细孔,经高温烧制所得的生物炭仍保留原有部分微孔;而秸秆类生物质富含纤维素,自身含有大量的孔隙且孔壁薄弱,高温下容易坍塌成中孔及大孔,导致比表面积变小。
通常情况下,灰分与pH、CEC呈正相关[19]。从表1可看出,灰分、pH、CEC的大小均为RSB600>WHB600>LCB600。生物炭中的灰分主要以Na、K、Mg、Ca等矿物元素的氧化物或碳酸盐形式存在。RSB600、LCB600 和WHB600的表面矿物组分通过XRD谱图(图1)显示,三种生物炭中除了大量SiO2出现外,LCB600表面还有CaCO3,而RSB600、WHB600表面则出现了Ca2(P2O7)。这可能与其原料有关,秸秆中P元素含量普遍高于树木中的P含量[20]。生物炭上的大量无机矿物组分是其呈碱性的主要原因,同时能与重金属发生共沉淀。
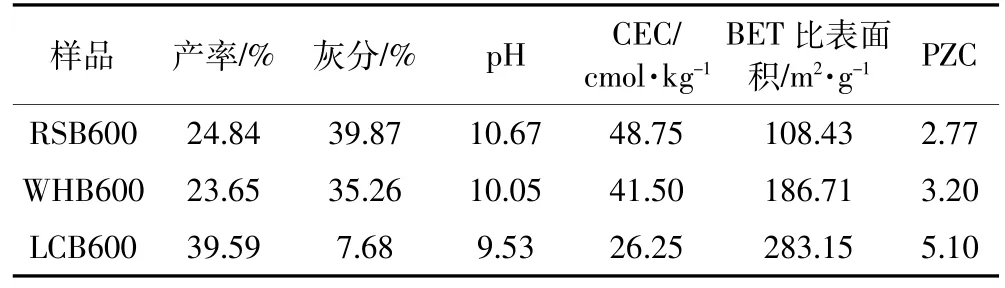
表1 生物炭的理化性质Table 1 Selected physical and chemical properties of biochars

图1 LCB600、RSB600、WHB600吸附Pb(Ⅱ)前后的XRD图Figure 1 XRD spectra of LCB600,RSB600,WHB600 before and after Pb(Ⅱ)adsorption
生物炭的表面官能团种类显示于FTIR光谱图(图2)中。与波数3388、1566、875 cm-1处所对应的羟基(-OH)、芳香性C=C、C-H基团,三种生物炭中均存在。1690 cm-1处为羧基(-COOH)或酮类中的C=O伸缩振动,只明显出现在LCB600中,WHB600只出现一个弱峰,而RSB600没有出现相应峰。LCB600在 1204、1394 cm-1处出现的吸收峰代表酚羟基和羧基中C-O键的形成[21]。1017、1054 cm-1处的吸收峰为专属纤维素中的C-O-C键[22],出现在RSB600、WHB600表面。789 cm-1处的吸收峰对应的是无机官能团Si-OSi的振动吸收。总体上看,荔枝树枝生物炭生成的表面官能团种类较多,其中以羟基、羧基等含氧基团为主,为吸附Pb(Ⅱ)提供了更多的活性位点。
PZC为表征生物炭表面酸碱性的一个重要参数,其大小与生物炭表面酸性官能团特别是羟基有着密切的关系。对比图2中-OH键对应的峰强,秸秆类生物炭的峰较为清晰。羟基基团在溶液中易于解离出质子,使得秸秆类生物炭的PZC低于荔枝树枝生物炭(与表1对应)。
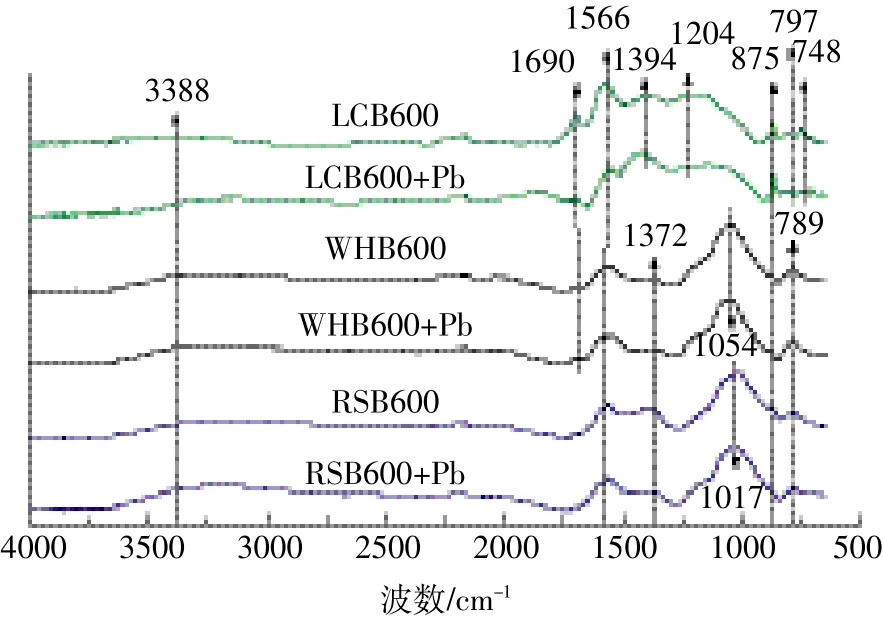
图2 LCB600、RSB600、WHB600吸附Pb(Ⅱ)前后的傅里叶红外光谱图Figure 2 FTIR spectra of LCB600,RSB600,and WHB600 before and after Pb(Ⅱ)adsorption
2.2热解温度对生物炭吸附Pb(Ⅱ)的影响
热解温度对生物炭吸附Pb(Ⅱ)的影响如图3所示,Pb(Ⅱ)溶液初始浓度为200 mg·L-1,热解温度为300、400、500、600℃。随着热解温度的提高,水稻秸秆与小麦秸秆生物炭对Pb(Ⅱ)的吸附效果变化很小,吸附容量均大于100 mg·g-1;而荔枝树枝生物炭对Pb(Ⅱ)的吸附量呈明显上升趋势,600℃时达最大吸附值。这与戴静等[23]的研究结果一致,他们发现水稻秸秆生物炭在300~700℃范围内对Pb(Ⅱ)的去除率几乎没有变化(97%以上),而木屑生物炭对Pb(Ⅱ)的去除率随温度升高而增大。
生物质在热解过程中C含量不断增加,而O、H和N含量逐渐降低,表明高温生物炭的碳化程度更高,具有更大的比表面积。一般情况下,高温生物炭具有更完备的芳香结构和较少的含氧官能团。随着热解温度的升高,生物炭中K、Ca和Mg等无机元素不断富集,但溶解性Ca2+、Mg2+和PO4-3含量却逐渐降低,这是由于无机元素在高温生物炭中形成了更稳定、更难溶的矿物晶体,如(Ca,Mg)3(PO4)2、Mg2P2O7等[28]。除此之外,高温生物炭(≥500℃)中更完备的π共轭芳香结构为阳离子-π作用提供了更多的活性位点,这一点对于木质类生物质来源的生物炭尤其明显[29]。由图1、

图3 热解温度对生物炭吸附Pb(Ⅱ)的影响Figure 3 Effect of pyrolysis temperature on Pb(Ⅱ)adsorption by biochars
2.3初始pH值对吸附Pb(Ⅱ)的影响
溶液pH是影响重金属离子吸附的重要因素之一。当pH>6时,溶液中Pb(Ⅱ)会与OH-产生沉淀,故本实验不予考虑。pH对生物炭吸附Pb(Ⅱ)的影响如Pb(OH)+逐渐增加(pH<8)。溶液中加入生物炭后,生物炭表面的吸附位点会与Pb(Ⅱ)迅速发生反应。当pH>5时,部分铅离子可能转化为Pb(OH)+形态,而当pH到达6.0时,溶液中OH-增加,可能与Pb(Ⅱ)生成氢氧化物络合物,从而减小金属离子的自由度,降低生物炭对其吸附的效果。
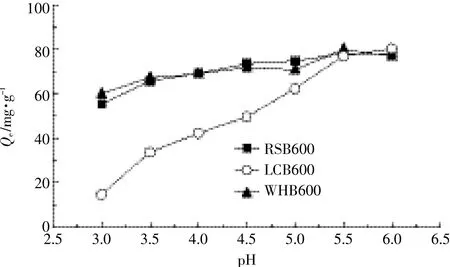
图4 初始pH值对生物炭吸附Pb(Ⅱ)的影响Figure 4 Effect of initial pH on Pb(Ⅱ)adsorption by biochars
2.4等温吸附曲线
用Freundlich模型拟合三种生物炭在25℃下对Pb(Ⅱ)的吸附等温线(图5),各参数拟合结果见表2。
Langmuir模型是假设所有的吸附点对吸附质具有相同的亲和力,且一个吸附点上的吸附不会影响邻近点吸附的理想单分子层吸附模型[25]。Freundlich模型适用于非均一表面条件下的吸附,在高浓度时吸附量会持续增加。比较两种模型拟合的线性相关系数R2可知,Freundlich模型能更好地描述3种生物炭的等温吸附行为,即RSB600、WHB600、LCB600的吸附位点呈现出异质性,可能存在表面有机官能团的专性吸附或络合作用。参数KF为Freundlich模型中与吸附容量和吸附强度有关的常数,KF越大则吸附能力越强。3种生物炭对Pb(Ⅱ)的吸附能力大小依次为LCB600>WHB600>RSB600。
为讨论不同生物炭对Pb(Ⅱ)可能的吸附机理,利用3种生物炭吸附Pb(Ⅱ)前后的XRD、FTIR对比谱图进行验证,其结果见图1和图2。生物炭对重金属离子的吸附机理与矿物组分有着很大的关系。在生物炭吸附前后的XRD图谱(图1)中可以看出,吸附Pb(Ⅱ)之后,LCB600主要形成PbCO3沉淀,而RSB600、WHB600表面主要生成了Pb2O3和Pb3(PO4)2。这表明,Pb(Ⅱ)被这3种生物炭吸附后进一步转化为以上这些新的矿物相。这与Cao等[26]的研究结果相同,他们比较了动物粪肥在200℃和350℃烧制的生物炭与活性炭对Pb(Ⅱ)的吸附效果,并发现溶液中85%的Pb(Ⅱ)通过生物炭中的磷酸盐和碳酸盐生成新的矿物相。因此,可以推断与矿物组分的共沉淀作用也是生物炭吸附Pb(Ⅱ)的主导机制。
为了进一步证明这一吸附机制,将去灰分生物炭(RSB600-DA、LCB600-DA、WHB600-DA)与未处理生物炭(RSB600、LCB600、WHB600)进行吸附比较实验,其结果见图6。数据显示去灰分生物炭对Pb(Ⅱ)的吸附容量为48.5~55.6 mg·g-1,约为未处理生物炭吸附Pb(Ⅱ)容量的43%。进一步证明生物炭表面矿物组分在吸附Pb(Ⅱ)过程中起了主导作用。
除了表面矿物组分的作用,生物炭还通过表面官能团与Pb(Ⅱ)之间的络合沉淀去除Pb(Ⅱ)。FTIR分析结果显示,RSB600、WHB600吸附前后谱图变化不大,LCB600中则有多处谱带发生明显位移或峰强减弱。从图2可以看出,LCB600在3388 cm-1处发生了明显位移,可能是Pb(Ⅱ)与羟基中的H+进行离子交换。吸附Pb(Ⅱ)后,代表羧酸中C=O、C-O的1690 cm-1与1204 cm-1处峰强显著降低,羧基同样能提供H+,与Pb(Ⅱ)发生离子交换反应,从而降低了溶液中的Pb(Ⅱ)浓度。1566 cm-1处峰强的减弱说明Pb(Ⅱ)可能与共轭芳香结构C=C中的π电子产生阳离子-π作用[27]。因此,荔枝树枝生物炭对Pb(Ⅱ)具有较强的吸附能力,主要是由于表面官能团与Pb(Ⅱ)发生了专性吸附,参与吸附反应的主要官能团有-OH、C=O、C-O。

图5 生物炭对Pb(Ⅱ)的吸附等温线Figure 5 Freundlich isotherms of Pb(Ⅱ)adsorption by biochars

图6 去灰分处理前后生物炭对Pb(Ⅱ)的吸附差异Figure 6 Difference of Pb(Ⅱ)adsorption by biochars(RSB600,LCB600,WHB600)and de-ashed biochars(RSB600-DA,LCB600-DA,WHB600-DA)

表2 Freundlich和Langmuir方程拟合吸附等温线的相关参数Table 2 Parameters of Freundlich and Langmuir equations for Pb(Ⅱ)adsorption on different biochars
总体来说,生物炭对Pb(Ⅱ)可能的吸附机制可归纳为3个方面:(1)Pb(Ⅱ)与矿物组分释放的PO3-4或CO2-3形成沉淀;(2)Pb(Ⅱ)与含氧官能团(如羟基和羧基)发生离子交换;(3)Pb(Ⅱ)与π电子(C=C)间的阳离子-π作用。
3 结论
600℃制备的三种生物炭对Pb(Ⅱ)的吸附性能最佳。生物炭对Pb(Ⅱ)的吸附量随着pH值的上升而增加,其中LCB600的吸附过程受pH值影响较大;三种生物炭对Pb(Ⅱ)的吸附可用Freundlich等温方程较好地拟合,LCB600对Pb(Ⅱ)具有较强的吸附性能。RSB600、WHB600主要通过CaCO3、Ca2(P2O7)等矿物组分与Pb(Ⅱ)产生共沉淀作用;LCB600表面含有大量矿物晶体,同时含有多种表面官能团如-OH、-COOH、C=C,可能与Pb(Ⅱ)发生离子交换、表面络合等反应。
参考文献:
[1]Emma M. Black is the new green[J]. Nature, 2006, 442:624-626.
[2]Lehmann J, Gaunt J, Rondon M. Biochar sequestration in terrestrial ecosystems:A review[J]. Mitigation and Adaptation Strategies for Global Change, 2006, 11(2):395-419.
[3]Kolodyńska D, Wnetrzak R, Leahy J J, et al. Kinetic and adsorptive characterization of biochar in metal ions removal[J]. Chemical Engineering Journal, 2012, 197:295-305.
[4]Cao X D, Ma L N, Liang Y, et al. Simultaneous immobilization of lead and atrazine in contaminated soils using dairy-manure biochar[J]. Environ Sci Technol, 2011, 45(11):4884-4889.
[5]谢志宜,陈能场.微胶囊EDTA对2种土壤中铅释放的影响[J].生态环境学报, 2012, 21(6):1131-1137. XIE Zhi-yi, CHEN Neng-chang. Extraction and leaching of Pb from two polluted soils as affected by addition of microencapsulated EDTA[J]. E-cology and Environmental Sciences, 2012, 21(6):1131-1137.
[6]李瑞月,陈德,李恋卿,等.不同作物秸秆生物炭对溶液中Pb2+、Cd2+的吸附[J].农业环境科学学报, 2015, 34(5):1001-1008. LI Rui-yue, CHEN De, LI Lian-qing, et al. Adsorption of Pb2+and Cd2+in aqueous solution by biochars derived from different crop residues[J]. Journal of Agro-Environment Science, 2015, 34(5):1001-1008.
[7]安增莉,侯艳伟,蔡超,等.水稻秸秆生物炭对Pb(Ⅱ)的吸附特性[J].环境化学, 2011, 30(11):1851-1857. AN Zeng-li, HOU Yan-wei, CAI Chao, et al. Lead(Ⅱ)adsorption characteristics on different biochars derived from rice straw[J]. Environmental Chemistry, 2011, 30(11):1851-1857.
[8]Xu X Y, Cao X D, Zhao L. Removal of Cu, Zn, and Cd from aqueous solutions by the dairy manure-derived biochar[J]. Environmental Science and Pollution Research, 2013, 20(1):358-368.
[9]袁金华,徐仁扣.生物质炭的性质及其对土壤环境功能影响的研究进展[J].生态环境学报, 2011, 20(4):779-785. YUAN Jin-hua, XU Ren-kou. Progress of the research on the properties of biochars and their influence on soil environmental functions[J]. Ecology and Environmental Sciences, 2011, 20(4):779-785.
[10]陈凤婷,李诗敏,曾汉民.几种植物基活性炭材料的表面结构与吸附性能比较[J].离子交换与吸附, 2004, 20(4):340-347. CHEN Feng-ting, LI Shi-min, ZENG Han-min. Comparison on surface structure and adsorption properities of several types of plant -based carbonaceousadsorbents[J].Ion Exchange and Adsorption,2004,20(4):340-347.
[11]刘洪凤,俞镇慌.秸秆纤维性能[J].东华大学学报(自然科学版), 2002, 28(2):123-127. LIU Hong-feng, YU Zhen-huang. Properties of straw fiber[J]. Journal of Donghua University(Natural Science Edition), 2002, 28(2):123-127.
[12]陈艺敏,陈建福.改性荔枝壳对废水中Cu(Ⅱ)的吸附性能[J].吉林师范大学学报(自然科学版), 2014(3):115-119. CHEN Yi-min, CHEN Jian-fu. Adsorption behavior of modified lychee exocarp for Cu(Ⅱ)in wastewater[J]. Journal of Jilin Normal University (Natural Science Edition), 2014(3):115-119.
[13]Lehmann J. A handful of carbon[J]. Nature, 2007, 447(7141):143-144.
[14]张彦雄,李丹,张佐玉,等.两种土壤阳离子交换量测量方法的比较[J].贵州林业科技, 2010, 38(2):45-49. ZHANG Yan-xiong, LI Dan, ZHANG Zuo-yu, et al. Comparison of two soil cation exchangecapacitymeasurement methods[J].Guizhou Forestry Science and Technology, 2010, 38(2):45-49.
[15]Nguyen B T, Lehmann J. Black carbon decomposition under varying water regimes[J]. Organic Geochemistry, 2009, 40(8):846-853.
[16]Kikuchi Y, Qian Q R, Machida M, et al. Effect of ZnO loading to activated carbon on Pb(Ⅱ)adsorption from aqueous solution[J]. Carbon, 2006, 44(2):195-202.
[17]陆泗进,谭文峰,刘凡,等.一种改进的盐滴定法测定氧化锰矿物的电荷零点[J].土壤学报, 2006, 43(5):756-763. LU Si-jin, TAN Wen-feng, LIU Fan, et al. Point of zero charge(PZC)of manganese oxides determined with an improved salt titration method [J]. Acta Pedologica Sinica, 2006, 43(5):756-763.
[18]Demirbas A. Effects of temperature and particle size on bio-char yield from pyrolysis of agricultural residues[J]. Journal of Analytical and Applied Pyrolysis, 2004, 72(2):243-248.
[19]Singh B, Singh B P, Cowie A L. Characterisation and evaluation of biochars for their application as a soil amendment[J]. Australian Journal of Soil Research, 2010, 48:516-525.
[20]Wang Z Y, Liu G C, Zheng H, et al. Investigating the mechanisms of biochar′s removal of lead from solution[J]. Bioresour Technol, 2015, 177:308-317.
[21]Cai D Q, Wang L H, Zhang G L, et al. Controlling pesticide loss by natural porous micro/nano composites:Straw ash -based biochar and biosilica[J]. ACS Applied Materials & Interfaces, 2013, 5(18):9212-9216.
[22]Fang Q L, Chen B L, Lin Y J, et al. Aromatic and hydrophobic surfaces of wood-derived biochar enhance perchlorate adsorption via hydrogen bonding to oxygen-containing organic groups[J]. Environ Sci Technol, 2014, 48(1):279-288.
[23]戴静,刘阳生.四种原料热解产生的生物炭对Pb2+和Cd2+的吸附特性研究[J].北京大学学报(自然科学版), 2013, 49(6):1075-1082. DAI Jing, LIU Yang-sheng. Adsorption of Pb2+and Cd2+onto biochars derived from pyrolysis of four kinds of biomasses[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2013, 49(6):1075-1082.
[24]Mohsen J, Fathemeh A. Sunflower stalk, an agricultural waste, as an adsorbent for the removal of lead and cadmium from aqueous solutions [J]. Journal of Material Cycles and Waste Management, 2013, 15(4):548-555.
[25]Langmuir I. The adsorption of gases on plane surfaces of glass, mica and platinum[J]. JACS, 1918, 40(9):1361-1403.
[26]Cao X D, Ma L Q, Gao B, et al. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environ Sci Technol, 2009, 43:3285-3291.
[27]Ma C, Dougherty D A. The cation-π interaction[J]. Chemical Reviews, 1997, 97(5):1303-1324.
[28]Zheng H, Wang Z Y, Zhao J, et al. Characteristics and nutrient values of biochars produced from giant reed at different temperatures[J]. Bioresource Technology, 2013, 130:463-471.
[29]王震宇,刘国成, Xing monica,等.不同热解温度生物炭对Cd(Ⅱ)的吸附特性[J].环境科学, 2014, 35(12):4735-4744. WANG Zhen-yu, LIU Guo-cheng, Xing monica, et al. Adsorption of Cd(Ⅱ)varies with biochars derived at different pyrolysis temperatures[J]. Environmental Science, 2014, 35(12):4735-4744.
中图分类号:X705
文献标志码:A
文章编号:1672-2043(2016)05-0992-07
doi:10.11654/jaes.2016.05.025
收稿日期:2015-11-11
基金项目:NSFC-广东联合重点基金项目(U1201234);国家自然科学基金(21347003)
作者简介:林宁(1991—),女,硕士研究生,主要研究方向为土壤重金属修复。E-mail:guaifene@163.com
*通信作者:舒月红E-mail:hongershu@163.com
Adsorption of Pb(Ⅱ)by biochars derived from three types of biomass
LIN Ning, ZHANG Han, JIA Zhen-zhen, HUANG Ren-long, SHU Yue-hong
(School of Chemistry and Environment, South China Normal University, Guangzhou 510006, China)
Abstract:Three different raw materials, including rice straw, wheat straw, and lychee branches, were used to produce biochars by pyrolysis at 300, 400, 500, and 600℃. The characteristics of the biochars obtained were analyzed. The effects of biochar pyrolysis temperature and mineral composition and initial solution pH on Pb(Ⅱ)adsorption by biochars were examined. Results showed that pyrolysis temperature exhibited no obvious influence on Pb(Ⅱ)adsorption by rice and wheat straw derived biochars, while the adsorption of Pb(Ⅱ)by lychee derived biochar increased with increasing pyrolysis temperature. As solution pH increased from 3.0 to 6.0, the amount of Pb(Ⅱ)adsorbed on all biochars gradually increased. Adsorption isotherms of Pb(Ⅱ)by these biochars fit the Freundlich model well. In addition, lycheederived biochar showed greater Pb(Ⅱ)adsorption than the biochars derived from rice and wheat straws. Chemical precipitation of Pb(Ⅱ)with mineral components might be the main mechanism of Pb(Ⅱ)adsorption by these biochars. Lychee-derived biochar contained a variety of functional groups, such as -OH, -COOH, and C=C, thus providing different adsorption sites, including aromatic-π structures(for cationπ interaction)and oxygen-containing groups(for ion exchange adsorption)for Pb(Ⅱ)adsorption.
Keywords:crop straw; lychee branches; biochar; Pb(Ⅱ); adsorption

