介孔二氧化硅在癌症化疗药物控释和靶向输送中的应用进展
穆京海, 叶 舟, 张 权, 尹 健
江南大学生物工程学院, 糖化学与生物技术教育部重点实验室, 江苏 无锡 214122
介孔二氧化硅在癌症化疗药物控释和靶向输送中的应用进展
穆京海,叶舟,张权*,尹健*
江南大学生物工程学院, 糖化学与生物技术教育部重点实验室, 江苏 无锡 214122
摘要:癌症化疗往往会给患者带来极大的毒副作用,开发新型具有可控药物释放和靶向药物输送功能的纳米材料是提高抗癌药物输送药效和降低毒副作用的关键。介孔二氧化硅的高比表面积、均一介孔结构、可控粒子尺寸、易于进行化学修饰等性能使其非常适合作为可控药物释放和靶向治疗癌症的优良载体系统。概括了最近几年介孔二氧化硅在药物控制释放和靶向药物输送治疗癌症中的研究进展,并展望了介孔二氧化硅纳米材料作为药物输送系统在癌症治疗方面未来的发展方向。
关键词:癌症化疗;介孔二氧化硅;可控药物释放;靶向药物输送
随着纳米科技的发展,纳米尺度材料的研究与开发已经在药物输送、诊断治疗和医学成像等医药学生物技术领域引起了越来越多科学家的关注[1,2]。在众多的纳米材料中,介孔二氧化硅纳米材料由于其具有高比表面积、连续可调控的介孔结构、优良的生物相容性及表面功能基团易于被修饰等特性,更是成为人们研究的热点[3,4]。自20世纪90年代,有序的介孔二氧化硅MCM-41家族被首次合成与报道后[5],关于介孔二氧化硅的合成方法研究进展突飞猛进。通常,介孔二氧化硅的合成方法包括溶胶-凝胶法、相转变法、微波合成法、水热合成法以及沉淀法等[6~11]。目前,各种各样新颖结构的介孔二氧化硅纳米材料如管状、棒状、薄膜状、中空、夹心、椭球状以及笼状等已经被成功制备出来[6,7,9,10]。
科研人员对介孔二氧化硅的早期研究限于工业催化等领域,而其在药物输送领域的研究起初并未引起人们的重视。直到2001年,介孔二氧化硅纳米粒子被首次报道应用于药物输送[12],人们才关注到其在药物输送方面的重要研究价值。而随着FDA将二氧化硅认证为安全后,出现了大量关于介孔二氧化硅材料用于药物输送的报道。相对于其他纳米材料而言,介孔二氧化硅在药物输送方面有着如下的特性:①高比表面积与孔道容量为药物吸附与装载提供了极大的方便[13];②优良的介孔结构与孔径大小的可调控性使其能够更好的控制和释放药物[14,15];③易于表面修饰为其提供了可控与靶向输送的可能,进而可以提高药效降低毒副作用[16,17];④介孔二氧化硅纳米材料还可以与磁性材料和发光材料相结合实现药物输送与生物成像的多功能协同作用[18]。正是由于这些独特的性质,介孔二氧化硅在药物输送领域的研究具有极大的发展空间。本文将重点归纳近年来介孔二氧化硅纳米粒子在可控药物释放和靶向药物输送方面的研究进展,以期为介孔二氧化硅纳米粒子在癌症治疗中的应用提供参考。
1可控药物释放
肿瘤微环境是肿瘤细胞所处的内环境,肿瘤微环境具有低氧、低pH、高间质液压的生理特性,与肿瘤的发生、发展、入侵、转移、代谢等密切相关。由于肿瘤组织高速代谢、快速生长,所以需要大量的能量供应,肿瘤组织中的代谢以无氧酵解为主,无氧酵解会产生很多乳酸,由于肿瘤组织中缺乏有效的脉管系统,不能及时有效地将代谢产物运输出去,促成了肿瘤组织中的微酸环境。此外,肿瘤微环境存在着高表达的基质金属蛋白酶。肿瘤微环境与正常组织环境在pH、谷胱甘肽、酶等各种理化因素方面有着显著的不同,因此为设计具有药物可控释放的介孔硅纳米粒子治疗肿瘤打下了坚实基础。
理想的可控药物释放系统应该具备两个条件:一方面在到达肿瘤部位前应尽量使药物的释放量降至最低甚至是零释放;另一方面,在到达肿瘤病变部位时能迅速大量地释放所载药物。介孔二氧化硅有着稳定的介孔结构,因而能够为所装载的药物提供比有机材料更加可靠的保护,保证了药物不会在进入病灶前过早释放。易修饰的表面使其容易通过修饰而获得对刺激因子响应的能力。
1.1pH敏感药物释放
人体正常组织或血液中的pH大致呈中性(pH 7.4),而很多实体肿瘤组织中的pH呈弱酸性(pH 6.75~6.87)[19],癌细胞内溶酶体的pH甚至比细胞外的肿瘤组织更低(pH<5.5)。因而,这种由正常组织到肿瘤组织直至癌细胞内的异常pH梯度是设计具有pH敏感药物释放性能的介孔二氧化硅选择性治疗肿瘤的理论基础。
实现pH敏感药物释放的关键是在介孔二氧化硅表面的孔道口处修饰对pH敏感的化学基团或大分子(图1,彩图见图版一)[20~23]。例如:Gulfam等[20]将壳聚糖连接在介孔二氧化硅表面,使其成为介孔二氧化硅孔道的“守门人”。在pH 7.4的正常组织和血液中,壳聚糖的去质子化使其收缩并关闭介孔二氧化硅孔道开口,药物不能释放。而在癌细胞溶酶体的酸性环境中,壳聚糖带有正电荷而质子化,通过静电排斥打开介孔二氧化硅孔道,从而释放出药物。而Zhang等[21]利用对酸性敏感的腙键将抗癌药物阿霉素共价键连在介孔二氧化硅的表面,同样可以实现pH敏感的抗癌药物阿霉素的释放,从而有效地抑制人宫颈癌细胞的增殖。
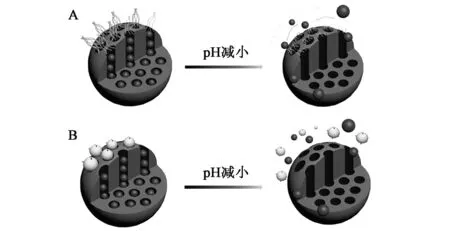
图1 利用pH敏感的连接臂将聚合物(A)或纳米粒子(B)连接在介孔硅纳米粒子表面示意图[23]Fig.1 Schematic diagram of polymers (A) and nanoparticles (B) that linked to the surface of MSNs via pH-sensitive linkers[23].(彩图见图版一)
1.2谷胱甘肽敏感药物释放
谷胱甘肽(glutathione,GSH)是人体中含量最丰富的还原性物质,而且其在肿瘤组织中的含量远远高于正常组织和血液[24]。此外,据报道癌细胞内细胞质中GSH含量远高于正常细胞内含量[25], 因此,GSH敏感的可控药物释放介孔二氧化硅可以作为选择性输送抗癌药物进入癌细胞的载体系统[26,27]。例如:Wang等[28]利用可以被谷胱甘肽还原的二硫键为连接臂把聚乙二醇(polyethylene glycol,PEG)连接于介孔二氧化硅的表面(图2,彩图见图版一)。二硫键连接的PEG作为“守门人”有效地改善了药物释放特性,实现了药物的氧化还原响应释放。
最近,Dong等[29]设计开发了一种利用二硫键将脂肪链键连在二氧化硅纳米粒子表面,再通过亲疏水相互作用将两亲性多肽包裹在粒子表面。在进入恶性胶质瘤细胞后,二硫键被谷胱甘肽键切断,从而释放出药物杀死细胞。
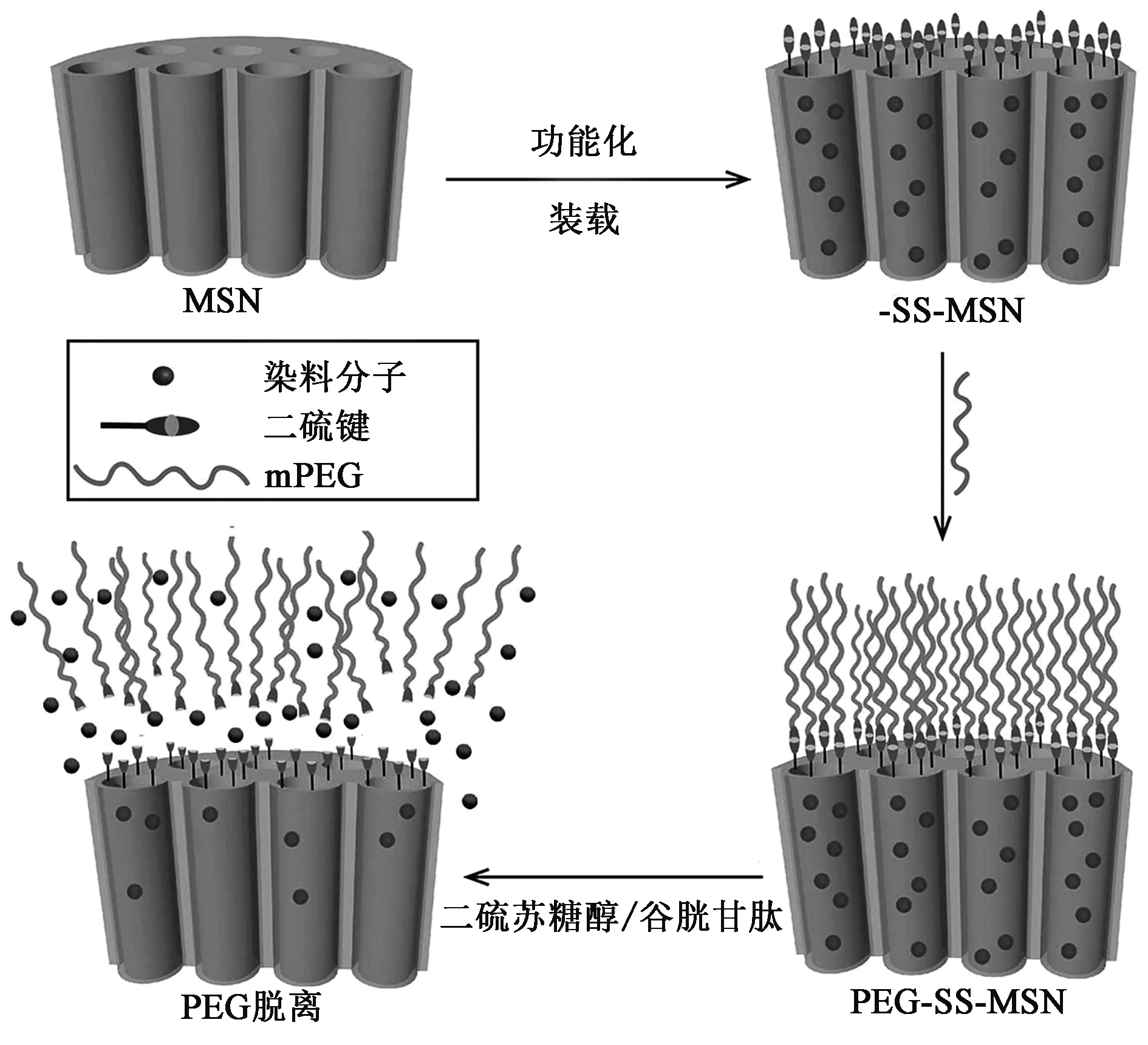
图2 谷胱甘肽敏感的PEG修饰介孔硅纳米粒子示意图[28]Fig.2 Schematic dragram of MSNs modified by GSH-responsive PEG[28].(彩图见图版一)
1.3酶敏感药物释放
基质金属蛋白酶MMP-2是在许多癌症细胞中都过表达的一种酶,而且它与肿瘤的入侵和转移密切相关。Liu等[30]将细胞穿透肽聚精氨酸和可被MMP-2分解的底物肽PVGLIG组合修饰到介孔二氧化硅表面。然后再以苯硼酸(phenylboronic acid,PBA)和人血清白蛋白(human serum albumin,HSA)组成的PBA-HSA封闭粒子介孔形成最终的酶响应药物输送系统。研究表明,PBA对唾液酸有很好的亲和性,而人肝癌细胞(HepG2)能够过量表达唾液酸,因而PBA作为此药物载体的靶向分子具有靶向肝癌细胞的巨大潜力。体外细胞实验证明该载药系统能够有效诱导HepG2细胞凋亡,并且体内动物实验也表明该酶敏感的药物输送系统能够高效抑制肿瘤生长而产生很小的毒副作用。
2靶向药物输送
静脉注射是最常见的化疗给药方式。与体外细胞实验相比,药物载体经静脉注射后体内的药物输送更为复杂。通常,未经修饰的药物载体经过静脉注射给药进入血液循环,会与血浆蛋白或糖蛋白等多种成分相结合,进而作为异物被网状内皮系统或单核巨噬系统吞噬,使负载药物在肝、脾、肺等器官的浓度大大增加,尤其易被肝巨噬细胞吞噬而引起药物在肝内的聚集。为了减少药物载体被巨噬系统的吞噬,采用PEG修饰可以获得长循环效果,促使药物载体利用实体瘤组织的高通透性和滞留效应(enhanced permeation and retention,EPR)富集于肿瘤组织[31~33](图3A,彩图见图版一)。此外,利用抗体、叶酸、多肽等表面修饰能使载体与肿瘤细胞表面的特异性抗原或受体识别,从而实现药物载体的主动靶向[34,35](图3B)。在众多靶向分子中,叶酸由于其明确的肿瘤细胞受体识别性在药物载体的主动靶向药物输送研究中被广泛使用[26,27,36]。除应具有上述常规的靶向策略外,还需综合考虑载体的理化性质,如粒径大小、形状以及表面电荷等对载体在体内的一系列生物学行为的影响[37,38]。按照药物靶向方式的不同,靶向药物输送可以分成被动靶向和主动靶向两种。
2.1被动靶向
被动靶向为针对癌症或炎症所特有的EPR效应,以特定尺寸的纳米粒子为载体的纳米靶向药物输送方式。由于癌症和炎症组织的细胞间隙明显大于正常组织、淋巴管的细胞间隙,特定尺寸的纳米粒子更易通过渗透作用进入癌症或炎症组织,同时淋巴回流也因此受阻,导致纳米粒子在癌症或炎症组织内滞留,此即增强渗透滞留效应。介孔二氧化硅拥有可调节的粒径和形状,因而非常适合于被动靶向药物输送系统的研究[39,40]。
Huang等[33]研究了聚乙二胺-聚乙二醇共聚物修饰的介孔二氧化硅纳米粒子注射小鼠后在其体内的分布情况。研究发现,载有阿霉素药物的纳米粒子在小鼠体内有很好的肿瘤抑制效果。通过体内成像和元素分析表明,该介孔二氧化硅纳米粒子表面的修饰物使得该纳米粒子能够通过显著的EPR效应滞留于肿瘤部位,释放负载药物发挥治疗效果。该被动靶向系统提高药效的同时也降低了阿霉素药物的毒副作用。

图3 纳米载体的被动靶向(A)与主动靶向(B)原理示意图[31]Fig.3 Schematic dragram of passive (A) and activing (B) tumor targeting of nanocarriers[31].A:1.纳米载体通过肿瘤周围易渗漏的血管选择性地到达肿瘤部位;2.尺寸大小对肿瘤组织中滞留效应的影响。B:1.表面连接了配体的纳米载体与受体过表达的癌细胞结合;2.表面连接了配体的纳米载体与受体过表达的血管内皮细胞结合(彩图见图版一)
2.2主动靶向
尽管EPR效应能够实现药物的被动靶向输送至肿瘤部位,但往往无法降低抗癌药物对正常细胞的毒性。因此,为了进一步提高药效,降低毒副作用,需要对介孔二氧化硅纳米粒子表面进行修饰,使其表面带有抗体、多肽、叶酸等靶向基团来特异性识别肿瘤细胞表面过度表达的受体,即主动靶向。
细胞膜糖蛋白是肿瘤血管发生标记物,其几乎能唯一性地在肿瘤增殖内皮细胞中表达。Chen等[41]以CD105做为肿瘤血管靶向实现途径不仅使载药量大大提高,而且使得肿瘤药物吸收率比非靶向对照组高出3倍。精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartic acid,RGD)三肽可以被人类癌细胞表面过量表达的CD105整合蛋白识别,因而被认为是纳米粒子药物输送系统理想的靶向剂。He等[42]以RGD三肽为靶向分子键连于介孔二氧化硅表面,以此方法合成靶向药物输送载体输送钌类抗癌药物RuPOP。通过受体介导的内吞作用,在载体表面进行RGD修饰能明显增强癌细胞对载体的内吞,有效提高药物载体对癌细胞的选择性,降低负载药物对正常细胞的毒性。
除了单一靶向功能的介孔二氧化硅纳米材料的研究外,越来越多的研究者将工作重点放在了多功能介孔二氧化硅药物输送体系的研究上,这一多功能输送体系集靶向输送抗癌药物及刺激性响应控制缓释于一体,大大提高了治疗效率,减少了药物到达癌症部位之前的损失,提高了药物利用度。Gan等[43]将具有磁靶向的Fe3O4纳米粒子通过酸敏感的硼酯键键连在介孔二氧化硅纳米表面,将药物封堵在孔道内防止提前释放。当药物载体处于癌症部位的pH环境时,Fe3O4纳米粒子会从介孔二氧化硅纳米粒子表面解离,从而打开孔道将药物释放到癌症部位。Chen等[44]合成并报道了具有靶向及酶响应的透明质酸修饰的介孔二氧化硅纳米粒子,该粒子中,透明质酸既具有特异性识别癌细胞表面过度表达的CD44受体的功能又可以作为实现药物可控释放的阀门。共聚焦实验结果显示,相对于没有透明质酸修饰的介孔二氧化硅纳米粒子而言,具有透明质酸修饰的介孔二氧化硅因透明质酸和CD44受体发生特异性识别因而能够被MDA-MB-231人胸腺癌细胞大量吞噬。并且,透明质酸会被肿瘤微环境中特有的透明质酸酶降解从而引发药物的释放。类似地,Guo等[45]利用叶酸作为靶向分子,通过二硫键键连在介孔二氧化硅纳米粒子表面,并且该叶酸可用于封堵介孔孔道以阻止药物在进入肿瘤细胞前过早释放。通过人宫颈癌细胞HeLa表面过度表达叶酸受体介导识别作用下,该粒子被癌细胞大量吞噬,在细胞质高浓度的谷胱甘肽的作用下切断二硫键从而引发药物释放发挥药效。
3展望
介孔二氧化硅纳米粒子因其特殊的性能在药物输送治疗癌症领域显示出了极大的应用前景。一方面,介孔二氧化硅纳米粒子的结构、尺寸和形态易于调控,使得其可以装载不同特性的药物。另一方面,作为药物输送系统,介孔二氧化硅表面易于修饰可以实现靶向传输、控释药物等多功能输送体系。虽然介孔二氧化硅纳米材料在靶向药物输送治疗癌症方面已经表现出一定的优势,但仍存在许多尚未解决的问题。
介孔二氧化硅纳米材料在细胞水平的毒性已经被广泛研究,但是其应用于临床诊断与治疗仍然有一定的距离。首先,介孔二氧化硅纳米材料给药方式的不同直接影响着其生物分布及急性、慢性毒性。其次,现有的研究表明粒径为110 nm的介孔二氧化硅纳米材料在进行肌肉注射或者皮下注射后会引起炎症反应。这些都表明在将介孔二氧化硅纳米材料用于临床应用前还需要开展更多深入的研究工作。目前开发一种具有生物可降解性能的介孔二氧化硅纳米材料应用于体内已经成为下一代介孔材料研发的热点和方向。随着科技的发展和越来越多科学家的努力,多功能介孔二氧化硅纳米材料有望在药物输送领域具有更广阔的应用前景。
参考文献
[1]Coelho S C, Pereira M C, Juzeniene A,etal.. Supra molecular nanoscale assemblies for cancer diagnosis and therapy [J]. J. Control. Release, 2015, 213: 152-167.
[2]Li J X. Nanotechnology-based platform for early diagnosis of cancer [J]. Chin. Sci. Bull., 2015, 64(4): 488-490.
[3]Wang Y, Zhao Q F, Hu Y C,etal.. Ordered nanoporous silica as carriers for improved delivery of water insoluble drugs: A comparative study between three dimensional and two dimensional macroporous silica [J]. Int. J. Nanomed., 2013, 8: 4015-4031.
[4]Kilpeläinen M, Riikonen J, Vlasova M,etal.. In vivo delivery of a peptide, ghrelin antagonist, with mesoporous silicon microparticles [J]. J. Control. Release, 2009, 137: 166-170.
[5]Kresge C, Leonowicz M, Roth W,etal.. Ordered mesoporous molecular sieves synthesized by a liquid-crystal template mechanism [J]. Nature, 1992, 359: 710-712.
[6]Huh S, Wiench J W, Yoo J C,etal.. Organic functionalization and morphology control of mesoporous silicas via a co-condensation synthesis method [J]. Chem. Mater., 2003, 15(22): 4247-4256.
[7]Bao Y Z, Liao J G, Huang Z M,etal.. Influences of individual and composed poly(vinyl alcohol) suspending agents on particle morphology of suspension poly(vinyl chloride) resin [J]. J. Appl. Polym. Sci., 2003, 90 (14): 3848-3855.
[8]Teeguarden J G, Hinderliter P M, Orr G,etal.. Particokinetics in vitro: Dosimetry considerations for in vitro nanoparticle toxicity assessments [J]. Toxicol. Sci., 2007, 95 (2): 300-312.
[9]Trewyn B G, Whitman C M, Lin V S Y. Morphological control of room-temperature ionic liquid templated mesoporous silica nanoparticles for controlled release of antibacterial agents [J]. Nano Lett., 2004, 4 (11): 2139-2143.
[10]Che S, Liu Z, Ohsuna T,etal.. Synthesis and characterization of chiral mesoporous silica [J]. Nature, 2004, 429: 281-284.
[11]Huh S, Wiench J W, Trewyn B G,etal.. Tuning of particle morphology and pore properties in mesoporous silicas with multiple organic functional groups [J]. Chem. Commun., 2003, 18: 2364-2365.
[12]Vallet-Regi M, Ramila A, Real R P,etal.. A new property of MCM-41: Drug delivery system [J]. Chem. Mater., 2001, 13(2): 308-311.
[13]Hu Y C, Wang J, Zhi Z Z,etal.. Facile synthesis of 3D cubic mesoporous silica microspheres with a controllable pore size and their application for improved delivery of a water-insoluble drug [J]. J. Colloid Interface Sci., 2011, 363(1): 410-417.
[14]Hu Y C, Zhi Z Z, Zhao Q F,etal.. 3D cubic mesoporous silica microsphere as a carrier for poorly soluble drug carvedilol [J]. Microporous Mesoporous Mater., 2012, 147(1): 94-101.
[15]Zhang Q, Ye Z, Wang S T,etal.. Facile one-pot synthesis of PEGylated monodisperse mesoporous silica nanoparticles with controllable particle sizes [J]. Chin. Chem. Lett., 2014, 25(2): 257-260.
[16]Sun L Z, Wang Y Z, Jiang T Y,etal.. Novel chitosan-functionalized spherical nanosilica matrix as an oral sustained drug delivery system for poorly water-soluble drug carvedilol [J]. ACS Appl. Mater. Interfaces, 2012, 5(1): 103-113.
[17]Nadrah P, Porta F, Planinsek O,etal.. Poly(propylene imine) dendrimer caps on mesoporous silica nanoparticles for redox-responsive release: Smaller is better [J]. Phys. Chem. Chem. Phys., 2013, 15(26): 10740-10748.
[18]Wu H X, Zhang S J, Zhang J M,etal.. A hollow-core, magnetic, and mesoporous double-shell nanostructure: in situ decomposition/reduction synthesis, bioimaging, and drug-delivery properties [J]. Adv. Funct. Mater., 2011, 21(10): 1850-1862.
[19]Gerweck L E. The pH difference between tumor and normal tissue offers a tumor specific target for the treatment of cancer [J]. Drug Resist. Updates, 2000, 3(1): 49-50.
[20]Gulfam M, Chung B G. Development of pH-responsive chitosan-coated mesoporous silica nanoparticle [J]. Macromol. Res., 2014, 22(4): 412-417.
[21]Zhang P, Kong J L. Doxorubicin-tethered fluorescent silica nanoparticles for pH-responsive anticancer drug delivery [J]. Talanta, 2015, 134: 501-507.
[22]Niedermayer S, Weiss V, Herrmann A,etal.. Multifunctional polymer-capped mesoporous silica nanoparticles for pH-responsive targeted drug delivery [J]. Nanoscale, 2015, 7: 7953-7964.
[23]Yang K N, Zhang C Q, Wang W,etal.. pH-responsive mesoporous silica nanoparticles employed in controlled drug delivery systems for cancer treatment [J]. Cancer Bio. Med., 2014, 11(1): 34-43.
[24]Saito G, Swanson G A, Lee K. Drug delivery strategy utilizing conjugation via reversible disulfide linkages: Role and site of cellular reducing activities [J]. Adv. Drug Delivery Rev., 2003, 55(2): 199-215.
[25]Kim H, Kim S, Park C,etal.. Glutathione-induced intracellular release of guests from mesoporous silica nanocontainers with cyclodextrin gatekeepers [J]. Adv. Mater., 2010, 22(38): 4280-4283.
[26]Zhang Q, Liu F, Nguyen K T,etal.. Multifunctional mesoporous silica nanoparticles for cancer-targeted and controlled drug delivery [J]. Adv. Funct. Mater., 2012, 22(24): 5144-5156.
[27]Zhang Q, Wang X L, Li P Z,etal.. Biocompatible, uniform, and redispersible mesoporous silica nanoparticles for cancer-targeted drug delivery in vivo [J]. Adv. Funct. Mater., 2014, 24(17): 2450-2461.
[28]Wang Y, Han N, Zhao Q F,etal.. Redox-responsive mesoporous silica as carriers for controlled drug delivery: A comparative study based on silica and PEG gatekeepers [J]. Eur. J. Pharm. Sci., 2015, 72: 12-20.
[29]Xiao D, Jia H Z, Ma N,etal.. A redox-responsive mesoporous silica nanoparticle capped with amphiphilic peptides by self-assembly for cancer targeting drug delivery [J]. Nanoscale, 2015, 7: 10071-10077.
[30]Liu J J, Zhang B L, Luo Z,etal.. Enzyme responsive mesoporous silica nanoparticles for targeted tumor therapy in vitro and in vivo [J]. Nanoscale, 2015, 7(8): 3614-3626.
[31]Danhier F, Feron O, Preat V. To exploit the tumor microenvironment: Passive and active tumor targeting of nanocarriers for anti-cancer drug delivery [J]. J. Control. Release, 2010, 148(2): 135-146;
[32]He Q J, Zhang Z W, Gao F,etal.. In vivo biodistribution and urinary excretion of mesoporous silica nanoparticles: Effects of particle size and PEGylation [J]. Small, 2011, 7(2): 271-280.
[33]Meng H, Xue M, Xia T,etal.. Use of size and a copolymer design feature to improve the biodistribution and the enhanced permeability and retention effect of doxorubicin-loaded mesoporous silica nanoparticles in a murine xenograft tumor model [J]. ACS Nano, 2011, 5(5): 4131-4144.
[34]Peer D, Karp J M, Hong S,etal.. Nanocarriers as an emerging platform for cancer therapy [J]. Nat. Nanotechnol., 2007, 2: 751-760.
[35]Zhang J, Yuan Z F, Wang Y,etal.. Multifunctional envelope-type mesoporous silica nanoparticles for tumor-triggered targeting drug delivery [J]. J. Am. Chem. Soc., 2013, 135(13): 5068-5073.
[36]Luo Z, Ding X W, Hu Y,etal.. Engineering a hollow nanocontainer platform with multifunctional molecular machines for tumor-targeted therapy in vitro and in vivo [J]. ACS Nano, 2013, 7(11): 10271-10284.
[37]Huang X L, Teng X, Chen D,etal.. The effect of the shape of mesoporous silica nanoparticles on cellular uptake and cell function [J]. Biomaterials, 2010, 31(3): 438-448.
[38]Du J Z, Du X J, Mao C Q,etal.. Tailor-made dual pH-sensitive polymer doxorubicin nanoparticles for efficient anticancer drug delivery [J]. J. Am. Chem. Soc., 2011, 133(44): 17560-17563.
[39]Theek B, Gremse S, Kunjachan S,etal.. Characterizing EPR-mediated passive drug targeting using contrast-enhanced functional ultrasound imaging [J]. J. Control. Release, 2014, 182: 83-89.
[40]Baeza A, Vallet-Regí M. Smart mesoporous silica nanocarriers for antitumoral therapy [J]. Curr. Top. Med. Chem., 2015, 15(22): 2306-2315.
[41]Chen F, Hong H, Shi S,etal.. Engineering of hollow mesoporous silica nanoparticles for remarkably enhanced tumor active targeting efficacy [J]. Sci. Rep., 2014, 4: 5080-5089.
[42]He L Z, Huang Y Y, Zhu H L,etal.. Cancer-targeted monodisperse mesoporous silica nanoparticles as carrier of ruthenium polypyridyl complexes to enhance theranostic effects [J]. Adv. Funct. Mater., 2014, 24(19): 2754-2763.
[43]Gan Q, Lu X Y, Yuan Y,etal.. A magnetic, reversible pH-responsive nanogated ensemble based on Fe3O4nanoparticles-capped mesoporous silica [J]. Biomaterials, 2011, 32(7): 1932-1942.
[44]Chen Z W, Li Z H, Lin Y H,etal.. Bioresponsive hyaluronic acid-capped mesoporous silica nanoparticles for targeted drug delivery [J]. Chem. Eur. J., 2013, 19(5): 1778-1783.
[45]Guo R, Li L L, Zhao W H,etal.. The intracellular controlled release from bioresponsive mesoporous silica with folate as both targeting and capping agent [J]. Nanoscale, 2012, 4(11): 3577-3583.
Progress on Application of Mesoporous Silica Nanoparticles in Controlled Drug Release and Targeted Drug Delivery of Cancer Chemotherapy
MU Jing-hai, YE Zhou, ZHANG Quan*, YIN Jian*
KeyLaboratoryofCarbohydrateChemistryandBiotechnology,MinistryofEducation,SchoolofBiotechnology,JiangnanUniversity,JiangsuWuxi214122,China
Abstract:Cancer chemotherapy normally produces systemic toxicity and undesired side effects on patients. In order to improve the chemotherapy, it’s desiderated to develop new type of nanomaterials for controlled drug release and targeted drug delivery. Mesoporous silica nanoparticles (MSNs) have attracted much attention for their potential use as drug delivery carriers. The unique properties of MSNs, such as high surface area, uniform mesoporous, tunable nanoparticle size and easy chemical functionalization, make them highly suitable as a therapeutic delivery vehicle. This article reviewed recent progress on controlled drug release and targeted drug delivery of MSNs, and prospected development as drug delivery carriers for cancer therapy.
Key words:cancer chemotherapy; mesoporous silica nanoparticles; controlled drug release; targeted drug delivery
收稿日期:2016-02-22; 接受日期:2016-03-15
基金项目:国家自然科学基金(51403081);江苏省自然科学基金(BK20140137)资助。
作者简介:穆京海,硕士研究生,主要从事介孔硅药物输送系统研究。E-mail:6130205019@vip.jiangnan.edu.cn。*通信作者:张权,副教授,主要从事智能靶向和控释药物输送系统研究。Tel:0510-85197039; E-mail:quanzhang@jiangnan.edu.cn; 尹健,教授,主要从事糖生物工程研究。Tel:0510-85328229; E-mail:jianyin@jiangnan.edu.cn
DOI:10.3969/j.issn.2095-2341.2016.03.05

