甘蔗茎尖离体培养褐变影响因素及细胞区室结构分析
杨 柳, 唐云仙, 廖 芬, 汪 淼, 梁永检, 杨丽涛*, 黄东亮, 李杨瑞,
( 1. 广西大学 农学院, 南宁 530004; 2. 广西农业科学院 甘蔗研究所/中国农科院甘蔗研究中心/农业部甘蔗遗传改良生物技术重点实验室/广西甘蔗遗传改良重点实验室, 南宁 530007 )
甘蔗茎尖离体培养褐变影响因素及细胞区室结构分析
杨柳2, 唐云仙1, 廖芬1, 汪淼2, 梁永检1, 杨丽涛1*, 黄东亮2, 李杨瑞1, 2
( 1. 广西大学 农学院, 南宁 530004; 2. 广西农业科学院 甘蔗研究所/中国农科院甘蔗研究中心/农业部甘蔗遗传改良生物技术重点实验室/广西甘蔗遗传改良重点实验室, 南宁 530007 )
摘要:该研究通过综合分析对甘蔗(ROC 22)茎尖离体培养褐变不同条件因素的影响以及褐变细胞区室结构的变化,探讨了甘蔗茎尖离体培养褐变的机理机制。结果表明:不同芽位茎尖诱导成活率具有明显差异,随着芽位的增加,诱导成活率不断降低;不同季节取芽对外植体茎尖总酚类物质含量无明显影响;但不同芽位及不同催芽天数,外植体芽的总多酚含量明显不同,随着催芽天数的增加,不同芽位的多酚含量呈现由低升高的趋势;蔗芽在培养4周时多酚含量较低,适宜进行采芽接种培养;从褐变甘蔗茎尖的解剖结构变化分析,褐变甘蔗茎尖细胞离体培养初期细胞核结构出现变形,线粒体有肿胀拉长,部分液泡膜开始分解;中后期质壁分离更为严重,胞质中出现大量溶酶体,线粒体等细胞器全分解,细胞膜、液泡膜、核膜、线粒体膜的双层膜结构出现破损和缺口;而正常发育的茎尖细胞,能基本保持细胞核的形态结构,只有少量的溶酶体出现。因此,可以推测细胞核和线粒体结构变形以及膜系统的大量破损是甘蔗茎尖培养褐变死亡的原因。
关键词:褐变, 茎尖, 甘蔗, 多酚类物质
近年来,甘蔗茎尖脱毒健康种苗技术健康技术得到不断的发展和完善,已经在世界上主要的甘蔗种植国家得到普遍的应用(Lee & Bressan, 2005; Yang et al, 2010; 杨柳等, 2011)。我国自20世纪80年代初从巴西引进该项技术,逐步建立起包括病原菌的去除(李文凤等, 2009)、组织培养快繁(陈彪等, 2001)、病原检测(沈万宽等, 2007)、田间扩繁与栽培(邓展云等, 2010; 李松等, 2010)为一体的甘蔗茎尖脱毒健康种苗技术体系,并成功地推广应用于我国主要的甘蔗种植区域。
褐变(又称酚污染或酚害) 也是植物组织培养过程中致使诱导率较低、生长缓慢的主要因素(Krishna et al, 2008),严重时会导致培养细胞、组织、外植体的死亡,且褐变的严重程度与外植体组织的基因型、取材部位及生长状态具有重要的关系(Uchendu et al, 2011),褐变现象产生的主要原因是因为外植体组织细胞中的PPO(多酚氧化酶)与天然底物酚产生醌引起的酶促褐变。多酚类物质是普遍存在于正常植物的细胞内,当组织细胞受到胁迫时会作为防御物质大量积累;而在植物组织培养的过程中剪切外植体是必不可少的步骤,因此,在酚类物质会因为外界伤害胁迫而大量积累,当多酚氧化酶被激活,酚类物质被氧化,产生醌类物质,使植物组织变褐并产生毒害作用。由于植物组织培养过程中褐变普遍存在,有关褐变的控制方法也有大量的报道,主要的控制方法总体可以分为两种:培养基中添加抗氧化剂物质(抗坏血酸、抗褪黑素、柠檬酸等)来减少酚类物质的氧化;培养基中添加强吸附剂(活性炭、聚乙烯比咯烷酮PVP、高分子吸附树脂等)(Peiser et al, 1998)。在这两种方法基础上增加转接继代的频率也是有效控制褐变的重要措施。也有报道指出培养基中添加苯丙氨酸解氨酶(PAL)抑制剂2-氨基茚磷酸(AIP)可以有效地降低培养组织中多酚类物质的合成,从而降低外植体培养的褐变程度(Andrew & Praveen, 2013)。
褐变也是甘蔗组织培养过程中的重要限制因素,特别是在甘蔗茎尖离体诱导培养阶段,褐变会导致茎尖诱导出苗率降低,或者直接导致组织死亡。褐变死亡是导致甘蔗茎尖离体培养的诱导成活率较低的主要原因。目前针对甘蔗茎尖离体培养茎尖褐变,主要是通过培养基中添加强吸附剂、抗氧化物质、增加转接继代频率等措施来降低褐变危害,并取得了一定的效果。防止褐变最常用的就是添加吸附剂或褐变抑制剂。如黄诚梅等(2004)的研究表明,甘蔗茎尖组织预先在无菌水中浸泡30 min ,再接种到6-BA 2.0 mg·L-1、NAA 0.1 mg·L-1MS 培养基中,可减轻外植体的褐变;茎尖诱导培养基中直接附加适量的活性炭(AC,以0.02%为宜,最高不超过0.05%),减轻茎尖组织酚害的效果最理想。另外,在培养基中附加抗氧化剂(如聚乙烯吡咯烷酮,PVP),或根据外植体的褐变情况及时转移到新鲜的培养基中,均能减轻甘蔗茎尖组织的酚害。贤武等(2000)认为液体滤纸桥震动培养效果最好,褐变最轻,茎尖存活数多,丛芽诱导率高。这是因为液体培养有利于外植体周围的有害物质扩散,减少了对外植体的毒害。另外在防止褐变中多次转接也可以减轻褐变,但此方法需要耗费大量的物力和人力。但有关茎尖褐变的影响因素分析以及褐变机理的研究较少,因此,本研究主要是通过对茎尖离体培养褐变不同条件因素的影响以及褐变细胞区室结构的变化观察的综合分析分析,探讨甘蔗茎尖离体培养褐变的机理,以期为提高甘蔗茎尖离体培养诱导成活率提供理论支持。
1材料与方法
1.1 材料
甘蔗品种为ROC 22,试供材料均来源于广西农科院甘蔗研究所试验基地。试验材料主要用于进行恒温催芽和茎尖离体培养试验。
1.2 方法
取单芽时期为春季(3月)、夏季(6月)、秋季(9月)、冬季(12月);以+1叶芽位为1位芽,依次往基部方向取3、5、7位芽,单芽蔗茎长度为5 cm,进行恒温38 ℃培养;恒温培养催芽时间分别设为2周、3周、4周、5周四个处理,因此本试验设计为三因素四水平试验(表 1),试验设计参照正交表L16(4^3), 共计16个处理组合,每个处理100个芽,3次重复。
1.2.1 诱导成活率的统计在不同催芽时间处理结束后,取出甘蔗单芽苗,在超净台剥去甘蔗茎尖,进行液体滤纸桥离体培养,培养基为MS + 2,4-D 2.5 mg·L-1+ NAA 0.1 mg·L-1+ 糖 30 g·L-1,每个处理40个茎尖,培养30 d后,统计诱导成活率。
1.2.2 PPO活性测定在不同催芽时间处理结束后,取出甘蔗单芽苗30株,取甘蔗茎尖样品0.2 g,加入5 mL pH 6.0的磷酸缓冲液,冰浴研磨,4 ℃条件下12 000 r·min-1离心15 min,上清液为粗酶液。PPO测定参照何思莲等(2009)的方法。
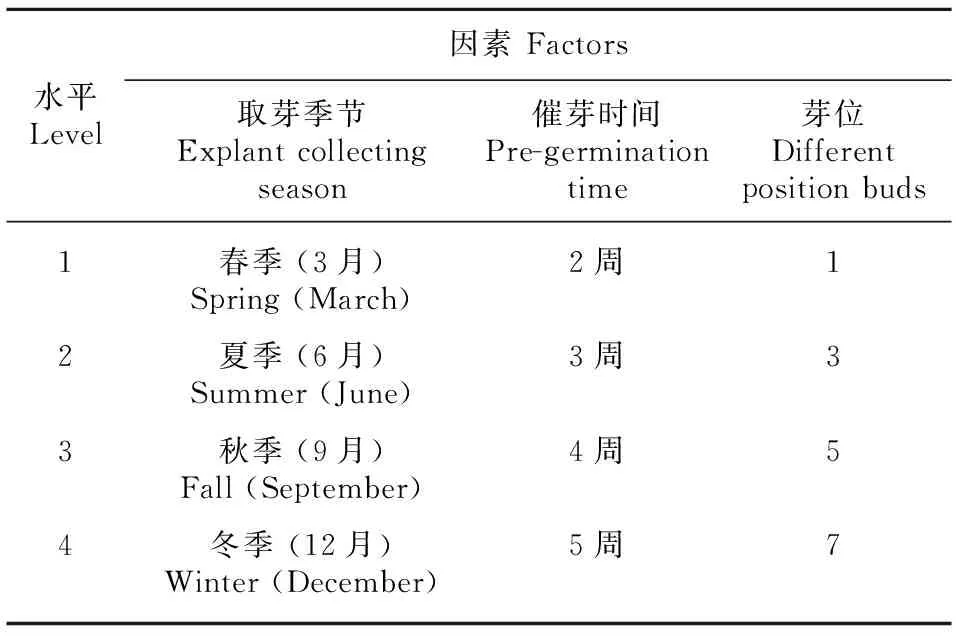
表 1 试验处理因素及水平设计
1.2.3 总酚含量的测定多酚提取采用甲醇水溶液浸提法(Gorinstein et al, 2004)。在不同催芽时间处理结束后,取出甘蔗单芽苗30株,取甘蔗茎尖样品0.2 g研磨,加入2 mL 40%的甲醇浸提液,55 ℃水浴浸提30 min。浸提完毕后,3 000 r·min-1离心10 min,得多酚粗提液。多酚含量测定采用Folin-Ciocalteau法(Pastrana-bonilla et al, 2004),以没食子酸为标准物,建立标准曲线。
1.2.4 超微结构观察在立体显微镜下,剥取出甘蔗茎尖原生分生组织进行滤纸桥液体离体培养,对不同培养天数的逐渐褐变的茎尖材料进行电镜组织观察, 连续观察30 d。电镜检测方法如下:将离体培养茎尖投入2.5% 戊二醛及4%甲醛混合固定液固定1~2 h后用2%锇酸作后固定, 0~4 ℃下固定过夜。按常规梯度丙酮脱水、环氧树脂包埋、超薄切片、电镜观察拍照。
1.3 数据分析
数据处理用SPSS 19.0 统计软件Duncan新复极差法进行多因素方差分析,使用Excel 软件进行作图比较。
2结果与分析
2.1 甘蔗茎尖离体培养褐变影响因素分析
表2结果显示,取芽季节对甘蔗茎尖离体培养诱导成活率(Sig.=0.135>0.05)、总酚类物质含量(Sig.=0.162>0.05)没有显著影响,取芽季节对多酚氧化酶活性在Sig. =0.01<0.05水平上影响显著,但在Sig.<0.01水平上没有显著影响;但催芽时间和不同芽位对甘蔗茎尖离体培养诱导成活率、茎尖多酚氧化酶活性及总酚类物质含量都有显著的影响。茎尖离体培养诱导成活率影响因素相关分析表明,总酚类物质含量与诱导成活率呈显著负相关,Pearson 相关性系数为0.818,显著性Sig.=0.01;而茎尖诱导成活率与多酚氧化酶活性也呈负相关,但相关性不显著(表 3)。
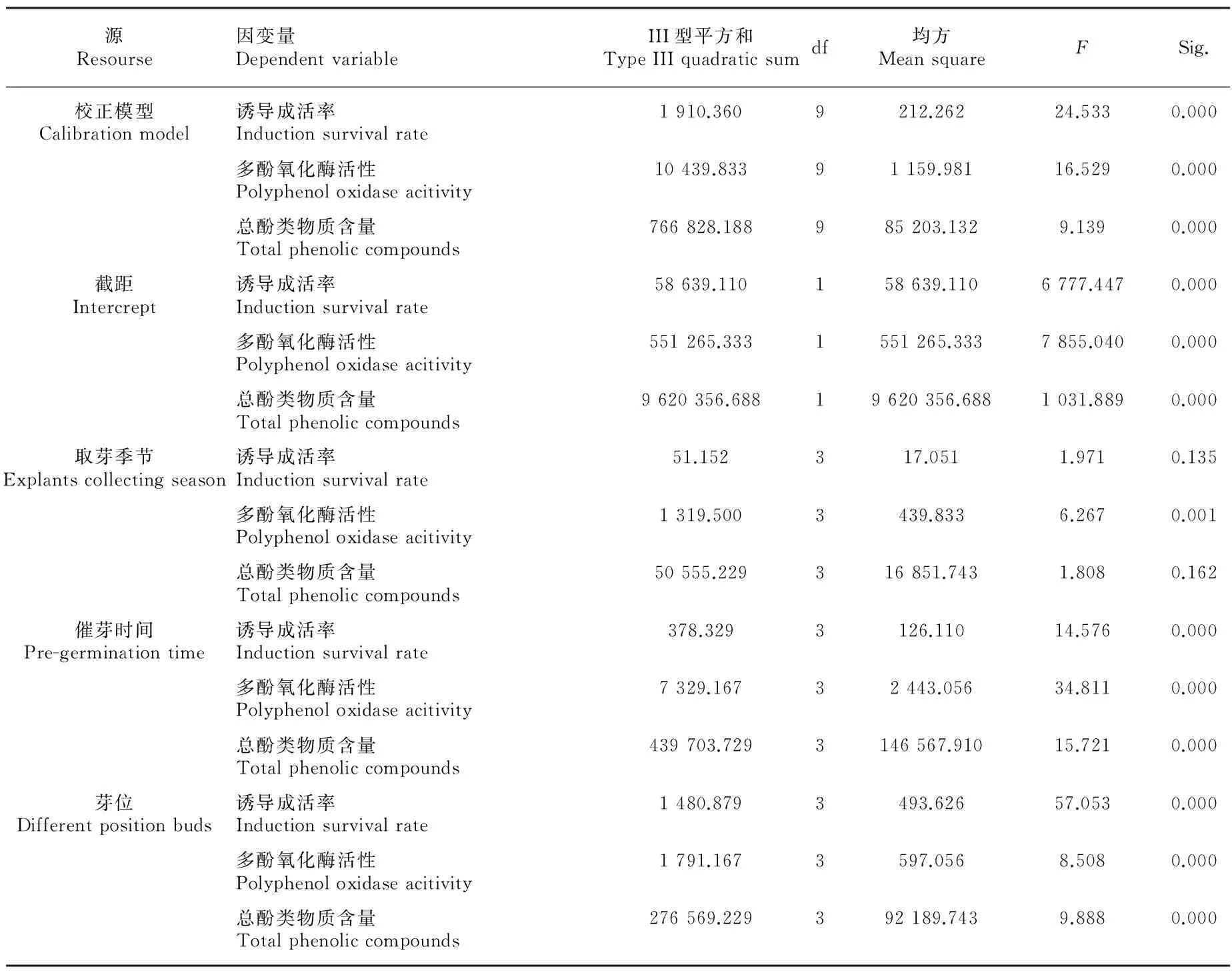
表 2 甘蔗茎尖离体培养褐变影响因素的总体效应分析

表 3 甘蔗茎尖诱导成活率影响因素的相关性分析
以不同季节采收甘蔗ROC 22为材料,从叶稍部下+1叶的第1个芽位起,共选用4个芽作为外植体,即1, 3, 5, 7位芽,在大棚中催芽,分别在催芽14、21、28、35和42 d后采集材料,同时测定茎尖多酚含量及多酚氧化酶活性,无菌条件下茎尖离体滤纸桥接种培养,30 d后统计茎尖离体培养诱导成活率(表3)。
图1结果显示,不同芽位茎尖诱导成活率具有明显差异,随着芽位的增加,诱导成活率不断降低,1位芽诱导成活率最高,这说明单芽外植体材料组织越越鲜嫩诱导成活率越高;在不同季节进行外植体材料取样对茎尖诱导成活率影响差异不大;外植体单芽催芽4周后剥取茎尖进行滤纸桥离体培养诱导成活率较高,与其他催芽时间相比较差异显著。
不同芽位在不同催芽培养时间的多酚氧化酶活性表现不同。催芽14 d的芽位(1~6)中酶活最低,在3~6位芽中,催芽28 d的酶活也较低;在第1~3位芽中,21 d催芽的酶活最高,但在第4~6位芽中,则以35 d催芽的酶活最高(图2)。
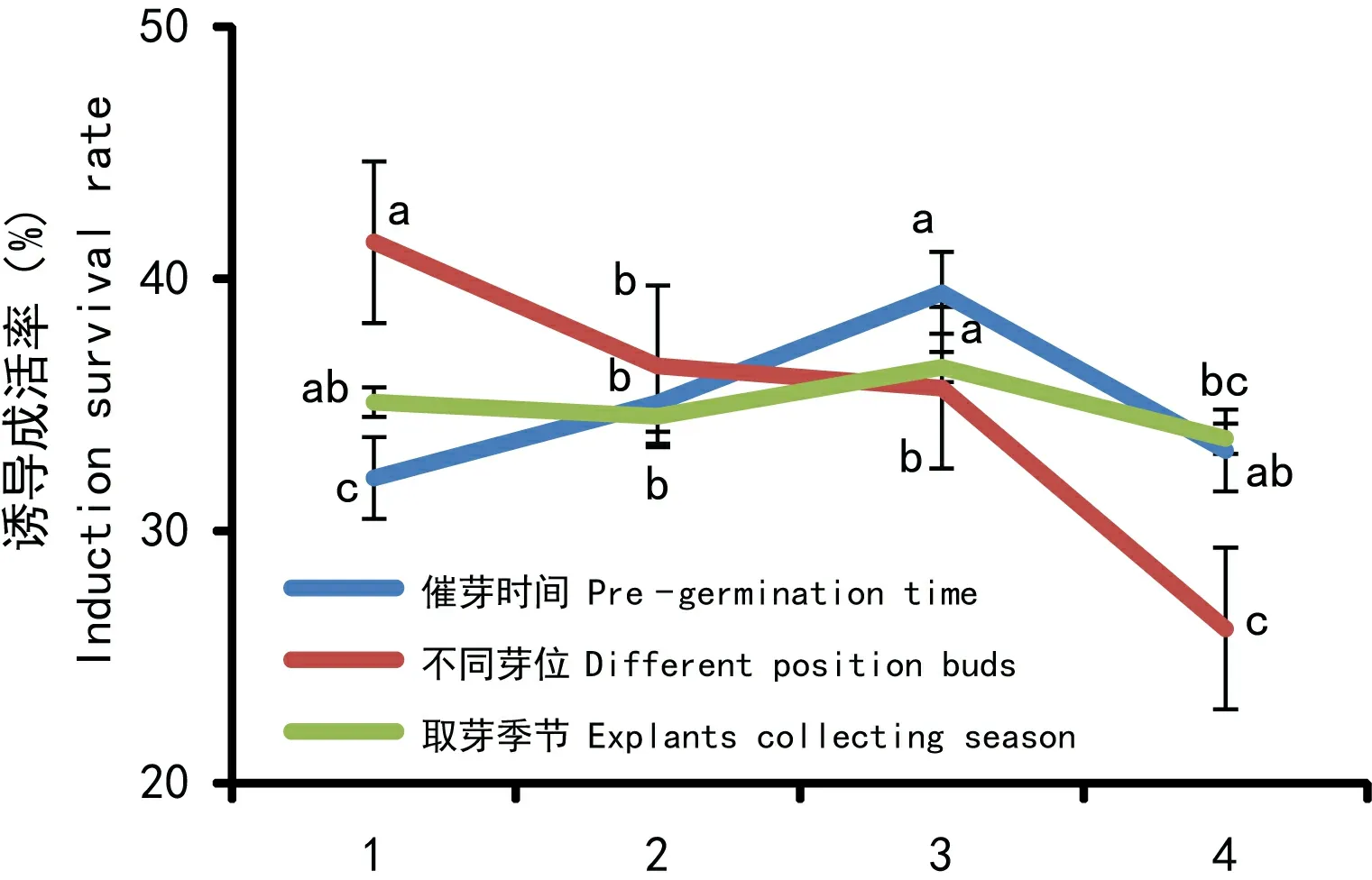
图 1 不同条件对甘蔗茎尖离体培养诱导成活率的影响Fig. 1 Survival rate of sugarcane stem tip which were induced in vitro tissue culture effected by different influence factors

图 2 甘蔗茎尖不同条件下的多酚氧化酶活性变化Fig. 2 Sugarcane stem tip polyphenol oxidase activity changes effected by different influence factors

图 3 甘蔗茎尖不同条件下的总酚类物质含量变化Fig. 3 Sugarcane stem tip polyphenol compounds content changes effected by different influence factors
不同季节取芽对外植体茎尖总酚类物质含量没有明显影响;但不同芽位及不同催芽天数,外植体芽的总多酚含量明显不同,随着催芽天数的增加,不同芽位的多酚含量呈现由高降低的趋势;催芽2周和3周的芽体所含多酚含量较高;而催芽4~5周的芽体所含多酚含量则较低,尤以4周的芽体最低。因此,在蔗芽在培养4周时期多酚含量较低,适宜进行采芽接种培养。
2.2 茎尖培养过程细胞组织的形态变化
茎尖培养后按接种后1~14 d分别取样固定材料,做电镜切片观察。以新鲜外植体材料作正常细胞对照。观察到,在1~4 d时,外观看未发现明显褐变的情况发生。从细胞超微结构看,培养1 d内,细胞的结构未发现在有明显的变形,细胞壁的框架结构仍存在。培养2 d时,细胞核结构仍保持完整,线粒体结构并未发现变形。细胞膜,液泡膜,核膜,线粒体膜的双层膜结构仍保持完整。但从第2天开始,可以观察到质壁开始分离。培养第4天后,细胞核结构出现变形,线粒体有肿胀拉长,部分液泡膜开始分解。培养第10~14天后,茎尖细胞明显褐变,细胞核出现变形,质壁分离更为严重,胞质中出现大量溶酶体,液泡也吞噬一些物质,空腔的线粒体增多。细胞膜,液泡膜,核膜,线粒体膜的双层膜结构出现破损,缺口。而正常发育的茎尖的细胞,还能基本保持细胞核的形态结构,只有少量的溶酶体出现。培养20 d后,完全褐化变黑的茎尖细胞,胞质完全溶解,整个细胞只剩下框架,液泡,线粒体等细胞器全分解(图4)。
3讨论与结论
甘蔗茎尖离体培养褐变与外植体采集时间、采集部位、培养基成分及继代转接频率等有重要关系。

图 4 甘蔗 (ROC22) 茎尖培养过程细胞组织结构的变化 A. 正常细胞; B. 培养1 d细胞; C,D. 培养2 d细胞; E,F. 培养4 d细胞; G. 10 d正常细胞; H,I. 培养10 d褐变细胞; J. 14 d正常细胞; K. 培养14 d褐变细胞; L. 培养20 d褐变细胞。 CW. 细胞壁; N. 细胞核; MIT. 线粒体; MB. 溶酶体; MW. 液炮; CYT. 高尔基体。Fig. 4 Sugarcane stem tip cell structure changes in the process of in vitro tissue culture A. Normal cell; B. Cell after 1 d inoculation; C, D. Cell after 2 d inoculation; E, F. Cell after 4 d inoculation; G. Normal cell after 10 d inoculation; H, I. Browning cell after 10 d inoculation; J. Normal cell after 14 d inoculation; K. Browning cell after 14 d inoculation; L. Browning cell after 20 d inoculation. CW. Cell wall; N. Nucleus; MIT. Mitochondria; MB. Lysosome; MW. Vacuole; CYT. Dictyosome.
本研究发现甘蔗外植体的采集时间对甘蔗茎尖离体培养诱导成活率的具有一定影响,其中与其他季节相比夏季采芽茎尖离体培养诱导成活率较高,但差异不显著。卢文祥等(2002)研究发现甘蔗外植体的最佳采集时期是每年6-8月,认为此时甘蔗生长处于拔节期,而冬季采集的外植体容易褐变且诱导期长。本研究发现位于顶部芽位的单芽经催芽后茎尖离体培养成活率较高,且受酚害影响较小,其主要原因是顶部芽位的多酚氧化酶活性较低,总酚含量也较低,所以受褐变影响较小。黄诚梅等(2004)研究发现甘蔗外植体的部位在甘蔗组织培养中,由于在生长点附近的酚类物质、酶比较多,所以甘蔗的芽繁培养的褐变程度远远大于嫩叶的组织培养,但该研究并未对不同甘蔗单芽离体培养的褐变影响进行分析。甘蔗腋芽催芽时间对茎尖离体培养诱导成活率具有重要的影响,本研究发现催芽3~4周后,进行茎尖离体培养,诱导成活率较高。以甘蔗腋芽催芽2周后即可进行离体取茎尖进行培养(秦延豪, 1997; 卢文祥等, 2002; 黄诚梅等, 2004),但未对不同催芽时间进行筛选方面的研究。
本研究发现甘蔗茎尖离体培养诱导成活率与多酚氧化酶活性也呈负相关,但相关性不显著,这可能与多酚氧化酶在酶促褐变的过程中受到多种因素的影响有关,如培养基pH值、光照强度、培养基成分等,邻位多酚类物质是甘蔗PPO 的最适反应底物,多酚氧化酶活性与pH值之间有很重要的关系,最适合反应为6.2,低于5.8或者高于7.0时则较稳定(Mahmud et al, 2014);甘蔗茎尖离体培养条件对其体内的多酚氧化酶活性也有重要的影响,如温度过高、光照过强都会增加PPO 的活性,从而加速培养组织褐变,甘蔗胚性细胞在光照2 500 lx 以上时细胞团表面会出现褐变,在弱光下易出现绿色芽点(Cheong et al, 2012);秦延豪(1997)研究表明外源激素会增加植物组织培养过程中酚害现象的产生,这是因为激素有刺激多酚氧化酶活性提高的作用,不同激素水平与不同组合产生的褐变程度也不一样,褐变最严重的激素组合为BA + KTT,最轻的为BA和BA+NAA,且浓度越低褐变越轻。
Yang et al(2010)采用固相微萃取技术与硅烷衍生化法结合气相色谱与质谱联用联用来分析甘蔗茎尖多酚类物质的种类,共得到6种多酚类物质,分别为间丙烯酸苯酚;3-(2-含氧甲基苯酚)-2,4-二甲基戊醇;2-含氧甲基苯酚;2,6-二异丁基-4-甲基苯酚;4-4'-亚甲基(2,3,6-三甲基苯酚);4,4'-亚甲基联苯酚。本研究中发现甘蔗茎尖组织中多酚类物质含量与茎尖离体培养诱导成活率呈显著负相关,说明甘蔗茎尖分类物质含量与茎尖褐变具有重要的影响;黄诚梅等(2004)研究发现甘蔗组织培养过程中外植体中的多酚类物质含量与甘蔗组织培养褐变有重要的关系,且发现甘蔗组织培养的外界温度一般为26~28 ℃,多酚类物质含量较低,可减轻褐变;印芳等(2006)对酚类物质与蝴蝶兰褐变关系的研究表明,绿原酸、邻苯二酚、儿茶酚、咖啡酸及没食子酸、对羟基苯甲酸、香豆酸可能与蝴蝶兰褐变相关, 苯甲酸对蝴蝶兰褐变影响很小; 在褐变过程中, 总酚含量越高, 褐变程度越严重。许传俊等(2005)也认为外植体总酚含量和PAL活性随褐变程度加重逐渐增加, 两者呈现显著正相关。
从解剖电镜观察结果发现,甘蔗茎尖离体培养褐变细胞初期细胞核结构出现变形,线粒体有肿胀拉长,部分液泡膜开始分解;中后期细胞核出现变形,质壁分离更为严重,胞质中出现大量溶酶体,液泡也吞噬一些物质,空腔的线粒体增多,细胞膜,液泡膜,核膜,线粒体膜的双层膜结构出现破损,缺口。而正常发育的茎尖的细胞,还能基本保持细胞核的形态结构,仅少量的溶酶体出现。因此,从解剖的甘蔗褐变茎尖细胞电镜检测结果,推测甘蔗茎尖培养褐变死亡的原因可能与其细胞核和线粒体结构变形有关,膜系统的大量破损也是重要原因之一。
参考文献:
ANDREW MPJ, PRAVEEN KS, 2013. Inhibition of phenylpropanoid biosynthesis inArtemisiaannuaL.: a novel approach to reduce oxidative browning in plant tissue culture [J]. PLoS ONE, 8(10): e76802.
CHEN B, LIANG JX, CHEN WD, et al, 2001. The effect of different hormones on sugarcane (Saccharunofficinarum) tissue culture [J]. J Sci Agric Univ, 2(1) : 60-62. [陈彪, 梁钾贤, 陈伟栋, 等, 2001. 甘蔗组织培养配方中不同激素效应的研究 [J]. 华南农业大学学报, 2(1): 60-62.]
CHEONG EJ, RAYMOND M, RUHUI L, 2012. Elimination of five viruses from sugarcane usinginvitroculture of axillary buds and apical meristems [J]. Plant Cell Tiss Org, 109:439-445.DENG ZY, LIU HB, FANG FX, et al, 2010. Comparison test of healthy seedcane on new sugarcane varieties [J]. Sugar Crops Chin, (4):19-28. [邓展云, 刘海斌, 方锋学, 等, 2010. 几个甘蔗新品种的健康种苗对比试验 [J]. 中国糖料, (4):19-28.]
GORINSTEIN S, HARUENKIT R, PRAK YS,et al, 2004. Bioactive compounds and antioxidant potential in fresh and dried Jaffa sweeties, a new kind of citrus fruit [J]. J Sci Food Agr, 84(2): 1 459-1 463.
HE SL, LIU HX, ZHOU SHJ, et al, 2009. A study on extraction and application of polyphenol oxidase sugarcane juice [J]. Sugar Cane, 6:35-39. [何思莲, 刘慧霞, 周少基, 等, 2009. 甘蔗多酚氧化酶的提取与应用试验 [J]. 甘蔗糖业, 6:35-39.]
HUANG CHM, LI YR, YE YP, 2004. Minimizing the detrimental effect of phenol pollution in stem apical culture of sugarcane [J]. Plant Physiol Comm, 40(1): 39-41. [黄诚梅, 李杨瑞, 叶燕萍, 2004. 甘蔗茎尖培养中减轻酚害 [J]. 植物生理学通讯, 40(1): 39-41.]
KRISHNA H, SAIRAM RK, SINGH SK, et al, 2008. Mango explant browning: effect of antigenic age, mycorrhization andpre-treatments [J]. Sci Hortic, 118: 132-138.
LEE TSG, BRESSAN EA, 2005. clean cane with nitrogen fixing bacteria [J]. Sugar Technol, 7(1):11-16.
LI S, LIU LM, YU KX, et al, 2010. Study on the factors of survive and growth of sugarcane bare-root seedlings transplanting in field[J]. Chin Agric Sci Bull, 26(22):155-159. [李松, 刘丽敏, 余坤兴, 等, 2010. 甘蔗脱毒健康组培裸根苗大田移栽成活生长影响因素 [J]. 中国农学通报, 26(22):155-159.]LI WF, HUANG YK, FAN YH, et al, 2009. Study on bacteria -free test of sugarcane ratoon stunting disease by hot water [J]. SW Chin J Agric Sci, 22(2):343-347. [李文凤, 黄应昆, 范源洪, 等, 2009. 甘蔗宿根矮化病(RSD)温水脱菌研究 [J]. 西南农业学报, 22(2):343-347.]
LU WX, WEI XQ, QIN B, 2002. The development of sugarcane axillary bud tissue culture and rapid propagation[J]. Guangxi Sugar Cane, (3):16-18. [卢文祥, 韦小强, 秦波, 2002. 甘蔗腋芽液体培养快速繁殖技术的研究进展 [J]. 广西蔗糖, (3):16-18.]
MAHMUD I, MONICA T, AREZUEB, et al, 2014. NMR-based metabolomics study of the biochemical relationship between sugarcane callus tissues and their respective nutrient culture media [J]. Anal Bioanal Chem, 406:5 997-6 005.
PASTRANA-BONILLA E, AKOH CC, SELLAPPAN S, et al, 2003. Phenolic content and antioxidant capacity of muscadine grapes [J]. J Sci Food Agric, 51(18): 5 497-5 503.
PEISER G, LóPEZ-GáLVEZ G, CANTWELL M, et al,1998. Phenylalanine ammonia lyase inhibitors control browning of cut lettuce [J]. Posth Biol Technol, 14: 171-177.
QIN YH, 1997. Prelminary studies on browning contamination in the process of sugarcane tissue culture[J]. Sugar Cane, (2): 12-14. [秦延豪, 1997. 浅析甘蔗组织培养中的酚害[J]. 甘蔗, (2): 12-14.]
SHEN WK, DENG HH, ZHOU GH, et al, 2007. A study on rapid detection of the pathogen causing sugarcane ratoon stunting disease with dot blot enzyme immunoassays (DB-EIA) [J]. Plant Prot, 33(2):110-113.[沈万宽, 邓海华, 周国辉, 等, 2007. 应用DB-EIA技术快速检测甘蔗宿根矮化病 [J]. 植物保护, 33(2):110-113.]
UCHENDU EE, PALIYATH G, BROWN DC, SAXENA PK, 2011.Invitropropagation of North American ginseng (Panaxquinquefolius. p. L.) [J]. In Vitro Cell Dev-pl, 47: 710-718.
XIAN W, WANG LW, WANG TS, 2000. Prelminary studies on sugarcane stem tip browning [J]. Guangxi Suga Cane, 12(4): 3-5. [贤武, 王伦旺, 王天算, 2000. 甘蔗茎尖脱毒培养研究初报 [J]. 广西甘蔗, 12(4): 3-5.]
XU CHJ, LI L, LI H, et al, 2005. Prelminary studies on the elements of browning and the changes in cellular texture of leaf explant browning inPhalaenopsis. [J]. Acta Hortic Sin, 32 (6): 1 111-1 113. [许传俊, 李玲, 李红, 等, 2005.蝴蝶兰褐变外植体的显微结构观察以及褐变成分的初步分析 [J]. 园艺学报, 32 (6): 1 111-1 113.]
YAO HJ, LUO XF, TIAN YT, 1999. Development of explants browning researches [J]. J Beijing For Univ, 5(3): 78-84.[姚洪军, 罗晓芳, 田砚亭, 1999. 植物组织培养外植体褐变的研究进展 [J]. 北京林业大学学报, 5(3): 78-84.]YANG L, QIN G, YANG LT, et al, 2011. Optimization of sugarcane rapid propagation in temporary immersion bioreactors system [J]. J S Chin Agric Univ, 32(3):37-42.[杨柳, 秦钢, 杨丽涛, 等, 2011. 利用间歇浸没式生物反应器(TIBs)进行甘蔗组织培养快繁研究 [J]. 华南农业大学学报, 32 (3):37-42.]
YANG L, ZAMBRANO Y, HU CJ,et al, 2010. Sugarcane metabolites produced in CO2-rich Temporary Immersion Bioreactors (TIBs) induce tomato (Lycopersicumesculentum) resistance against bacterial wilt (Ralstoniasolanacearum)[J]. In Vitro Cell Dev-Pl, 46(6):558-568.
Cell chamber structure and influences factors analysis on sugarcane stem tips browninginvitro
YANG Liu2, TANG Yun-Xian1, LIAO Fen1, WANG Miao2, LIANG Yong-Jian1,YANG Li-Tao1*, HUANG Dong-Liang2, LI Yang-Rui1,2
( 1.CollegeofAgriculture,GuangxiUniversity, Nanning 530004, China; 2.SugarcaneResearchInstitute,GuangxiAcademyofAgriculturalSciences/SugarcaneResearchCenter,ChineseAcademyofAgriculturalSciences/GuangxiKeyLaboratoryofSugarcaneBiotechnologyandGeneticImprovement,MinistryofAgriculture/GuangxiKeyLaboratoryofSugarcaneGeneticImprovement, Nanning 530007, China )
Abstract:This research was mainly carried out to analyze the mechanism of sugarcane stem tip browning in vitro culture through investigating the influences factors which relate to phenolic browning and observing stem tip cellular compartments structure changes in the process of browning. Sugarcane variety ROC 22 which provided by sugarcane research institute of Guangxi Academy of Agricultural Sciences was selected as experiment material. The result showed that different axillary buds obtained obviously different induction survival rates, the more fresh buds resulted in the more high survival rate, the first position bud got the highest survival rate, that is to mean the more fresh bud get the more higher induction survival rate; the induction survival rate was not effected by different explants collecting seasons; pre-germination time 4 weeks resulted higher induction survival rate, and obtained significant difference compared with other pre-germination time treatments. Different buds with different pre-germination time treatments had obvious different total phenolic compounds content, the longer pre-germination time resulted in the lower phenolic compounds accumulated in stem tip cells, pre-germination time for 2 weeks and 3 weeks obtained higher total phenolic compounds in stem tip cells at different position buds, while pre-germination for 4 weeks and 5 weeks got low total phenolic compounds content, therefore, sugarcane axillary bud was pre-germinated for 4 weeks is a better period for induction tissue culture; stem tip total phenolic compounds content was not effected by explants collecting season;polyphenol oxidase acitivity changed significantly in different axillary buds with different pre-germination time treatments, lower polyphenol oxidase acitivity were obtained in 1-6 position buds with 2 weeks pre-germinated treatment and in 3-6 position buds with 4 weeks pre-germinated treatment; while higher polyphenol oxidase acitivity were obtained in 1-3 position buds with 3 weeks pre-germinated treatment and in 4-6 position buds with 5 weeks pre-germinated treatment. Sugarcane browning stem tips were observed by electron microscope, the result showed that the nucleus structure deformed, swollen mitochondria stretched, part of the vacuole membrane started to break down at the early browning stage; more serious plasmolysis appeared, a large number of lysosomes appeared in cytoplasm, organelles such as mitochondria completely decomposed, cell membrane, vacuole membrane, nuclear membrane and mitochondrial membrane broke down, cytoplasm completely dissolved, vacuoles mitochondria and other organelles completely decomposed at the later browning stage. This finding inferred that nucleus and mitochondria structural distortion and cell membrane systems break were the main reasons for sugarcane stem tip browning to death in the process of tissue culture in vitro.
Key words:browning, stem tips, sugarcane, phenolic compounds
DOI:10.11931/guihaia.gxzw201409057
收稿日期:2014-11-29修回日期: 2015-06-01
基金项目:广西自然科学基金 (2012jjBA30008, 2013GXNSFBA019064); 广西农科院基本业务费专项(桂农科2012YZ14, 桂农科2013YQ09); 广西科学研究与技术开发计划项目 (桂科攻1222009-1B); 广西“八桂学者”团队项目;广西甘蔗遗传改良重点实验室开放项目[Supported by the Natural Science Foundation of Guangxi(2012jjBA30008,2013GXNSFBA019064); Basic Research Fund of Guangxi Academy of Agricultural Sciences(2012YZ14,2013YQ09); Guangxi Research and Development Plan(1222009-1B); Team Fund for “Bagui” Scholars of Guangxi; Open Fund for Guangxi Key Laboratory of Sugarcane Biotechnology and Genetic Improvement]。
作者简介:杨柳( 1983-),男,安徽宿州市人,博士,副研究员,主要从事植物组织培养和甘蔗氮素生理研究,(E-mail)yangliutibs@126.com。*通讯作者: 杨丽涛,博士,教授,主要从事甘蔗育种及生理生化研究,(E-mail)litao61@hotmail.com。
中图分类号:Q942.5, S566.1
文献标识码:A
文章编号:1000-3142(2016)05-0574-08
杨柳, 唐云仙, 廖芬, 等. 甘蔗茎尖离体培养褐变影响因素及细胞区室结构分析[J]. 广西植物, 2016, 36(5):574-581
YANG L, TANG YX, LIAO F, et al. Cell chamber structure and influences factors analysis on sugarcane stem tips browninginvitro[J]. Guihaia, 2016, 36(5):574-581

