秦川牛 MYH8基因多态性及其与生长性状的关联分析
段鹏杰,张慧林,刘 宇,于翔宇,刘鲲鹏,拓艳云,齐晨阳,刘小林,贺 花
(西北农林科技大学 动物科技学院,陕西省农业分子生物学重点实验室,陕西杨凌 712100)
秦川牛 MYH8基因多态性及其与生长性状的关联分析
段鹏杰,张慧林,刘宇,于翔宇,刘鲲鹏,拓艳云,齐晨阳,刘小林,贺花
(西北农林科技大学 动物科技学院,陕西省农业分子生物学重点实验室,陕西杨凌712100)
摘要为研究秦川牛 MYH8基因的多态性及其与秦川牛生长性状的关联性,选取163头健康的30月±2月龄秦川牛,采用DNA测序技术发现 MYH8基因外显子上的SNP位点,并以PCR-RFLP技术分析秦川牛群 MYH8基因型,研究其遗传多样性,再通过SPSS 19.0软件分析SNP位点与秦川牛体尺性状和胴体性状的关联性。研究结果表明,在 MYH8基因第33外显子上存在3个SNP位点,分别在基因序列26 064、26 094和26 100 bp 3处,且26 064 bp处(T>C)为同义突变,26 094 bp处(T>C)为错义突变,26 100 bp处(C>G)为错义突变。关联分析显示, C26100G突变发生在体斜长指标,表现为GG基因型个体的群体均值显著高于GC、CC基因型个体(P<0.05);而其他突变中不存在显著性差异。某些基因型(T26064C突变处TC基因型和T26094C突变处CT基因型)可能为优势基因型,但还需通过更多个体验证。说明: MYH8基因对秦川肉牛生长性状存在一定影响。
关键词秦川牛; MYH8;PCR-RFLP;多态性;关联分析
伴随着分子生物学的发展和各种生物技术的广泛运用,分子标记技术在秦川牛育种过程中逐渐发挥着重要作用,比如从分子水平研究基因与重要经济性状之间的关联性,可以提高选择效率与准确性,快速筛查出具有优良基因的种牛,对家畜育种繁殖和生产具有重要意义。肌球蛋白作为骨骼肌纤维的主要成分,在骨骼肌纤维的收缩特性方面有重要作用[1]。研究发现,作为肌球蛋白主干的肌球蛋白重链(MHC)具有多种不同组成形式[2]:哺乳动物横纹肌中至少有9种MHC异型体[3],人类基因组的2种MHC亚型存在于14号染色体、6种MHC亚型存在于17号染色体,而在成年骨骼肌中MHC有4种类型[4]。
目前,关于肌球蛋白重链基因的研究多集中于肌球蛋白重链基因的分离克隆、结构、表达及功能分析等方面。龚亮等[5]克隆和分析小菜蛾肌球蛋白重链部分cDNA序列;ZHANG等[6]揭示成年牛骨骼肌中MHC-Ⅰ、MHC-Ⅱa、 MHC-Ⅱb、 MyHC-Ⅱx 4种亚基在西门塔尔杂交牛背最长肌、半腱肌和比目鱼肌中的表达情况,及其与肌内脂肪间的联系;李锡癸[7]通过基因芯片及生物信息学技术对 CMT2L转基因小鼠进行全基因组差异表达分析,发现 MYH1、 MYH4与肌肉蛋白、动力蛋白结合、肌肉收缩有关;焦青贞[8]分离克隆猪 MYH1、 MYH2、 MYH4基因的5-侧翼序列和其中的ATZ元件,发现了1个位于 MYH4基因5-侧翼序列的SNP位点;罗建杰[9]在肉仔鸡胸肌蛋白质组学研究中发现, MYH1、MYH3、MYH6、MYH7B、MYH9是与细胞骨架构建相关的功能蛋白;Bryson等[10]研究发现,鱼类MHC基因属于多基因家族成员,且基因产物的表达受组织器官、发育阶段及环境因子等因素的影响。另外,也有学者对 MYH8基因进行研究。Munazzah等[11]探讨 MYH8基因突变与牙关紧闭假屈曲指综合征的关系;张莺莺等[12]利用基因芯片技术筛选秦川牛公牛与阉牛肌肉组织差异表达基因,并用实时定量PCR技术对部分差异表达基因进行验证,发现 MYH3和 MYH8等直接影响肌原纤维构成和肌纤维组织学特性的基因在公牛肌肉中的表达量显著高于阉牛,而且 MYH3基因和 MYH8基因可能是调控秦川牛公、阉牛肉质性状差异包括嫩度差异的重要基因[13];赵春平[14]通过探索因外科手术引起的创伤性强烈应激对牛肉肉质性状的影响,初步确定 MYH3、 MYH8基因可能是影响牛肉质性状的重要基因。有研究通过转录组测序技术进一步发现, MYH8基因在肌肉发育过程中表现出发育阶段特异性[15];而Zhao等[16]通过功能蛋白质组学技术发现, MYH8基因与牛肉嫩度相关。基于以上研究,表明 MYH8基因可能是影响秦川牛胴体和生长性状的候选基因,有必要对其基因多态性进行进一步分析。
鉴于 MYH8基因对秦川牛肉质性状的重要影响,且在秦川牛 MYH8基因的多态性及其SNP位点与体尺、胴体性状关联性方面的研究较少,本研究以秦川牛 MYH8基因作为研究目标,通过对 MYH8基因的多态性的检测及其SNP位点与体尺、胴体性状的关联分析,为秦川牛的选育、留种提供理论基础,为秦川牛肉用性能的提高和新品系的培育提供理论依据。
1材料与方法
1.1材 料
1.1.1试验动物 随机选择163头健康的30月±2月龄的秦川牛(由陕西省秦宝牧业发展有限公司提供),饲养管理条件相似。
1.1.2试剂蛋白酶K、TaqDNA聚合酶、含染料2×TaqMaster Mix、DNA Marker Ⅰ等,均购自天根生化科技(北京)有限公司。柠檬酸、柠檬酸钠、葡萄糖、NaCl、KCl、Na2HPO4、KH2PO4、Tris碱、HCl、十二烷基磺酸钠、NaOH、乙醇、乙二胺四乙酸二钠、琼脂,均为分析纯。
1.1.3主要仪器设备凝胶成像系统、冷冻离心机、电子分析天平、PCR仪、微量移液器、微量紫外分光光度计、普通冰箱、干燥箱、磁力搅拌器、微波炉、冷冻柜、超净工作台、高压灭菌锅、全温立式摇床、三恒电泳仪、水平电泳槽、小型离心机、超低温冰箱、恒温水浴锅等。
1.1.4软件工具通过Primer Premier 5.0软件设计引物,通过chromas软件进行序列比对与分析;采用Excel和SPSS 19.0进行各性状指标的统计与分析;通过POPGENE软件进行遗传多态参数的统计与计算。
1.2方 法
1.2.1血样采集当牛只处于自然状态时,通过颈静脉采血,ACD抗凝处理[V(ACD)∶V(血液)=1∶6]后置于冰上,-80 ℃超低温冰箱保存,备用。
1.2.2牛血液基因组DNA提取秦川牛血液基因组DNA的提取采用常规的酚-氯仿抽提法[17],提取后用10 g/L琼脂糖凝胶电泳检测DNA质量,紫外分光光度计测定DNA质量浓度。
1.2.3引物设计与合成 以NCBI数据库中GenBank公布的牛 MYH8基因序列(AC_000176.1)为参考,通过Premier 5.0软件设计13对牛 MYH8基因外显子的PCR引物(表1),送至南京金斯瑞生物科技有限公司合成。
1.2.4PCR扩增体系和程序PCR扩增采用15 μL体系,最佳反应体系:2×TaqMaster Mix 7.5 μL,上、下游引物各0.3 μL,DNA模板0.6 μL,超纯水6.3 μL。根据每对引物产物大小,其退火温度为50~60 ℃(表2中的X表示不同引物对应的最适退火温度),循环30~36次,其他反应过程变化不大,具体程序见表2。
1.2.5PCR产物测序随机挑选出30个个体,每个体吸取1 μL DNA,组成混合DNA样本。以混合DNA样本为模板进行PCR扩增,PCR产物回收、检测后,交由生工生物工程(上海)股份有限公司测序。测序结果通过Chromas软件进行序列比对及分析。
1.2.6扩增产物的PCR-RFLP将经PCR获得的产物用15 g/L琼脂糖凝胶电泳检测,确定为目的片段后,用相应的限制性内切酶进行酶切,酶切产物用30 g/L琼脂糖凝胶电泳检测,确定基因型。
采用的限制性内切酶包括:MboⅠ、TaqⅠ、DdeⅠ。其中,TaqⅠ在65 ℃反应,其他2种酶均在37 ℃反应。
酶切反应体系为10 μL,反应时间为10~14 h,最佳反应体系见表3。
1.3数据统计与分析
1.3.1遗传多样性指标分析采用Excel进行数据统计,通过POPGENE软件分析常用遗传多样性指标(基因型频率、等位基因频率、哈代-温伯格平衡检验、位点纯合度、杂合度、有效等位基因数和多态信息含量)。

表1 秦川牛 MYH8基因的引物序列及相关信息

表2 PCR反应程序

表3 酶切反应体系
1.3.2相关分析统计模型通过SPSS 19.0软件的一般线性模型GLM分析群体中不同基因型个体与生长性状指标的关联性。建立的统计模型如下:
Yijk=μ+Gj+Eijk
其中,Yijk为个体表型记录;μ为总体均数;Gj为标记的基因型效应;Eijk为随机误差。
2结果与分析
2.1 MYH8基因的遗传变异检测
2.1.1 MYH8基因测序结果及序列分析PCR扩增结果经琼脂糖凝胶电泳分离出目的条带,回收后送测序,结果显示,F12处有2个多态位点,即秦川牛 MYH8基因在26 064 bp处存在T/C突变,在26 100 bp处存在C/G突变;F13处有1个多态位点,即秦川牛 MYH8基因在26 094 bp处存在T/C突变(图1)。将测序结果与牛 MYH8基因序列比对分析,发现3个多态位点均位于 MYH8基因的第33外显子,且T26064C、C26100G、T26094C分别为MboⅠ、TaqⅠ和DdeⅠ的酶切位点。
2.1.2 MYH8基因的RFLP检测结果分析 MYH8基因的F12、F13两对引物经PCR-RFLP分析发现,F12区域的2个多态位点中,T26064C经MboⅠ酶切后呈现3种基因型,分别命名为TT型、TC型和CC型。其中,TT型酶切后产生3个条带,大小分别为48、102和180 bp;TC型酶切后产生5个条带,大小分别为32、48、102、148和180 bp;CC型酶切后产生4个条带,大小分别为32、48、102和148 bp。32和48 bp条带不清晰,102、148和180 bp条带清晰,故可根据102、148和180 bp 3个条带判断不同个体基因型(图2)。C26100G经TaqⅠ酶酶切后呈现3种基因型,分别命名为GG型、GC型和CC型。其中,GG型酶切后只有1个条带,大小为330 bp;GC型酶切后产生3个条带,大小分别为147、183和330 bp;CC型酶切后产生2个条带,大小分别为147和183 bp(图3)。F13区域的多态位点T26094C经DdeⅠ酶切后呈现3种基因型,分别命名为CC型、CT型和TT型。其中,CC型酶切后产生3个条带,大小分别为57、67和467 bp;CT型酶切后产生5个条带,大小分别为57、67、120、347和467 bp;TT型酶切后产生4个条带,大小分别为57、67、120和347 bp。57、67和120 bp条带不清晰,347和467 bp条带清晰,故可根据347 bp和467 bp 2个条带判断不同个体基因型(图4)。
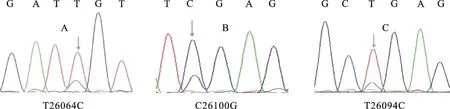
A.T26064C;B.C26100G;C.T26094C
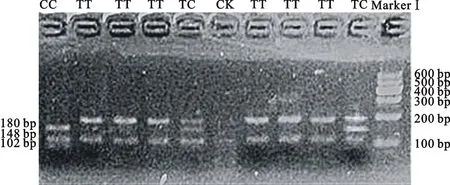
CK为空白对照 CK means blank control;下同 The same below
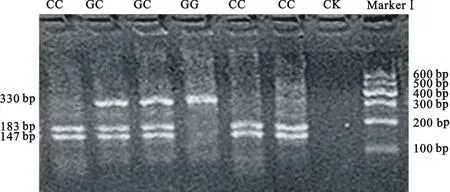
图3 MYH8基因C26100G位点PCR-RFLP电泳图谱

图4 MYH8基因T26094C位点PCR-RFLP电泳图谱
2.2 MYH8基因的群体遗传结构分析
共检测163头秦川牛个体的 MYH8基因,其群体的基因型频率、基因频率及部分遗传参数见表4。由表4可知,F12处的2个多态位点T26064C和C26100G均有3种基因型。其中,T26064C位点有2种等位基因T和C,且T等位基因分布频率大于C;经χ2适合性检验可知,该位点的秦川牛群体处于Hardy-Weinberg不平衡状态(P<0.05),说明可能受基因突变、漂变、外部基因交流等因素影响,人工选育对此多态位点的选择压力较大,平衡状态已经被打破。C26100G位点有2种等位基因C和G,且C等位基因分布频率大于G;经χ2适合性检验可知,该位点的秦川牛群体处于Hardy-Weinberg平衡状态(P>0.05),说明人工选育对此多态位点的选择压力不强,在基因突变、漂变、人工选育等因素作用下仍处于平衡状态。F13处多态位点T26094C有3种基因型,该位点有2种等位基因T和C,且T等位基因分布频率大于C;经χ2适合性检验可知,该位点的秦川牛群体处于Hardy-Weinberg平衡状态(P>0.05),说明人工选育对此多态位点的选择压力不强。根据多态信息含量PIC的分类:PIC<0.25,为低度多态信息含量;0.25
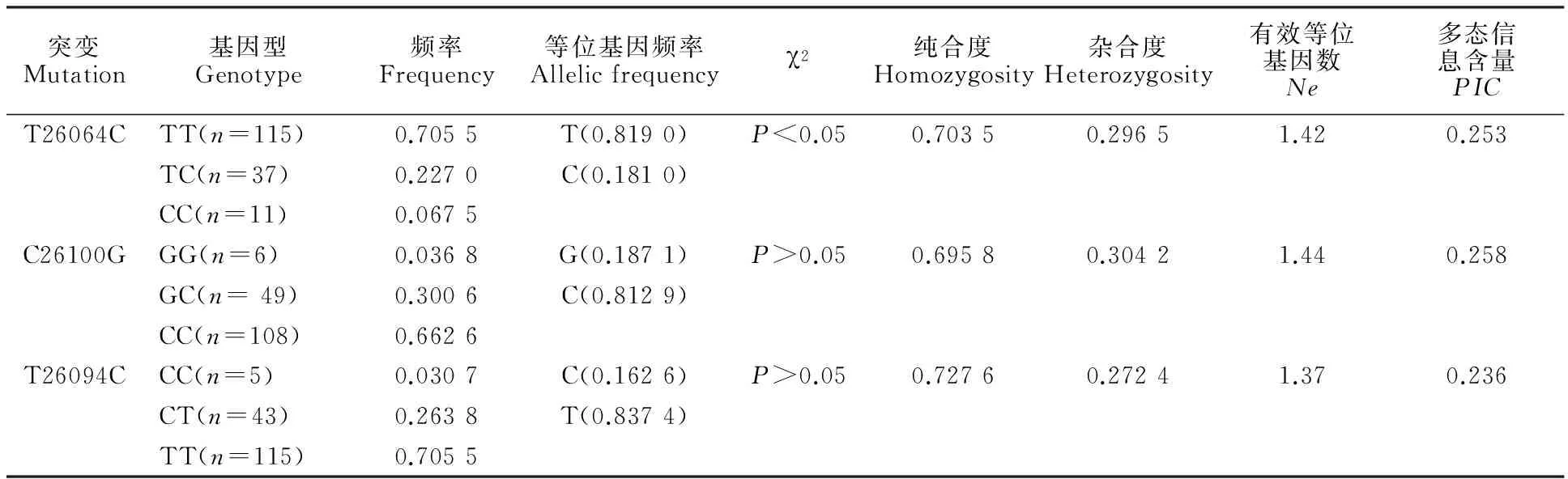
表4 秦川牛 MYH8基因突变区域的群体遗传学参数
注:n表示秦川牛头数。χ2是对该位点不同基因型分布的哈代-温伯格平衡检验。下同。
Note:nis the quantity of Qinchuan cattle. χ2is Hardy-Weinberg equilibrium test value of genotype distribution on the testing locus. The same below.
2.3 MYH8基因多态性与体尺性状、胴体性状的关联分析
将秦川牛 MYH8基因发现的多态性位点与体尺性状、胴体性状进行关联分析,结果显示(表5),T26064C位点在6个生长性状指标上,3种基因型间无显著差异(P>0.05),但在整个群体的3个胴体性状中呈TC>TT>CC趋势,表明TC基因型可能为胴体指标的优势基因型。C26100G位点,在体高、腰角宽2个生长性状指标上,3种基因型间无显著差异(P>0.05),而在体斜长指标上GG基因型个体的群体均值显著高于GC、CC基因型个体;在空腹24 h宰前活体质量、胴体质量、屠宰率指标上3种基因型之间均无显著差异(P>0.05),但在体高、空腹24 h宰前活体质量指标上,GG基因型个体的群体均值也高于GC、CC基因型个体。T26094C位点在6个生长性状指标上,3种基因型间无显著差异(P>0.05),但在体高、腰角宽、空腹24 h宰前活体质量、胴体质量、屠宰率指标上,CT基因型群体均值高于CC和TT,表明CT基因型可能为优势基因型。
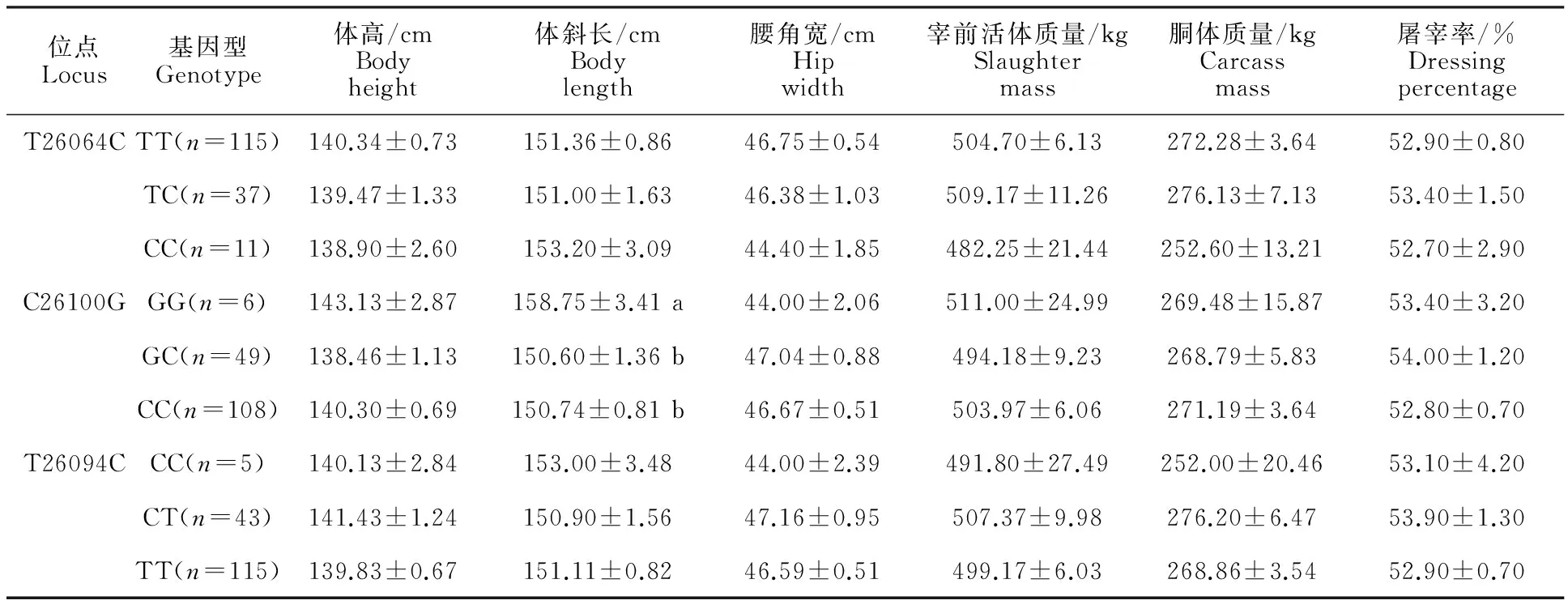
表5 不同基因型与生长性状间关联分析
注:数据为“平均数±标准误”。 同列数据小写字母不同表示差异显著(P<0.05)。
Note:Data in the table are “Average ±SE”. Different letter after the same column mean significant difference atP<0.05.
3讨 论
3.1 MYH8基因的遗传变异
本研究利用DNA测序法结合PCR-RFLP技术,筛查 MYH8基因部分序列的SNP位点,发现该基因第33外显子上存在3个SNP位点,分别在基因序列26 064、26 094和26 100 bp 3处。其中,基因序列26 064 bp处是胸腺嘧啶突变为胞嘧啶,即T>C,属于转换型碱基突变,且该突变为同义突变;通过PCR-RFLP技术对该位点进行MboⅠ酶切,发现存在T和C 2种等位基因,出现TT、TC和CC 3种基因型。26 094 bp处也是胸腺嘧啶突变为胞嘧啶,即T>C,属于转换型碱基突变,且该突变为错义突变,由谷氨酰胺突变为精氨酸;通过PCR-RFLP技术对该位点进行DdeⅠ酶切,发现存在T和C 2种等位基因,出现TT、CT和CC 3种基因型。26 100 bp处是胞嘧啶突变为鸟嘌呤,即C>G,属于颠换型碱基突变,且该突变为错义突变,由甘氨酸突变为精氨酸;通过PCR-RFLP技术对该位点进行TaqⅠ酶切,发现存在C和G 2种等位基因,出现CC、GC和GG 3种基因型。
3.2 MYH8基因多态性对秦川牛体尺性状、胴体性状的影响
肌球蛋白重链(MHC)作为肌球蛋白的组成单位,在维持肌细胞的正常工作中发挥着重要作用。 MYH8基因作为MHC的一种亚基,对肌肉的生长发育有一定的影响。已经有研究发现, MYH8基因可能与牛胴体性状相关[18]。王丽君[19]采用实时荧光定量PCR法检测30月龄左右秦川牛组织中 MYH8基因表达量,发现 MYH8基因在肌肉中的表达量较高,可能是影响秦川牛生长性状与胴体性状的一个重要因素。也有研究表明, MYH8基因可能通过与非编码基因 MIMT1的相互作用,调节印迹基因 PEG3表达,从而在牛胚胎的早期发育过程中发挥调控作用[20-21]。本研究筛选秦川牛 MYH8基因部分外显子的多态性,并对 MYH8基因的多态性与体高、体斜长、腰角宽、空腹24 h宰前活体质量、胴体质量、屠宰率等性状的关联性进行分析,发现T26064C位点在体高、体斜长、腰角宽、空腹24 h宰前活体质量、胴体质量、屠宰率指标上,不同基因型间差异不显著,但在空腹24 h宰前活体质量、胴体质量、屠宰率指标上,TC基因型个体的群体均值高于其他基因型个体,呈TC>TT>CC的趋势,表明TC在胴体性状中可能为优势基因型;T26094C位点在6个性状指标上,不同基因型间差异也不显著,但在体高、腰角宽、空腹24 h宰前活体质量、胴体质量、屠宰率指标上,CT基因型个体的群体均值高于TT、CC基因型个体,表明CT可能为优势基因型;C26100G位点在体高、腰角宽、空腹24 h宰前活体质量、胴体质量、屠宰率指标上,不同基因型间差异不显著,但在体斜长指标上,GG基因型个体的群体均值显著高于GC、CC基因型个体,且体高、宰前活体质量指标上,GG基因型个体的群体均值也高于GC、CC基因型个体;说明 MYH8基因对秦川肉牛体尺性状、胴体性状存在一定影响,且T26064C位点上TC基因型个体、T26094C位点上CT基因型个体和C26100G位点上GG基因型个体的性状相对优良。以上结论可为秦川肉牛选育、留种提供参考,而T26064C位点上TC基因型个体、T26094C位点上的CT基因型个体及C26100G位点上的GG基因型个体是否需要加强选育,有待进一步研究。
本研究在一定程度上拓展秦川牛 MYH8基因多态性研究,同时将其多态性与秦川牛体尺、胴体性状进行关联分析,为后期秦川牛基因的研究提供一些理论依据。至于能否将发现的 MYH8基因多态位点作为秦川牛相关性状的重要分子标记,还需要研究更多个体进行验证。
参考文献Reference:
[1]苏艳红,周越,王瑞元.运动与肌球蛋白重链研究综述[J].天津体育学院学报,2008,23(4): 328-332.
SU Y H,ZHOU Y,WANG R Y.The review of training and myosin heavy chain [J].JournalofTianjinInstituteofPhysicalEducation,2008,23(4): 328-332 (in Chinese with English abstract).
[2]余蕾,樊小力.骨骼肌肌球蛋白重链研究近展[J].陕西医学杂志,2014,43(9): 1259-1261.
YU L,FAN X L.Progress on the study of myosin heavy chain of skeletal muscles[J].ShaanxiMedicalJournal,2014,43(9): 1259-1261(in Chinese).
[3]SCHIAFFINO S,REGGIANI C.Molecular Diversity of myofibrillar proteins gene regulation and functional significance[J].PhysiologyReview,1996,72(6): 371-423.
[4]BALDWIN K M,HADDAD F.Plasticity in skeletal,cardiac,and smooth muscle invited review:effects of different activity and inactivity paradigms on myosin heavy chain gene expression in striated muscle[J].JournalofAppliedPhysiology,2001,90(1):346-357.
[5]龚亮,钟国华,任珍珍,等.小菜蛾肌球蛋白重链部分cDNA序列克隆、表达概况及分析[J].江西农业大学学报,2010,32(1):85-89.
GONG L,ZHONG G H,REN ZH ZH,etal.Cloning,expression profile and sequence analysis of partial cDNA coding for myosin heavy chain from the diamondback moth,Plutellaxylostella[J].ActaAgriculturaeUniversitatisJiangxiensis,2010,32(1): 85-89(in Chinese with English abstract).
[6]ZHANG M,LIU Y L,FU CH Y,etal.Expression ofMYHCgenes,composition of muscle fiber type and their association with intramuscular fat,tenderness in skeletal muscle of Simmental hybrids[J].MolecularBiologyReports,2014,41(2): 833-840.
[7]李锡癸.运用芯片技术对CMT2L转基因小鼠进行全基因组差异表达分析[D].长沙: 中南大学,2013.
LI X K.Analysis of the whole genome expression of CMT2L transgenic mice using gene chip technology[D].Changsha: Central South University,2013(in Chinese with English abstract).
[8]焦青贞.猪骨骼肌肌肉肥大和肌纤维转化通路中相关功能基因的表达规律研究[D].武汉: 华中农业大学,2009.
JIAO Q ZH.Gene expression studies of pig postnatal skeletal muscle hypertrophy and myofiber transformation pathway[D].Wuhan: Huazhong Agricultural University,2009(in Chinese with English abstract).
[9]罗建杰.日粮添加不同益生菌对肉仔鸡益生作用分子研究机制[D].北京: 中国农业科学院,2013.
LUO J J.The probiotic mechanism of several diatery probiotics on broiler[D].Beijing: Chinese Academy of Agricultural Sciences,2013(in Chinese with English abstract).
[10]BRYSON-RICHARDSON R J,DAGGETT D F,CORTES F,etal.Myosin heavy chain expression in zebrafish and slow muscle composition[J].DevelopmentalDynamics,2005,233(3): 1018-1022.
[11]MUNAZZAH T,ROMANA I,ASIMUL I,etal.Structural characterization,homology modeling and docking studies of ARG674 mutation in MYH8 gene associated with trismus-pseudocamptodactyly syndrome[J].LettersinDrugDesign&Discovery,2014,11(10): 1177-1187.
[12]张莺莺,昝林森,王洪宝.利用基因芯片技术筛选秦川牛公牛与阉牛肌肉组织差异表达基因[J].遗 传,2010,32(11): 1166-1174.
ZHANG Y Y,ZAN L S,WANG H B.Genome array on differentially expressed genes of muscle tissue in intact male and castrated Qinchuan cattle[J].Hereditas,2010,32(11): 1166-1174(in Chinese with English abstract).
[13]张莺莺.中国主要牛种肌肉组织基因表达谱特征比较分析[D].陕西杨凌: 西北农林科技大学,2010.
ZHANG Y Y.Gene expression patterns analysis and the comparative analysis on transcriptional profiling of muscle tissues from Chinese major species of cattle[D].Yangling Shaanxi: Northwest A&F University,2010(in Chinese with English abstract).
[14]赵春平.创伤性应激对安格斯牛肉品质影响机制研究[D].陕西杨凌: 西北农林科技大学,2012.
ZHAO CH P.Mechanism analysis on beef quality variation induced by acute stress[D].Yangling Shaanxi: Northwest A&F University,2012(in Chinese with English abstract).
[15]ZHANG Y,CONG X,WANG A,etal.Identification of the gene as a skeletal muscle-specifically expressed gene and a novel regulator of satellite cell differentiation in cattle[J].JournalofAnimalScience,2014,92(8): 3284-3290.
[16]ZHAO CH P,ZAN L S,WANG Y,etal.Functional proteomic and interactome analysis of proteins associated with beef tenderness in Angus cattle[J].LivestockScience,2014,161: 201-209.
[17]萨姆布鲁克 J,拉塞尔D W.分子克隆实验指南[M].黄培堂,译.北京: 科学出版社,2002.
SAMBROOK J,RUSSELL D W.Molecular Cloning:a Laboratory Manual[M].HUANG P T,Trans.Beijing: Science Press,2002 (in Chinese).
[18]WANG L J,LIU X L,WANG H L,etal.Expression analysis,single nucleotide polymorphisms and combined genotypes in candidate genes and their associations with growth and carcass traits in Qinchuan cattle[J].MolecularBiologyReports,2013,40 (3): 2335-2346.
[19]王丽君.秦川牛生长与胴体性状相关候选基因的表达谱,遗传多样性及其关联分析[D].陕西杨凌: 西北农林科技大学,2013.
WANG L J.Expression patterns,genetic diversity and correlation analysis with related traits of candidate genes in Qinchuan beef cattle[D].Yangling Shaanxi: Northwest A&F University,2013(in Chinese with English abstract).
[20]HELI V,STEFAN B,JUHANI T,etal.Fetal growth restriction caused by MIMT1 deletion alters brain transcriptome in cattle[J].InternationalJournalofDevelopmentalNeuroscience,2013,31 (7): 463-467.
[21]KIM J ,ANNA K,YONATAN G,etal.Identification of many microRNAs that copurify with polyribosomes in mammalian neurons[J].ProceedingsoftheNationalAcademyofSciences,2004,101(1): 360-365.
Received 2015-05-13Returned2015-07-09
Foundation itemNational High Technology Research and Development Program “863” Project(No.2011AA100307); the Shaanxi Province Science and Technology Co-ordinating Innovative Plan Projects(No.2015KTCL02-11); Postdoctoral Fund Project(No.2015M570856); College Students’ Scientific and Technological Innovation Projects(No.201310712033).
First authorDUAN Pengjie,male,undergraduate student. Research area:animal science.E-mail:1360483655@qq.com
(责任编辑:郭柏寿Responsible editor:GUO Baishou)
Polymorphism in MYH8 Gene and Association with Growth Traits of Qinchuan Beef Cattle
DUAN Pengjie,ZHANG Huilin,LIU Yu,YU Xiangyu,LIU Kunpeng,TA Yanyun,QI Chenyang,LIU Xiaolin and HE Hua
(Key Laboratory of Agricultural Molecular Biology in Shaanxi, College of Animal Science and Technology,Northwest A&F University,Yangling Shaanxi712100,China)
AbstractThe aim of the study is to research polymorphism of MYH8 and its association with growth traits of Qinchuan beef cattle,and to provide a theoretical basis for the improvement of Qinchuan beef cattle. 163 Qinchuan cattle were used to detected polymorphism of MYH8 by means of DNA sequencing and PCR-RFLP. The association analysis was conducted between MYH8 gene and growth and carcass traits of Qinchuan cattle with SPSS 19.0 software. The results showed that three SNPs,including one synonymous mutation at 26 064(T>C),two mis-sense mutations at 26 094(T>C) and 26 100(C>G) respectively,were detected in Exon 33 of MYH8 gene. The association analysis indicated that only GG genotype at 26 100 (C>G) had longer body length than GC and CC genotypes,no significant association was detected between other genotypes and growth traits,however,some genotypes tend to have better performance,namely TC genotype at 26 064 (T>C) and CT genotype at 26 094 (T>C),further analysis in larger group may be helpful to classified.The result showed that MYH8 had effect on growth traits in Qinchuan beef cattle.
Key wordsQinchuan beef cattle; MYH8 ; PCR-RFLP; Polymorphism; Association analysis
收稿日期:2015-05-13修回日期:2015-07-09
基金项目:国家高技术研究发展计划(2011AA100307);陕西省科技统筹创新工程计划(2015KTCL02-11);博士后基金(2015M570856);大学生科技创新项目(201310712033)。
通信作者:张慧林,女,副教授,主要从事动物遗传育种教学与科研工作。E-mail:Huiling@163.com
中图分类号S823.12
文献标志码A
文章编号1004-1389(2016)01-0001-08
Corresponding authorZHANG Huilin,female,associate professor. Research area:animal genetics and breeding.E-mail:Huiling@163.com
网络出版日期:2016-01-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160107.2053.002.html
第一作者:段鹏杰,男,本科生,动物科学专业。E-mail:1360483655@qq.com
