龙葵碱联合VEGF抗体对人结肠癌鸡胚移植模型血管生成的影响*
杨雪峰,邓冬雪,张 桃,宁伟伟,郑兴斌,谢 铭
(遵义医学院附属医院胃肠外科,贵州遵义 563003)
龙葵碱联合VEGF抗体对人结肠癌鸡胚移植模型血管生成的影响*
杨雪峰,邓冬雪,张桃,宁伟伟,郑兴斌,谢铭△
(遵义医学院附属医院胃肠外科,贵州遵义 563003)
[摘要]目的建立人结肠癌鸡胚移植模型,探讨龙葵碱、VEGF抗体及两者联合对人结肠癌细胞诱导肿瘤血管生成及肿瘤增殖的影响。方法将人结肠癌HT-29细胞鸡胚移植模型分为实验组和对照组,实验组加入龙葵碱、VEGF抗体和龙葵碱+VEGF抗体混合液,对照组加入磷酸盐缓冲液(PBS)液。通过立体显微镜照相、IPP 6.0图像分析软件分析图片;免疫组织化学方法检测CD34抗原和ki-67抗原,观察龙葵碱、VEGF抗体和龙葵碱联合VEGF抗体对肿瘤血管生成及肿瘤增殖的影响。结果肿瘤血管面积、CD34抗原和ki-67抗原表达:龙葵碱+VEGF抗体组明显优于单药VEGF抗体组和龙葵碱组,VEGF抗体组优于龙葵碱组,3组均明显优于对照组(P<0.01)。结论龙葵碱、VEGF抗体及两者联合时均能抑制人结肠癌HT-29细胞系诱导的肿瘤血管生成及肿瘤增殖,为抗肿瘤血管生成提供了一种新途径。
[关键词]龙葵碱;人结肠癌HT-29细胞;VEGF抗体;肿瘤血管生成;CAM
结直肠癌是消化道最常见的恶性肿瘤,其发生、发展、侵袭及转移与肿瘤血管生成密切相关。寻找高效、低毒的血管生成抑制剂是抗肿瘤血管生成的热点之一。作为传统中草药龙葵,其提取物龙葵碱,在抗肿瘤作用方面已取得较好的研究成果[1];血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管形成最为关键的刺激因子,其抗体已证实具有抑制血管生成的作用[2]。为探究龙葵碱、VEGF抗体及两者联合应用对人结肠癌肿瘤血管生成及肿瘤增殖影响效果,本研究应用鸡胚绒毛尿囊膜(chick embryo chorioallantoic membrane,CAM)模型,研究龙葵碱与VEGF抗体对人结肠癌HT-29细胞系诱导的肿瘤血管生成及移植瘤的影响。
1材料与方法
1.1材料人结肠癌细胞系HT-29细胞株遵义医学院中心实验室提供。实验试剂RPMI 1640培养基、南美胎牛血清、胰蛋白酶均为Hyclone公司产品。龙葵碱(纯度95%)购自陕西慈缘生物技术有限公司;兔抗人VEGF多克隆抗体购自北京博奥森生物有限公司。受精鸡蛋购自广东南雄养鸡场,每个平均55~60 g,孵化机购自德州德兴孵化设备有限公司。
1.2方法
1.2.1细胞培养HT-29细胞生长于含10%灭活胎牛血清RPMI 1640培养基中,37 ℃、5%CO2及饱和湿度的恒温培养箱中培养,3~5 d传代1次,实验时采用对数生长期的细胞。
1.2.2鸡胚孵育将受精鸡蛋在高锰酸钾液中消毒后,气室向上置于温度为38.2 ℃、湿度60%的孵化器孵育,每天翻蛋1次。选取9 d后孵育成功的鸡胚,作为实验备用。
1.2.3试剂配制龙葵碱液的配制:将纯度95%的龙葵碱5 mg溶于1 mL 二甲基亚砜(DMSO)液中,用pH7.4、0.01 M磷酸盐缓冲液(PBS)999 mL调整含龙葵碱的DMSO,使DMSO液在0.1%以下,抽取100 mL含龙葵碱的PBS液溶于2 mL的PBS液,配置成剂量为250 μg/mL的龙葵碱,无菌保存备用。VEGF抗体液的配制:将1 mg VEGF抗体溶于1 mL PBS液中,取100 μL溶于900 μL PBS液,配制成100 μg/mL VEGF抗体液,无菌保存备用。
1.2.4明胶海绵制备将明胶海绵剪成大小约0.5 mm×0.5 mm,无菌保存备用。
1.2.5人结肠癌鸡胚移植模型的建立(1)CAM制备,参照1993年付生法的方法并加以改进,在照蛋器下,选取孵育至9 d生长较好的鸡胚,距胎头下方0.5~1.0 cm处划定开窗位置,其大小约1.0 cm×1.0 cm,予75%乙醇消毒后置于超净台中,改进方面用无菌锯片在鸡胚上沿划定的开窗大小轻轻划开,用无菌眼科镊沿开口打开蛋壳,用5 mL的无菌注射器刺破卵壳膜,并加无菌生理盐水1滴使卵壳膜与CAM分离,制造人工气室去除卵壳膜暴露CAM。(2)HT-29细胞接种,取生长对数期的细胞,消化、离心(1 000 r/min,5 min,15~18 ℃),用PBS调整细胞数为4×106,以制作好的明胶海绵为载体,取20 μL HT-29细胞悬液接种于鸡胚CAM相对无血管区域。用无菌封口膜封口,置于孵化机继续孵育。
1.2.6给予不同类型试剂将接种HT-29细胞的鸡胚于继续孵育后的第2天,分为实验组3组(龙葵碱组、VEGF抗体组、龙葵碱+VEGF抗体组,n=10)和对照组(n=10),去除封口膜后分别加入剂量为250 μg/mL的龙葵碱,100 μL/mL的VEGF抗体各20 μL,以及250 μg/mL的龙葵碱+100 μL/mL的VEGF抗体各10 μL;对照组给予等量的PBS。封口膜封口后继续孵育5 d,每天观察鸡胚的生长情况及血管特性。
1.2.7固定取膜给药第5天后,用4%的甲醛溶液原位固定移植瘤15~20 min,以接种区为中心用眼科镊剪下CAM,平铺于平皿中立体显微镜拍照,收集CAM上移植瘤血管图片,用Image-pro plus 6.0图像分析软件处理图像,收集数据;取下的移植瘤常规石蜡包埋、切片,采用Envision二步法,检测移植瘤CD34抗原标记的肿瘤微血管密度(MVD)和ki-67抗原表达指数反应肿瘤增殖。

2结果
2.1HT-29细胞移植后肿瘤新生血管的生成对照组中,接种HT-29细胞24 h内,细胞呈淡白色黏附于CAM接种区,除CAM上原有的正常血管外,未见明显的血管变化;2 d后接种区域的癌细胞开始聚集,并可见少量微细的血管向瘤体集中。3~5 d后大量的新生血管向肿瘤组织接近,呈放射状,排列紊乱,部分血管长入或跨越瘤体表面,移植瘤迅速生长,直径可达5 mm,瘤体也由最初的苍白色变成深褐色,部分瘤体表面有白色小点,见图1。
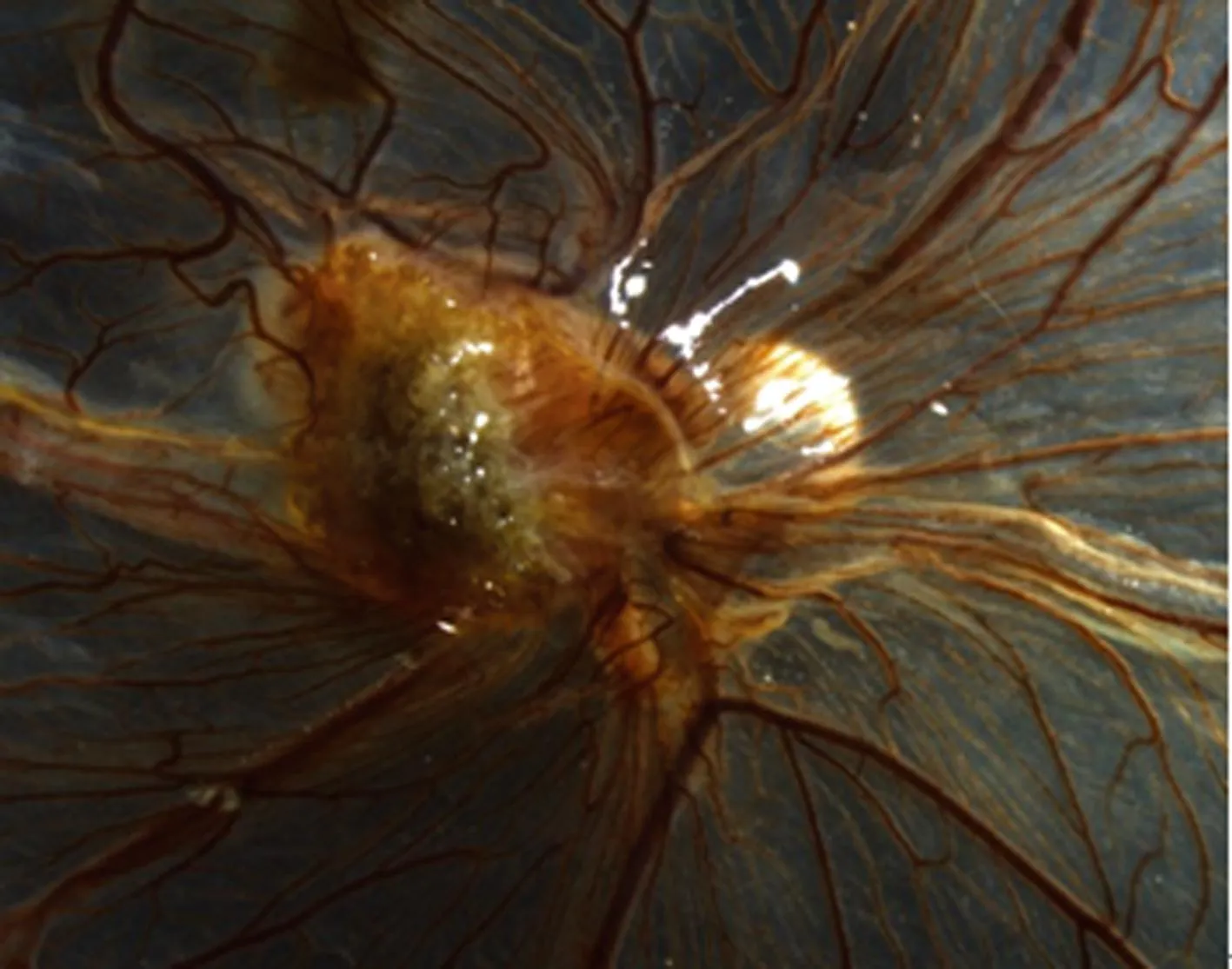
图1 HT-29细胞移植后肿瘤新生血管的生成
2.2龙葵碱、VEGF抗体和龙葵碱联合VEGF抗体对肿瘤新生血管面积的影响在实验组中,应用Image-pro plus 6.0图像分析软件定量处理图片和收集数据后,得出龙葵碱组(8.92±0.79)、VEGF抗体组(5.07±0.30)及龙葵碱+VEGF抗体组(3.40±0.20)与对照组(22.91±1.45)比较,肿瘤血管新生面积均减少,VEGF抗体组优于龙葵碱组,龙葵碱+VEGF抗体组明显优于龙葵碱组和VEGF抗体组,上述差异有统计学意义(P<0.01),见图2。

A:对照组;B:龙葵碱组;C:VEGF抗体组;D:龙葵碱+VEGF抗体组。
图2不同类型试剂血管新生面积

A:对照组;B:龙葵碱组;C:VEGF抗体组;D:龙葵碱+VEGF抗体组。
图3不同类型试剂CD34的表达(Envision ×100)
2.3龙葵碱、VEGF抗体和龙葵碱联合VEGF抗体对MVD的影响免疫组织化学显示CD34标记MVD:龙葵碱组(16.4±3.51)、VEGF抗体组(14.9±2.54)和龙葵碱+VEGF抗体组(12.6±2.39)与对照组(37.83±4.03)比较,MVD值均降低,VEGF抗体组优于龙葵碱组,龙葵碱+VEGF抗体组明显优于龙葵碱组和VEGF抗体组(P<0.01),与血管新生面积的结果相一致,见图3。
2.4龙葵碱、VEGF抗体和龙葵碱+VEGF抗体对ki-67抗原的影响ki-67抗原表达反应肿瘤增殖程度:龙葵碱组(24.74±2.31)、VEGF抗体组(22.07±1.77)、龙葵碱联合VEGF抗体组(17.15±1.06)与对照组(58.75±4.29)比较,ki-67抗原表达指数均降低,VEGF抗体组优于龙葵碱组,龙葵碱+VEGF抗体组优于龙葵碱组和VEGF抗体组,上述组间存在差异有统计学意义(P<0.01),见图4。

A:对照组;B:龙葵碱组;C:VEGF抗体组;D:龙葵碱+VEGF抗体组。
图4不同类型试剂ki-67的表达(Envision ×100)
3讨论
CAM已成为经典的研究血管及抗血管形成的理想体内模型。王捷等[3]应用CAM作为载体,研究人乳腺癌细胞血管侵袭机制。本实验通过建立CAM,动态观察人结肠癌细胞系HT-29诱导的肿瘤血管生成及移植瘤生长特点,与于文静等[4]建立的人大肠癌鸡胚移植模型及诱导的血管生长特性相似。同时,运用建立的CAM,研究龙葵碱、VEGF抗体及两者联合应用时对肿瘤血管及移植瘤的影响。
现有的研究证明,龙葵碱可通过多种途径达到抗肿瘤作用。李志雄等[5]研究发现龙葵碱可诱导Du145及LNCaP 细胞发生凋亡,从而达到抗肿瘤增殖的作用;同样,龙葵碱还可通过升高人乳腺癌MCF-7 细胞微观系统内管蛋白及微管相关蛋白(MAP-2)的表达,将MCF-7细胞阻滞于S期,抑制乳腺癌MCF-7细胞增殖[6-7]。张卫东等[8]研究发现龙葵碱可通过减少胃癌MGC-803 荷瘤小鼠癌细胞钙黏蛋白的表达,干扰β-Catenin /TCF复合物的形成,阻断Wnt/β-Catenin 信号通路而诱导期凋亡。许扬等[9]研究显示龙葵给药组药物载体下CAM组织周围血管数与对照组比较明显减少,并可见部分大中血管结构受到严重破坏,提示龙葵中含有抗肿瘤血管成分。基于此,本实验研究发现龙葵碱组血管新生面积及MVD明显低于对照组,证实了龙葵碱能抑制人结肠癌细胞诱导的肿瘤血管生成;ki-67抗原表达降低程度,龙葵碱组优于对照组,提示龙葵碱可抑制肿瘤细胞增殖。但这一现象是龙葵碱直接作用于瘤体组织,还是通过抑制肿瘤诱导的新生血管而抗肿瘤作用,或者同时作用于两者的结果,还待进一步研究。
肿瘤血管生成是指肿瘤细胞分泌因子的刺激下,肿瘤血管生成相关因子被激活或者诱导生成形成血管,它能加速实体肿瘤生长、侵袭与转移[10]。VEGF是公认的直接作用于血管内皮细胞的最强生长因子,与肿瘤的发生、发展存在密切关系。李贵新等[11]研究发现乳腺癌组织中p53基因和VEGF之间存在正相关性,在p53和VEGF同时阳性的肿瘤中,其MVD明显增高,且易发生颈淋巴结转移。因此,通过下调VEGF的表达,抑制肿瘤新生血管生成,降低MVD值,可达到抗肿瘤增殖作用。VEGF抗体,作为VEGF特异性抗体,已被证实能明显抑制肿瘤血管生成。郑青平等[12]研究证实了VEGF抗体能使肝癌组织中VEGF表达下降,抑制肿瘤血管因子的生成。李明娥等[13]研究表明抗VEGF121抗体能够有效降低肿瘤组织中MVD,抑制裸鼠体内浆液性卵巢癌下移植肿瘤的血管形成,从而抑制肿瘤生长。因此,本实验发现移植瘤周围血管数明显减少,肿瘤组织生长缓慢。MVD、血管新生面积及ki-67抗原表达明显低于对照组(P<0.01)。表明VEGF抗体能抑制人结肠癌HT-29细胞系诱导的肿瘤血管生成,从而达到抗肿瘤目的。本实验还发现,对微血管面积与MVD的影响,VEGF抗体组高于龙葵碱组;而ki-67核增殖抗原表达,VEGF抗体组高于龙葵碱组(P<0.01)。结果显示VEGF抗肿瘤作用强于龙葵碱,其原因有待进一步研究。
然而,由于肿瘤细胞的异质性,诱导相应肿瘤血管生长因子的生成多样性,以及血管内皮细胞的多样性,单一肿瘤血管抑制剂与联合用药治疗某一实体肿瘤相比较,有效性可能差[14]。龙葵碱与VEGF抗体联合,利用两者不同的抗肿瘤机制,一方面龙葵碱既可直接杀死肿瘤细胞,也可通过抑制肿瘤血管生成而抗肿瘤增殖,弥补VEGF 抗体单一通过抑制肿瘤血管形成而抗肿瘤作用;另一方面,VEGF抗体弥补龙葵碱的抗肿瘤作用不及VEGF抗体,起到增强作用。因而,龙葵碱与VEGF抗体起到了协同抑瘤作用。本实验初步应用龙葵碱与VEGF抗体联合作用于人结肠癌细胞所诱导的肿瘤血管生成,实验显示,龙葵碱联合VEGF抗体作用于人结肠癌细胞诱导的肿瘤血管生成,其微血管面积、MVD及ki-67核增值抗原均明显低于龙葵碱与VEGF抗体单体应用(P<0.01)。
综上所述,龙葵碱与VEGF抗体均能抑制人结肠癌诱导肿瘤血管生成,达到抗肿瘤增殖作用,而单药VEGF抗体强于龙葵碱;但龙葵碱与VEGF抗体联合应用,能明显抑制肿瘤血管生成,增加抗肿瘤效果作用,为临床指导抗肿瘤血管生成的治疗方面提供了一个新途径。
参考文献
[1]归小龙.龙葵碱抗肿瘤作用机制研究进展[J].中国中医药信息杂志,2009,5(S1):80-82.
[2]白宇宏,李金源,刘刚.VEGF单克隆抗体对人舌癌细胞Tca-8113增殖抑制作用观察[J].山东医药,2011,51(10):19-20.
[3]王捷,宋惠雪,夏冰,等.骨涎蛋白单克隆抗体抑制亲骨转移人乳腺癌细胞血管侵袭机制的探讨[J].中华肿瘤防治杂志,2010,17(1):30-32.
[4]于文静,赵静,连波,等.人大肠癌鸡胚尿囊膜移植模型的建立及血管生成特征的观察[J].中国比
较医学杂志,2012,22(3):32-35,81.
[5]李志雄,梁蔚波,唐晖,等.龙葵碱对前列腺癌LNCaP 及Du145细胞系的作用及机制[J].广东医学,2013,34(8):1153-1156.
[6]高世勇,苏怡君,季宇彬.龙葵碱对HepG2细胞NAT1酶活性及动力学影响的研究[J].中国药学杂志,2011,46(8):589-594.
[7]季宇彬,刘家源,高世勇.龙葵碱对乳腺癌MCF-7细胞微管系统的影响[J].中草药,2012,43(1):111-114.
[8]张卫东,孙睿,李莉,等.龙葵碱对人胃癌MGC-803荷瘤小鼠癌细胞钙粘蛋白表达的影响[J].安徽农业科学,2013,41(30):11965-11966.
[9]许扬,潘瑞乐,常琪,等.龙葵抑制鸡胚绒毛尿囊膜血管新生的研究[J].中国中药杂志,2008,33(5):549-552.
[10]赵新汉,田方.肿瘤血管生成抑制剂的研究现状与展望[J].现代肿瘤医学,2008,16(11):2004-2006.
[11]李贵新,郭璐,李鹏鑫,等.乳腺癌组织p53和nm23及VEGF表达相关性的研究[J].中华肿瘤防治杂志,2010,17(12):923-925.
[12]郑青平,陈龙华,石玉生,等.放疗联合抗VEGF抗体对肝癌移植瘤血管形成因子影响的实验观察[J].中华肿瘤防治杂志,2008,15(24):1852-1855.
[13]李明娥,彭芝兰,王和,等.抗血管内皮生长因子抗体对人浆液性卵巢癌裸鼠移植瘤生长的影响[J].山西医科大学学报,2006,37(10):1011-1013.
[14]马波,张汉超,徐新戈,等.Vpr对人结肠癌细胞抑制作用及其机制[J].中华消化外科杂志,2012,11(1):86-90.
Effect of angiogenesis on Solanine and VEGF antibody in chicken embryo transplantation model of human colon cancer cells*
YangXuefeng,DengDongxue,ZhangTao,NingWeiwei,ZhengXingbin,XieMing△
(DepartmentofGastrointestinalSurgery,theAffiliatedHospitalofZunyiMedicalColleague,Zunyi,Guizhou563003,China)
[Abstract]ObjectiveTo establish model of the chicken embryo transplantation of human colon cancer cells,and investigate the effect of Solanine、VEGF antibody and Solanine combined with VEGF antibody on human colon cancer cells induce tumor angiogenesis and tumor proliferation.MethodsThe model of the chicken embryo transplantation of human colon cancer HT-29 cells were divided into three experimental group and control group.We added to the chick embryo chorioallantoic membrane with Solanine、VEGF antibody and Solanine+VEGF antibody mixture,PBS was added to the control group.Then we analysed picture through the stereomicroscope and IPP 6.0 image analysis software,using immunohistochemistry envision method to detect of CD34 antigen and ki-67 antigen,and observing effect of Solanine group,VEGF antibody group,Solanine+VEGF antibody group and the effect on the tumor angiogenesis and tumor proliferation.ResultsThe tumor angiogenesis,CD34 antigen and ki-67 antigen of Solanine+VEGF antibody group were significantly better than those of VEGF antibody group and Solanine group(P<0.01);VEGF antibody group had statistical significant difference with Solanine group(P<0.01);the effect of other three groups were better than that of the control group(P<0.01).ConclusionSolanine、VEGF antibody and Solanine combined with VEGF antibody could inhibit tumor angiogenesis and tumor proliferation of human colon cancer cell line HT-29 to induce.It provides a new way for anti-angiogenes.
[Key words]solanine;HT-29 human colon cancer cells;VEGF antibody;tumor angiogenesis;chick embryo chorioallantoic membrane
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.03.017
*基金项目:贵州省卫生厅科学技术基金(gzwkj2012-1-112);遵义医学院中青年基金(院字[2009]号)。
作者简介:杨雪峰(1973-),副主任医师,硕士,主要从事消化道肿瘤的研究。△通讯作者,E-mail:2581303091@qq.com。
[中图分类号]R735.3
[文献标识码]A
[文章编号]1671-8348(2016)03-0342-03
(收稿日期:2015-07-29修回日期:2015-10-24)

