皮质酮对大鼠股骨头微环境11β-HSD1表达及骨重建影响的初步实验研究*
赵 佳,魏 波,刘 军,梁荣班,黄 涛,谢锋伟,黄先进,冯德辉
皮质酮对大鼠股骨头微环境11β-HSD1表达及骨重建影响的初步实验研究*
赵佳1,魏波2,刘军1,梁荣班1,黄涛1,谢锋伟1,黄先进1,冯德辉3△
[摘要]目的研究内源性糖皮质激素对大鼠股骨头微环境11β-羟基类固醇脱氢酶(11β-HSD1)表达的影响,并结合股骨头病理变化探讨相应的机制。方法将60只SD大鼠分成对照组、1月组、3月组(每组20只)。后两组分别于腹腔内注射醋酸皮质酮(8 mg/kg),2次/周,各干预1个月及3个月。此后取股骨头标本免疫组织化学,实时定量PCR方法进行11β-HSD1含量测定,苏木素-伊红(HE)染色观察股骨头组织学表现。结果免疫组织化学,实时定量PCR方法检测出1月组及3月组11β-HSD1含量均高于对照组(P<0.05);HE染色结果表明,与对照组相比,1月组出现骨髓腔脂肪细胞比例升高(P<0.05),3月组出现软骨下骨小梁密度降低(P<0.05)。结论增加皮质酮可促进大鼠股骨头微环境11β-HSD1表达和出现软骨下骨小梁密度降低。
[关键词]皮质酮;股骨头;骨重建;11β-羟基类固醇脱氢酶
随着糖皮质激素类药物的广泛使用,由激素所引发的股骨头坏死发病呈现增多趋势。研究表明正常剂量下糖皮质激素在促进骨代谢,骨骼生长等方面发挥了必不可少的重要作用,但是在糖皮质激素过量的情况下,会引起骨代谢紊乱,从而出现一系列的骨组织、骨功能的病理性变化。11β-羟基类固醇脱氢酶(11β-hydroxysteroid dehydrogenase,11β-HSD)是内源糖皮质激素的关键代谢酶,可以催化其C11位的酮基与羟基之间的氧化还原反应,使有生物活性的皮质醇与无活性11-脱氢皮质酮(以下简称为皮质酮)的相互转化[1],所以被称为是糖皮质激素在组织水平上的受体前调节剂[2-3]。故以其为基础研究糖皮质激素与骨代谢的关系成为近年来该领域研究热点之一。本实验旨在观察过量皮质酮诱导下的SD大鼠股骨头微环境内11β-HSD1的表达和股骨头病理的变化特征,根据结果作出相应讨论。
1材料与方法
1.1材料
1.1.1实验动物SD大鼠60只,雄性,12月龄,购自广东医学院实验动物中心。
1.1.2主要实验用品一抗11β-HSD1,链霉亲和素-生物素复合物(SABC)试剂盒购自武汉博士德公司;实时定量PCR(RT-PCR)试剂盒,RNA提取试剂,DNA-MAKER购自TAKARA公司;GelRed染料购自北京中昊生物科技公司;11β-HSD1引物合成参照PubMed所查询出的基因序列,交由上海生物工程有限公司设计及合成;醋酸皮质酮购自sigma公司。
1.2方法
1.2.1实验分组将60只SD大鼠分为3组,每组20只,对照组大鼠腹腔内注射青霉素4万单位,另2组为实验组。其中实验组分别于腹腔内注射醋酸皮质酮(8 mg/kg),2次/周,各干预1个月及3个月(简称1月组及3月组),同时每次青霉素4万单位预防感染。
1.2.2各组股骨头标本收集及分类颈椎脱臼法处死大鼠,无菌条件下摘取其双侧股骨头,一侧股骨头行3%多聚甲醛固定,10%乙二胺四乙酸(EDTA)液脱钙,人工梯度脱水,常规透明、浸渍、石蜡包埋,切片备用。另一侧股骨头紧急送至-80 ℃冰箱冷冻及防RNA酶处理以备下一步RT-PCR处理。
1.2.3常规苏木素-伊红(HE)染色标本制备各组股骨头石蜡标本脱蜡进行常规HE染色,光镜下观察股骨头组织病理变化进行比较,选取软骨下骨小梁面积及其相应区域的面积做出选定,利用Image proplus软件计算两者比例,其比例值暂定位骨小梁骨密度。
1.2.4免疫组织化学染色标本制备选用石蜡切片标本,使用兔抗大鼠多克隆一抗11β-HSD1,4 ℃冰箱孵育12 h,采用SABC法测定各组股骨头内11β-HSD1的表达,实验过程按照说明书进行,染色后选取骨小梁及骨髓腔边缘成骨细胞作为观察对象,使用Image proplus软件分析11β-HSD1阳性者占总成骨细胞比例。
1.2.5实时定量PCR标本制备取-80 ℃冰箱股骨头样本,削除表面软骨组织后用Trizol液提取总RNA逆转录:取4 uL RNA,经PrimeScript RT-PCR Kit反转录后总体积为20 uL,产物cDNA调整至相同浓度后,选择11β-HSD1的引物进行PCR扩增。11β-HSD1上游引物:5′-AAT GGT GGA AAA GAA CCC ATC-3′,下游引物:5′-CTC AGC TAT GTG GTC CTG AGC-3′;β-actin上游引物:5′-CAC CCG CGA GTA CAA CCT TC-3′,下游引物:5′-CCC ATA CCC ACC ATC ACA CC-3′)上机置于LightCycler 480荧光定量PCR系统中测定产物相对含量。
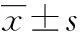
2结果
2.1股骨头样本病理学观察结果股骨头软骨下骨小梁密度测定提示:与对照组[(56.6±4.2)%]相比较,1月组大鼠软骨下骨小梁密度[(56.1±5.8)%]没有明显改变,3月组大鼠软骨下骨骨小梁密度[(46.8±5.5)%]明显下降,差异有统计学意义(P<0.05);骨髓腔内脂肪细胞所占比例值测定提示:与对照组[(25.7±2.6)%]相比较,1月组[(29.6±2.4)%]及3月组[(30.2±2.5)%]均较对照组升高明显,差异有统计学意义(P<0.05),而1月组及3月组差异无统计学意义(P>0.05),见图1。
2.2免疫组织化学指标与对照组[(17.5±1.8)%]相比,1月组[(19.3±1.5)%]及3月组[(21.2±1.7)%]阳性率出现显著上升,差异有统计学意义(P<0.05);1月组阳性率与3月组相比差异有统计学意义(P<0.05),见图2。

A:对照组;B:1月组;C:3月组。
图1各组股骨头HE染色(×40)

棕色部分为11β-HSD1阳性表达细胞。A:对照组;B:1月组;C:3月组。
图2各组股骨头组织11β-HSD1免疫组织化学染色(×200)
2.3股骨头组织总mRNA 中11β-HSD1含量指标通过3组股骨头样本的11β-HSD1表达(跟内参产物相对值)进行对比,与对照组(0.76±0.07)相比,1月组(0.94±0.08)及3月组(1.05±0.11)总量出现上升,差异有统计学意义(P<0.05);而1月组表达与3月组差异有统计学意义(P<0.05)。
3讨论
股骨头微环境内存在成骨细胞,脂肪细胞骨髓间质细胞等多种成分,而成骨细胞作为骨重建的桥梁细胞,对糖皮质激素效应比较敏感[3],是本文研究的重点。
骨重建指的是在同一个骨表面下骨吸收及形成相偶联的事件,简单来说就是新骨替换旧骨的过程。成骨细胞作为骨形成的主要功能细胞,负责骨基质的合成、分泌和矿化,其活动受到糖皮质激素的干扰。在正常激素剂量条件下,成骨细胞能维持其功能,而高剂量激素影响下则会导致骨小梁密度减少等一系列不利因素,延缓骨重建进程。本实验3月组SD大鼠骨小梁密度明显比对照组减少,关节软骨下面的骨承载区进一步减弱[4],这也证实了以上的观点。
11β-HSD1在成骨细胞中呈现中等浓度存在于大鼠体内[5-6],作为自反馈调节的一个主要因素,11β-HSD1的还原作用能使得局部组织活性低的皮质酮转化为活性高的皮质醇,而过量的皮质醇通过稳定Ⅲ型胶原酶mRNA及抑制Ⅰ型胶原和β1整联蛋白的形成[3](后二者是骨基质的主要成分),从而达到增强局部组织糖皮质激素效应的作用。与对照组相比,1月组及3月组无论是成骨细胞本身或者在总股骨头11β-HSD1含量增加均较明显,差异有统计学意义(P<0.05),表明在糖皮质激素过量的情况下,11β-HSD1会自发地形成正反馈效应,以增强激素对组织或者成骨细胞的效应,延长皮质醇的活性半衰期[7],从而进一步影响微环境内骨小梁发育及生理状态,而其与既往研究体外实验中11β-HSD1的活动随着激素的增加而升高相一致[8]。11β-HSD1基因序列研究表明,其启动子区存在GRE样构造,皮质酮可能通过GRE对11β-HSD1基因表达进行调节。本实验中免疫组织化学的结果表明,过量的皮质酮1月内对11β-HSD1表达具有上调作用,而11β-HSD1的上调反过来促使更多的皮质酮活化为皮质醇,导致成骨细胞长期暴露于高浓度皮质醇环境下。由此形成的正反馈作用可能是引起股骨头骨小梁密度下降的一个重要原因。当糖皮质激素浓度及活性未能达到影响成骨细胞制造骨小梁降低的阈值后,相应的组织形态学表现就未能体现出来。一旦达到临界点后,就形成了量变向质变的过程,延缓成骨细胞骨重建的进程。本实验3月组股骨头就呈现出软骨下骨承载区骨小梁密度降低的趋势。
从整个股骨头微环境内11β-HSD1水平的升高也会间接影响股骨头骨髓腔内脂肪细胞的形成,Justesen等[9]发现11β-HSD1敲除小鼠有一部分骨髓腔内脂肪组织缺失,提示了11β-HSD1对激素的增敏反应影响了骨髓脂肪细胞的形成。而Tomlinson等[2]发现11β-HSD1通过激活内源性皮质酮达到促进前脂肪细胞向脂肪细胞分化的功能。而随着脂肪组织及分泌产物的增加也会使骨组织中成分的改变从而使骨质疏松的进程加速[10-11]。本实验也证实了1月组SD大鼠骨髓腔内脂肪细胞所占比例增高,亦会间接影响骨重建的进程[12]。11β-HSD1表达的增加会增加糖皮质激素所引起的骨质疏松效应[13],而抑制其活性即可延缓糖皮质激素所诱发的骨质疏松效应[14]。
参考文献
[1]Zhou HY,Hu GX,Lian QQ,et al.The metabolism of steroids,toxins and drugs by 11β-hydroxysteroid dehydrogenase 1[J].Toxicology,2012,292(1):1-12.
[2]Tomlinson JW,Walker EA,Bujalska IJ,et al.11beta-Hydroxysteroid dehydrogenase type 1:a tissue-specific regulator of glucocorticoid response[J].Endocr Rev,2003,12(8):831-866.
[3]Pierotti S,Gandini L,Lenzi A.Pre-receptorial regulation of steroid hormones in bone cells:insights on glucocorticoid-induced osteoporosis[J].J Steroid Biochem Mol Biol,2008,108(3/5):292-299.
[4]Delling G.Pathohistology of femoral head necrosis[J].Orthopade,2007,36(5):303-310.
[5]Ergang P,Leden P,Vagnerová K,et al.Local metabolism of glucocorticoids and its role in rat adjuvant arthritis[J].Mol Cell Endocrinol,2010,12(323):155-160.
[6]Hardy RS,Raza K,Cooper MS.Glucocorticoid metabolism in rheumatoid arthritis[J].Ann N Y Acad Sci,2014,18(3):1318-1326.
[7]Cooper MS,Blumsohn A,Goddard PE,et al.11beta-hydroxysteroid dehydrogenase type 1 activity predicts the effects of glucocorticoids on bone[J].J Clin Endocrinol Metab,2003,88(8):3873-3877.
[8]Cooper MS.11beta-Hydroxysteroid dehydrogenase:a regulator of glucocorticoid response in osteoporosis[J].J Endocrinol Invest,2008,31(7 Suppl):16-21.
[9]Justesen J,Mosekilde L,Holmes M,et al.Mice deficient in 11beta-hydroxysteroid dehydrogenase type 1 lack bone marrow adipocytes,but maintain normal bone formation[J].Endocrinology,2003,7(135):1916-1925.
[10]Hipmair G,Böhler N,Maschek W,et al.Serum leptin is correlated to high turnover in osteoporosis[J].Neuro Endocrinol Lett,2010,31(1):155-160.
[11]Burch J,Rice S,Yang H,et al.Systematic review of the use of bone turnover markers for monitoring the response to osteoporosis treatment:the secondary prevention of fractures,and primary prevention of fractures in high-risk groups[J].Health Technol Assess,2014,18(11):1-180.
[12]Nava-González EJ,Gallegos-Cabriales EC,Bastarrachea RA.Phenotypes of bone and adipose tissue metabolism.A systematic review of their relationship[J].Rev Med Inst Mex Seguro Soc,2014,52(6):644-650.
[13]Elvy Suhana MR,Farihah HS,Faizah O,et al.Effect of 11β-HSD1 dehydrogenase activity on bone histomorphometry of glucocorticoid-induced osteoporotic male Sprague-Dawley rats[J].Singapore Med J,2011,52(11):786-793.
[14]Ramli ES,Suhaimi F,Asri SF.Glycyrrhizic acid as 11β-hydroxysteroid dehydrogenase inhibitor exerts protective effect againstglucocorticoid-induced osteoporosis[J].J Bone Miner Metab,2013,31(3):262-273.
(广东医学院附属医院:1.急诊科;2.骨科;3.老年科,广东湛江 524001)
The preliminary research for the corticosterone to the femoral head microenvironment of rat 11 beta HSD1 expression and the influence of bone reconstruction*
ZhaoJia1,WeiBo2,LiuJun1,LiangRongban1,HuangTao1,XieFengwei1,HuangXianjin1,FengDehui3△
(1.DepartmentofEmergency; 2.DepartmentofOrthopedic;3.GeriatricDepartment,AffiliatedHospitalofGuangdong>MedicalCollege,Zhanjiang,Guangdong524001,China)
[Abstract]ObjectiveTo study the endogenous glucocorticoid on rat femoral head microenvironment of 11 hydroxysteroid dehydrogenase expression,and to discuss the influence of combined with femoral head pathological changes of the corresponding mechanism.MethodsSixty SD rats were divided into control group,1-month group,3-months group,each 20 rats in group.1-month group and 3-months group inject cortisone acetate in the abdominal cavity intraperitoneal for 1-month or 3-months each.Immunohistochemical,immunofluorescence,Real-time qPCR,HE staining were employed in this study.ResultsFrom immunohistochemical,immunofluorescence,Real-time qPCR,the 11 hydroxysteroid dehydrogenase content of 1-month group and 3-months group were higher than that of the control group(P<0.05).From HE staining we detected 1-month group in the bone marrow cavity increased in fat cells,3-months group subchondral trabecular bone density decreased,compared with the control group(P<0.05).ConclusionSupplement of corticosterone could promote rat femoral head microenvironment 11 hydroxysteroid dehydrogenase expression and subchondral trabecular bone density decrease.
[Key words]corticosterone;femoral head;bone reconstruction;11β-hydroxysteroid dehydrogenase
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.03.015
*基金项目:广东医学院附属医院优硕基金项目资助(20501YS011005)。
作者简介:赵佳(1973-),主任医师,本科,主要从事骨质疏松方面研究。△通讯作者,E-mail:Fdh4866@163.com。
[中图分类号]R816.8
[文献标识码]A
[文章编号]1671-8348(2016)03-0336-03
(收稿日期:2015-08-08修回日期:2015-10-16)

