肉桂醛对烟曲霉菌体外生物膜的影响*
邬丽红,陈一强,孔晋亮,罗 劲,黄 宏,侯长春
(广西医科大学第一附属医院呼吸内科,南宁 530000)
肉桂醛对烟曲霉菌体外生物膜的影响*
邬丽红,陈一强△,孔晋亮,罗劲,黄宏,侯长春
(广西医科大学第一附属医院呼吸内科,南宁 530000)
[摘要]目的探讨肉桂醛对烟曲霉菌生物膜(BF)的体外作用。方法体外建立烟曲霉菌BF;采用2倍稀释法测定肉桂醛的最低抑菌浓度(MIC);结晶紫法评价不同浓度的肉桂醛对烟曲霉菌BF的影响;扫描电镜观察BF的形态学变化。结果烟曲霉菌可在体外形成生物膜;肉桂醛对受试烟曲霉菌的MIC为256 μg/mL;在1 MIC、 1/2 MIC、1/4 MIC 时,生物膜量分别为0.81±0.11、1.13±0.18和1.59±0.11,与阳性对照组(2.18±0.15)相比,差异有统计学意义(P<0.05);电镜下可见肉桂醛作用后生物膜结构变稀疏松散。结论肉桂醛对烟曲霉菌具有抗菌活性,亚抑菌浓度的肉桂醛对生物膜具有一定的破坏作用,其中浓度越高作用越强。
[关键词]肉桂;烟曲霉菌,烟;生物膜;肉桂醛
烟曲霉菌是侵袭性真菌感染中最常见的病原体,具有很高的产孢子能力。不同机体免疫状态的患者吸入孢子后可发生不同的疾病,如侵袭性曲霉病、曲霉球、变应性支气管肺曲霉病等[1]。随着广谱抗真菌药的应用及突变株的出现,烟曲霉菌对传统抗真菌药的耐药率逐渐增高。近年来,烟曲霉菌生物膜逐渐引起人们的关注。烟曲霉菌生物膜也是导致抗真菌药耐药的机制之一[2]。肉桂醛是一种芳香醛类物质,具有抗菌活性,并且可以抑制金黄色葡萄球菌生物膜的形成[3]。另外肉桂醛对白色念珠菌生物膜也具有抑制和破坏作用[4]。前期课题组研究发现肉桂醛对临床分离的烟曲霉菌具有抗菌活性[5],但其对已经形成生物膜的烟曲霉菌群体的作用尚未清楚。本研究主要探讨肉桂醛对烟曲霉菌生物膜的体外影响。
1材料与方法
1.1材料
1.1.1药物和试剂肉桂醛(cinnamaldehyde,美国Sigma公司,批号V900539),用100%二甲基亚砜(DMSO)溶解,储存液的浓度为102 400 μg/mL,分装后于-70 ℃保存;RPMI-1640粉末(Gibco公司)、MOPS(Sigma公司),结晶紫(天津市河东区红岩试剂厂),马铃薯葡萄糖琼脂培养基(PDA,中国路桥技术责任有限公司)。
1.1.2菌株受试菌株为烟曲霉临床分离株,编号为A.f4002,经前期试验鉴定为在体外具有形成稳定生物膜的能力,药敏实验的质控菌株为近平滑念珠菌ATCC22019(广西医科大学第一附属医院临床微生物检验中心鉴定及提供)。菌株均于-4 ℃保存。
1.1.3主要仪器96孔细胞培养板(美国Corning公司),24孔细胞培养板(美国Corning公司),13 mm×13 mm圆形载玻片(北京博润莱特科技有限公司),作为生物膜载体,75%乙醇浸泡过夜后备用;SPX型智能生化培养箱(常州市伟嘉仪器制造有限公司),BHC-1300ⅡA/B2型生物安全柜(苏州净化设备有限公司),Multiskan MK3酶标仪(美国Thermo公司),电子扫描显微镜(SEM,日本S3400N)。
1.2方法
1.2.1菌悬液的制备将冻存的受试菌株A.f4002接种于PDA斜面复苏,37 ℃培养3 d。后取单菌落转种于新的PDA斜面,37 ℃孵育72 h。用含0.025%吐温20的灭菌磷酸盐缓冲液(PBS)冲洗PDA表面收集孢子,用经MOPS缓冲后pH为7.0的RPMI-1640培养液重悬孢子,血细胞计数板调节使孢子液终浓度为1×105cfu/mL。
1.2.2药物浓度实验药物肉桂醛的最终受试浓度范围为4~1 024 μg/mL。
1.2.3实验分组实验分为无药的阳性对照组,阴性对照组(仅含RPMI-1640培养液),肉桂醛组。肉桂醛储存液用RPMI-1640培养液按2倍稀释法制备最低抑菌浓度(MIC)梯度,试验使用浓度为1 MIC、1/2 MIC、 1/4 MIC、 1/8 MIC、1/16 MIC。
1.2.4MIC值的测定参照美国临床实验室标准化协会(CLSI)的 M83-A2方案[6],测定肉桂醛对临床分离株A.f4002的MIC。MIC值为肉眼直接观察到的无真菌生长的最低药物浓度。实验平行重复3次,当MIC只差1个浓度梯度时,取最高浓度作为MIC值。
1.2.5结晶紫法定量生物膜将上述浓度的菌悬液100 μL接种于96孔板中,37 ℃孵育24 h形成生物膜。各孔分别用灭菌PBS轻轻漂洗3次除去未黏附菌,弃除漂洗液后,分别加入不同浓度的肉桂醛100 μL,空白组则加入100 μL的RPMI-1640培养液作为阳性对照孔,并设阴性对照孔。培养板于37 ℃继续孵育48 h。各组药物作用48 h后,再次漂洗各孔,漂洗液吸出,室温干燥后各孔加入1%结晶紫染色15 min,用灭菌的0.9%NaCl充分漂洗以除去未结合的结晶紫,室温中晾干后,每孔加入95%乙醇脱色3 min,紫外分光光度计测定波长570 nm处的吸光度值。各组每次分别重复3次取平均值,实验独立重复3次。
1.2.6电镜观察生物膜的形态学改变如上述实验分组,取1 mL上述浓度的菌悬液和灭菌生物膜载体各1个分别置于24孔板中,并于37 ℃孵育24 h建立烟曲霉菌生物膜模型[6]。建模后,各组分别弃去培养液,并用灭菌PBS轻轻漂洗3次除去浮游菌。除去漂洗液后,药物组分别加入如上述浓度的肉桂醛,空白组加入新鲜培养液作为阳性对照,相同条件下继续孵育48 h后,各孔分别取出载体,再次漂洗后,经2.5%戊二醛固定60 min,分别用50%、70%、80%、90%、100%的乙醇脱水各15 min,干燥后,表面镀金处理,于扫描电镜下观察。

2结果
2.1药物的MIC肉桂醛对烟曲霉临床分离株A.f4002的MIC为256 μg/mL。
2.2烟曲霉菌生物膜定量的结果1 MIC、1/2 MIC、1/4 MIC的肉桂醛作用后,生物膜量均较阳性对照组减少,差异有统计学意义(P<0.05);而1/8 MIC 和1/16 MIC的肉桂醛作用于生物膜后,生物膜量并没有减少,与阳性对照组比较差异无统计学意义(P>0.05),见表1。
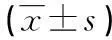
表1 肉桂醛对烟曲霉菌A.f4002生物膜的
a:P<0.05,与阳性对照组比较;b:P<0.05,组间比较。
2.3SEM观察烟曲霉菌生物膜结构烟曲霉临床分离株A.f4002在体外可形成典型的生物膜结构,菌丝之间有稠厚的细胞外基质黏附,且胞外基质将菌丝包裹起来形成致密的网状结构(图1)。1/8 MIC的肉桂醛作用后,与空白组相比,生物膜结构无明显改变,菌丝间及菌丝表面仍有较多的胞外基质黏附,菌丝饱满,生物膜结构仍较结实(图2A)。而1/4 MIC、1/2 MIC、1 MIC的肉桂醛作用后,菌丝之间和菌丝表面的细胞外基质明显较空白组减少,生物膜结构相对稀疏,其中1/2 MIC和1 MIC组的菌丝轮廓清晰,1 MIC组可见菌丝密度较低浓度组减少,部分菌丝变形断裂,见图2。

图1 空白组A.f4002 生物膜(SEM ×2 000)

A:1/8 MIC;B:1/4 MIC;C:1/2 MIC;D:1 MIC。
图2不同浓度的肉桂醛作用后的A.f4002生物膜(SEM ×2 000)
3讨论
烟曲霉菌生物膜是一个不可逆的微生物结构。烟曲霉孢子可黏附于有活力或者无活力的材料表面,并在生长过程中产生细胞外多聚基质,进一步促进菌体的黏附和生物膜结构的形成[7]。目前的治疗方法主要是应用强有力的抗真菌药抑制或破坏生物膜。早期两性霉素B是用于治疗烟曲霉菌感染的有效药物,但其导致机体发生明显的毒副作用,尤其是肾毒性的发生,两性霉素B的应用受到限制[8]。近年来,唑类药物成为治疗烟曲霉菌相关性感染的有效药物。然而,随着唑类药物的广泛应用,烟曲霉菌对唑类药物的敏感性明显降低,甚至产生耐药性[9]。随着曲霉耐药机制的不断探讨,生物膜的形成成为临床上烟曲霉菌感染难以治疗的原因之一[2]。因此,在针对烟曲霉菌生物膜相关性感染的药物研发中,不仅要考虑药物对真菌细胞的有效性,还要顾及药物穿透生物膜屏障到达菌细胞的能力。当前,中药在治疗一些常见的细菌及真菌生物膜感染方面取得较好的治疗效果,采用中药治疗越来越受到关注。
肉桂醛又称为桂醛,主要是从桂皮、桂叶和桂枝中提取出来的一种醛类物质,其为无色或者琥珀色液体,刺激性小,易溶于醇、醚类物质,广泛应用于传统医药,对细菌和真菌具有较强的抑制作用,并且具有抗生物膜活性[3-4]。本研究结果表明,测试浓度范围内的肉桂醛对浮游状态的烟曲霉菌具有一定的抗菌作用,但对于已经形成生物膜的烟曲霉群体,抑菌浓度的肉桂醛可以减少胞外基质和部分菌丝,但不能够完全抑制菌丝的生长。该结果说明肉桂醛对浮游状态的烟曲霉菌具有一定的抗菌活性,但对生物膜内菌细胞的抑菌效果明显减弱,这进一步证实了烟曲霉菌生物膜的形成可降低菌体对药物的敏感性。上述现象在以往烟曲霉菌生物膜的研究中有类似的报道,随着生物膜的成熟,大量胞外基质产生,使生物膜内菌体对抗真菌药的敏感性减低[2]。有研究证实,白色念珠菌生物膜被破坏后对氟康唑的敏感性提高8倍以上[10]。可见生物膜的形成是导致难治性感染的重要因素。有研究证实肉桂醛通过抑制细菌的DNA、RNA、蛋白质的生物合成表现抗菌效应[11]。肉桂醛抗真菌的机制也可能是通过抑制相关基因和蛋白的表达从而发挥抗真菌作用。然而,生物膜状态的烟曲霉菌与浮游菌相比具有许多不同的生物学特性。烟曲霉菌生物膜可以增强药物外派泵的活性、上调疏水蛋白基因、外派泵基因,以及药物靶酶基因的表达等机制介导耐药[12-13]。另外,生物膜成熟后,一些次级代谢产物的相关生物合成蛋白显著上调,菌体代谢活力减低,进一步耐受抗真菌药物[14]。因此,烟曲霉菌生物膜的耐药机制是十分复杂的,不同的机制之间有可能存在相互作用,肉桂醛抗真菌作用机理有待于进一步探索。本实验通过体外建立烟曲霉菌生物膜后,使用亚抑菌浓度的肉桂醛作用于成熟的生物膜,结果显示亚抑菌浓度范围的肉桂醛可以减少生物膜量,结合电镜所见,肉桂醛作用后生物膜结构中的细胞外基质明显减少。该结果可能说明肉桂醛是通过抑制胞外基质成分的产生从而发挥抗生物膜活性。但由于生物膜耐药机制是多途径,肉桂醛抗生物膜的具体作用机理需要进一步的研究证实。在亚抑菌浓度的肉桂醛作用下,细胞外基质随着药物浓度的增多而减少,对生物膜破坏作用逐渐增强。提示生物膜的破坏作用与肉桂醛的浓度有一定的关系。以往研究发现生物膜状态生长的白色念珠菌对传统抗真菌药物和肉桂醛等中药耐药性明显增加,但亚抑菌浓度的肉桂醛可使生物膜三维结构变畸形,并与传统抗真菌药具有协同杀菌作用[4]。也观察到亚抑菌浓度的肉桂醛作用于已经成熟的烟曲霉菌生物膜后,生物膜的致密结构变松散,菌丝表面及菌丝之间胞外基质被清除,且在高浓度时部分菌丝被裂解。提示应该防止生物膜的形成或者破坏已经形成的生物膜结构,使得药物能够克服生物膜屏障渗透到菌细胞内达到有效浓度而发挥抗菌作用。因此,本研究设想肉桂醛与抗真菌药物联合作用,肉桂醛虽对生物膜细胞没有明显地抑菌作用,但可通过去除生物膜胞外基质,使生物膜结构被破坏,从而提高抗菌药物的敏感性,同时联合作用也可降低抗菌药的浓度从而减低毒副作用。
本实验结果说明肉桂醛具有抗烟曲霉菌活性,并能够破坏烟曲霉菌生物膜。提示应用肉桂醛治疗烟曲霉菌生物膜相关性感染具有一定的应用前景,另外肉桂醛抗烟曲霉菌及抗生物膜的作用机制仍不明确,有待于进一步探索。
参考文献
[1]Thompson GR,Patterson TF.Pulmonary aspergillosis:recent advances[J].Semin Respir Crit Care Med,2011,32(6):673-681.
[2]Seidler MJ,Salvenmoser S,Muller FM.Aspergillus fumigatus forms biofilms with reduced antifungal drug susceptibility on bronchial epithelial cells[J].Antimicrob Agents Chemother,2008,52(11):4130-4136.
[3]Zhang H,Zhou W,Zhang W,et al.Inhibitory effects of citral,cinnamaldehyde,and tea polyphenols on mixed biofilm formation by foodborne staphylococcus aureus and Salmonella enteritidis[J].J Food Prot,2014,77(6):927-933.
[4]Khan MS,Ahmad I.Antibiofilm activity of certain phytocompounds and their synergy with fluconazole against Candida albicans biofilms[J].J Antimicrob Chemother,2012,67(3):618-621.
[5]黄宏,陈一强,孔晋亮,等.不同中药单体成分对两性霉素B耐药的烟曲霉抑菌活性的体外研究[J].中国现代医药杂志,2014,16(2):1-4.
[6]Mowat E,Butcher J,Lang S,et al.Development of a simple model for studying the effects of antifungal agents on multicellular communities of Aspergillus fumigatus[J].J Med Microbiol,2007,56(Pt 9):1205-1212.
[7]Singhal D,Baker L,Wormald PJ,et al.Aspergillus fumigatus biofilm on primary human sinonasal epithelial culture[J].Am J Rhinol Allergy,2011,25(4):219-225.
[8]Moen MD,Lyseng-Williamson KA,Scott LJ.Liposomal amphotericin B:a review of its use as empirical therapy in febrile neutropenia and in the treatment of invasive fungal infections[J].Drugs,2009,69(3):361-392.
[9]Howard SJ,Cerar D,Anderson MJ,et al.Frequency and evolution of Azole resistance in Aspergillus fumigatus associated with treatment failure[J].Emerg Infect Dis,2009,15(7):1068-1076.
[10]Walker LA,Gow NA,Munro CA.Fungal echinocandin resistance[J].Fungal Genet Biol,2010,47(2):117-126.
[11]杨霞,黄萍,肖晓蓉,等.中药桂皮醛对牙周致病菌的体外抑菌活性研究[J].重庆医学,2009,38(1):75-76.
[12]Rajendran R,Mowat E,McCulloch E,et al.Azole resistance of Aspergillus fumigatus biofilms is partly associated with efflux pump activity[J].Antimicrob Agents Chemother,2011,55(5):2092-2097.
[13]Gibbons JG,Beauvais A,Beau R,et al.Global transcriptome changes underlying colony growth in the opportunistic human pathogen Aspergillus fumigatus[J].Eukaryot Cell,2012,11(1):68-78.
[14]Bruns S,Seidler M,Albrecht D,et al.Functional genomic profiling of Aspergillus fumigatus biofilm reveals enhanced production of the mycotoxin gliotoxin[J].Proteomics,2010,10(17):3097-3107.
Effects of cinnamaldehyde on aspergillus fumigatus biofilm in vitro*
WuLihong,ChenYiqiang△,KongJinliang,LuoJing,HuangHong,HouChangchun
(DepartmentofRespiratoryMedicine,theFirstAffiliatedHospital,GuangxiMedicalUniversity,Nanning,GuangxiZhuangAutonomousRegion530000,China)
[Abstract]ObjectiveTo study the treatment effect of cinnamaldehyde on Aspergillus fumigatus biofilm(BF) in vitro.MethodsThe models of A.fumigatus BF were established in vitro;the minimum inhibitory concentration(MIC) on A.fumigatus was measured.The crystal violet assay and scanning electron microscopy were employed to determined the treatment effect of A.fumigatus biofilm under varying concentrations of cinnamaldehyde.ResultsBF models were established successfully in vitro.MIC value of A.fumigatus of cinnamaldehyde was 256 μg/mL;The biofilm biomass in serially increasing concentrations of cinnamaldehyde(1 MIC,1/2 MIC,1/4 MIC)were 0.81±0.11,1.13±0.18 and 1.59±0.11 respectively.Compared to untreated control group(2.18±0.15),difference achieved statistical significance(P<0.05).SEM studies revealed the deformity of three-dimensional structures of biofilms treated with sub-MICs of cinnamaldehyde.ConclusionCinnamaldehyde has significant antifungal activity against Aspergillus fumigatus,sub-MICs could disrupt the mature biofilm in vitro.
[Key words]cinnamomum cassia;aspergillus fumigatus;biofilm;cinnamaldehyde
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.03.012
基金项目:国家自然科学基金项目(81260002)。
作者简介:邬丽红(1989-),住院医师,硕士,主要从事生物膜耐药的研究。△通讯作者,E-mail:chenyq163@tom.com。
[中图分类号]R285
[文献标识码]A
[文章编号]1671-8348(2016)03-0326-03
(收稿日期:2015-08-28修回日期:2015-10-23)

