油茶内生拮抗菌的筛选与鉴定
姜 微,刘效辰,邱荣群,吴晓菲,温锦涛,罗 娜,罗 琼
(长沙医学院生物技术教研室,湖南长沙 410219)
油茶内生拮抗菌的筛选与鉴定
姜 微,刘效辰,邱荣群,吴晓菲,温锦涛,罗 娜,罗 琼*
(长沙医学院生物技术教研室,湖南长沙 410219)
摘要[目的]通过对湖南长沙地区油茶内生拮抗菌的筛选,为油茶根腐病、叶枯病、炭疽病及软腐病的生物防治提供理论依据。[方法]采用研磨法从健康油茶根、茎、叶组织中分离出内生菌,通过平板对峙试验筛选出对油茶根腐病、叶枯病、炭疽病及软腐病都具有拮抗活性的内生菌,并进行形态观察和16S rDNA序列分析。[结果]不同组织内生细菌数量不同,根中内生细菌的数量最多,其次为茎,叶中最少。菌株J-3-1对油茶根腐病菌、叶枯病菌、炭疽病菌及软腐病菌均有拮抗活性,其抑菌圈半径分别为12.5、16.8、13.5、13.4 mm。16S rDNA相似性为99%。[结论]通过对该菌株进行形态观察及16S rDNA序列分析,鉴定其为枯草芽孢杆菌(Bacillus subtilis)。
关键词油茶;内生拮抗菌;分离鉴定
油茶根腐病、叶枯病、炭疽病和软腐病是近年来发生频繁且危害严重的油茶病害[1-2],该病分布广泛,可造成重大的经济损失。内生菌具有在植物体内独立自主的分裂繁殖和传递特性,可增强宿主对其他生物如病原细菌和真菌的抗性,分离并利用植物内生菌控制植物病虫害、开发有益内生菌以提高作物产量和品质对于可持续农业具有重要意义。自20世纪中叶以来,国外在多种植物中分离得到了不同种属的内生细菌[3]。近年来,对植物内生菌代谢物的生防物质研究取得了一定进展[4]。杨慧勇等[5]从银杏上分离到一株病菌,该病菌的代谢产物对小麦赤霉病毒和纹枯病菌等植物病原真菌有很强的抑制作用[5]。陈敏等[6]从黄瓜根系内筛选出对黄瓜枯萎病具有一定拮抗能力的内生菌HE-1和HE-2。截至目前,对油茶病害主要采用化学防治,但大量化学农药会影响油茶品质和茶园生态环境。笔者筛选出对油茶炭疽病、叶枯病、根腐病和软腐病有强拮抗作用的内生细菌,为进一步开发应用生防菌资源防治油茶病害提供参考。
1材料与方法
1.1试验材料于2014年10月在湖南省长沙市望城区采集健壮的油茶根、茎、叶样品备用。
1.2基础培养基NA培养基:牛肉浸膏 3 g,蛋白胨10 g,氯化钠 5 g,琼脂 15~20 g,自来水 1 000 mL,pH 7.0~7.2。NB培养基:牛肉浸膏 3 g,蛋白胨10 g,氯化钠 5 g,自来水1 000 mL,pH 7.0~7.2 。PDA培养基:先洗净去皮,再称取300 g马铃薯切成小块,加水煮烂(20~30 min,能被玻璃棒戳破即可),用4层纱布过滤。葡萄糖 20 g,琼脂 15~20 g,自来水 1 000 mL。
1.3试验方法
1.3.1材料的消毒。取新鲜油茶的根、茎、叶,用自来水冲洗晾干后,各称取1 g,用75%乙醇浸泡1 min, 再用2.5%的次氯酸钠浸泡5 min,最后用无菌水冲洗3~ 4次。在无菌环境下,将最后一次冲洗液涂布于NA培养基上,26~28 ℃培养2 d,平板中若无菌落出现,则表示消毒彻底,若有,则需重新分离。
1.3.2菌悬液的制备。将消毒后的根、茎、叶分别放入无菌研钵中,吸取9 mL无菌水,将其研磨彻底后充分混匀,即为10-1的菌悬液,再依次进行梯度稀释,根和茎的梯度为10-1、10-2、10-3、10-4,叶的梯度为10-1、10-2、10-3。
1.3.3内生菌的分离与种群密度测定。取各稀释度的菌悬液0.1 mL分别涂布于NA培养基平板上,每个处理3 个平行。28 ℃恒温培养2 d,分别计数。根据菌落形态(包括颜色、大小、形状、透明度、表面光泽度、边缘整齐度等)[7],挑取具有代表性的单菌落,纯化后斜面保存。
1.3.4内生拮抗菌的筛选[8]。将预先培养的病原真菌接种于PDA培养皿中心,采用两点对峙的方法,在距PDA平板中心3 cm的2点上,分别接种内生菌,每个处理均设2个重复。将只接种病原菌不接种内生菌的处理设为空白对照,置于28 ℃恒温箱中培养,每天观察抑菌作用,用毫米刻度尺测量其内生菌与病菌菌落生长的相向半径(R病)以及空白对照半径(R0),并计算抑制率。
病菌的生长抑制率=(R0-R病)/R0×100%
1.3.5PCR反应体系及扩增条件。 菌株用NB培养基振荡培养过夜,用Tiangen细菌基因组DNA提取试剂盒提取菌株DNA,再进行PCR扩增。
引物为细菌16S rDNA通用引物,其序列(扩增片段大小约1 500 bp)为Univeirsal bacterial F:5′AGAGTTTGATCMTGGCTCAG-3′,Univeirsal bacterial R:5′-AAGGAGGTGWTCC-ARCC-3′。
PCR反应体系(25.0 μL):2×powerTapMix 12.5 μL,去离子水9.5 μL,引物F 1.0 μL,引物R 1.0 μL,DNA模板1.0 μL。混匀后稍微离心。
PCR反应条件:95 ℃ 预变性5 min;95 ℃变性30 s,55 ℃退火0.5 min,72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min,4 ℃保存。
取PCR扩增产物5 μL,用含GoldView的1.0%琼脂糖凝胶电泳检测,电压90 V,电泳30 min。在紫外分光仪下观察并拍照。
1.3.6DNA序列测定和分析。扩增产物送至铂尚生物技术有限公司进行测序,将测序结果在NCBI网站上(http://www.ncbi.nlm.nih.gov)进行比对分析。
2结果与分析
2.1油茶不同组织内生菌的种群密度由图1可知,油茶内生菌的种群密度在根中最高,约为2.10×104CFU/mg,茎中次之,约为2.20×103CFU/mg,叶中最低,约为1.1×102CFU/mg。
2.2内生细菌对油茶常见病原菌的拮抗效果由表1可知,菌株J-3-1对油茶叶枯病菌、炭疽病菌、软腐病菌和根腐病菌均有较强的拮抗作用(图2),抑制圈半径分别为16.8、13.5、13.4和12.5 mm,抑菌率分别为66.3%、71.0%、52.2%和65.2%。由此可见,菌株J-3-1对油茶常见病原菌拮抗作用较强,抑菌谱较广,具有较好的生防应用潜力。
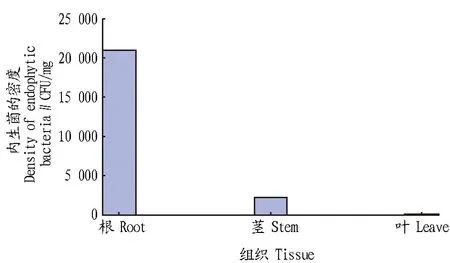
图1 油茶不同组织内生菌的种群密度Fig.1 Population density of endophytic fungi in different tissues of oil-tea
表1内生细菌对油茶4种病原菌的抑菌效果
Table 1The antibacterial effect of endophytic bacteria on four kinds of common pathogens of oil-tea

菌株Strains病原菌Pathogenicbacteria抑制圈半径Inhibitoryzoneradius∥mm抑菌率Inhibitionrate∥%J-3-1油茶叶枯病菌16.866.3J-3-1油茶炭疽病菌13.571.0J-3-1油茶软腐病菌13.452.2J-3-1油茶根腐病菌12.565.2

注:a.炭疽病菌;b.根腐病菌;c.软腐病菌。Note:a.Anthrax bacteria;b.Fusarium oxysporum;c.Bacteria erwinia.图2 J-3-1对油茶常见病菌的拮抗效果Fig.2 Antagonistic effect of J-3-1 on common pathogen of oil tea
2.3内生拮抗菌16S rDNA PCR扩增及序列相似性分析由图3可知,在1 500 bp左右产生明显的条带,条带清晰且单一,与预期目标大小一致。将测序结果与基因库(www.ncbi.nov.gov/blast)中的序列进行BLAST比对,结果表明该菌株为枯草芽孢杆菌(Bacillussubtilis),16S rDNA相似性为99%。
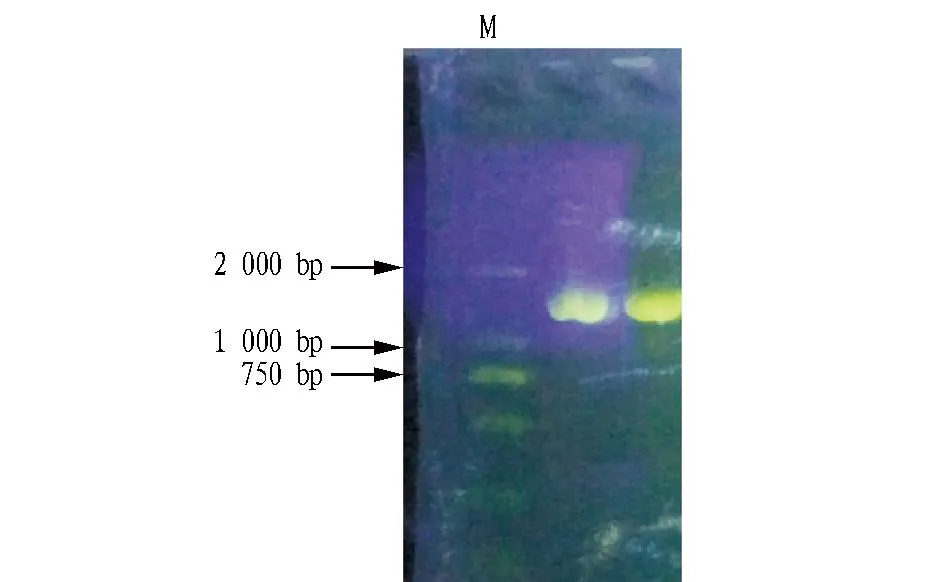
注:M.DL2 000 DNA Marker。Note:M.DL2 000 DNA Marker.图3 PCR 产物Fig.3 PCR products
3结论与讨论
在分离植物内生菌的过程中,表面灭菌和分离培养条件是筛选内生菌的关键,表面灭菌不彻底会造成所分离的菌株不是内生菌,而表面灭菌过度会造成部分内生菌被杀死,最佳培养条件能最大限度地获得较多的内生菌[9-10]。该试验采用研磨法分离油茶内生菌,仅获得14株菌株,与从其他一些植物,如马铃薯[11]、黄瓜[12]、大豆[13]等植物材料中筛选出100多株菌株相比,筛选的内生菌较少,这可能与油茶表面消毒有关。
该研究表明,根中油茶内生菌的种群密度最高,叶中最低,这说明微生物菌群密度与植株部位密切相关,这与相关研究[14]结果一致。内生细菌定殖在宿主植物各种组织和器官的细胞内和细胞间隙中,利用宿主细胞内或分泌到细胞间隙的分泌物或宿主防御反应的产物作为营养物质,而这些物质的产生与植物的生长部位有很大关系,这可能是造成同种植物不同部位内生菌数目有较大差异的主要原因。除植物本身外,菌群密度的不同可能还与分离内生菌的数量、灭菌时间的长短、消毒剂的渗入、培养基的选择以及细菌对植物的吸附作用等因素有关[15]。
植物体内存在大量有益的内生细菌和内生真菌,这些内生菌在植物体中具有多种生物学功能,能提供植物所需的营养物质及某些激素,参与植物的防卫功能,促进植物快速生长,增强植物抗病、抗逆、抗动物危害的能力[16]。该研究从湖南长沙油茶中分离出一株内生细菌,该内生细菌对油茶常见的4种病原菌均有拮抗作用,经16S rDNA鉴定该内生细菌属于枯草芽孢杆菌,16S rDNA相似性为99%。16S rDNA分子约为1 500 bp,只能提供部分基因组信息,所以要确定菌株的分类地位,还应结合胞壁分析、生理生化特征、G+C含量等最终确定[17]。
为了使拮抗菌的拮抗病菌效果更佳,更好地应用于生产,笔者将进一步探究拮抗菌与病菌的联合条件(最适温度、最适pH、最适拮抗菌浓度等)。
参考文献
[1] 宋光桃.油茶主要病害检测和生物技术控制研究[D].长沙:中南林业科技大学,2012.
[2] 刘君昂,潘华平,伍南,等.油茶主要虫害空间格局规律的研究[J].中国森林病虫,2010,29(5):7-10.
[3] 靳爱仙,周国英,李河.油茶炭疽病的研究现状、问题与方向[J].中国森林病虫,2009,28(2):27-31.
[4] KLUEPFEL D A The behavior and tracking of bacteria in the rihizosphere[J].Annu Rev Phytopathol,1993,31:441-447.
[5] 杨慧勇,李飞凤,陆琼娴,等.拮抗菌株AFR0406对小麦赤霉病菌和纹枯病菌的生物活性鉴定[J].江苏农业科学,2006(6):142-144.
[6] 陈敏,方序.黄瓜青枯病内生拮抗菌株的分离及ARDRA分析[J].微生物学报,2006,46(6):984-987.
[7] 何红,蔡学清,洪永聪,等.辣椒内生细菌的分离及拮抗菌的筛选[J].中国生物防治,2002,18(4):171-175.
[8] 罗琼.作物内生固氮菌分离及其生物学特性研究[D].长沙:湖南农业大学,2011.
[9] BARRAQUIO W L,REVILLA L,LADHA J K.Isolation of endophytic bacteria from wetland rice[J].Plant and soil,1997,194:15-24.
[10] 崔娜.枣内生细菌种群多样性和内生拮抗细菌筛选研究[D].保定:河北农业大学,2014.
[11] LAHLALI R,HIJRI M.Screening,identification and evaluation of potential biocontrol fungal endophytes againstRhizoctonsolaniAG3 on potato plants[J].Research letter,2010,311:152-159.
[12] 游成真,李平兰,张志刚,等.黄瓜立枯病高效拮抗菌的筛选与鉴定[J].中国农业大学学报,2015,20(1):90-95.
[13] 窦桂铭,刘晓瑜,张银东,等.大豆菌核病拮抗内生细菌的筛选与鉴定[J].广东农业科学,2013(7):78-82.
[14] 朱凤,陈夕军,童蕴慧,等.水稻内生细菌的分离及其拮抗性与潜在致病性测定[J].中国生物防治,2007,23(1):68-72.
[15] 杨明琰,田稼,马瑜,等.杜仲内生真菌的分离鉴定及抗菌活性研究[J].西北植物学报,2012,32(1):193-198.
[16] 姜怡,杨颖,陈华红,等.植物内生菌及其在农业和医学上的用途[J].贵州农业科学,2006,34(3):113-115.
[17] 罗娜,肖海兰,鲁颂,等.辣椒内生固氮菌的分离鉴定与多样性分析[J].作物杂志,2014(6):52-56.
Screening and Identification of Oil-tea Endophytic Antagonistic Bacteria
JIANG Wei, LIU Xiao-chen, QIU Rong-qun, LUO Qiong*et al
(Department of Biotechnology, Changsha Medical University, Changsha, Hunan 410219)
Abstract[Objective] Through screening out oil-tea endophytic antagonistic bacteria in Changsha, the aim was to provide a theoretical basis for biological control of root rot, leaf blight, anthracnose and soft rot disease. [Method] Using grinding method, endophytic bacteria was isolated from healthy root, stem and leaf of oil-tea. Through plate confrontation test, endophytic bacteria with antagonistic activity against oil-tea root rot, leaf blight, anthrax disease and soft rot disease was screened out, morphological observation and 16S rDNA sequence analysis was conducted. [Result] The quantity of endophytic bacteria in different tissues of oil-tea was root>stem>leaf. Strain J-3-1 had antagonistic activities against root rot, leaf blight, anthrax disease and soft rot disease, the inhibitory zone radius was 12.5, 16.8, 13.5 and 13.4 mm, 16S rDNA similarity was 99%. [Conclusion] By morphological observation and 16S rDNA sequence analysis, it is identified as Bacillus subtilis.
Key wordsOil-tea; Endophytic antagonistic bacteria; Isolation and identification
作者简介姜微(1994- ),女,湖南湘潭人,本科生,专业:生物技术。*通讯作者,讲师,硕士,从事内生固氮菌方面的研究。
收稿日期2016-03-07
中图分类号S 188
文献标识码A
文章编号0517-6611(2016)08-125-03

