毛尖茶叶中脂氧合酶活性测定方法的建立
吴桂玲+吴艳玲+刘品祯

摘要:采用紫外分光光度法,以亚油酸钠为反应底物,研究毛尖茶叶中的脂氧合酶(LOX)的酶活性测定方法。结果表明,毛尖茶叶中的脂氧合酶的最适pH值为6.3,最适温度为50 ℃,在底物300 μL时酶活性最好,且有较好的热稳定性,60 ℃保温1 h后仍具有一定活性。
关键词:毛尖茶叶;脂氧合酶(LOX);活性
中图分类号: S571.101
文献标志码: A
文章编号:1002-1302(2016)04-0331-03
都匀毛尖别称“白毛尖”“细毛尖”“鱼钩茶”“雀舌茶”,是中国十大名茶之一,产于贵州省都匀市,都均市属贵州省黔南州布依族苗族自治区。都匀毛尖主要产于牛场、白芒、团山一带,这里山谷起伏,峡谷溪流,冬无严寒,夏无酷暑,四季怡人,年均气温16 ℃,年均降水量1 400 mm。加上土层深厚,泥土疏松湿润,土质是酸性或微酸性,内含大量铁质和磷酸盐,这些特殊的自然条件不仅适宜茶树的生长,而且也形成了都匀毛尖的独特风格,都匀毛尖因独特的芳香气味而备受青睐[1]。目前分离得到的与茶叶芳香气味有关的物质主要是一些小分子的醇、醛、脂类物质,在茶叶中这些小分子物质主要是由脂氧合酶、脂氢过氧化物裂解酶联合催化产生,其中脂氧合酶是关键酶[2]。脂氧合酶(lipoxygenase,LOX,EC1.13.11.12)别称脂肪氧化酶、脂氧酶、脂肪加氧酶、脂肪氧合酶(LOX),是一种含非血红素铁的加氧酶,专一催化具有顺、顺-1,4-戊二烯结构的多元不饱和脂肪酸及其相应的脂,通过对其分子加氧,形成具有共轭双键的脂氢过氧化物(hydroperoxides,HPOD)[3]。在茶叶中HPOD进一步被脂氢过氧化物裂解酶(hydroperoxidelyase,HPL)催化,从而生成各种挥发性的脂类物质,即茶叶芳香味的来源。因此,研究茶叶中脂氧合酶的活性,以及建立一个简便、准确、重现性好的LOX活性测定体系可为茶叶芳香气味形成生理的基础研究提供依据。
1 材料与方法
1.1 材料与试剂
试验材料茶树鲜叶采自贵州省都匀市白芒;亚油酸(Sigma 公司生产,纯度为99. 9%);吐温20;麦氏缓冲溶液(pH值为6.3,0.1 mol/L 柠檬酸-磷酸氢二钠缓冲液)。其他化学试剂均为分析纯,试验用水为实验室自制去离子水。
1.2 仪器与设备
TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;PHS-2C精密pH计,上海理达仪器厂;HH-S型数显恒温水浴锅,巩义市予华仪器有限责任公司;GTR21-1 高速冷冻离心机,上海赵迪生物科技有限公司;电子天平,北京赛多利斯仪器系统有限公司。
1.3 反应底物的制备
参照Axelord等的方法[4],略作修改后具体操作如下:将0.25 mL 吐温20分散于10 mL、pH值为9.0的0.2 mol/L硼酸盐缓冲液中,摇动下逐滴加入0.27 mL亚油酸,充分混合,再加入1 mol/L氢氧化钠溶液使体系澄清,并调pH值至90,然后用上述缓冲液稀释到500 mL作为底物。
1.4 粗酶液(LOX)的提取
将鲜茶叶洗净晾干,粉碎,称取10 g加入200 mL pH值为6.3的麦氏缓冲溶液,匀浆2 min,过滤,滤液在4 ℃时高速离心5 min,取上清液,加入固体硫酸铵至30%饱和度,放入冰箱4 h后取出,高速离心5 min后取上清液,加入固体硫酸铵至70%饱和度,在冰箱中过夜,取出高速离心10 min,取沉淀加入15 mL麦氏缓冲溶液溶解,得到粗酶液。
1.5 脂氧合酶(LOX)活性的测定
参照Axelrod等的方法[4],略作修改后具体操作如下,取亚油酸钠母液50 μL,缓冲液2 750 μL,粗酶液0.2 mL,配成3 mL 反应体系。在室温25 ℃下反应,测定234 nm处的吸光度(D)。反应1 min时记录1个数据,反应5 min时再记录1个数据,观察2个时间D值的变化。重复3次。酶活性以ΔD234 nm/(g·min)来表示。酶活计算公式:
1.6 毛尖茶叶中LOX酶最适pH值的测定
在不同的pH值条件(pH值=6.0~7.0磷酸氢二钠-柠檬酸缓冲液,pH值=7.5~8.0磷酸盐缓冲液,pH值=8.0~9.0甘氨酸-氢氧化钠缓冲液,缓冲液的浓度均为0.1 mol/L)下,在3 mL反应体系中依次加入麦氏缓冲液2 750 μL、亚油酸钠母液50 μL、粗酶液0.2 mL,加入后立即准确计时,反应1 min时测1个吸光度值,待反应5 min后再测1个吸光度值,酶活性同样以ΔD234 nm/(g·min)来表示。重复3次,以LOX活性最大时的酶反应的pH值作为毛尖茶叶LOX的最适pH值。
1.7 毛尖茶叶中LOX酶最适温度的测定
将1支空试管置于不同温度(10、20、30、40、50、60、70、80 ℃)的恒温水浴中,于试管中依次加入麦氏缓冲液(pH值=6.3,0.1 mol/L)2 750 μL、亚油酸钠母液50 μL、粗酶液0.2 mL。加入后立即准确计时,反应1 min时测1个吸光度值,待反应5 min后再测1个吸光度值,酶活性以ΔD234 nm/(g·min)来表示。重复3次,以LOX活性最大时的酶反应温度作为毛尖茶叶LOX的最适温度。
1.8 毛尖茶叶LOX酶反应最适底物浓度的测定
在50 ℃、pH值为6.3时,在不同底物浓度下反应,测定LOX酶活性。测定体系基本同“1.5”节,在3 mL反应体系中分别加入底物亚油酸钠母液25、50、100、150、200、250、300、350、400 μL,通过调节所加缓冲溶液的体积来保证最终3 mL体系不变。
1.9 毛尖茶叶LOX酶的热稳定性研究
在pH值为6.3时,在不同温度(30~80 ℃)下处理LOX粗酶液3 min,测定其吸光度值,然后再用相应的温度处理1 h后,立即置于冰上,降至室温(15 ℃)下测定酶保持的活力,测定体系同“1.5”节。
2 结果与分析
2.1 毛尖茶叶LOX酶的最适pH值
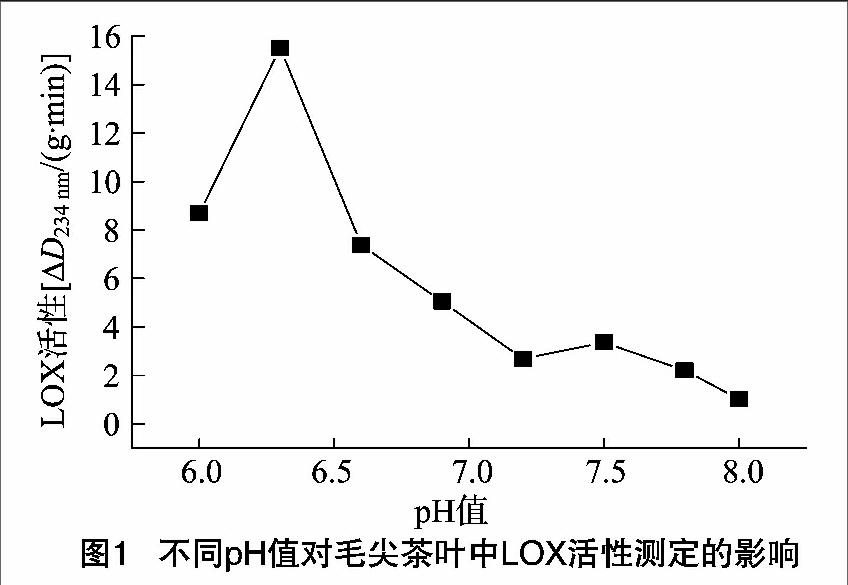
由图1可见,毛尖茶叶LOX活性有2个活性峰,其中pH值=6.3时活性最高;另外在碱性范围(pH值=7.5附近)也有1个小峰,但很不明显,其LOX活性远低于pH值=6.3时的活性峰。类似茶叶脂氧合酶的这种情况在其他物种中也有。如侧耳(Pleurotus ostreatus)中的LOX在pH值=8.0处有最大活性,在pH值=4.5处也有1个较小的峰[5];念珠地丝菌(Geotrichum candidum)中的LOX在pH值=3.75和pH值=8.0处显示了最大活性[6];桃果实中的LOX在pH值=4.5和pH值=6.0处有最大活性[7];尼罗罗非鱼(Tilapia nilotica)中鳃组织的LOX在pH值=10.0和4.0处也有最大活性[8]。对于植物中LOX活性最适pH值的研究也有报道,如甜玉米的最适pH值为6.0[9];猕猴桃为5.0~5.5[7];花生种子为5.8和8.0[10];水稻为7.6[11];荔枝果实为6.5[12];番茄为6.0左右,黄瓜为7.0左右,甜瓜为 7.0,青苹果为65[13-14]。对于茶叶中LOX的最适pH值也有报道,如陈宗道等研究发现茶树中LOX的最适pH值为6.2[15],而本研究的毛尖茶叶的最适pH值为6.3,与其相差不大。因此毛尖茶叶中LOX活性的最适pH值为6.3,在碱性范围(pH值=75)附近也有1个较小的活性峰。
2.2 毛尖茶叶LOX酶的最适温度
由图2可见,在10~20 ℃时LOX活性呈缓慢上升趋势,20~30 ℃时缓慢下降,在30~50 ℃时急剧上升,至50 ℃时达到最大值,50 ℃后开始急剧下降。有关其他物种LOX活性最适温度的报道有大豆LOX最适温度18 ℃[16];花生种子脂氧合酶的最适反应温度为35 ℃[10];黄瓜果实脂氧合酶的最适温度为40 ℃[13];对于植物来源的香蕉叶片LOX最适温度为40 ℃[17];水产动物罗非鱼鳃组织中脂氧合酶的最适温度为30 ℃[8];而陈宗道等的研究结果表明茶树中LOX的最适温度为40 ℃[15]。而本研究的毛尖茶叶LOX最适温度为50 ℃。
2.3 毛尖茶叶LOX酶反应最适底物浓度的测定
由图3可见,在3 mL反应体系中加入300 μL底物亚油酸钠母液时测得的酶活性最大。在低浓度范围内,酶反应速度随底物体积增加而增加,当底物体积增加到一定值后,酶活性却下降,这可能是由于底物亚油酸与LOX反应过程中,也有一部分在空气中自动氧化为羟基过氧化物,而当生成的羟基过氧化物达到一定浓度时,就会引起LOX自我失活[6]。
2.4 毛尖茶叶LOX酶的热稳定性
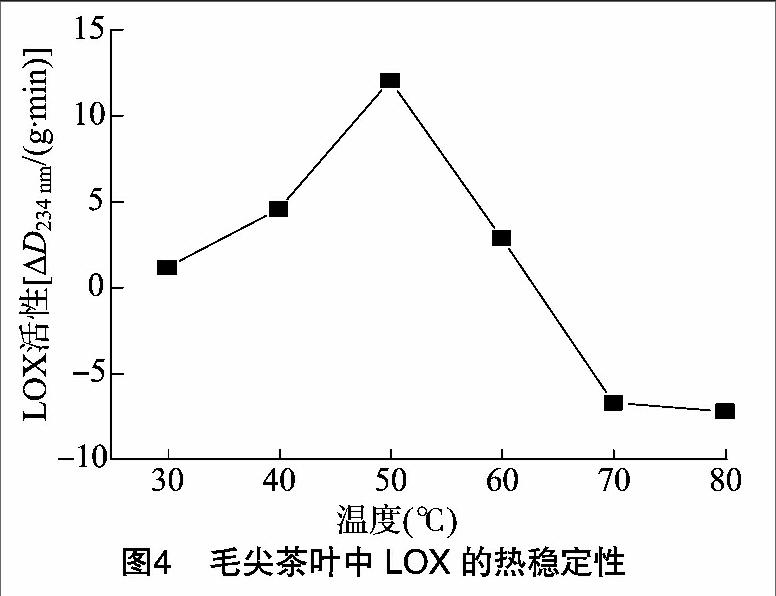
由图4可见,本试验采用紫外分光光度法测定LOX酶活性的原理实质是测定LOX反应产物脂氢过氧化物HPOD的增加速率,因为HPOD在234 nm处有光吸收。毛尖茶叶LOX对热相对稳定,在50 ℃时活性最高,即使60 ℃处理1 h,酶仍表现出一定的活性。用70 ℃处理1 h后,酶已经失活,因此活性迅速下降。
3 结论
本研究通过对毛尖茶叶中脂氧合酶(LOX)活性影响因素即最适温度、最适pH值的研究,从而确立了一个适合毛尖茶叶LOX活性测定的体系,即毛尖茶叶经粉碎机粉碎后,取10 g毛尖茶叶加200 mL的麦氏缓冲溶液溶解并过滤,将上清液用高速冷冻离心机离心(12 000 r/min,5 min),上清液加(NH4)2SO4 30%饱和度,冰箱中4 h后继续离心(12 000 r/min,5 min),于上清液中加(NH4)2SO4 70%饱和度,冰箱中过夜,再继续离心(15 000 r/min,10 min)后弃去上清液并加15 mL的麦氏缓冲液溶解沉淀,摇匀后用于LOX活性测定。在3 mL的反应体系中加入pH值为6.3的麦氏缓冲液2 500 μL、亚油酸钠母液300 μL、粗酶液0.2 mL。在 50 ℃ 反应1 min时记录1个数据,到5 min时再记录1个数据,于234 nm处测定LOX的活性,记录D234 nm值的变化,酶活性以ΔD234 nm/(g·min)来表示。茶叶中脂氧合酶有着较好的热稳定性,60 ℃保温1 h后仍具有一定的活性,50 ℃保温1 h可能对该酶的活性有激活作用。通过对茶叶中脂氧合酶活性测定体系的确定,为进一步探讨都匀毛尖茶独特香味的形成机理、改良毛尖茶叶的品质提供理论基础。
参考文献:
[1]王海滨,包先进. 茶树脂肪氧化酶对亚油酸的降解作用[J]. 贵州茶叶,1990(4):22-23.
[2]汪 仁,沈文飚,翟虎渠,等. 植物种子脂氧合酶[J]. 植物生理学通讯,2005,41(3):388-394.
[3]李彩凤,赵丽影,陈业婷,等. 高等植物脂氧合酶研究进展[J]. 东北农业大学学报,2010,41(10):143-149.
[4]Axelrod B,Cheesbrough T M,Leakso S.Lipoxygenase from soybeans[J]. Methods in Enzymology,1981(7):443-451.
[5]Takashi K,Hitomi K,Chiharu U,et al.Purification and characterization of lipoxygenase from Pleurotus ostreatus[J]. Journal of Agricultural & Food Chemistry,2002,50(5):1247-1253.
[6]Perraud X,Kermasha S,Bisakowski B.Characterization of a lipoxygenase extract from Geotrichum candidum[J]. Process Biochemistry,1999,34(8):819-827.
[7]陈昆松,徐昌杰,许文平,等. 猕猴桃和桃果实脂氧合酶活性测定方法的建立[J]. 果科学报,2003,20(6):436-438.
[8]何 熊,薛长湖,杨文鸽,等. 罗非鱼鳃组织中脂氧合酶的性质研究[J]. 水产科学,2005,24(7):15-19.
[9]生吉萍,刘开朗,申 琳. 蔬菜中脂氧合酶活性的快速测定[J]. 食品科学,2003,24(12):146-149.
[10]侯美玲,苗华荣,陈 静,等. 花生种子脂肪氧化酶的活性测定研究[J]. 安徽农业科学,2008,36(32):14033-14035.
[11]姚锋先,曾晓春,蒋海燕,等. 水稻中以亚麻酸为底物的脂氧合酶活性测定[J]. 江西农业大学学报,2006,28(2):183-186.
[12]胡位荣,刘顺枝,张昭其,等. 荔枝果实采后脂氧合酶活性的变化[J]. 华中农业大学学报,2005,24(3):285-289.
[13]李 强,吴晓露,李红伟,等. 黄瓜果实脂氧合酶活性测定方法的建立[J]. 东北农业大学学报,2008,39(5):62-65.
[14]冯尚坤,徐海菊. 不同pH值反应体系对果蔬中脂氧合酶活性测定的影响[J]. 食品研究与开发,2008,29(3):60-62.
[15]陈宗道,宋 伟. 茶叶片遭损伤时的脂性过氧化作用[J]. 贵州茶叶,1989(4):35-37.
[16]蔡 琨,方 云,夏咏梅,等. 大豆脂氧合酶的提取及影响酶活因素的研究[J]. 林产化学与化工,2004,24(2):52-56.
[17]Jen-Min K,Ann H,Dong-Bor Y,et al.Lioxygenase from banana leaf:purification and characterization of an enzyme that catalyzes linoleic acid oxygenation at the 9-position[J]. Journal of Agricultural & Food Chemistry,2006,54(8):3151-3156.缪凌鸿,戈贤平,高启平,等. 不同体型鳙鱼幼鱼营养成分与品质的比较[J]. 江苏农业科学,2016,44(4):334-338.

