重金属胁迫对人参生长发育及生理生化特性的影响
王志栓+薛晓丽+费洋
摘要:通过盆栽方式研究铅(Pb)、镉(Cd)、铜(Cu)、镍(Ni)、锌(Zn)单一元素胁迫对人参地上部分生长发育及生理生化指标的影响。结果表明:各元素胁迫对人参的株高、叶面积均有抑制作用;对人参叶的各项生理生化指标产生不同程度的影响。在Pb、Cu、Ni、Zn胁迫下,人参叶的各项生理指标变化趋势基本一致,即游离脯氨酸、丙二醛(MDA)含量整体上提高,叶绿素含量下降,SOD活性减弱,POD活性波动性地增强,可溶性糖、可溶性蛋白含量下降。其中Ni 4水平(400 mg/kg)处理下人参幼苗死亡;Cd处理下多项指标出现异常,具体机理有待进一步研究。综合各项指标发现,各重金属对人参地上部分胁迫程度从大到小为Pb>Zn>Cu>Cd。
关键词:重金属;胁迫;人参地上部分;生长;生理生化特性
中图分类号: S567.5+10.1
文献标志码: A
文章编号:1002-1302(2016)04-0253-04
随着我国工业城市化的不断发展,工业和生活用水排放,汽车废气排放,污水灌溉,含重金属的化肥、有机肥、农药等的不合理施用所造成的土壤重金属污染问题也日益严重[1-2]。重金属不仅对土壤的生态结构、功能稳定性有明显的不良影响,而且对植物的膜透性、光合作用、呼吸作用等代谢作用也有着严重的影响[3]。由于重金属的强富集性,导致其可通过食物链进入动物和人体,从而严重危害生物健康[4-5],因此,研究重金属对植物的危害成为热点问题。人参(Panax ginseng)是多年生宿根植物,其根是名贵药材,具有大补元气、复脉固脱、补脾益肺、生津养血、安神益智功效,其主要有效成分是人参皂苷[6],历来被称为百草之王,在我国主要分布于吉林省东部的长白山地区。近年来人参价格一路攀升[7],一方面是因为人参强大的药用价值;另一方面是因为人参已经成为一种新食品资源[8],市场面的扩大,使得人参种植面积快速增加,尤其是新发展而来的农田栽培,使得人参中重金属残留问题引起广泛重视,人参重金属残留量方面的质量标准也在制定中,而重金属胁迫对人参地上部分的生长及生理生化指标的影响却鲜见报道。人参是自养植物,其地上部分的生长状况直接影响其有效成分人参总皂苷含量。本试验旨在通过讨论单一重金属胁迫对人参生长及生理生化指标的影响,为进一步研究重金属胁迫对人参有效成分人参总皂苷的影响做好基础工作。
1 材料与方法
1.1 试验材料
供试植物为购自吉林省抚松县人参种植基地的二年生带芽苞的人参,每株质量(10.0±2.3) g。供试土壤采自吉林农业科技学院左家校区人参种植基地的黑黄混合土,其pH值为6.1,有机质含量26.05 mg/kg,重金属背景含量为铅(Pb)17.3 mg/kg,镍(Ni)23.6 mg/kg,铜(Cu)14.8 mg/kg,镉(Cd)0.13 mg/kg,锌(Zn)3.1 mg/kg。添加的各重金属形式:Pb(NO3)2、Ni(NO3)2·6H2O、Cu(NO3)2·3H2O、CdSO4、(CH3COO)2Zn·H2O,均为分析纯试剂。
1.2 器具与仪器
陶瓷花盆(高20 cm,直径30 cm);紫外光谱仪(岛津 UV-1700);原子吸收光谱仪(岛津 AA-6300);叶面积仪(AM-300)。
1.3 盆栽试验
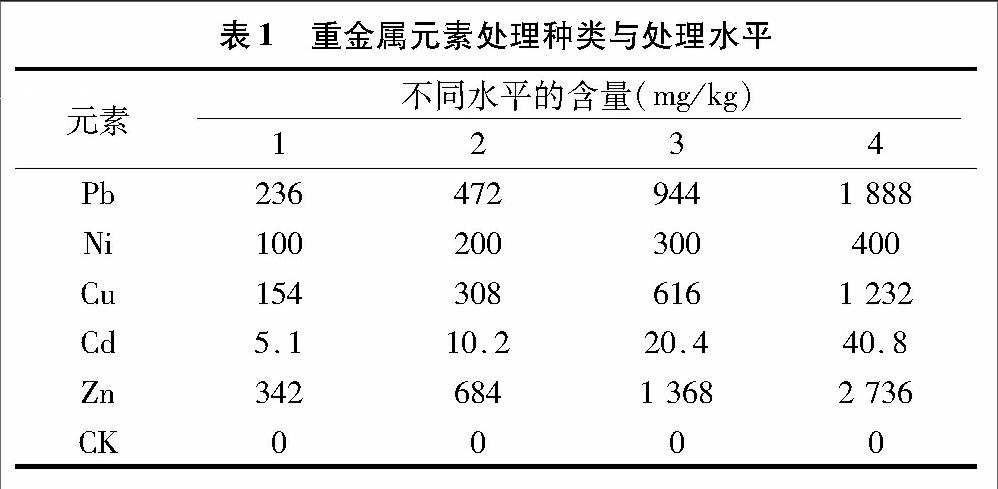
土壤经自然风干、捣碎、剔除杂物后过2 mm筛,同时测定其重金属背景值及基本理化性质。每盆中加入10 kg土壤,按照预先试验设计(表1)添加各重金属并作均匀处理。于4月19日将带有芽孢的人参栽种入处理好的盆中,每盆3株作为3个重复。将处理好的盆埋于参床内,盆内的土与参床土相平,并搭建复式棚[9]。试验期间适当浇水,使土壤保持湿润且不积水。于当年5月13日、5月23日、6月3日对人参株高、叶面积进行测量并记录数据;于当年7月15日采集人参叶片并对其理化指标进行测定。
1.4 生理生化指标测定方法
人参叶中游离脯氨酸含量的测定采用磺基水杨酸法[10];丙二醛(MDA)含量的测定采用TBA-MDA显色法[11-13];总叶绿素含量的测定采用80%丙酮浸提24 h法,然后在663、645 nm下测定吸光度D663 nm、D645 nm,用Arnon公式计算总叶绿素浓度[14];可溶性糖含量的测定采用蒽酮法[15];SOD活性的测定采用SOD抑制NBT光化还原法[16],以抑制NBT光化还原的50%为1个酶活性单位(U);POD活性的测定采用比色法[17-19],在UV-1700动力学模式下,于470 nm下测定吸光度D470 nm,设定每隔0.5 s测定读数1次,连续读数2 min;可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[15]。
2 结果与分析
2.1 重金属胁迫对人参地上部分生长发育的影响
Pb、Cd、Cu、Ni、Zn胁迫对人参地上部分生长影响的各项指标见表2。每项指标作3个平行,用SPSS 19.0进行数据处理与分析。其中在镍3水平处理下的人参发芽出现了滞后,在镍4水平处理下的人参全部死亡。
2.1.1 单一重金属胁迫对人参株高的影响 由表2可知,除镉4水平处理下的人参出现反常外,单一重金属胁迫下人参的株高都明显低于对照,且每个单一元素在不同处理水平下,随着重金属浓度的增高,人参的株高呈现下降趋势,其中铜1、铜2、铜3水平处理下对人参的株高影响不明显。通过3个不同时间测定人参株高的总体比较可见,随着时间的推移,重金属胁迫对人参株高的影响差异明显。对人参的株高而言,各元素影响程度由大到小为Ni>Zn>Cu>Pb>Cd。
2.1.2 单一重金属胁迫对人参单叶面积的影响 由表2可以看出,单一重金属胁迫下人参单叶面积明显低于对照。3个不同时间测得的人参单叶面积中,5月23日除铜外的各元素在1、2水平下差异不显著,2、3、4水平下差异明显;而随着人参的生长,到6月3日在各元素第1、2水平处理下的人参单叶面积呈现出明显差异。
2.2 重金属胁迫对人参叶生理生化指标的影响
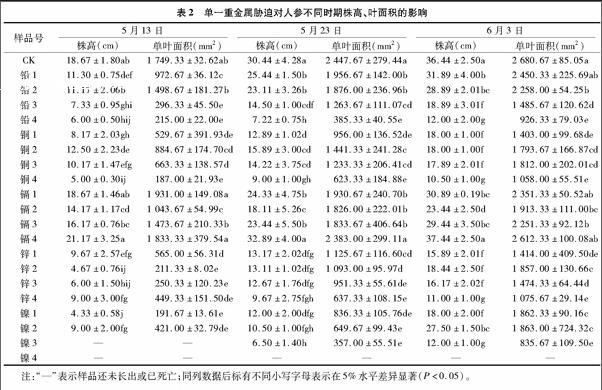
2.2.1 重金属胁迫对人参叶游离脯氨酸含量的影响 由图1可知,在Pb、Ni、Cu、Zn高浓度处理水平下,脯氨酸含量均呈现上升趋势,而Cd各处理水平下脯氨酸含量均无明显变化。由此看出,低浓度重金属处理下脯氨酸含量变化不明显,而高浓度的重金属严重影响了植物根系细胞的渗透压,阻碍了植物对水分的吸收,从而导致植物严重缺水。
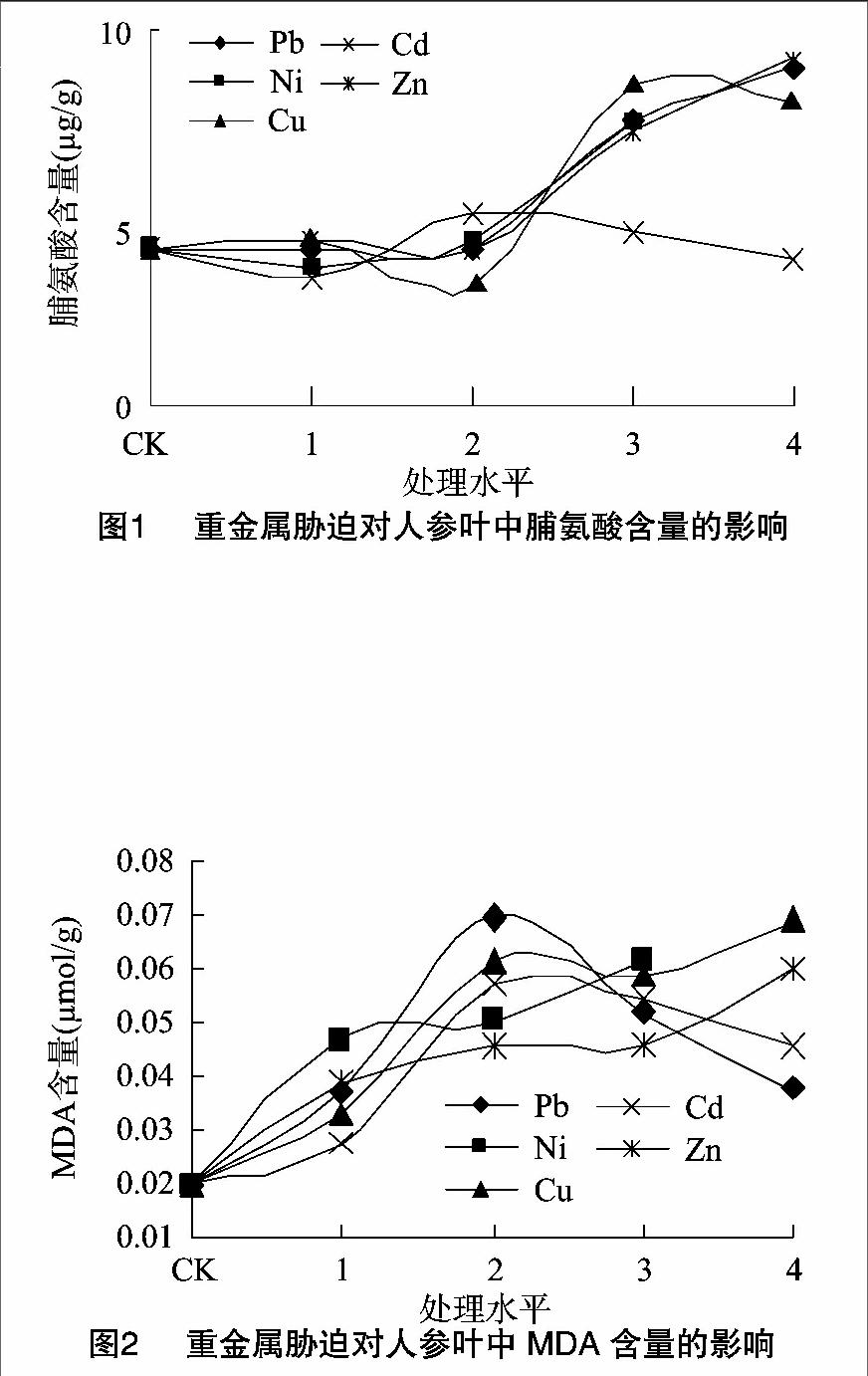
2.2.2 重金属胁迫对人参叶MDA含量的影响 MDA是植物体内酯膜过氧化物的产物,其含量反映了植物内酯膜过氧化程度,MDA可作为植物受害强弱的标准之一。在Pb、Cd胁迫下,MDA含量先增后降;而在Ni、Cu、Zn胁迫下,MDA含量递增(图2)。
2.2.3 重金属胁迫对人参总叶绿素含量的影响 由图3可见,除Cd外,不同重金属胁迫对人参叶中总叶绿素含量均有明显的抑制作用,且随着浓度的升高,对人参叶片中叶绿素含量的抑制作用越来越强。因此,随着处理浓度增加,重金属胁迫下人参叶片中叶绿素含量逐渐下降。但在Cd胁迫下,叶绿素含量的变化与此结论并不相符,4水平处理下,叶绿素含量反而高于空白对照。
2.2.4 重金属胁迫对人参叶SOD活性的影响 从图4看出,Pb、Ni、Zn在较低浓度水平下,SOD活性缓慢增强;当浓度高于2处理水平后,SOD活性急剧减弱;当浓度高于3处理水平后,SOD活性呈现稳定或缓慢减弱的趋势;Cd在1处理水平时,酶活性达到最高值,随后减弱,3处理水平后趋于平稳;Cu在3处理水平前对酶的活性影响较小,3处理水平后呈现急剧减弱的趋势。
2.2.5 重金属胁迫对人参叶POD活性的影响 由图5可以看出,随着重金属浓度水平的升高,人参叶片中POD活性呈不同程度的增强,且各元素呈现不同的变化特征。在Cu、Cd等2种单一元素胁迫下,POD活性均呈现先升后降(仍高于对照)然后再升(高于处理2)再降的波动性特征。在Ni、Zn 2种单一元素胁迫下,POD活性则呈现波动性上升的特征。而在Pb元素胁迫下,POD活性则在3处理水平前均呈现上升趋势,3水平后呈下降趋势。
2.2.6 重金属胁迫对人参叶可溶性糖含量的影响 由图6可知,除镉3、4处理外,在各元素胁迫下,随着处理浓度的升高,人参叶片中可溶性糖含量均呈现出不同的下降趋势。这表明随着重金属浓度的升高,可溶性糖的合成速率小于转化、运输速率,碳水化合物的合成路径相对受阻。这一趋势与人参的株高呈现一定相关性。由此可推断,不同单一重金属对人参叶中可溶性糖的胁迫是对人参株高胁迫的内因之一。
2.2.7 重金属胁迫对人参叶可溶性蛋白含量的影响 从图7可以看出,在单一重金属胁迫下,人参叶中可溶性蛋白的含量大体呈波动下降的趋势,表明重金属胁迫对人参叶中可溶性蛋白具有低促高抑性。本研究所得关于Cd的结论并不与上述结论完全相符,在Cd 3处理下,可溶性蛋白含量达到较低值后,反而在4水平即40.8 mg/kg Cd下表现促进作用,又达到最高值。
3 结论与讨论
Pb、Ni、Cd、Cu、Zn重金属胁迫对人参地上部分及生理生化指标均有影响,且各项指标表明,人参对这5种重金属胁迫较为敏感。综合人参地上部分各生理生理生化指标,各单一重金属对人参地上部分的胁迫程度由强到弱为Pb>Zn>Cu>Cd(以各金属不同水平下的生理指标与相应空白对照差值的总和大小为判断依据,总和越大,胁迫程度越高)。其中,在Ni 4水平(400 mg/kg)处理下人参直接死亡,无后期生理指标数据,因此不作比较;在3水平(300 mg/kg)处理下人参芽苗出土时间滞后。由此表明,Ni胁迫对人参幼芽的毒害较为严重。值得思考的是,Cd胁迫下人参地上部分的多项指标出现异常,这虽然符合植物体内脯氨酸可以跟Cd2+螯合,形成无毒的螯合物[20]这一理论,但与大多数研究结果[21-23]并不相符,具体机理有待进一步研究。参考文献:
[1]宋 伟,陈百明,刘 琳. 中国耕地土壤重金属污染概况[J]. 水土保持研究,2013,20(2):293-298.
[2]杨 军,陈同斌,雷 梅,等. 北京市再生水灌溉对土壤、农作物的重金属污染风险[J]. 自然资源学报,2011,26(2):209-217.
[3]胡 文. 土壤-植物系统中重金属的生物有效性及其影响因素的研究[D]. 北京:北京林业大学,2008.
[4]李德明,郑 昕,张秀娟. 重金属对植物生长发育的影响[J]. 安徽农业科学,2009,37(1):74-75.
[5]Kaiser J. Toxicologists shed new light on old poisons[J]. Science,1998,279(5358):1850-1851.
[6]国家药典委员会.中华人民共和国药典[M]. 2010版. 北京:中国医药科技出版社,2010.
[7]丁立威.人参产销历史、现状与后市预测[J]. 特种经济动植物,2014,2(2):15-20.
[8]卫生部. 中华人民共和国卫生部2012年第17号文件公告[R]. 2012.
[9]田义新. 药用植物栽培学[M]. 3版.北京:中国农业出版社,2011.
[10]张殿忠,汪沛洪,赵会贤. 测定小麦叶片游离脯氨酸含量的方法[J]. 植物生理学通讯,1990(4):62-65.
[11]张剑云,陈水红,郝 瑞. 不同苜蓿品种中丙二醛含量与抗逆性关系的研究[J]. 黑龙江畜牧兽医,2008(8):53-54.
[12]李荣富,梁 莉,胡晓红,等. 低温对杏花丙二醛含量及过氧化物酶与超氧化物歧化酶活性的影响[J]. 内蒙古农业科技,2005(6):29-30.
[13]方海田,刘慧燕,张光弟. 不同贮藏温度下辣椒中丙二醛含量的变化[J]. 农产品加工:创新版,2010,5(5):29-31,35.
[14]曾建敏,姚 恒,李天福,等. 烤烟叶片叶绿素含量的测定及其与SPAD值的关系[J]. 分子植物育种,2009,7(1):56-62.
[15]张治安,陈展宇. 植物生理学实验技术[M]. 长春:吉林大学出版社,2008.
[16]Evansa J J,Alldridgea N A. The distribution of peroxidases in extreme dwarf and normal tomato(Lycopersicon esculentum Mill.)[J]. Phytochemistry,1965,4(3):499-503.
[17]Wittenbach V A,Bukovac M J. Cherry fruit abscission:peroxidase activity in the abscission zone in relation to separation[J]. J Amer Soc Sci,1975,100:387-389.
[18]韦素玲. 白花泡桐根分化过程中过氧化物酶、IAA氧化酶和过氧化氢酶的变化[J]. 广西科学,2001,8(2):135-137.
[19]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[20]Sharma S S,Schat H,Vooijs R. In vitro alleviation of heavy metal-induced enzyme inhibition by proline[J]. Phytochemistry,1998,49(6):1531-1535.
[21]张义贤. 重金属对大麦(Hordeum vulgare)毒性的研究[J]. 环境科学学报,1997,17(2):199-205.
[22]江海东,周 琴,李 娜,等. Cd对油菜幼苗生长发育及生理特性的影响[J]. 中国油料作物学报,2006,28(1):39-43.
[23]吴甘霖. 镉对花生幼苗生长及生理生态特性的影响[J]. 生物学杂志,2008,25(5):31-33,68.蒋天仪,卓 宇,唐 敏,等. 外源一氧化氮(NO)对铁皮石斛类原球茎生长及多糖积累的影响[J]. 江苏农业科学,2016,44(4):257-260.

