磷酸改性花生壳固定化α-淀粉酶研究
廖晓峰,于荣,梁华正,严根华(东华理工大学,江西南昌330038)
磷酸改性花生壳固定化α-淀粉酶研究
廖晓峰,于荣*,梁华正,严根华
(东华理工大学,江西南昌330038)
摘要:以磷酸改性花生壳为载体固定α-淀粉酶,研究改性后的花生壳吸附固定α-淀粉酶的最优固定化条件以及固定化酶的酶学性质。试验结果表明:用磷酸溶液对粉碎的花生壳颗粒进行浸泡处理来改性,研究出酶固定化最优条件是:酶液/载体比11∶1(mL/mg),缓冲液pH6.0,固定时间8h和温度35℃。经3次平行试验,所得实际固定化酶活力平均值为27 980 U/g。对游离酶和固定化酶部分酶学性质比较,得出改性固定化后酶的最适反应pH、温度有所改变,为pH= 6.0,温度45℃,其储存时间、操作稳定性和耐热性比游离酶更好。
关键词:改性花生壳;固定化酶;磷酸
固定化酶技术既指用固体材料将酶束缚在一定的密闭空间内,能连续地进行反应,反应后的酶可以回收重复使用的一类技术。酶的固定方法分主要分为化学和物理方法,化学方法为交联法和共价法,物理方法为吸附法和包埋法共4大类[1-4]:吸附法、包埋法、交联法和共价法。共价法是利用酶蛋白分子上的官能团和固定化载体表面上的基团反应形成共价键而使酶固定化的的方法,α-淀粉酶表面上有多种可利用的化学基团,比如羟基、巯基等,本论文α-淀粉酶的固定化就是使用这一技术。
我国是一个农业大国,也是花生生产大国,花生年产量达到1 500万t,为世界第一,占全球花生产量的2/5以上。在花生加工过程中会产生大量的花生壳废弃物,我国每年产生的花生壳废弃物高达500万t之多[5]。
共价法通常是指用化学试剂对花生壳颗粒进行活化处理,不仅可以改善花生壳的孔状结果,还可以增加花生壳上的官能团数量,增强花生壳的吸附能力。活化花生壳常用的化学试剂有:柠檬酸、饱和KOH、磷酸、硫酸等[6-10]。
1 材料与方法
1.1仪器和试剂
1.1.1仪器
试验仪器见表1。
1.1.2实验试剂
试验试剂见表2。

表1 试验常用仪器Table 1 The mainly used equipments in the experiment
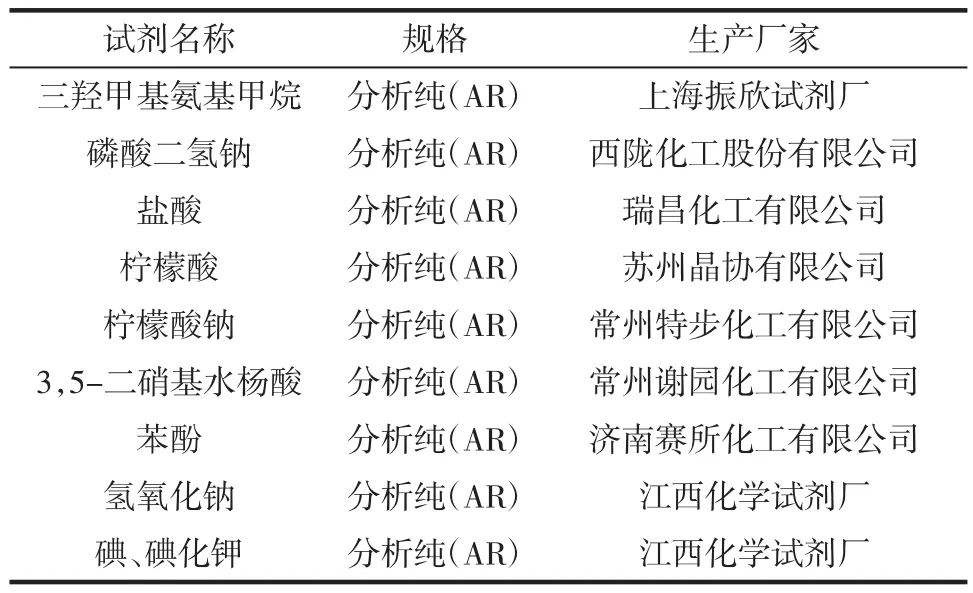
表2 试验试剂Table 2 The real test reagents
1.1.3试验原料
α-淀粉酶:上海蓝季发展有限公司;花生壳:产地南昌。
1.2原料处理
1.2.1花生壳
将花生壳剪碎,直径1 mm~2 mm大小,然后与蒸馏水充分混匀,浸泡24 h,过滤掉悬浮细小物质,在45℃下烘干备用。
1.2.2花生壳改性
称取10 g未改性已烘干的花生壳粉置于500 mL的烧杯中,加入100 mL 1 mol/L的磷酸缓冲液溶液,搅拌8 h后,抽滤去除液体部分,在45℃下烘干,用蒸馏水清洗,在45℃下烘干后备用。
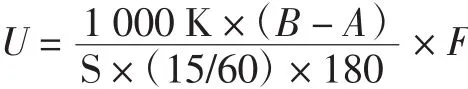
1.3测定方法
1.3.1淀粉酶活力的测定方法
α-淀粉酶的酶活力定义:在45℃,pH 5.6磷酸缓冲液的条件下,每反应15 min消耗1 mg葡萄糖的酶量为一个酶活力单位(U/g)[8]。
游离酶的酶活力测定方法:将2%的可溶性淀粉溶液100 μL作为底物放入烧杯中,加入pH 5.6的1 mol/L醋酸缓冲液100 μL和400 μL蒸流水的混合溶液,随后加入1 g的α-淀粉酶,混匀后置于45℃的水浴锅中准确反应15 min,反应后立即加入0.1 mol/L的盐酸1.0 mL终止反应。取反应液1.0 mL放入10 mL的比色管中,加入1.0 mL稀碘液后用蒸流水定容至10.0 mL,放在540 nm波长下比色。以相同量的淀粉酶和蒸馏水溶液为对照组,根据多糖标准曲线计算出反应消耗的葡萄糖的量。取3次的平均值为最终结果值[8]。
固定化酶的酶活力测定方法:试验方法同上述游离酶的酶活力测定方法,取一定量的固定化酶溶液经过适当的稀释替换以上的游离α-淀粉酶。测定是以3次结果为平均值。酶的相对酶活是指:在同一组试验中,以活性最高的一组为100%,其余的酶活力与之相比,结果以百分数表示。
1.3.2可溶性淀粉溶液中多糖含量的测定方法
1.3.2.1葡萄糖标准曲线的绘制
葡萄糖标准曲线的绘制方法:分别精确吸取2.0 mg/mL的葡萄糖标准溶液0.00、0.40、0.50、0.60、0.70、0.80、0.90、1.00 mL和蒸馏水2.00、1.60、1.40、1.30、1.20、1.10、1.00 mL,配制成浓度为0.4 mg/mL~1.0 mg/mL的葡萄糖标准系列。分别吸取0.5 mL上述葡萄糖标准液于10 mL的比色管中,加入1.0 mL DNS试剂,沸水浴5 min。待溶液冷却至室温后,用蒸馆水定容至10 mL,摇匀后放在540 nm波长下比色,以葡萄糖含量为横坐标,对应的OD值为纵坐标,算出标准线性回归方程。(Y=AX+B)
反应后的样品在室温下放置15 min,若出现浑浊现象则放在3 000 r/min的离心机离心10 min,以上清液以标准空白调零,在540 nm波长处测定样品空白A和样品溶液B的吸光值,B-A为实际吸光值。用直线回归方程计算样品α-淀粉酶的活性。
1.3.2.2淀粉酶活力U
淀粉酶活性U按下式计算:
式中:U为样品淀粉酶活性,U/mL;K为标准曲线斜率;F为样品溶液的总量,mL;S为样品测试量;式中S为1 mL;60为1 h为60 min;15为反应时间,min。
固定化酶的酶活力和改性之后的测定方法:试验方法同上述游离酶的酶活力测定方法,测定时做3次平行试验,结果取其平均值。
1.4固定化α-淀粉酶的单因素条件试验
1.4.1酶液/载体比的确定
取6个三角瓶,在缓冲液pH6.0,固定温度35℃,固定时间5 h条件下,按酶液/载体(mL/mg)分别为2∶1、5∶1、8∶1、11∶1、14∶1和17∶1的配比进行固定,分别用去蒸馏水洗涤3次,过滤抽干,检测固定化酶活力。
1.4.2固定化时间对酶固定化活性的影响
取6个三角瓶,分别加入9 mL酶液和1 g改性花生壳,于35℃、120 r/min恒温振荡摇床中,分别固定4、6、8、10、12、14 h,固定完成后,抽干过滤,用蒸馏水洗涤滤纸上的固定化酶3次,晾干,测定固定化酶活力。
1.4.3固定化温度的选择
取6个三角瓶,分别加入9 mL酶液和1 g改性花生壳,分别置于25、30、35、40、45、50℃,120 r/min恒温振荡摇床内固定6 h,固定完成后抽干过滤,根据葡萄糖标准曲线测出酶的活力。
1.4.4缓冲液pH对酶固定化的影响
用不同pH的磷酸缓冲液将α-淀粉酶液分别配成pH为4.0、5.0、6.0、7.0、8.0和9.0的酶液。取6个三角瓶,分别加入9 mL酶液和1 g改性花生壳,于35℃、120 r/min恒温振荡摇床中固定6 h,固定完成后的处理步骤同上,根据葡萄糖标准曲线测出酶的活力。1.5改性花生壳固定化a淀粉酶的酶学性质[9-10]
1.5.1游离酶与固定化酶酶最适pH比较
在酶的固定化温度为35℃、固定化时间为6 h、及固定化酶用磷酸盐缓冲液的pH为6.0的情况下,测定的固定化葡萄糖氧化酶的活性为100。
游离酶最适反应pH的测定方法:取1 g游离酶和固定化酶,按照酶活力测定的方法在体系中分别加入pH为5.0、5.5、6.0、6.5、7.0、7.5、8.0的1 mol/L的缓冲液100 μL,将配制好的体系置于35℃的水浴锅中准确反应15min,而后分别计算出其相对酶活力。每组试验设置3次平行试验。
1.5.2游离酶与固定化酶的最适温度比较
分别将游离酶与固定化酵在25、35、45、55、65、75℃的水浴锅中进行反应,分别测定游离酶与固定化酶的相对酶活力。每组试验设置3次平行试验。绘制出游离酶和固定化酶在不同温度条件下的相对酶活力曲线。比较游离酶与固定化酶的最适反应温度是否发生改变。
1.5.3固定化酶的贮藏稳定性
将游离酶和固定化好的酶储存在4℃冰箱4、8、12、16、20、24、28 d,分别测定各自的酶活力以及计算出酶相对活力。比较两者的储存稳定性。
1.5.4固定化酶的操作稳定性
将游离α-淀粉酶和固定化α-淀粉酶在pH=6的缓冲液,温度35℃与2%淀粉溶液反应15 min,反应后过滤抽干,继续使用反应。总共反应6次,分别测出酶活力和相对酶活力。
2 结果与分析
2.1葡萄糖标准曲线的绘制
葡萄糖的标准曲线绘制见表3。葡萄糖的标准曲线见图1。
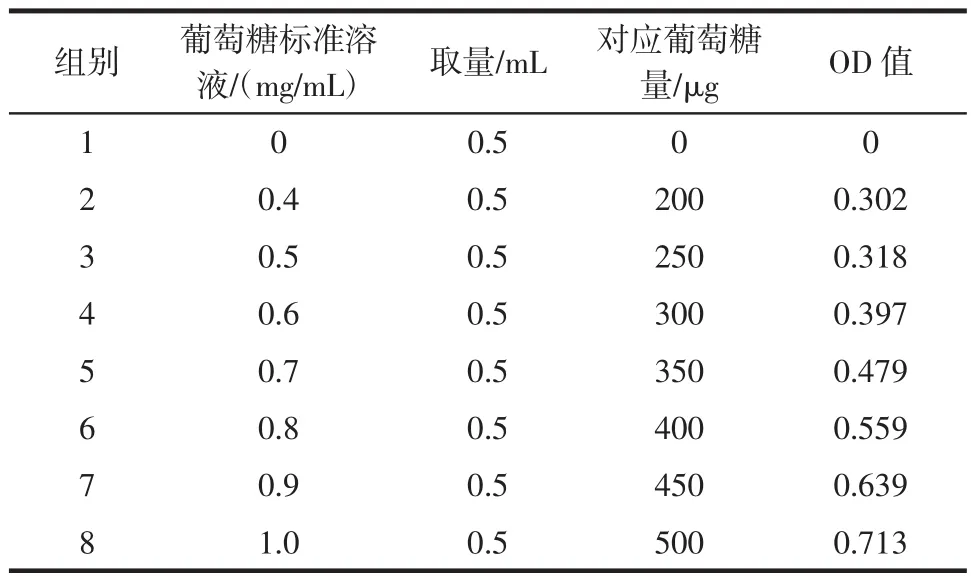
表3 葡萄糖的标准曲线绘制Table 3 Draw the standard curve of glucose
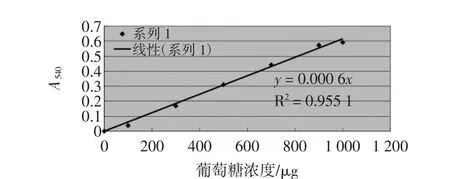
图1 葡萄糖的标准曲线Fig.1 Glucose standard curve
2.2改性花生壳固定α-淀粉酶的单因子试验
2.2.1酶液/载体比对改性花生壳固定化α-淀粉酶活力的影响
按不同的酶液/载体比对改性花生壳固定α-淀粉酶活力的影响见图2。
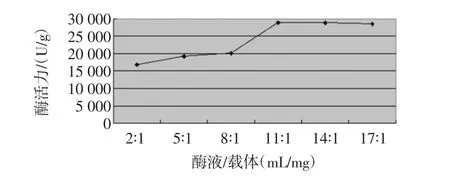
图2 不同酶液/载体比对酶活力影响Fig.2 Different enzyme/carrier ratio effect on the enzyme activity
从图2中可以看出随着酶液/载体的增大,固定化酶的相对活力呈先增大后减小的趋势,但之后下降的趋势变小,总体上保持不变,当酶液/载体为11∶1(mL/mg)时,固定化酶活力最高。这是因为固定化载体可吸附的酶量是有限的,当固定化载体相对较少时,可能由于每个载体分子表面吸附的蛋白量相对过多,造成酶分子相互聚集成团,酶分子的活性中心有可能被遮盖,因此,酶液/载体的较适值为11∶1(mL/mg)。
2.2.2缓冲液pH对改性花生壳固定化α-淀粉酶活力影响
在不同的pH环境中改性花生壳固定α-淀粉酶的结果见图3。
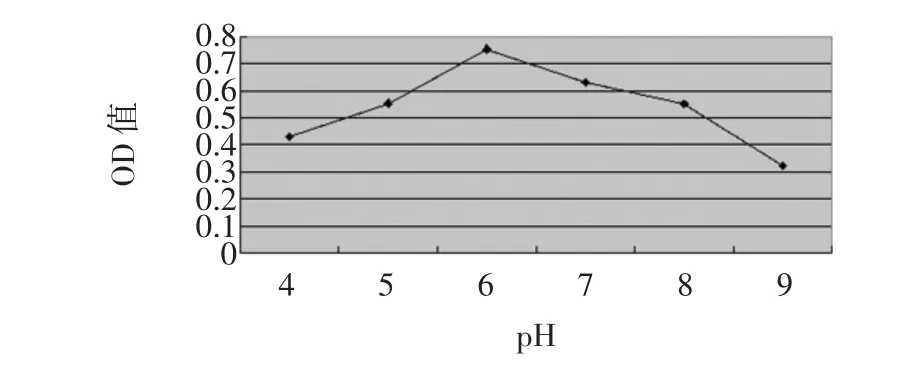
图3 缓冲液pH对酶活力的影响Fig.3 pH corresponds to the impact of enzyme activity
从图3中可以看出,缓冲液pH不同,固定化酶活力也不同。当缓冲液pH为6.0时,固定化酶活力相对较高;改性花生壳在酸性环境中固定α-淀粉酶好于在碱性环境中固定α-淀粉酶。原因是酸性缓冲液可以改变酶分子和固定化载体的离子化状态,另外酶作为一种蛋白质,当溶液pH超出一定范围时,微观结构会发生变化,从而引起酶变性失活。因此缓冲液pH是影响固定化α-淀粉酶催化活力的重要因素,最适值在6.0。
2.2.3固定化时间对改性α淀粉酶活性的影响
固定时间对改性花生壳固定化α-淀粉酶活力的影响,结果见图4。
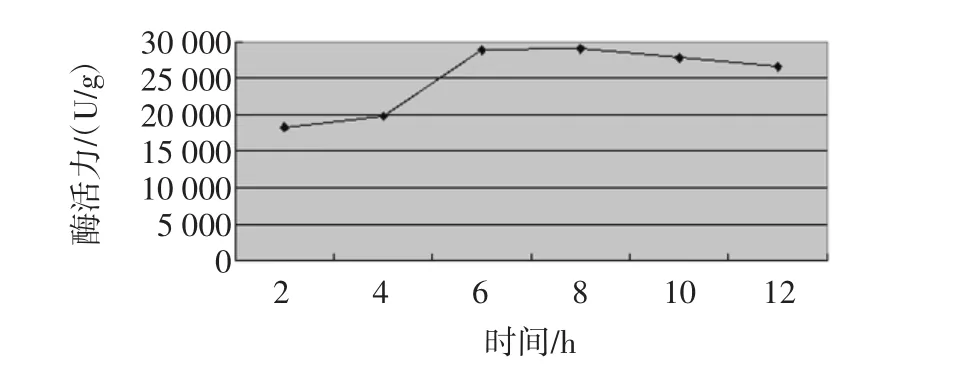
图4 固定化时间对酶活力的影响Fig.4 Immobilization of time corresponding to the enzyme activity
从图4中可以看出,固定时间也是影响固定化酶活力的因素之一,α-淀粉酶和载体结合需要一段时间,但是并不是时间越长越好,这是因为α-淀粉酶为蛋白质,时间越长会导致部分活力损失。所以,改性花生壳固定α-淀粉酶的时间为8 h左右。
2.2.4固定化温度对α淀粉酶活性的影响
固定化温度对改性花生壳固定化α-淀粉酶活力的影响结果见图5。
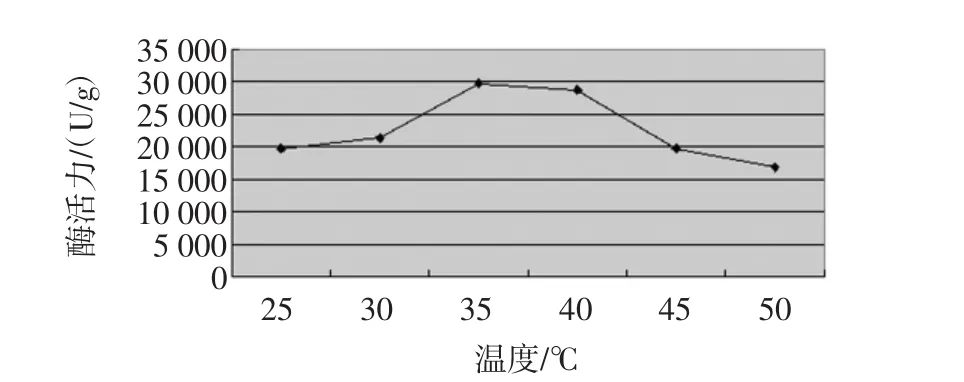
图5 不同固定化温度对酶活力的影响Fig.5 Effect of different immobilized on the enzyme activity
从图5中可以看出,固定化酶活力随着温度上升活力升高,在35℃达到最高值29 700 U/g,之后随着温度上升活力下降,可以看出之后的下降速度明显较快。因此α-淀粉酶的固定化温度因为35℃。在40℃以后酶活力就由于高温开始失活。
2.3改性花生壳固定化α-淀粉酶的酶学性质
2.3.1游离酶与固定化酶酶最适pH比较
在酶的固定化温度为35℃、固定化时间为6 h、及固定化酶用磷酸盐缓冲液的pH为6.0的情况下,测定的固定化酶的活性为100(酶活力为:29 950 U/g)见表4。
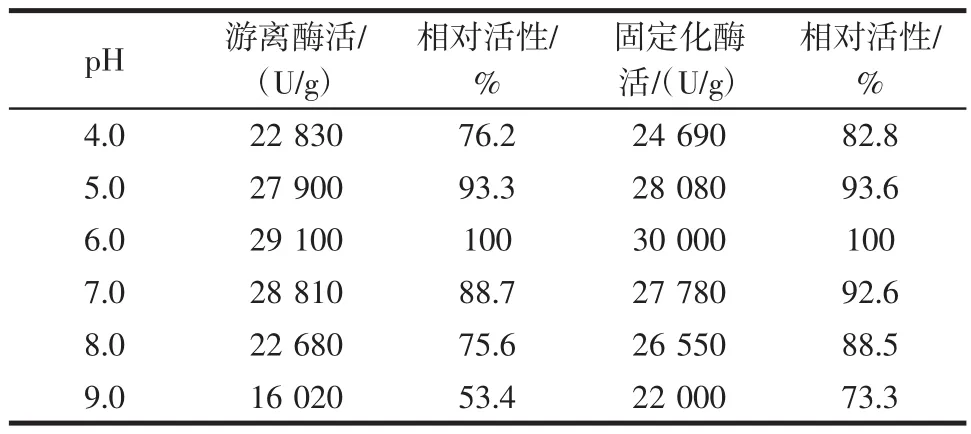
表4 不同pH对游离酶和固定化酶相对酶活的影响Table 4 pH corresponds to a different free enzyme and the relative activity of the immobilized enzyme
从表4可以看出不同pH有不同的酶活力,从游离酶和固定化酶相对酶活力可以看出,pH在6之前一直升高,在6之后就逐渐下降,游离酶最适pH=6.0,最高活力为29 100 U/g左右;固定化酶最适pH为6.0,最高酶活力为30 000 U/g左右。
2.3.2游离酶与固定化酶最适反应温度比较
不同温度对游离酶和固定化酶的相对酶活的影响见表5。
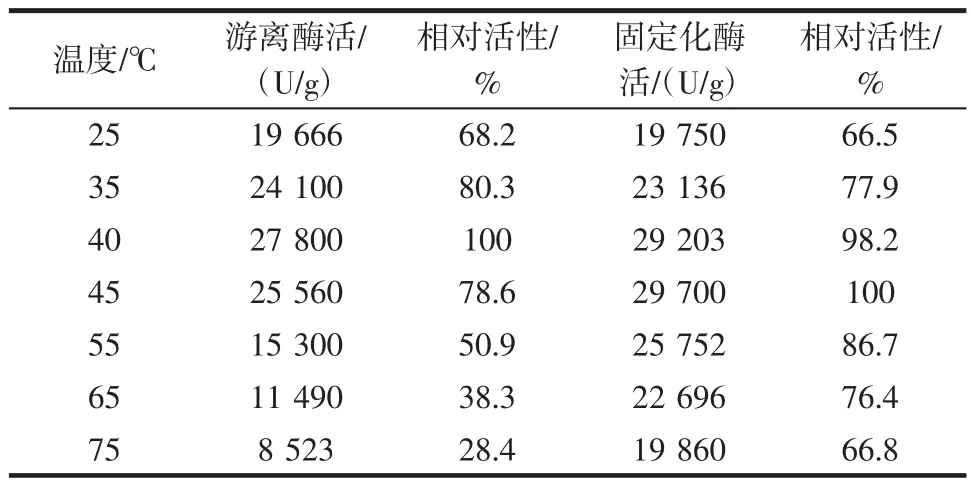
表5 不同温度对游离酶和固定化酶的相对酶活的影响Table 5 Corresponding to the free enzyme at different temperatures and relative activity of the immobilized enzyme
从表5中可以看出游离酶和固定化酶最适反应温度分别在40℃和45℃左右。游离酶在45℃之后相对酶活性下降较快而固定化酶下降较缓慢。固定化酶在75℃还能保持66.8%。游离酶却只有28.4%左右。可能是因为改性固定化后改变了α-淀粉酶的内部结构使得酶的热耐受力较强,因此可以看出固定化酶热稳定性较好。
2.3.3固定化酶的贮藏稳定性
不同储存时间下对游离酶和固定化酶的相对酶活的影响见表6。

表6 不同储存时间下对游离酶和固定化酶的相对酶活的影响Table 6 Different storage time relative activity of the free enzyme and immobilized enzyme
游离酶在放置一周后酶活下降的幅度较大,在28 d后酶活性保持在57.8%左右,而改性固定化α-淀粉酶相对酶活在28 d后还保持在78%。可知固定化α-淀粉酶的储存稳定性较好。
2.3.4固定化酶的操作稳定性
不同操作次数对游离酶和固定化酶的相对酶活的影响见表7。
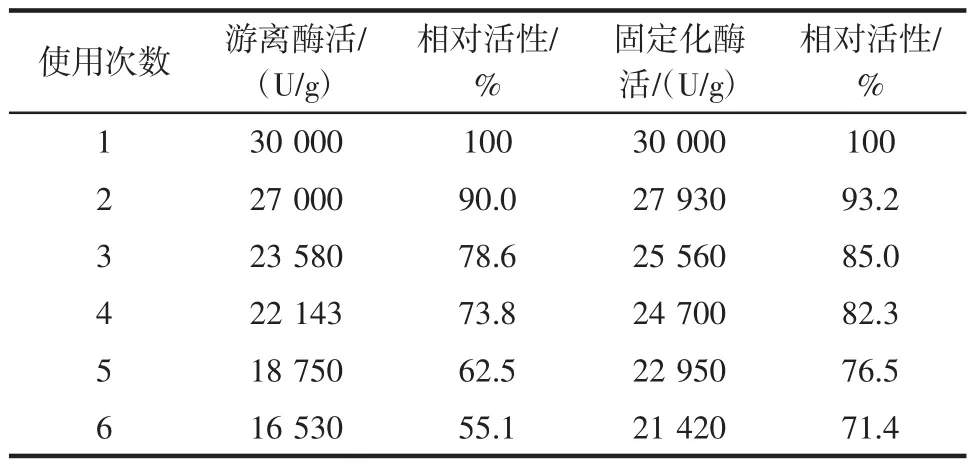
表7 不同操作次数对游离酶和固定化酶的相对酶活的影响Table 7 Different operating frequency corresponds to the free enzyme and the relative activity of the immobilized enzyme
操作稳定性可以从固定化酶的连续使用效果看出。如果制备的固定化酶在操作2到3次以后其酶活力就大幅度下降,那么固定化酶就失去了一定应用价值。由表7可以看出,固定化α-淀粉酶的酶活力随着使用次数的增加呈下降的趋势,但是下降的幅度较缓慢,连续进行6次操作以后,固定化α-淀粉酶的相对酶活仍然可以保持在第一次酶活力的71.4%,相比游离酶在操作6次后55.1%而言,固定化α-淀粉酶具有良好的操作性。
3 结论
本研究以磷酸改性花生壳为载体固定α-淀粉酶,研究了改性后的花生壳吸附固定α-淀粉酶的最优固定化条件以及固定化酶的一些酶学性质。试验结果表明:用磷酸溶液对粉碎的花生壳颗粒进行浸泡处理进行改性,研究出酶固定化最优条件是:酶液/载体比11∶1(mL/mg),缓冲液pH 6.0,固定时间8 h和温度35℃。经3次平行试验,固定化酶活力平均值为27 980 U/g。
对游离酶和固定化酶部分酶学性质进行了比较,得出改性后固定化后酶的最适反应pH、温度有所改变,最适pH=6.0,最适温度为45℃,固定化酶储存时间、操作稳定性和耐热性比游离酶都更好。
参考文献:
[1]白坤,于德贵,周冬颖.α-淀粉酶的性质及其液化作用[J].中国酿造,1999(5):24-26
[2]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.1-2003食品卫生检验方法理化部分总则[S].北京:中国标准出版社,2004:223-236
[3]张洪渊,万海清.生物化学[M].北京:化学工业出版社,2001:115-117
[4]Peter W C. Immobilized Enzymes in Analytic and Clinical Chemistry Wiley[D]. New York:New rork University,1980:6-9
[5]赵军,王述洋.我国农业生物质资源与利用[J].现代化农业,2007 (1):30-31
[6]周瑞宝.花生加工技术[M].北京:化学工业出版社,2003
[7]章明奎,方利平.利用非活体生物质吸附废水中重金属的研究四[J].生态环境,2006,15(5):897-900
[8]王富科.α-淀粉酶固定化的研究[J].安徽农业科学,2008,36(21):8872-8873
[9]MASSOLINIG,CALLERIE.Immobilized trypsin systems couple donline to methods:Recent develop ment sand tical applications[J].J Sci,2005,28(1):7-21
[10]千烟一郎.固定化酶[M].石家庄:河北人民出版社,1981:83-85
Modified Peanut Shells on α- Amylase Immobilized by Phosphoric Acid
LIAO Xiao-feng,YU Rong*,LIANG Hua-zheng,YAN Gen-hua
(East China Institute of Technology,Nanchang 330038,Jiangxi,China)
Abstract:A modified peanut shells as α-amylase immobilized on the enzymatic properties of the immobilized enzyme was detected,study the modified peanut shells fixed α-amylase adsorption optimal immobilization conditions and immobilized enzyme enzymatic properties. The results showed that:enzyme immobilization devel oped optimal conditions were:enzyme / carrier 11∶1(mL/mg)buffer pH6.0,8 h fixed time and Temperature 35℃. After three parallel experiments,the resulting immobilized enzyme actual average of 27 980 U/g. The free enzyme and immobilized enzymatic properties comparison,the immobilized enzyme modified optimum pH,temperature changes,as pH = 6.0,temperature was 45℃. At the same storage time,number of operations and the heat resistance was more than the free enzy.
Key words:modified peanut shells;immobilized enzyme;phosphoric acid
DOI:10.3969/j.issn.1005-6521.2016.09.007
作者简介:廖晓峰(1965—),男(汉),教授,硕导,博士,从事食品药品分析。
*通信作者:于荣(1965—),女,高级实验师,从事化学分析工作。
收稿日期:2015-03-15

