基于荧光的流式细胞检测与分选*
岑 毅, 刘 威
(武汉大学 物理科学与技术学院,湖北 武汉 430072)
基于荧光的流式细胞检测与分选*
岑毅, 刘威
(武汉大学 物理科学与技术学院,湖北 武汉 430072)
摘要:利用微流控技术相关软硬件实现了快速检测的流式细胞术。使用玻璃基质的聚二甲基硅氧烷(PDMS)芯片。将结肠癌HTC116细胞用罗丹明B染色,通过流动聚焦以液滴包裹,利用激光诱导荧光(LIF)共聚焦检测法检测细胞,利用放大电路和滤波电路采集微弱光电信号。然后根据检测结果,利用电润湿方法(EWOD)将HTC116细胞分离出来。通过单片机RS—232串口将信号传送到PC端,在屏幕上显示检测结果,并将数据存储。该系统实现了快速流式细胞检测、计数与分选。癌细胞的放大后的信号为900~1 300 mV,对于浓度为2×106/mL细胞样品可以8 min检测完毕。
关键词:流式细胞术; 共聚集检测; 电润湿; 信号采集
0引言
流式细胞术(flow cytometry,FCM)是 20 世纪 70 年代初发展起来的一项高新技术 ,结合了微流控技术、激光技术、电子技术、生物与化学技术。流式细胞术用于实验室研究各种细胞的结构和功能,以及临床上对疾病的监测诊断。流式细胞分析中,细胞首先用荧光染料染色,或者是荧光染料标记的抗体特异性结合,然后单个细胞依次通过检测通道,从而进行细胞分析和疾病诊断[1]。
利用流式细胞术可以实现精确的高通量检测和分选。利用流动聚焦(flow focusing)法可以产生单分散的液滴,包裹住单个细胞,以单列通过检测通道。检测技术主要有光学检测和电化学检测方法。光学检测灵敏度高,与样品无接触,设备简单且易于与微流控芯片相集成。光学检测方法可分为荧光检测、化学发光、生物发光检测、拉曼光谱检测等。激光诱导荧光( LIF) 可以精确控制激发光的参数,其敏感性更高,成为微流控技术中最主要的光学检测方法之一[2]。
传统的细胞分选方法有电场分选法[3]、声表面波分选法[4]、流体动力学分选法[5]和微阀分选法[6]等。使用电场控制反应速度快,对液滴无需标记,能降低沟道的复杂程度。Ahn B等人使用裸露的电极对液滴充电,然后利用静电场对液滴分选[3],充电电压为80 V,分选电压为110 V。郭峰等人使用静电场对没有预充电的液滴进行分选,利用了液滴自身由于其他原因所带的电荷[7],使用的电压为300~1 200 V。传统的电场分选方法所需的电压较高[7],经常达到千伏以上,高电压会引起绝缘层的击穿、电化学反应以及对生物样品的损害。电润湿(electro-wetting)方法,是一种无接触的电场操控方法,操控电压较低[8]。
本文以激光诱导荧光检测和电润湿分选方法为基础,开发了荧光检测和电润湿分选的硬件电路,配合微流控平台和相关的软件,实现了对HTC116结肠癌细胞的快速检测、计数与分选。
1系统结构
系统主要包括:1)微流控芯片与液流驱动系统 ;2)激光光源与光束形成系统;3)荧光接收与放大系统;4)数据显示与存储系统 ;5)细胞分选系统。系统结构如图1。

图1 系统结构图Fig 1 Structure diagram of system
1.1微流控芯片与液流驱动系统
将HTC116细胞磷酸盐缓冲液(phosphate buffered saline,PBS)悬液与3 %海藻酸钠溶液以1︰2的体积比混合,作为离散相,进行流动聚焦,得到均匀大小的液滴,液滴中包裹细胞。通过恒流泵将细胞悬液与连续相(油)通入芯片,利用流动聚焦法生成单分散的液滴,液滴中包裹细胞,并以另一路油相调节液滴移动速度。
1.2激光光源与光束形成系统
液滴依次单列通过光学检测系统,激光器发出的激光聚焦到沟道中的一个点上,激发出癌细胞上的荧光。
采用共聚焦模式激光诱导荧光检测系统,同侧激光入射与荧光收集,其光路结构如图2所示。激光器发射波长532 nm的激光,功率100 mW,经前置带通滤光片(532±10)nm滤光,再通过分光滤光镜和物镜组1聚焦于微流控芯片的沟道。诱导产生的荧光经带通滤光片(590±10)nm滤光后,通过物镜组2聚焦进入小孔,由光电倍增管将其转换为微弱电流信号。

图2 激光光源和荧光探测结构Fig 2 Laser source and fluorescence detection structure
平台移动聚焦是利用步进电机控制平台水平方向和竖直方向移动。水平方向移动,使激光对准微流控芯片沟道中间位置;竖直方向移动,光电倍增管收集芯片反射的荧光,调节芯片与物镜之间的距离,根据光强度判定激光是否聚焦在芯片沟道中。水平X,Y轴移动平台行程各为50 mm,竖直Z轴移动平台行程30 mm。每个轴两端有用于保护的光电限位器,每个限位器的状态接入单片机中断I/O口。
1.3荧光信号放大系统
荧光接收系统是共聚焦式LIF检测系统,使用滨松公司生产的侧窗型光电倍增管R928(PMT)进行检测,将光信号转换为微弱电信号,再进行放大和A/D转换。
光电倍增管接收荧光,产生微弱的电流,需要将电流放大。选用如图3所示的电路,包含前置放大电路和低通滤波器。前置放大电路要求具有低噪声,高精度的特性[9]。前置跨导放大电路将弱电流转换为放大的电压信号。选用精密JFET输入型运放AD8627作为前置运算放大器。该运放的噪声小,0.1~10 Hz噪声为1.9 μV;输入偏置电流小,输入偏置电流IB典型值0.25 pA,最大值1 pA。为了减小电路中的噪声,采用误差小的贴片式金属薄膜电阻器和温度特性好的贴片电容器。前置放大电路中,反馈电阻器并联上电容器C1,用于补偿信号相位,避免产生自激震荡。后级采用有源二阶低通滤波器,可以实现低通滤波和放大[10]。

图3 微弱光电流信号放大电路Fig 3 Amplifier circuit for weak photoelectric current signal
1.4数据显示与存储
信号处理系统是以Atmel公司的Atmega128单片机作为控制核心搭建控制系统,实现平台移动、对焦、接收及上传数据,并判断是否对细胞进行分离。
数据通过RS—232串口传送到PC端,用C#语言设计一个人机交互程序。PC端接收数据,并显示在窗体中,可以直观地区分有效信号与噪声信号,并可存储数据。
1.5细胞分选系统
细胞分选系统利用电润湿效应进行分选。如图4,利用自激振荡产生160 kHz的正弦波,峰—峰值可达350 V,由单片机定时控制固态继电器接通90 ms,短暂接入交变电场,作用于分选电极上,将目标细胞分选进分支沟道。电阻器R2,R3给振荡管Q1提供偏置,电容器C1将振荡电压进行正反馈,高频变压器的初级线圈是三端电感谐振线圈,中间抽头接电源。变压器次级线圈是高匝数高压输出,用于细胞分选电极。
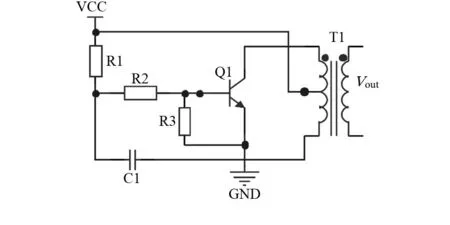
图4 自激振荡电路Fig 4 Self-oscillation circuit
细胞分选利用电润湿效应,如图5,在两电极间加上交变电场,两个电极间会产生一个势阱。当一个导电液滴处于两个电极上方时,由于绝缘层的存在,形成了包括两个串联的平板电容的电路。静电场引起的液滴的势能为
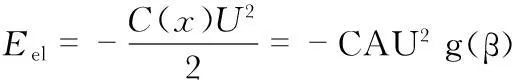
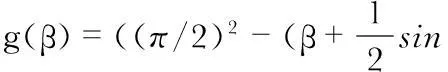
相应的静电场力为
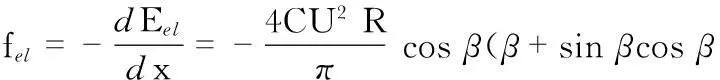
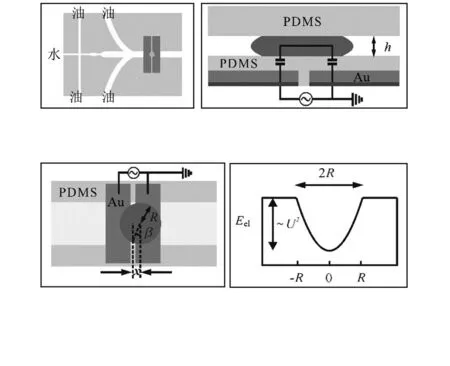
图5 微沟道中的电润湿原理图Fig 5 Principle of electro-wetting in micro-channel
2实验
2.1试剂与细胞样品
细胞培养基DMEM(Dulbecco’s modified Eagle’s medium)(美国Hyclone公司),植物油(中国北亚药用油公司),PDMS(美国GE—东芝有机硅公司),PBS缓冲液(美国Hyclone公司),Trypsin-EDTA(美国Gibco公司),罗丹明(BCRhB,上海试剂三厂)。实验中获得去离子水使用超纯水净化系统(Direct—Q3,美国Millipore公司)。HCT116结肠癌细胞由武汉中南医院提供。
HCT116细胞在DMEM中培养,其中添加10 %的胎牛血清,1 %的青霉素和链霉素等质量混合物,在5 %的CO2气氛中培养,培养温度37 ℃。细胞分裂增殖后,HCT116使用胰酶细胞消化液(美国Gibco公司)将细胞团分散,离心,去除上清液,加入PBS溶液冷藏待用。
将PBS细胞悬液离心,使用0.4 %的罗丹明B溶液500 μL在暗室染色30 min。用0.9 %NaCl溶液清洗离心3次,用0.9 %NaCl稀释到需要的浓度,再与3 %的海藻酸钠溶液以1︰2的体积混合,作为实验用的细胞悬液。
2.2实验操作
实验使用恒流泵(TS2—60,中国兰格公司)通入连续相和分散相液体,使用倒置显微镜(IX71,Olympus)进行观测,并使用CCD相机记录液滴的运动情况。将细胞悬液作为分散相通入,将植物油作为连续相通入,形成稳定的包裹细胞的单分散液滴。
打开激光光源,调节平台移动,使激光聚焦在沟道中心。打开PC端串口,接收放大的荧光信号,在屏幕上显示数据。使用浓度为2×106/mL细胞悬液,可以8 min检测完毕。
2.3荧光检测结果
如图6,在没有癌细胞通过时,电路中的噪声和细胞悬液中的杂质会引起较小的信号波动。而有癌细胞通过时,则会产生较高的峰。噪声信号幅值一般不超过500 mV。癌细胞中荧光信号则会达到900 mV以上,小于1 300 mV。连接串口后,进行信号采样,将信号传输到上位机,显示到界面图中,并能将数据以文本文档存储。
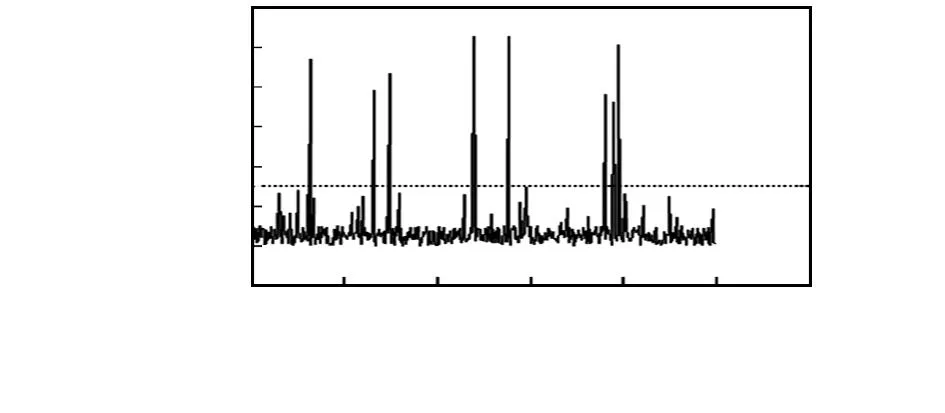
图6 HTC116细胞荧光检测效果Fig 6 Results of fluorescence detection on HTC116 cell
2.4分选效果
在三叉路的沟道中,使用电润湿对液滴进行分选。当荧光信号强度超过900 mV时,单片机判定液滴包裹癌细胞,接通继电器,进行液滴捕获分选。使用的芯片参数为:
沟道高度80 μm,中间沟道宽度为200 μm,分支沟道的宽度为150 μm。当液滴进入待分选沟道时,利用连续相将液滴调节到适当间距。芯片上共有三个电极,当液滴到达叉路交汇处时,在某一分支沟道两侧的电极加交变电压,液滴由于受到电润湿作用力,向指定的叉路运动。图7(a),(b),(c)是分选的示意图。图7(a)中右边电极悬空不加电场,则液滴进入中间分支沟道;图7(b)中驱动电极,则液滴进入上边分支沟道;图7(c)中驱动电极,则液滴进入另一分支沟道。实验中用电润湿方法进行不含细胞的1 %NaCl液滴的分选,图7(d)中将一个液滴分选到上边分支沟道;图7(e)中将一个液滴分选到下边分支沟道。所加的交变电压有效值为60 V,作用时间为40 ms。
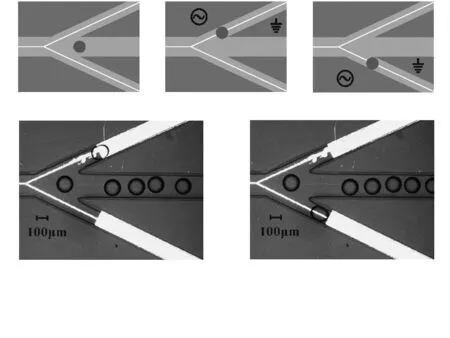
图7 电润湿分选Fig 7 Electro-wetting for sorting
3结论
本文利用激光诱导荧光检测方法,结合软硬件协同设计,实现了对HTC116细胞快速检测、计数和分选的流式细胞术。本方法利用共聚焦检测,检测与计数结果准确;外围信号放大与分选电路小型化,简化了分选系统的结构;使用电润湿效应,在较低的电压下实现对细胞的分选。使用这种芯片可以在较低的电压下进行液滴的捕获和分选。
参考文献:
[1]Aghaeepour N,Finak G,Hoos H,et al.Critical assessment of automated flow cytometry data analysis techniques[J].Nat Meth,2013,10(3):228-238.
[2]Poe B G,Navratil M,Arriaga E A.Analysis of subcellular sized particles-Capillary electrophoresis with post-column laser-induced fluorescence detection versus flow cytometry[J].J Chromatogr A,2006,1137(2):249-255.
[3]Ahn B,Lee K,Panchapakesan R,et al.On-demand electrostatic droplet charging and sorting[J].Biomicrofluidics,2011,5(2):24113.
[4]Franke T,Abate A R,Weitz D A,et al.Surface acoustic wave (SAW) directed droplet flow in microfluidics for PDMS device-s[J].Lab on a Chip,2009,9(18):2625-2627.
[5]Maenaka H,Yamada M,Yasuda M,et al.Continuous and size-dependent sorting of emulsion droplets using hydrodynamics in pinched microchannels[J].Langmuir,2008,24(8):4405-4410.
[6]Abate A R,Agresti J J,Weitz D A.Microfluidic sorting with high-speed single-layer membrane valves[J].Appl Phys Lett,2010,96(20):203509.
[7]Guo F,Ji X H,Liu K,et al.Droplet electric separator microfluidic device for cell sorting[J].Appl Phys Lett,2010,96(19):3.
[8]de Ruiter R,Pit A M,de Oliveira V M,et al.Electrostatic potential wells for on-demand drop manipulation in microchannel-s[J].Lab on a Chip,2014,14(5):883-891.
[9]何瑾,刘铁根,孟卓,等.弱光强信号检测系统前级放大电路的设计[J].科学技术与工程,2007(9):1904-1906,1910.
[10] 杨茂,胡立群,段艳敏,等.微弱光电流信号放大器的设计[J].核电子学与探测技术,2011(7):734-738.
Flow cytometry for detection and sorting based on fluorescence*
CEN Yi, LIU Wei
(School of Physics and Technology,Wuhan University,Wuhan 430072,China)
Abstract:Flow cytometry is implemented with combination of microfluidic,and its related software and hardware.Microfluidic chip is made of polydimethylsiloxane(PDMS)on substrate of slide glass.The flow focusing is used to form droplets which contain stained colorectal HTC116 cells,then laser induced fluorescence(LIF)confocal detection method is used.Amplifier and filtering circuits are utilized to detect weak photoelectric current signal.According to detection results,droplets which contain HTC116 cells are sorted by electro-wetting on dielectric (EWOD).Signals are transmitted from micro control unit (MCU) to PC by RS—232 serial port,displayed on screen and stored.Fast detection,count and sorting for cells are realized by the system.The amplified signal of HTC116 are at range of 900~1 300 mV,and detection can be completed in 8min for sample cell with concentration of 2×106/mL.
Key words:flow cytometry; confocal detection; electro-wetting; signal acquisition
DOI:10.13873/J.1000—9787(2016)03—0154—03
收稿日期:2015—06—28
*基金项目:国家自然科学基金资助项目(81272443);国家基础科学人才培养基金资助项目(J1210061)
中图分类号:TN 405
文献标识码:B
文章编号:1000—9787(2016)03—0154—03
作者简介:
岑毅(1990-),男,湖北枣阳人,硕士研究生,主要从事微流控与微纳加工研究。

