女性生殖道HPV感染与子宫颈上皮内瘤样病变现状及薄层液基细胞学检测筛查方法的评价
安红 阎文莉
女性生殖道HPV感染与子宫颈上皮内瘤样病变现状及薄层液基细胞学检测筛查方法的评价
安红 阎文莉
目的 了解青岛市门诊女性生殖道高危型人乳头瘤病毒(HPV)感染及子宫颈病变的情况,对薄层细胞学检测筛查方法(LTC)进行评价。方法 对就诊的15~69岁共2596例有性生活女性,采用TCT检查及第二代杂交捕获技术(HC-Ⅱ)检测子宫颈分泌物中高危型HPV,并进行Bethesda分级系统(TBS)分类,对HPV阳性且TCT未明确诊断意义的不典型鳞状上皮细胞(ASCUS)和低级别鳞状上皮内病变(LSIL)行阴道镜下组织病理学活检确诊。结果 HPV感染总阳性率为14.9%,各年龄组组间HPV阳性感染率经比较差异有统计学意义(P<0.05),HPV感染率大体呈现双峰状。TCT检查阳性率16.5%,将TCT检查与病理组织学活检结果进行比较:ASCUS中CINII+(≥CINII)检出率为2.96%(5/169),符合率为13.61%(23/169),假阳性率
83.43 %(141/169);LSIL中CINII+检出率为13.90%(26/187),符合率为68.45%(128/169),假阳性率17.65%(33/187);HSIL中CINII+检出率为79.71%(55/69),符合率为17.39%(12/69),假阳性率2.90%(2/69);SCC中CINII+检出率为100%(3/3),符合率为100%(3/3),假阳性率0%(0/3);TCT检查与病理结果总符合率为38.79%(166/428)。结论 青岛地区社区人群HPV感染现患率属于HPV感染中发地区,因此在宫颈癌防治过程中HPV筛查及治疗仍是工作重点。TCT结合Bethesda分级系统(TBS)诊断在宫颈上皮内瘤变及宫颈癌的筛选中,尤其较高级别病变有较高的可信度。
细胞学技术;HPV;TBS诊断;宫颈病变;宫颈肿瘤
宫颈癌发病率占女性恶性肿瘤的第二位,研究证实人乳头状瘤病毒(HPV)感染与宫颈癌前期病变(宫颈上皮内瘤变,CIN)和宫颈癌有着密切的联系[1]。高危型HPV检测及液基薄层细胞学技术(TCT)的在临床的应用使宫颈病变早诊断和早治疗成为可能。其中TCT结合Bethesda分级系统(TBS)诊断有较高的敏感性,已成为宫颈筛查重要措施,本文通过分析门诊患者HPV及TCT结果,结合组织病理学活检查,探讨TCT在宫颈癌筛查中的临床意义及青岛地区妇女HPV感染状况,现报道如下。
1 资料与方法
1.1 一般资料 2009年1月~2015年12月到青岛市市南区妇幼保健院妇科就诊的2596例资料,年龄17~69岁,平均(36.57±11.92)岁,细胞学检查异常的患者例行阴道镜检查及镜下活组织病理检查。妇女就诊时应月经干净3d以上,3d内无阴道冲洗、用药、性生活及妇科检查等,行常规妇科检查,送液基细胞学检查和高危型HPV检测。对ASC-US及以上患者在阴道镜下行组织病理学活检,根据CIN系统作出病理诊断。
1.2 质量控制 妇女就诊时应月经干净3d以上,3d内无阴道冲洗、用药、性生活及妇科检查等,行常规妇科检查,按标准方法取材,送液基细胞学检查和高危型HPV检测。对ASC-US及以上患者在阴道镜下行组织病理学活检,根据CIN系统作出病理诊断,作为金标准。
1.3 实验器材 细胞学诊断方法TCT检查采用广州安必平医药科技公司的LBP-2801自动样本转移机制片。美国公司的基因杂交信号放大检测系统,亚能基因芯片HPV分型检测系统。电子阴道镜(深圳金科威公司)。
1.4 评价方法 细胞学的评价方法和报告采用TBS,即:无上皮内病变或恶性病变(NILM),意义不明的不典型鳞状上皮细胞(ASCUS),LSIL,高级别鳞状上皮内病变(HSIL),鳞状细胞癌(SCC)。≥ASCUS为LTC结果阳性。病理诊断报告结果按病变程度由轻到重分为以下5类:阴性或炎症、一级宫颈上皮内瘤变(CINI)、二级宫颈上皮内瘤变(CINII),三级宫颈上皮内瘤变(CINIII)、浸润癌(SCC)。在TCT检查结果与病理组织学活检结果对照中则把ASCUS归于CINI,LSIL归于CINI,HSIL归于CINⅡ或CINⅢ,SCC相当于浸润癌,作为对照方法。
1.5 统计学方法 数据统计分析采用SPSS17.0,计数资料用例数(n)表示,计数资料组间率(%)的比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 人乳头瘤病毒各年龄别的感染率 入选患者共2596例,高危型HPV感染总阳性率为14.9%,按年龄(5岁为组距)进行分为7组,HPV阳性率分别为18~24岁16.57%(30/181),25~29岁20.16%(101/501),30~34岁12.78%(50/391),35~39岁10.13%(47/464),40~44岁11.11%(49/441),45~49岁16.38%(77/470),50~70岁22.97%(34/148),各年龄组组间HPV阳性感染率经比较差异有统计学意义(χ2=34.36,P<0.001),其中25~29岁组及50~70岁组感染率较高,经比较差异无统计学意义(χ2=2.13,P=0.145)。HPV感染率大体呈现双峰状。见图1。
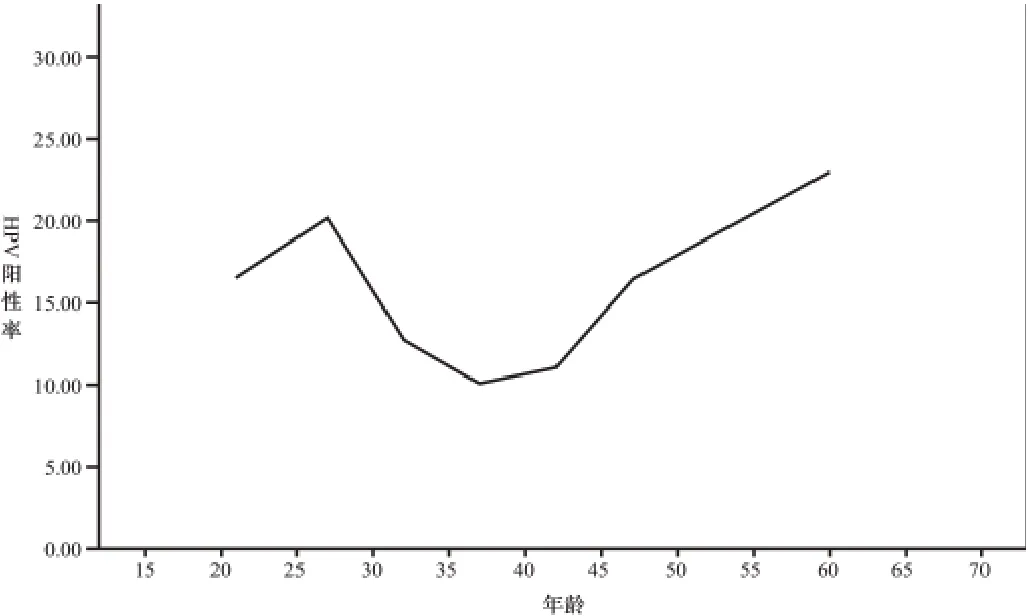
图1 青岛市社区人群HPV感染率情况
2.2 TCT检测结果 TCT检查2596例,NILM2168例,阴性率为83.5%,阳性428例,阳性率16.5%,包括ASCUS6.51%(169/2596),LSIL7.20%(187/2596),HSIL2.67%(69/2596),SCC0.12%(3/2596),其中阳性样本中,各级别构成情况分别为ASCUS 39.49%(169/428),LSIL43.69%(187/428),HSIL16.11%(69/428),SCC0.71%(3/428)。见图2。
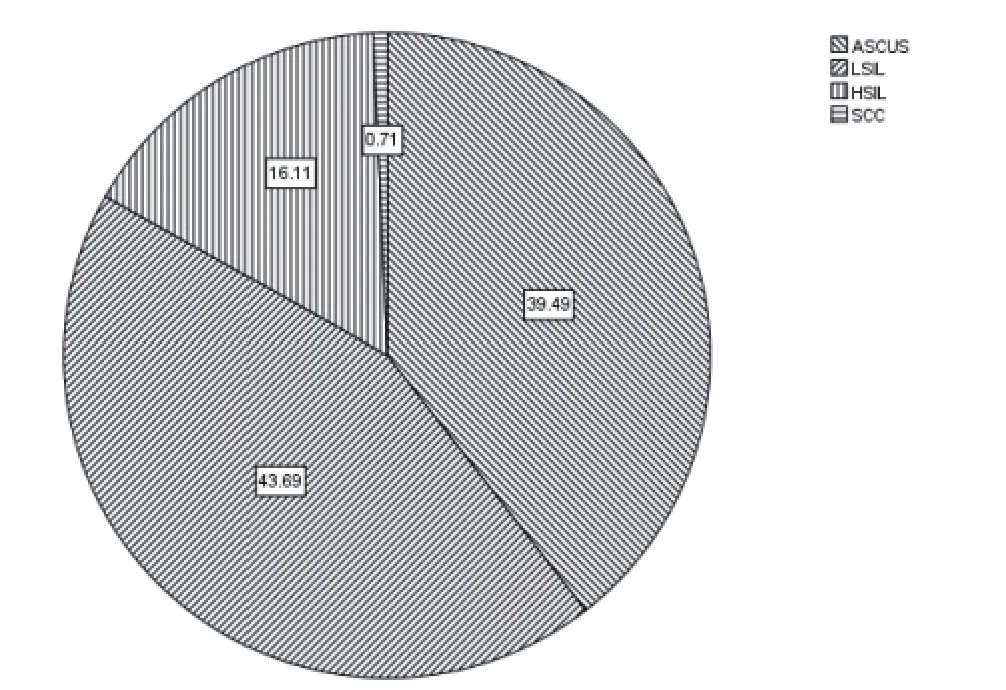
图2 TCT检查结果各级别构成情况
2.3 TCT检查结果与病理组织学活检结果对照 428名TCT阳性患者病理组织学结果示:宫颈炎症41.12%(176/428),CINI38.08%(163/428),CINⅡ11.68%(50/428),CINⅢ7.94%(34/428)例,浸润癌SCC1.17%(5/428)。CINI及以上病变阳性率为58.88%(252/428)。将TCT检查与病理组织学活检结果进行比较。见表1。
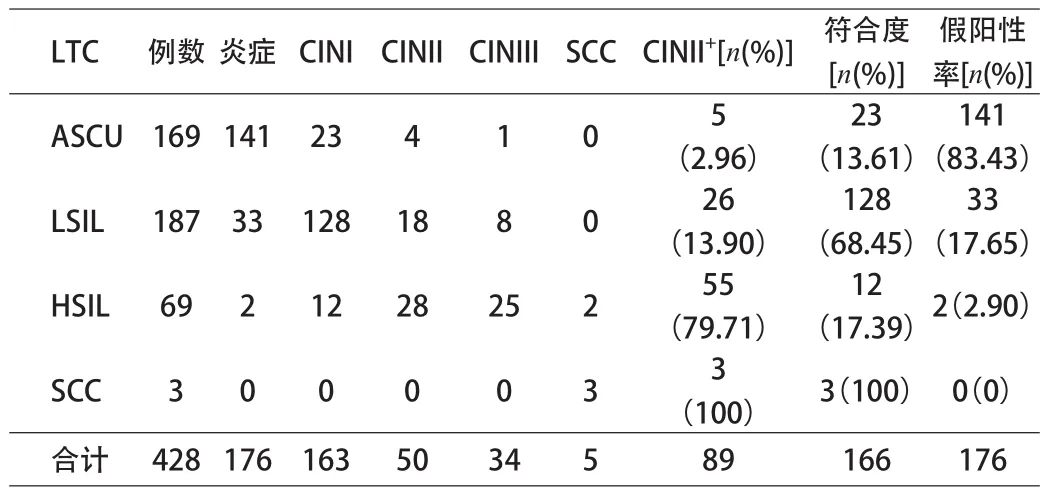
表1 TCT检查结果与病理组织学活检结果对照(n)
3 讨论
我国每年宫颈癌新增病例约10万,占世界新发病例的1/5,每年约5万患者死于此病,且年轻化慢慢成为趋势,危害极大[2]。但宫颈病变从CINI发展到SCC,需要长达10年左右的时间,早期宫颈癌患者则拥有高达90%以上的5年治愈率,所以早期筛查和早期干预成为预防和治疗宫颈癌的关键。询证医学已证实高危型HPV感染与宫颈癌发生及年轻化趋势有着密切联系[3],且HPV检测简单易操作,可重复性高,且国外研究已证实,HPV检测有高达88%~100%的敏感度及99%阴性预测值,高效筛查和密切监测HPV患者感染情况能有效防止宫颈癌的发生[4]。本文通过分析2596例本院门诊妇女的HPV感染情况,旨在为区域性HPV疫苗的临床应用和干预性预防措施提供基础资料,本研究所得高危型HPV感染总阳性率为14.9%,按年龄分7组,各组之间HPV感染率差异有统计学意义,其中25~29岁组及50~70岁组感染率较高(两者差异无统计学意义),40~44岁组感染率最低,总体分布呈现双峰形状,Lanzcanno等[5]发现HPV感染年龄分布呈现“V”字形,其中双峰出现在20~24岁及40~49岁组,低点在30~34岁,这于本研究结果基本相符,但各组峰值略有不同,考虑地域、种族及性文化差异所致。25~29岁组感染率较高,考虑本年龄组为结婚育龄期,性活动较为活跃所致。40~49岁组感染率较高则表示持续感染存在的可能。本研究的青岛HPV感染率为14.9%,低于重庆永川地区(37.65%)[6],北京社区(15.38%)[7],但高于大庆市(8.64%)[8],西安(8.79%)[9],说明青岛属于HPV感染中发地区,因此在宫颈癌防治过程中
HPV筛查及治疗仍是工作重点。
宫颈病变早期筛查对宫颈癌防治起到极大作用。在宫颈病变早期筛查的方法中,TCT检查联合TBS细胞学描述性诊断因其采样方法科学,仪器制片,单层细胞图片清晰易读,诊断描述简单实用,大大提高了检出率及准确率,该方法已成为国际公认并推荐的较为先进的一种宫颈病变检查技术[10]。本次研究参与TCT检查病例共2596例,其中NILM 2168例,阳性率为16.5%(428/2596),高于Ronco等[11]报道的欧洲15个国家的阳性率
1.2 %~11.7%的数值,并指出TCT结果LSIL、HSIL、SCC符合率分别为40.43%、69.57%、100.00%,而本研究所的符合率分别为13.90%、76.81%、100%,其中本研究LSIL符合率较报道中低,提示在低级别的TBS系统诊断中诊断范围过于宽泛,今后工作中注意改进。TCT检查在高级别的诊断中符合率与文献中基本一致,与病理结果有较高的符合率,说明TCT检查在宫颈癌前病变,尤其高度病变有较高的可信度。TCT结合TBS在临床应用过程中重点在筛查及发现HSIL及SCC即CINII+,本研究该项目ASCUS、LSIL、HSIL、SCC检出率分别为2.96%、13.90%、79.71%、100%,随着宫颈病变的等级的上升,CINⅡ+的发生率逐渐上升,病理学结果有较好的契合。其中ASCUS、LSIL中也有CINII+的检出,提示仅对HSIL以上的患者行阴道镜活检,对
CINII+的检出有漏检的可能,故本研究认为对于低级别的宫颈病变应结合HPV检测或者必要时亦行阴道镜活检检查。
综上所述,青岛地区社区人群HPV感染现患率属于HPV感染中发地区,因此在宫颈癌防治过程中HPV筛查及治疗仍是工作重点。TCT结合Bethesda分级系统(TBS)诊断在宫颈上皮内瘤变及宫颈癌的筛选中,尤其较高级别病变有较高的可信度。
[1] Ault KA,Epidemiology and natural history of human papillomavirus infections in the female genital tract[J].Infect Disobstet Gynecol,2006,14(40):470.
[2] Woodman CB,Collins S,Winter H,et a1.Natural history of cerviealhuman papillomavirus infection in young women:longitudinalcohorts study[J]. Lancet,2001,35(21):1831-1836.
[3] 李从铸,翟玉霞.宫颈癌年轻化极其治疗模式的临床研究[J].癌变·畸变·突变,2005,17(1):36-38.
[4] Balleyguier C,Fournet C,BenHassen W,et al.Management of cervical cancer detected during pregnancy:Role of magnetic resonance imaging[J]. Clinical imaging,2013,37(1):70-76.
[5] Lanzcanno PE,Herrero R,Munoz Z.Epidemiology of HPV infection among Mexican women with normal cervical cytology[J].Int J Cancer,2011,9(1):412-414.
[6] 张晓静,袁瑞,代红莹.重庆永川地区妇科门诊人乳头瘤病毒哑型分布的研究[J].重庆医科大学学报,2010,35(9):56-58.
[7] 李静,屠铮,赵超,等.北京市社区妇女人乳头瘤病毒感染率及其对HPV和疫苗认知情况的调查分析[J].中国肿瘤,2008,17(3):168-172.
[8] 杨琳,李霓,郭兰,等.2010年黑龙江省大庆市妇女人乳头状瘤病毒感染状况及其危险因素调查[J].中华预防医学杂志,2013,47(2):118-123.
[9] 惠凌云,王亚文,冯艾,等.西安市员1650例已婚妇女宫颈细胞HPV感染调查分析[J].中国妇幼健康研究,2012,23(6):738-740.
[10] Klinkhamer PJ,Meerding WJ,Rosier PF,et al.Liquid based cervical cytology[J].Cancer,2003,99(5):263-271.
[11] Ronco G,Ballegooijen M,Becket N,et al.Process performance of cervical screening programmes in Europe[J].Eur J Cancer,2009,45(15):2659-2670.
10.3969/j.issn.1009-4393.2016.33.128
山东 266071 青岛市市南区妇幼保健院 (安红 阎文莉)

