小儿急性肺损伤患者血清miR-155的表达水平及其临床意义
崔秀平 周子健
小儿急性肺损伤患者血清miR-155的表达水平及其临床意义
崔秀平 周子健
目的 通过检测小儿急性肺损伤(acute lung injury,ALI)患者血清中miR-155的表达水平,探讨其在诊断和评估小儿ALI中的临床意义。方法 选择符小儿AMI诊断的患者30例作为研究对象,分别于明确诊断后1、3、5、7 d取患者血清样本,采用实时荧光定量RT-PCR(RT-PCR)检测血清miR-155表达改变情况;并与30例正常人进行对照。探讨血清miR-155的表达水平在诊断和评估小儿ALI上的临床价值。结果 小儿ALI患者血清miR-155表达水平在明确诊断后1、3、5、7 d时均明显高于正常对照组(P<0.05)。随着病情的缓解,血清miR-155表达呈逐渐下降趋势。Pearson相关分析显示,血清miR-155与APACHE-II评分具有显著相关性(P<0.05)。结论 在小儿ALI患者血清中血清miR-155的表达水平不仅能够成为新的ALI检测标记物,还可以作为患者病情监测的临床指标。
急性肺损伤;儿童;miR-155;血清
急性肺损伤(acute lung injury,ALI)以肺部炎症炎症和肺毛细血管通透性增加为特征的临床综合征。ALI导致弥漫性肺间质及肺泡水肿,临床上表现为进行性低氧血症和呼吸窘迫,严重时则进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。由于小儿肺部发育尚不够成熟和免疫力低下,因此ALI在小儿中的发病率要高于成人。近年流行病学统计显示国外ALI占儿科重症监护病房收治的10%[1]。ALI属于儿科临床危重症之一,由于目前临床上缺乏具有较高敏感性和特异性的早期诊断ALI的生物标记物,因此诊治难度较大。微小RNA(miRNA)是近年来发现的一类长度约20~25 nt的非编码调控单链小分子RNA。研究显示,miRNA在调控肿瘤发生发展、炎症免疫反应等一系列重要生理病理过程起着非常重要的调控作用[2]。最新的研究证实,miRNAs能在血液中稳定存在,且其表达谱和表达水平改变情况也与疾病有关[3]。因此,科学家们推测miRNA可能是一个理想的生物检测标志物。miR-155是目前已知的在炎症和免疫反应起重要调控作用的miRNA。本次研究我们通过检测小儿ALI患者血清中miR-155的表达水平,探讨其在诊断和评估小儿ALI中的临床意义。
1 资料与方法
1.1 一般资料 选择2013年5月~2015年5月在梅河口市中心医院住院并确诊的小儿ALI患者30例作为研究对象。所有小儿ALI患者均符合我国1999年中华医学会推荐的ALI诊断标准:(1)有导致ALI的高危因素;(2)急性起病,呼吸频数增加和(或)呼吸窘迫;(3)低氧血症:ALI时PaO2/ FiO2≤300 mmHg;(4)胸部X线检查示双肺浸润阴影;(5)肺动脉楔压(PCWP)≤18 mmHg或临床上能除外心源性肺水肿。其中男19例,女11例,年龄1~11岁,平均年龄(3.5±1.2)岁。另选择30例正常小儿作为对照组。所有入选小儿家长研究前均被告知签署知情同意书。
1.2 方法 (1)血清样本采集:所有研究对象均在各个时间点采集静脉血5 mL,室温下自然凝固20 min,然后2 000 rpm/ min条件下离心15 min,吸出上层血清,放入-80℃冰箱待实验。(2)主要设备及试剂:RNAisoTMPlus和RT-PCR试剂盒(Takara公司);mirVanaTMmiRNA Isolation Kit和miScript Reverse Transcription Kit(Ambion公司);miR-1及U6引物序列购于上海吉凯基因化学技术有限公司;微量高速离心机(Eppendorf公司);ABI PRISM 7900实时荧光定量PCR仪(ABI公司)。(3)miR-155的检测:①血清总RNA提取:采用RNAisoTMPlus并按照操作说明提取血清中的总RNA,异丙醇沉淀法浓缩
RNA,NanoDrop® ND-1000检测RNA浓度并评估纯度,1.5%甲醛变性琼脂糖凝胶电泳检测RNA质量。②逆转录(RT)反应:采用miScript Reverse Transcription Kit并按照实验步骤说明进行操作。建立20μL RT混合反应体系:dNTP(2.5 mM each)2μL;Total RNA 0.3 ug;RT特异引物(1 uM):0.5μL;MMLV反转录酶(10U/μL):2μL;RNA酶抑制剂(40 u/ μL):0.3μL;10×RT Buffer 2μL;加入无RNA酶水至总体积20μL。反应条件:16℃:30 min;40℃:40 min;85℃:5 min。③PCR反应:构建20μL反应体系:通用引物1μL,目的引物1μL,QuantiTect SYBR Green PCR Master Mix 10μL,模板CDNA 1μL,无RNA酶水7μL。按以下程序进行扩增:95℃,3 min;40个PCR循环(95℃,15 s;60℃,30 s;70℃,30 s)。实验重复3次。以U6 snRNA作为内参,数据采用2-ΔΔCT法进行分析。
1.3 统计学方法 采用SPSS 13.0统计软件进行统计分析,计量资料结果用“x±s”表示,治疗前后及组间比较用t检验,计数资料以构成比表示,用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 RNA质量检测结果 提取血清RNA经检测吸光度(A)值A260/A280在1.6~1.8,表明RNA浓度和纯度较高,无DNA及蛋白质污染。变性凝胶电泳结果显示为3个清晰条带,18 S和28 S条带清晰无明显拖尾,证实RNA提取成功,无RNA降解发生。
2.2 小儿ALI患者和正常小儿血清miR-155表达比较 正常小儿血清中只表达较低水平的miR-155表,约为(0.12±0.02);小儿ALI患者血清miR-155表达水平较正常小儿有显著的升高,约为(1.41±0.36);两者比较,差异具有统计学意义(P<0.05)。见图1。

图1 各组血清miR-1表达情况比较
2.3 不同时间点小儿ALI患者血清miR-155表达情况小儿ALI患者血清miR-155表达水平在明确诊断后1、3、5、7 d时均明显高于正常对照组,3 d左右达到高峰(P<0.05)。随着病情的缓解,血清miR-155表达呈逐渐下降趋势。见图2。
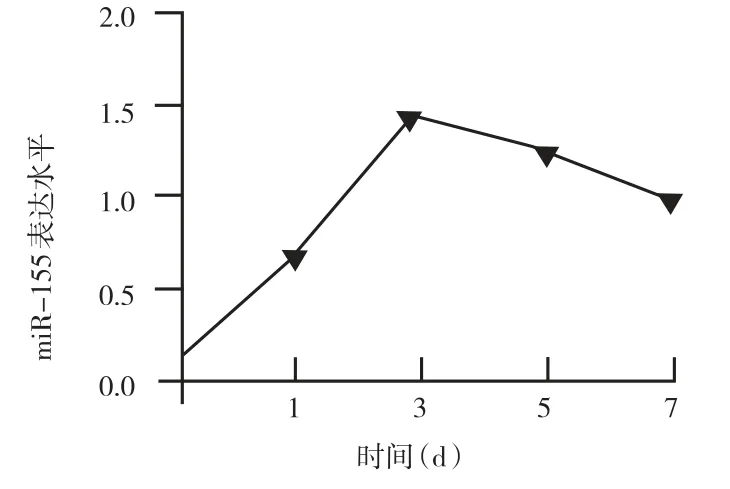
图2 不同时间点小儿ALI患者血清miR-155表达
2.4 小儿ALI患者血清miR-155表达与APACHE-II评分的相关性分析 Pearson相关分析结果显示,小儿ALI患者血清miR-155表达与APACHE-II评分的相关系数r=0.68,呈明显正相关(P<0.05)。
3 讨论
ALI发病机制错综复杂,涉及多种病理生理机制,目前已知各种致病因素导致的全身炎症反应是小儿ARDS的根本原因。ALI疾病进展迅速,如果不能得到及时有效的治疗。ALI会发展为ARDS,严重威胁患者的生命[4]。据流行病学资料显示,美国ALI/ARDS的年总发病率为19万,其病死率高达30%~40%[5]。小儿ALI早期往往缺乏特异性表现,待出现典型临床表现时疾病往往已进展至中晚期。因此,寻找能早期诊断小儿ALI,且特异性、敏感性更高的标志物,对于及时开展治疗,改善患者预后是至关重要的。近年来,虽然在ALI的生物标记物研究上已经获得一些进展,如肺细胞及基质损伤的生物标记物(AECⅠ、Ⅱ损伤标记物、层黏连蛋白、血管性血友病因子)和炎症反应标记物(TNF-α、IL-6、IL-8)[6-8]。但目前临床上尚缺乏具有较高敏感性和特异性的诊断ALI的生物标记物。
miRNA是近年来发现的一类非编码调控单链小分子RNA。研究证实,miRNA可通过转录后水平下调炎症因子和炎症因子信号通路的受体来调控失衡的炎症反应,因此在炎症免疫反应过程起着非常重要的调控作用。值得关注的是,由于miRNA与疾病的发生及发展密切相关,且在患者病变组织、血液中均可以发现异常表达的,与疾病发展密切关联的miRNAs。因此,miRNA具备成为新的疾病检测标志物的潜力[9]。
miR-155是近年来发现的免疫系统相关的miRNA之一,其位于人类21号染色体上B-cell Integration Cluster(bic)基因的第三个外显子内。研究表明,LPS刺激可导致人免疫细胞中miR-155表达升高,且这种改变与Toll样受体(TLR)的活化有关,提示miR-155可能通过转录后水平下调炎症因子和炎症因子信号通路的受体来调控失衡的炎症反应,因而在人体的炎症反应和免疫调节过程中发挥重要作用[10-11]。
综上所述,小儿ALI患者血清miR-155表达水平较正常小儿显著升高。随着病情的缓解,血清miR-155表达呈逐渐下降趋势。Pearson相关分析显血清miR-155与APACHE-II评分呈明显正相关。以上数据结果表明,血清miR-155具备成为早期诊断小儿ALI的新指标。而其血清水平的下降也预示着疾病的好转,提示血清miR-155水平也可作为判断ALI预后的重要指标。此外,由于小儿ALI的整个病理过程主要由炎症反应介导,因此,能够调控炎症反应的miR-155也可能成为ALI治疗的潜在靶点。
[1] Hernu R,Wallet F,Thiolliere F,et al.An attempt to validate the modification of the American-European consensus definition of acute lung injury/acute respiratory distress syndrome by the Berlin definition in a university hospital[J].Intensive Care Med,2013,39(12):2161-2170.
[2] David R.Small RNAs:miRNA machinery disposal[J].Nat Rev Mol Cell Biol, 2013,14(1):4-5.
[3] Dong L,Li Y,Han C,et al.miRNA microarray reveals specific expression in the peripheral blood of glioblastoma patients[J].Int J Oncol,2014,45(2): 746-756.
[4] Ware L B,Herridge M.Acute lung injury[J].Semin Respir Crit Care Med, 2013,34(4):439-440.
[5] Meade MO,Lamontagne F.Clinical trial design in acute lung injury--issues and controversies[J].Semin Respir Crit Care Med,2013,34(4): 516-521.
[6] Hoesch RE,Lin E,Young M,et al.Acute lung injury in critical neurological illness[J].Crit Care Med,2012,40(2):587-593.
[7] Calfee CS,Gallagher D,Abbott J,et al.Plasma angiopoietin-2 in clinical acute lung injury:prognostic and pathogenetic significance[J].Crit Care Med, 2012,40(6):1731-1737.
[8] Guo Q,Jin J,Yuan JX,et al.VEGF,Bcl-2 and Bad regulated by angiopoietin-1 in oleic acid induced acute lung injury[J].Biochem Biophys Res Commun, 2011,413(4):630-636.
[9] Blondal T,Jensby NS,Baker A,et al.Assessing sample and miRNA profile quality in serum and plasma or other biofluids[J].Methods,2013,59(1): S1-S6.
[10] Fairfax KA,Gantier MP,Mackay F,et al.IL-10 regulates Aicda expression through miR-155[J].J Leukoc Biol,2015,97(1):71-78.
[11] Xie GB,Liu WJ,Pan ZJ,et al.Evolution of the mir-155 family and possible targets in cancers and the immune system[J].Asian Pac J Cancer Prev, 2014,15(18):7547-7552.
10.3969/j.issn.1009-4393.2016.30.007
吉林 135000 梅河口市中心医院儿科 (崔秀平) 梅河口市中心医院心内科(周子健)

