PEDV亚单位疫苗免疫增强剂的筛选
陈 瑾,黄春娟,于晓明,侯立婷,乔绪稳,郑其升,侯继波
(1.江苏省农业科学院,国家兽用生物制品工程技术研究中心,江苏 南京 210014;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
PEDV亚单位疫苗免疫增强剂的筛选
陈瑾1,2,黄春娟1,2,于晓明1,2,侯立婷1,2,乔绪稳1,2,郑其升1,2,侯继波1,2
(1.江苏省农业科学院,国家兽用生物制品工程技术研究中心,江苏 南京210014;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州225009)
摘要:为了研究PEDV的新型亚单位疫苗,提高PEDV亚单位疫苗的免疫原性,选取免疫增强剂CVC1302、CVC1303与国家兽用生物制品工程技术研究中心构建的可溶性表达PEDV S蛋白核心表位COE的重组蛋白(pQZ-COE-LTB)混合乳化制成疫苗,免疫4周龄的ICR小鼠,首免14 d后加免1次,随后采集首免14(加强免疫前),21,28,55 d的小鼠血清,分别用琼扩试验的方法定性检测血清IgG抗体以及用ELISA试剂盒定量检测小鼠血清IgG抗体滴度动态变化,肠组织sIgA抗体滴度。结果表明,重组蛋白与 CVC1303配合使用免疫小鼠能产生显著高于灭活苗(CV777)阳性对照组的IgG和sIgA抗体水平,说明CVC1303免疫增强剂能有效增强该重组蛋白的免疫原性,提高亚单位疫苗免疫效果。
关键词:猪流行性腹泻病毒;核心抗原表位;免疫增强剂;免疫效力
猪流行性腹泻是由猪流行性腹泻病毒(Porcineepidemicdiarrheavirus,PEDV)引起的以呕吐、腹泻脱水和对哺乳仔猪致死率高为特征的一种高度接触性猪肠道传染病,PEDV在全球很多地区普遍流行[1-3]。由于PEDV 具有难以适应细胞的培养特性,目前市场上针对该病的疫苗均为CV777毒株生产的灭活苗和弱毒苗。2011年该病再次在我国大规模流行,给养猪业造成严重的经济损失[4]。毒株的变异,特别是S基因的变异[5-6],现有疫苗不能提供足够的免疫保护是引起此次流行的主要原因。S蛋白是PEDV编码蛋白中的一种结构蛋白,它能把病毒粒子吸附在宿主细胞受体上,通过膜融合渗进细胞中,刺激宿主诱导产生中和抗体,具有PEDV抗原的作用。PEDV的核心表位(COE)存在于S蛋白的编码基因中,被认为是PEDV的亚单位疫苗的重要靶标抗原[7-10]。所以本试验针对PEDV的变异毒株,选取含有中和表位的S蛋白的COE区域,进行亚单位疫苗的设计,并选用实验室可溶性表达载体进行蛋白的可溶性表达,重组蛋白的可溶性表达方便后期蛋白的纯化,为快速研制高效、实用的PEDV新型疫苗奠定基础。
大肠杆菌不耐热性肠毒素(Heat-labile enterotoxin,LT)是一种由大肠杆菌分泌的热不稳定肠毒素,LT的B型亚单位(LTB)是其结合部位。LTB具有与LT相似的黏膜免疫原性和黏膜免疫佐剂活性[11-13],可在多种表达系统中表达[14],而且无致泻毒性,是黏膜疫苗研究的一个重要目标蛋白。综上所述,利用COE的核心表位和LTB的黏膜免疫佐剂,开发一种高效、安全、价廉的PEDV亚单位疫苗具有十分重要的现实意义。
免疫增强剂CVC1302(ZL201310042983.0)与CVC1303(2014105765620)是由国家兽用生物制品工程与技术研究中心猪用新型疫苗课题组自行研制,已经证明与多种猪用疫苗联用可以提高疫苗的免疫效果和抗体持续期,如猪圆环病毒、猪口蹄疫病毒、猪流行性腹泻病毒等。已在南京、丹阳、浙江等多家猪场进行推广试验,取得很好的效果。
本试验选取实验室原核表达的pQZ-COE-LTB/BL21蛋白,将PEDV的主要保护性抗原S基因中保守的中和表位区(COE基因)以Linker与大肠杆菌不耐热肠毒素B亚单位相连,克隆入原核表达载体pQZ,获得可溶性的重组蛋白。重组蛋白制苗后皮下免疫小鼠表现良好的免疫原性[15],首免14 d时就能高于灭活苗对照组的抵抗PEDV的免疫水平,但免疫持续期较短。本试验进一步筛选出能有效增强重组蛋白免疫原性的免疫增强剂,为PEDV新型疫苗的开发提供更好的选择和思路。
1材料和方法
1.1抗原、佐剂
PEDV灭活毒株CV777由国家兽用生物制品工程技术研究中心提供;佐剂为实验室自购的白油司本、吐温;免疫增强剂为CVC1302和CVC1303。
1.2主要试剂及仪器
PEDV ELISA抗体检测试剂盒购于哈尔滨动物生物制品国家工程技术研究中心有限公司;小鼠分泌型免疫球蛋白A(sIgA)酶联免疫检测试剂盒购于南京建成生物工程研究所;质粒提取试剂盒、胶回收试剂盒购于Axy GEN公司;限制性内切酶、T4DNA连接酶、PCR试剂、PMD-19-T vector、DH5α感受态细胞、DL Marker、10×Loading Buffer、6×SDS protein Loading Buffer及相关试剂购于TaKaRa公司;PVDF膜购于MILLIPORE公司;HRP标记羊抗猪二抗购于KPL公司;DAB显色液,HRP羊抗鼠二抗购于生兴公司;其他试剂均为分析纯。HZ-9210k型台式冷冻摇床为华利达公司产品;VCX800型超声破碎仪来自美国SONICS公司。
1.3抗原准备
1.3.1pQZ-COE-LTB/BL21质粒的构建选取PEDV TX株S蛋白COE (S基因的 499~638aa 区域)目标抗原,同时以Linker与大肠杆菌不耐热肠毒素B亚单位相连,克隆入原核表达载体pQZ,获得重组表达载体pQZ-COE-LTB。1.3.2pQZ-COE-LTB/BL21重组蛋白的表达诱导表达一批重组菌pQZ-COE-LTB/BL21,超声破碎,离心12 000 r/min 10 min,取上清液于-20 ℃保存备用。在制备疫苗前对上清液进行SDS-PAGE分析和Western Blot鉴定,确保上清液中存在精确的重组蛋白。
1.4疫苗制备
超声破碎后鉴定好的重组菌pQZ-COE-LTB/BL21上清液2份(前2份分别添加每头份量为0.5 μL的CVC1302和CVC1303)、PEDV灭活毒株CV777和空载体菌株pQZ/BL21为抗原,与白油佐剂1∶2混合乳化制苗(表1)。
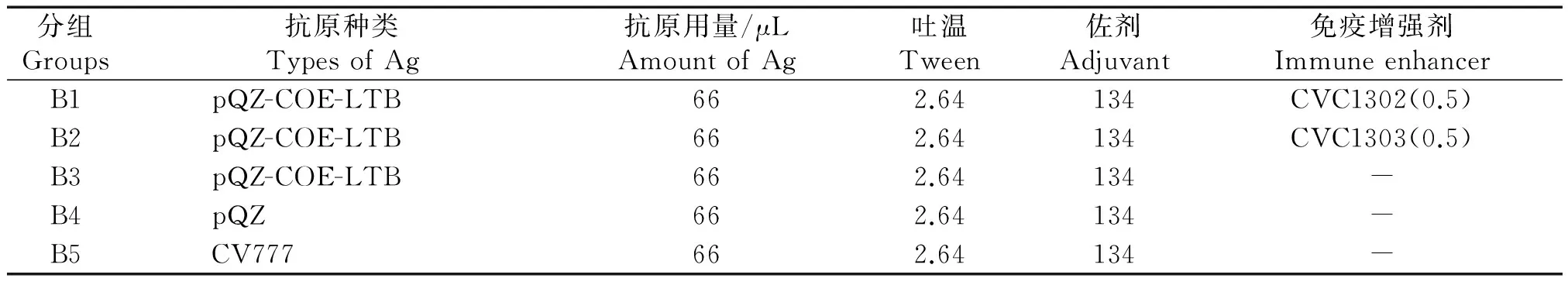
表1 疫苗的制备
1.5动物分组、免疫
从南京医科大学实验动物中心购入4 周龄ICR小鼠40 只。随机分为5 组,每组8 只,分别标记为B1、B2、B3、B4、B5组。B1组为重组蛋白与免疫增强剂CVC1302配合使用组;B2组为重组蛋白与免疫增强剂CVC1303配合使用组;B3组为单独用重组蛋白组;B4组为不含重组蛋白的空载体对照组;B5为CV777灭活苗阳性对照组。按0.2 mL/只的免疫剂量免疫4周龄的ICR小鼠,14 d后加免1次(表2)。
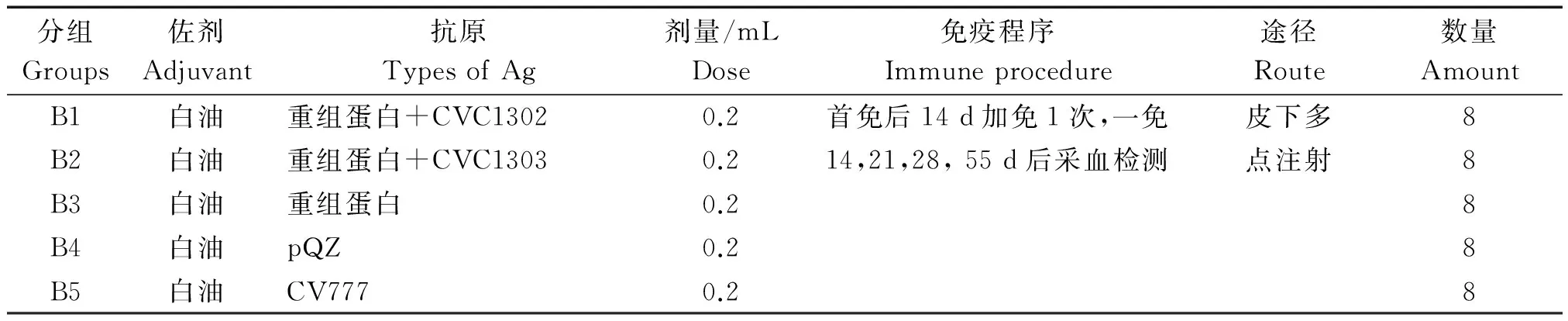
表2 试验动物分组及免疫
1.6血清IgG抗体定性检测
取首免后第21,28,55 天的小鼠血样,离心分离到的血清,保存于-20 ℃备用。取毒价为7.5的PEDV CV777病毒液作为抗原加入中央孔,试验动物组B1~B5组第21,28,55 天的血清混样作为待检样,PBS作为空白对照。将20 μL抗原加入中心孔,20 μL未经稀释的待检血清混样加入周围孔;待孔内液体渗入凝胶后置于湿盒中,再将湿盒置于37 ℃温箱中保温5~6 h,观察抗原抗体产生的白色沉淀线。
1.7血清IgG抗体动态变化检测
取首免后21,28,55 d的小鼠血样,离心分离到的血清,取每组的血清混样作为待检血清。用PEDV ELISA抗体检测试剂盒检测。
1.8肠组织sIgA抗体变化
捕杀首免55 d后小鼠,每只小鼠取0.2 g小肠组织于研钵中,向研钵中倒入液氮,冷冻研磨肠组织至粉末状后再次天平称重,按1∶10比例加入PBS混匀后离心,取同组上清液等比例混合做混样,作为待检样品用小鼠分泌型免疫球蛋白A(sIgA)酶联免疫检测试剂盒检测肠组织sIgA抗体滴度。具体操作步骤如下:使用前将试剂盒恢复至常温,对标准品按说明书要求稀释;根据待检样品数量加上标准品的数量决定所需板条数,每个标准品和空白孔做复孔;空白孔只加显色剂A&B和终止液,标准品孔加入50 μL标准品和50 μL链霉素-HRP,待检样品孔加入40 μL样品、10 μL抗-sIgA抗体和50 μL链酶亲和素-HRP,盖上封板膜,轻轻振荡混匀,37 ℃温育1 h;将30 倍浓缩洗涤液用蒸馏水30 倍稀释后备用;小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5 次,拍干;每孔先加入50 μL显色剂A,再加入50 μL显色剂B,轻轻振荡混匀,37 ℃避光显色10 min;每孔加50 μL终止液终止反应;以空白孔调零,450 nm波长依序测量各孔的OD值。测定应在加终止液后10 min内进行;根据标准品的浓度及对应的OD值计算出标准曲线的直线回归方程,再根据样品的OD值在回归方程上计算出对应的样品浓度。
2结果与分析
2.1抗原准备
2.1.1pMD-COE-LTB克隆载体酶切鉴定分别用NdeⅠ和BamHⅠ对构建的pMD-COE-LTB质粒进行双酶切,经1 %琼脂糖凝胶电泳鉴定,得到大小约为834 bp的片段,与预期结果一致。测序结果也表明插入序列与设计的序列100%相同,阅读框正确(图1)。
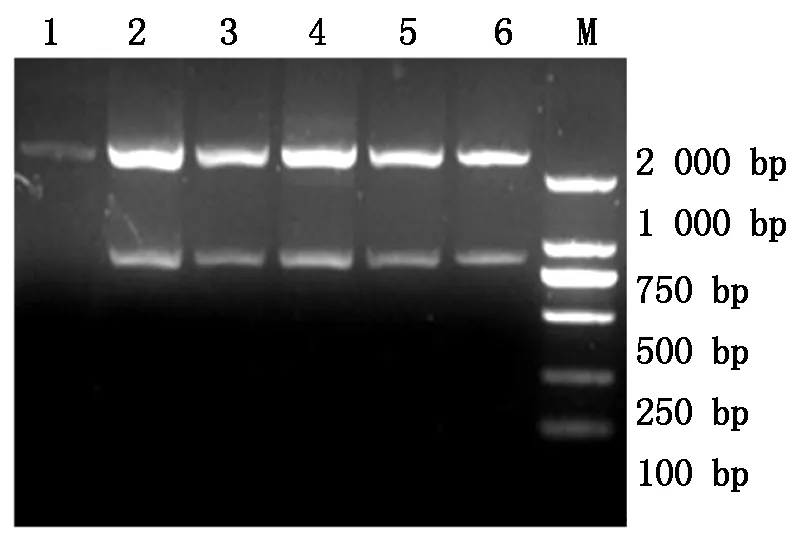
1.重组质粒对照;2~6.经 NdeⅠ和 BamHⅠ双
2.1.2pQZ-COE-LTB表达载体酶切鉴定构建的pQZ-COE-LTB质粒用NdeⅠ和BamHⅠ酶切,经1%琼脂糖凝胶电泳鉴定,得到大小约为834 bp的片段,与预期结果相符(图2)。
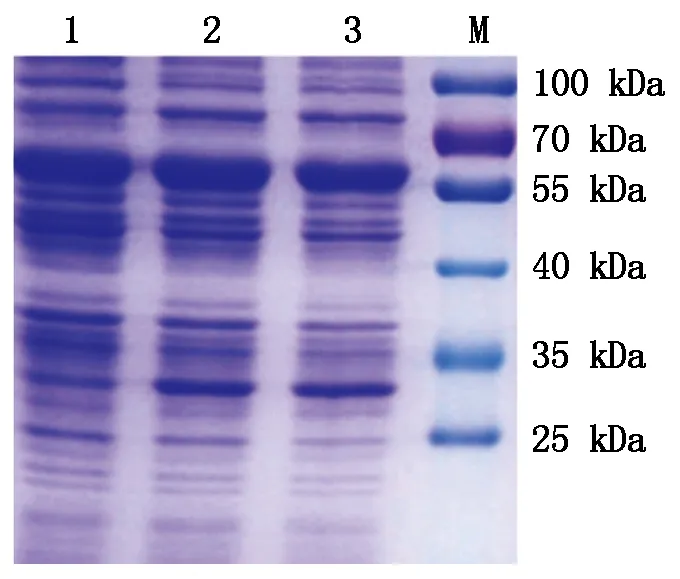
2.1.3重组蛋白表达及可溶性分析重组质粒pQZ-COE-LTB转化到宿主菌BL21中,通过诱导表达,经SDS-PAGE蛋白电泳分析,重组菌比对照菌pQZ/BL21明显多出1条条带,大小约为30 kDa,与预期设计相符合(图3)。
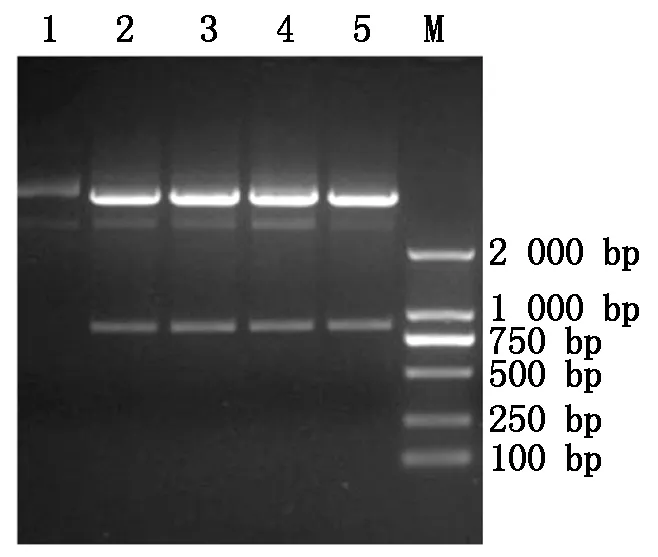
1.对照质粒pQZ-COE-LTB;2~5.经 NdeⅠand BamHⅠ
1.IPTG诱导的空菌 pQZ/BL21;2~3.IPTG
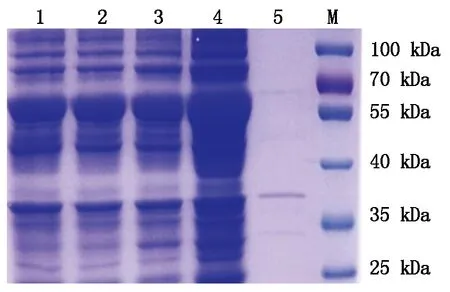
对经诱导表达的重组菌反复冻融后超声破碎,取pQZ/BL21菌,诱导前重组菌,诱导后全菌,破碎后上清和破碎后沉淀进行SDS-PAGE分析,结果诱导后全菌和破碎后上清中明显存在目的条带30 kDa,而沉淀中未出现目的条带(图4)。说明诱导表达到的pQZ-COE-LTB蛋白为可溶性蛋白。
2.1.4重组蛋白Western Blot鉴定取对照菌pQZ1/BL21和重组菌破碎后上清进行SDS-PAGE电泳后进行Western Blot鉴定。发现加含重组菌的上清样出现单一的特异性很强的条带,大小约为30kDa,而对照菌pQZ1/BL21未产生任何条带,与预期相符(图5)。说明重组蛋白获得表达,且该蛋白能被PEDV抗体特异性识别,具有较好的抗原性。
1.IPTG诱导的空菌 pQZ/BL21;2.未经IPTG诱导的
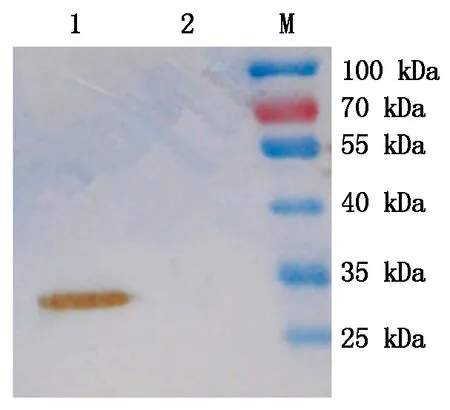
1.超声破碎后的pQZ-COE-LTB/BL21 上清;2.IPTG 诱导的
2.2琼扩试验定性检测血清IgG抗体
首免后第21 天,加有血清样品的孔均未产生白色免疫沉淀线(图6-A);28 d时,重组蛋白与CVC1303混合组和灭活苗(CV777)阳性对照组产生白色免疫沉淀线,且前者白色沉淀线更明显(图6-B);55 d时,同28 d时观察到的结果类似(图6-C)。

A,B,C.琼扩试验检测免疫后21,28,55 d血清。
2.3血清IgG抗体效价的变化
首次免疫后第14 天,重组蛋白+CVC1303组的血清IgG浓度(0.119±0.012 μg/mL)显著高于其他组(P<0.05),重组蛋白+CVC1302组(0.093±0.008 μg/mL)与重组蛋白组之间差异不明显,但这两者均显著高于CV777阳性对照组(0.059±0.003 μg/mL);首免后第21,28,55 天,重组蛋白+CVC1303组的血清IgG浓度均显著高于其他组(P<0.05)(图7)。
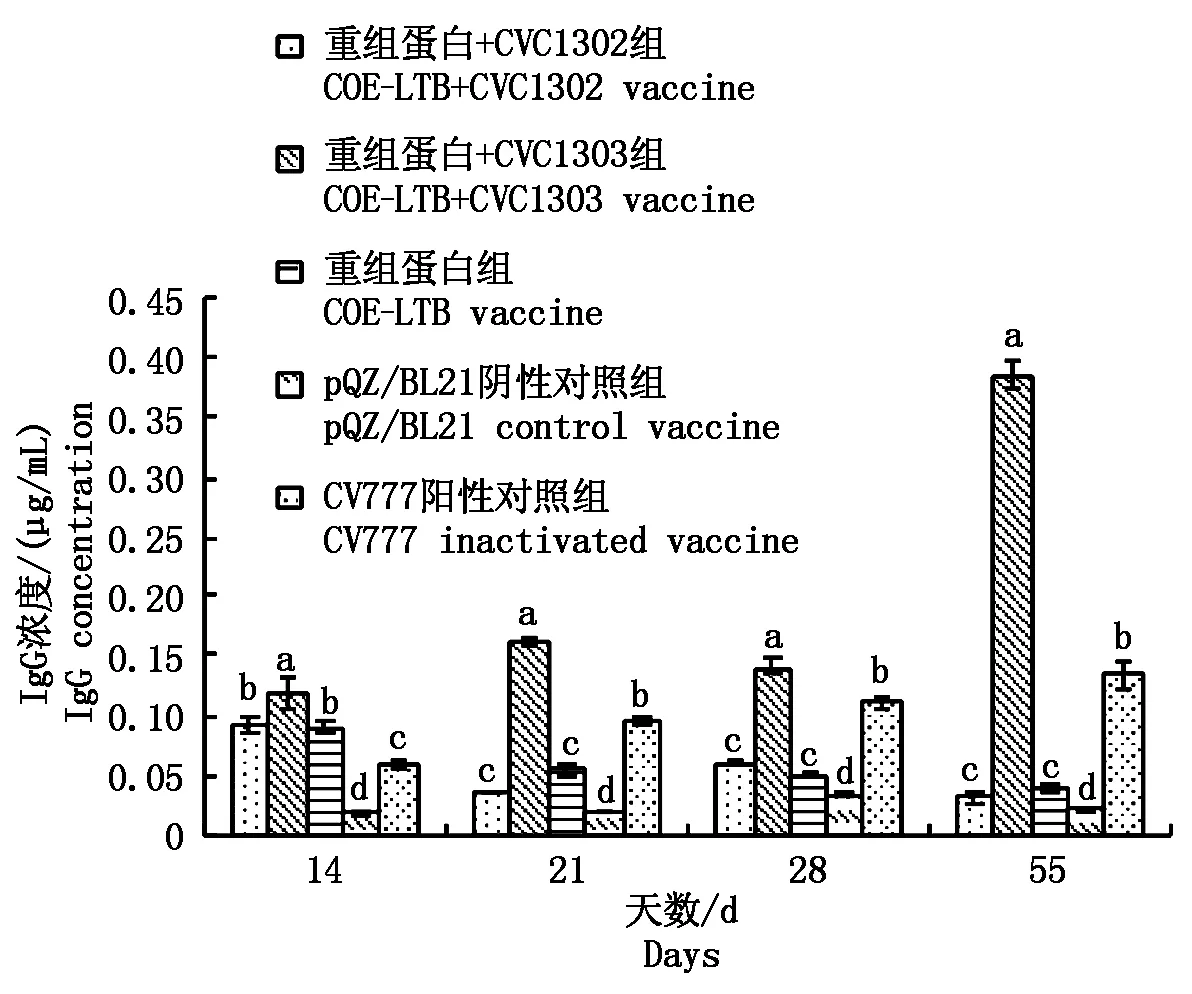
不同的字母表示存在显著性差异(P<0.05)。图8同。
2.4肠组织sIgA抗体的变化
首次免疫后第55 天扑杀小鼠,重组蛋白+CVC1303组的肠组织sIgA(387±11.032a)显著高于其他组(P<0.05);CV777阳性对照组(307.4±7.987b)显著高于重组蛋白+CVC1302组、重组蛋白组和阴性对照组(P<0.05);重组蛋白组(215.6±4.332c)与重组蛋白+CVC1302组差异不显著;重组蛋白+CVC1302(208.5±6.435c)组显著高于阴性对照组(130.5±8.003d)(P<0.05)(图8)。

图8 五组小鼠肠组织sIgA效价的变化
3讨论
亚单位疫苗以重组或纯化蛋白和合成肽为基础,与含有许多免疫成分的完整生物疫苗相比,反应原性低且免疫原性也很低,通常需要佐剂辅助来增强和引导亚单位疫苗特异性免疫。本试验利用大肠杆菌原核表达的蛋白,以可溶性存在,省去了对包涵体的处理要先变性溶解后再进行复性,才能得到溶解的具有活性的蛋白,且复性后蛋白活性容易降低[16],由于单独构建表达到的重组蛋白抗原免疫小鼠产生的免疫原性持续时间较短,选择合适的佐剂与重组蛋白合用就变得十分有意义。本试验成功筛选出免疫增强剂CVC1303,与重组蛋白配合免疫产生了非常有效的小鼠血清IgG抗体和小鼠黏膜sIgA抗体,能有效地增强抗原的全身局部黏膜反应,有效地增强了重组蛋白的免疫原性,为该亚单位疫苗进一步进行的猪体试验奠定了良好的基础。
近年来PEDV在我国流行趋势不减反增[17],目前预防PEDV感染主要采用的疫苗为灭活苗或弱毒疫苗。传统疫苗在防治PED时遇到的问题越来越多,现有灭活疫苗接种剂量大、成本高、免疫期短、细胞免疫作用弱、产生完全免疫力需2周,不能用于紧急预防,而弱毒疫苗存在成本高、易返祖、有潜在感染危险等缺陷,且随着2008年以后毒株的变异导致毒力增强,对仔猪致病力增强[18],现有常规疫苗不能对其产生足够的免疫保护。且PEDV病毒的细胞适应能力差,研究针对流行毒株的传统疫苗周期长。因此,研制新型的安全、有效果、成本低及保存使用方便的基因工程疫苗迫在眉睫。其中亚单位疫苗[19]不含病毒核酸等感染性组分,具有无需灭活、无致病性、安全性极高等优点,是PED 基因工程疫苗中最有前景的疫苗。本试验针对PEDV S蛋白的COE并进行密码子优化后用Linker连接[20-21]LTB构建的亚单位疫苗,在免疫增强剂的协同作用下,产生了比现有灭活疫苗更好的免疫效果,并筛选出能有效增强重组蛋白免疫原性的免疫增强剂CVC1303,可将重组蛋白与CVC1303有效结合开发出一种新型PEDV疫苗。
参考文献:
[1]朱迪国,宋建德,袁丽萍,等.2013-2014年全球猪流行性腹泻重大疫情分析[J].中国动物检疫,2014,31(10):42-46.
[2]Chen Q,Li G,Stasko J,et al.Isolation and characterization ofPorcineepidemicdiarrheavirusesassociated with the 2013 disease outbreak among swine in the United States[J].Journal of Clinical Microbiology,2014,52(1):234-243.
[3]Temeeyasen G,Srijangwad A,Tripipat T,et al.Genetic diversity of ORF3 and spike genes ofPorcineepidemicdiarrheavirusin Thailand[J].Infection,Genetics and Evolution:Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases,2014,21:205-213.
[4]李龙.2011年冬哺乳仔猪病毒性腹泻最新流行情况[J].养猪,2012,21(2):96-96.
[5]张志,董雅琴,刘爽,等.我国部分省份猪流行性腹泻的流行病学监测[J].中国动物检疫,2014,31(10):47-51.
[6]郑逢梅,霍金耀,赵军,等.2010-2012年华中地区猪流行性腹泻病毒分子特征和遗传进化分析[J].病毒学报,2013,29(2):197-205.
[7]Nguyen-Xuan Huy,Sae-Hae Kim,Moon-Sik Yang,et al.Immunogenicity of a neutralizing epitope fromPorcineepidemicdiarrheavirus:M cell targeting ligand fusion protein expressedin transgenic rice calli[J].Plant Cell Rep,2012,31(10):1933-1942.
[8]杨榕,顾超逸,李郁,魏建忠等.猪流行性腹泻病毒COE基因的原核表达和免疫原性分析[J].安徽农业大学学报,2013,40(6):955-958.
[9]满坤,杨兵,覃湘婕,等.猪流行性腹泻病毒中和抗原表位基因的原核表达、纯化及免疫原性鉴定[J].黑龙江畜牧兽医,2013,11:26-29.
[10]向敏,张洁,高其双,等.猪流行性腹泻病毒COE核酸疫苗的构建及免疫原性[J].中国兽医学报,2013,33(11):1627-1630.
[11]李鹏,王家乡,陈碧军.仔猪大肠杆菌病 K88-K99-987P-F41 四价亚单位疫苗的研制Ⅳ[J].疫苗生产与免疫效力试验,2006,27(9):55-58.
[12]Rosales-Mendoza S,Soria-Guerra R E,De Jesús Olivera-Flores M T,et al.Expression ofEscherichiacoliheat-labile enterotoxin b subunit(LTB)in carrot(DaucuscarotaL.)[J].Plant Cell Reports,2007,26(7):969-976.
[13]郭鹰,邹全明,朱永红,等.Balb/c小鼠口服幽门螺杆菌疫苗rLTB-HspA的免疫应答[J].免疫学杂志,2004,20(3):201-203,207.
[14]陈明,李超,王瑞,等.大肠杆菌不耐热肠毒素B亚单位在毕赤酵母中的表达及鉴定[J].西南农业学报2010,23(6):2093-2097.
[15]Ricci S,Medaglini D,Rush C M,et al.Immunogenicity of the B monomer ofEscherichiacoliheat-labile toxin expressed on the surface ofStreptococcusgordonii[J].Infect Immun 2000;68(2):760-766.
[16]霍军,宋予震,董青.猪流行性腹泻病毒流行毒株COE基因的原核表达及免疫原性分析[J]. 江苏农业科学,2014,42(9):34-36.
[17]李龙.2011年冬哺乳仔猪病毒性腹泻最新流行情况[J].养猪,2012,21(2):96.
[18]Park S,Kim H,Song D,et al.Molecular characterization and phylogenetic analysis ofPorcineepidemicdiarrheavirus(PEDV)field isolates in Korea[J].Archives of Virology,2011,156(4):577-585.
[19]焦茂兴,吴锋,刘德辉,等.猪流行性腹泻病毒重组腺病毒疫苗的构建及小鼠免疫试验[J].中国畜牧兽医,2012,39(2):11-16.
[20]Tae-Jin Kang,So-Chon Han,Moon-Sik Yang,et al.Expression of synthetic neutralizing epitope ofPorcineepidemicdiarrheavirusfused with synthetic B subunit ofEscherichiacoliheat-labile enterotoxin in tobacco plants[J].Protein Expression and Purification,2006,46(1):16-22.
[21]Tae-Jin Kang,Young-Sook Kim,Yong-Suk Jang,et al.Expression of the synthetic neutralizing epitope gene ofPorcineepidemicdiarrheavirusin tobacco plants without nicotine[J].Vaccine,2005,23(17-18):2294-2297.
Screening the Immune Enhancer ofPorcineepidemic
diarrheavirusSubunit Vaccine
CHEN Jin1,2,HUANG Chunjuan1,2,YU Xiaoming1,2,HOU Liting1,2,QIAO Xuwen1,2,ZHENG Qisheng1,2,HOU Jibo1,2
(1.Jiangsu Academy of Agricultural Sciences,National Research Center of and Technology Veterinary Biologicals Engineering,Nanjing210014,China;2.Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses,Yangzhou225009,China)
Abstract:This study successfully constructed pQZ-COE-LTB expression vector and expressed the soluble recombinant protein,which was chosen for PEDV subunit vaccine candidate.In order to enhance the immunogenicity of the PEDV subunit vaccine,we selected CVC1302 and CVC1303 as immune enhancer,combined with PEDV subunit vaccine.Immunize 4-week-old ICR mice,second immunize conducted after 14 d,then collected the 14,21,28,55 d mouse serum after first immune.Agar diffusion test and ELISA kits of detection of serum IgG antibody levels,intestinal tissue sIgA levels were conducted.The results showed that PEDV subunit vaccine combined with CVC1303 immune enhancer group produced significantly higher levels of IgG and sIgA antibodies than CV777 inactivated vaccine positive control group,indicating CVC1303 immune enhancer can effectively enhance the immunogenicity of the PEDV subunit vaccine.
Key words:PEDV;COE;Immune enhancer;Immunogenicity
doi:10.7668/hbnxb.2016.02.033
中图分类号:S858.28
文献标识码:A
文章编号:1000-7091(2016)02-0205-06
作者简介:陈瑾(1983-),女,黑龙江齐齐哈尔人,助理研究员,硕士,主要从事猪用型疫苗研究。通讯作者:郑其升(1979-),男,山东潍坊人,副研究员,博士,主要从事猪用新型疫苗研究。侯继波(1960-),男,山东德州人,研究员,博士,主要从事兽用生物制品研究。
基金项目:江苏省农业科技自主创新资金项目(CX(15)1062);公益性行业(农业)科研专项(201303046)
收稿日期:2016-02-18

