活性氧调控可溶性环氧化物水解酶表达增高在门静脉高压症大鼠体内的实验研究
施丹丽,秦骏,何越,罗蒙
(1.上海交通大学医学院附属第三人民医院 普通外科,上海 201999;2.上海交通大学医学院附属仁济医院 普通外科,上海 200011;3.上海交通大学医学院附属第九人民医院 普通外科,上海 200127)
活性氧调控可溶性环氧化物水解酶表达增高在门静脉高压症大鼠体内的实验研究
施丹丽1,秦骏2,何越2,罗蒙3
(1.上海交通大学医学院附属第三人民医院 普通外科,上海 201999;2.上海交通大学医学院附属仁济医院 普通外科,上海 200011;3.上海交通大学医学院附属第九人民医院 普通外科,上海 200127)
[摘 要]目的 明确活性氧(reactive oxygen species,ROS)是否可在肝硬化门静脉高压症大鼠肝外环境中调控可溶性环氧化物水解酶(soluble epoxide hydrolase,sEH)表达,验证sEH对这一疾病模型肠系膜血管中肌源性反应的影响。方法 利用多道生物分析仪分别测定正常对照组大鼠、实验对照组大鼠(四氯化碳处理)及NAPDH抑制剂夹竹桃麻素(apocynin,Apo)干预的处理组大鼠门静脉压力;免疫印迹分析3组大鼠肠系膜动脉组织sEH、ROCK及p-moesin蛋白表达水平的变化;血管灌流系统测定各组大鼠肠系膜动脉血管的肌源性反应。多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验。结果 (1)正常对照组、实验对照组和Apo处理组大鼠平均门静脉压力分别为(6.5±0.9)mmHg(1 mm Hg=0.133 kPa)、(15.9± 1.6)mmHg和(10.6±1.2)mm Hg,肝硬化门静脉高压症大鼠经Apo处理后,门静脉压力显著降低(P<0.05)。(2)与正常对照组比较,实验对照组大鼠肠系膜组织sEH蛋白表达水平明显增高(P<0.05),p-moesin表达显著降低(P<0.01),但Apo处理组sEH蛋白表达水平显著降低(P<0.05),p-moesin表达回复,但仍与正常对照组存在显著差异(P<0.05)。(3)肌源性收缩在实验对照组大鼠显著降低(P<0.05),经过Apo干预后,肌源性收缩改善,血管恢复收缩活性。结论 四氯化碳致肝硬化门静脉高压症大鼠肝外环境sEH表达增高,与活性氧含量相关。使用NAPDH特异性抑制剂去除活性氧后,sEH表达减低,血管肌源性反应恢复,提示在肝硬化门静脉高压症中限制sEH作用可作为缓解氧化应激外的另一治疗方向。
[关键词]肝硬化;高血压,门静脉;可溶性环氧化物水解酶;肌源性反应;大鼠
肝硬化门静脉高压症除肝内明显的肝纤维化作为该疾病的显著特征外,在肝外部分表现为全身高动力循环及氧化应激水平升高[1]。因肝内肝纤维化形成这一病理过程不可逆,因此改善肝外环境、缓解高动力循环从而降低门静脉压力正成为近年研究的重点。多项研究表明:某些疾病(糖尿病、高血压等)可使机体处于氧化应激状态的,同时机体sEH表达水平均增高[2-3],提示其在肝硬化门静脉高压症肝外也有增高的可能。另一方面,前研究已证实活性氧(reactive oxygen species,ROS)与门静脉高压症内脏血管收缩功能受损有关[4],但其具体机制仍处在探索阶段,抑制sEH可显著缓解高血压和肺动脉高压的发生发展[5],提示将其作为治疗靶点也有改善肝硬化门静脉高压症血管肌源性反应的可能。夹竹桃麻素(apocynin,Apo)为NADPH特异性抑制剂,可显著降低机体内活性氧的产生。ROCK以及p-moesin为常见的血管肌源性反应蛋白标记物[4],其表达水平降低则表明血管收缩反应性降低。本实验采用四氯化碳诱导肝硬化门静脉高压症大鼠模型,采用Apo干预抑制活性氧的产生,从而探讨sEH蛋白表达与门静脉高压症全身高氧化应激状态之间的联系,并检测血管肌源性反应活性相关蛋白,从而为临床通过肝外途径降低门静脉压力提供新的思路及理论依据。
1 材料和方法
1.1动物与试剂
体重为120~150 g雄性SD大鼠14只,由上海交通大学医学院实验动物中心提供。NADPH抑制剂Apo购自美国Santa Cruz公司。兔抗sEH单克隆抗体,兔抗ROCK单克隆抗体以及兔抗p-moesin单克隆抗体购自美国Abcam公司。抗兔抗体购自美国Cell Signaling Technology公司。RIPA裂解液,SDS上样缓冲液购自中国碧云天公司。蛋白酶抑制剂购自美国Roche公司。蛋白定量试剂购自美国Bio-Rad公司。血管灌流系统由美国纽约医学院生理教研室提供。
1.2动物模型制备与分组
根据文献[6]制备肝硬化门静脉高压症SD大鼠模型。正常组4只:雄性SD大鼠生理盐水4 μL/g肌肉注射,每周2次,共16周。实验对照组5只:雄性SD大鼠60%四氯化碳油溶液4 μL/g肌肉注射,每周2次,同时饮5%乙醇,共16周。Apo处理组5只:四氯化碳注射同实验对照组,自造模开始第12周,每日腹腔注射Apo 30 mg/kg。
1.3门静脉压力测定
大鼠停止注射四氯化碳或生理盐水1周后,禁食1 d,进行门静脉压力测定。腹腔注射3%戊巴比妥钠生理盐水溶液2 mL/kg进行麻醉,沿腹正中线作切口,暴露门静脉及其小肠系膜血管分支,18-GA导管肝素化后一端穿刺进入小肠系膜血管,并沿血管管腔将导管缓慢送入门静脉管腔中并固定。将18-GA导管另一端与多道生物换能器连接,平衡10 min数值稳定后,测得数值即为门静脉压力。
1.4免疫印记法检测蛋白表达
门静脉压力测定完成后,将大鼠肠系膜组织取出,4 ℃磷酸盐缓冲溶液中洗净后立即放入液氮中,后置于-80 ℃冰箱中保存。应用免疫印迹法检测肠系膜组织sEH,ROCK及p-moesin的表达。并用GAPDH作为内参照,采用美国Fusion公司数码成像分析系统对免疫印记结果进行定量分析。ROCK及p-moesin为公认的血管收缩功能相关蛋白,其在组织中表达情况可检测血管功能状态。
1.5血管灌流装置检测肠系膜动脉肌源性反应
测定门静脉压力后,切除肠系膜上动脉及相连肠系膜和肠管,置入MOPS生理缓冲液(0~4 ℃,pH= 7.4)中保存用于分离第3级微动脉。解剖显微镜下,在含有MOPS的血管分离槽内,锐性分离得到第三级肠系膜微动脉。将分离得到的肠系膜微动脉转移到含有PSS的血管灌流系统血管槽内,将玻璃微管(含有PSS顶端直径约50 μm)插人微动脉管腔的一端,并用11-0单股线结扎固定,以80 mmHg的灌注压冲洗出血管腔内的血液,并维持血管另一端的开放。然后,将另一玻璃微管插入血管管腔的另一端,同样以11-0线结扎固定。血管直径通过显微镜摄像系统显示于计算机显示屏上,其变化通过微动脉显像尺测定。血管在80 mmHg的管内压下,稳定30 min,记录基础状态的直径,并依次加大血管管腔内压力,分别记录不同压力下血管的收缩性,以收缩率(血管内径改变量占血管基础状态直径的百分比)为量化标准,绘制压力-收缩曲线。以收缩率作为纵坐标,以管腔内压力作为横坐标。
1.6统计学分析
2 结果
2.1大鼠门静脉压力检测
正常对照组、实验对照组和Apo处理组大鼠平均门静脉压力分别为(6.5±0.9)mmHg(1 mmHg=0.133 kPa)、(15.9±1.6)mmHg和(10.6±1.2)mmHg,肝硬化门静脉高压症大鼠经Apo处理后,门静脉压力显著降低,差异有统计学意义(P<0.05)。见图1。
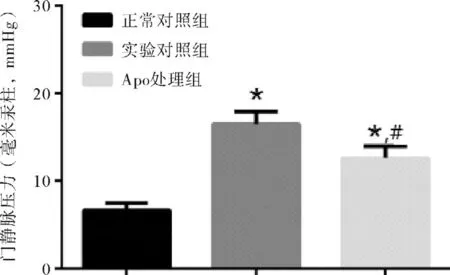
图1 三组大鼠门静脉压力变化
2.2大鼠肠系膜血管组织sEH蛋白表达变化
使用免疫印记法检测大鼠肠系膜组织中sEH蛋白表达变化。免疫印记法检测大鼠肠系膜组织sEH表达变化:与正常对照组比较,实验对照组大鼠肠系膜动脉sEH蛋白表达水平明显增高(P<0.05),Apo处理后,sEH蛋白表达显著降低(P<0.05),但仍高于正常对照组(P<0.05)。见图2。
2.3血管功能相关蛋白表达变化
Western blotting检测3组大鼠肠系膜动脉组织中ROCK及p-moesin蛋白表达水平的变化情况。(1)ROCK蛋白表达水平的变化:三组大鼠ROCK蛋白无明显变化,与前研究相吻合。(2)p-moesin蛋白表达水平的变化:与正常对照组比较,实验对照组大鼠肠系膜组织p-moesin蛋白表达水平明显降低(P<0.05),Apo处理组蛋白表达水平虽较实验对照组显著升高(P <0.05),但仍低于正常对照组(P<0.05),提示血管收缩功能部分恢复。见图3。
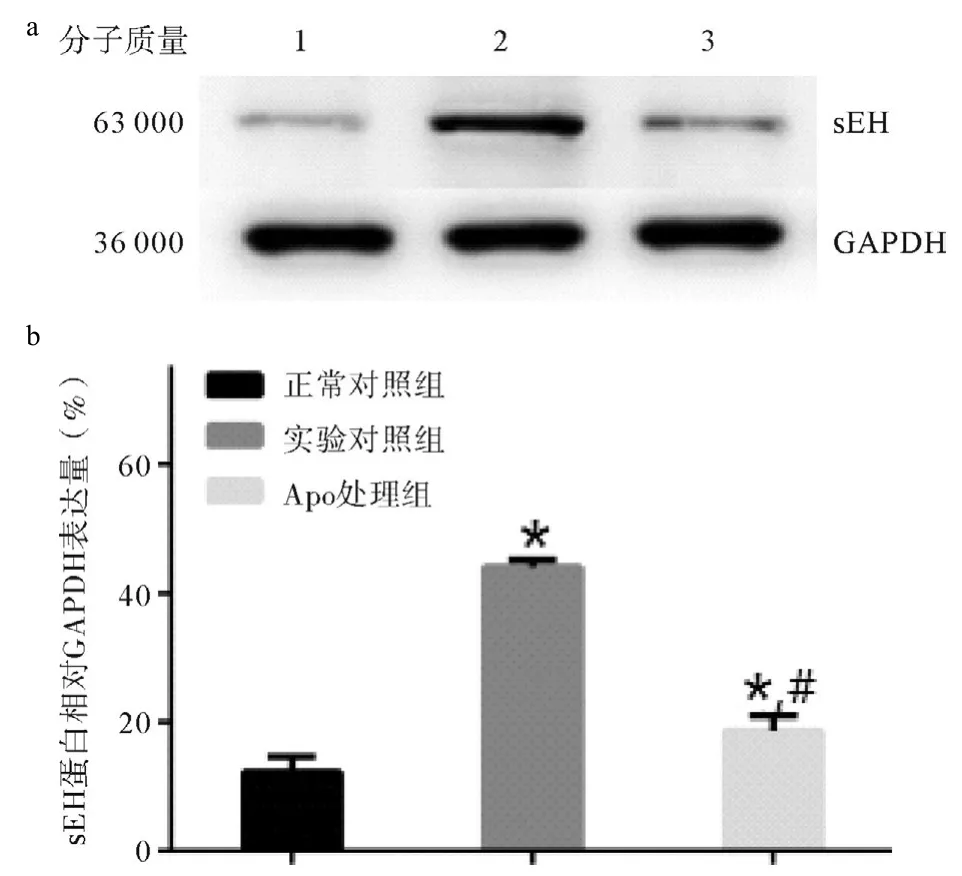
图2 三组sEH蛋白表达变化图
2.4三组大鼠肌源性反应
采用血管灌流系统检测3组大鼠肠系膜3级动脉的肌源性收缩,与正常对照组大鼠相比,肝硬化门静脉高压症大鼠肌源性反应均显著减弱(P<0.05);使用NADPH抑制剂后,肌源性反应恢复(P<0.05)。结果见图4。
3 讨论
在肝硬化门静脉高压症大鼠体内,氧化应激水平是增高的[7],表明有高于正常生理量的活性氧存在于机体内,但其在该疾病发生发展过程中的具体作用仍未探明。已有研究证实,过量的活性氧如过氧化氢在门脉系统内,可导致侧支循环产生,引起静脉曲张破裂等严重并发症[8],在肝外,可导致血管对缩血管物质的低反应性,导致内脏血管扩张,门静脉灌注增多,最终促进门静脉高压症的发生。本实验采用的NADPH抑制剂Apo,在之前其他疾病模型的研究中已证实可显著降低机体组织氧化应激水平,因此可以认为本实验中Apo治疗组大鼠机体氧化应激水平是降低的。
sEH可降解多种具有抗炎、抗氧化应激的脂类物质[10],提示其在氧化应激相关疾病发生发展的过程中具有重要作用,在高血压及糖尿病等动物疾病模型的研究中,抑制sEH可显著改善机体微血管功能[2-3],从而为相关疾病的治疗提供新的思路。我们的研究发现,sEH蛋白表达水平在肝硬化门静脉大鼠肠系膜微动脉显著升高,通过抑制NADPH活性后sEH蛋白表达水平降低,可以证明sEH在肝硬化门静脉高压症机体的高表达与氧化应激水平相关,且通过检测肌源性反应,证实活性氧可直接导致血管收缩功能受损,这一发现很好地完善了我们之前的研究结果[4],证实了氧化应激状态不仅会造成血管对缩血管物质的反应性减弱,其自身舒缩调节也会受到损害,为该疾病中活性氧的认识提供了新的视角和思考方向。
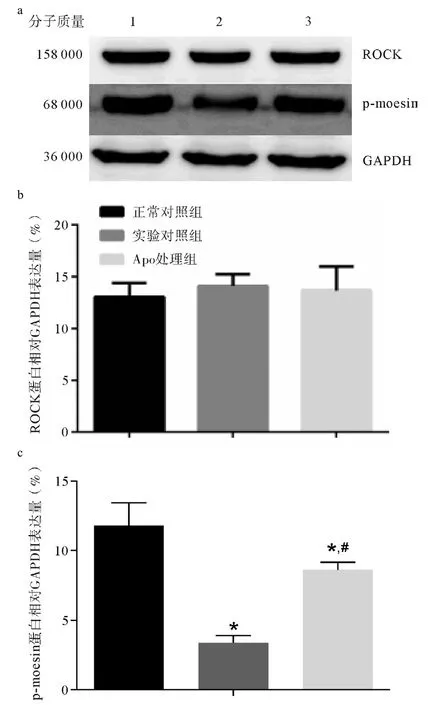
图3 三组血管功能相关蛋白表达变化图

图4 三组大鼠肠系膜动脉肌源性反应
在之后的研究中,我们将采用特异性sEH抑制剂,观察其是否具有与Apo类似的作用。考虑到活性氧在正常生理条件下为重要的细胞内第二信使,单纯地抑制其在门静脉高压症机体内的产生缺乏可靠的临床依据,而sEH已证实确与血管舒缩功能相关[11],且其特异性抑制剂已进入临床试验,若可在肝硬化门静脉高压症中也得到证实,则对该疾病治疗方式的发展有显著的开拓作用,具有深刻的实际意义。
参考文献:
[1] MARUYAMA H, YOKOSUKA O. Pathophysiology of portal hypertension and esophageal varices [J]. Int J Hepatol, 2012,2012: 895787-895787.
[2] LEE G-H, BHANDARY B, LEE E-M, et al. The roles of er stress and p450 2e1 in ccl4-induced steatosis [J]. Int J Biochem Cell Biol, 2011, 43(10): 1469-1482.
[3] PANIGRAHY D, KALISH B T, HUANG S, et al. Epoxyeicosanoids promote organ and tissue regeneration [J]. P Natl Acad Sci USA, 2013, 110(33): 13528-13533.
[4] CHEN W, LIU D-J, HUO Y-M, et al. Reactive oxygen species are involved in regulating hypocontractility of mesenteric artery to norepinephrine in cirrhotic rats with portal hypertension [J]. Int J Biol Sci, 2014, 10(4): 386-395.
[5] QIN J, SUN D, JIANG H, et al. Inhibition of soluble epoxide hydrolase increases coronary perfusion in mice [J]. Physiol Rep, 2015, 3(6), pil: e12427.
[6] 罗蒙, 陈炜, 秦骏, 等. 一氧化氮降低肝硬化门静脉高压症血管收缩反应性的实验研究 [J]. 中华消化外科杂志, 2013,12(3): 222-227.
[7] KISSELEVA T, BRENNER D A. Mechanisms of fibrogenesis [J]. Exp Biol Med, 2008, 233(2): 109-122.
[8] 段明, 何越, 陈炜, 等. 过氧化氢在门静脉高压症大鼠侧支循环建立中的作用 [J]. 肝胆胰外科杂志, 2015, 27(1): 22 -25.
[9] ANGERMAYR B, MEJIAS M, GRACIA-SANCHO J, et al. Heme oxygenase attenuates oxidative stress and inflammation, and increases vegf expression in portal hypertensive rats [J]. J Hepatol, 2006, 44(6): 1033-1039.
[10] STABLES M J, GILROY D W. Old and new generation lipid mediators in acute inflammation and resolution [J]. Prog Lipid Res, 2011, 50(1): 35-51.
[11] SIRISH P, LI N, LIU J-Y, et al. Unique mechanistic insights into the beneficial effects of soluble epoxide hydrolase inhibitors in the prevention of cardiac fibrosis [J]. Proc Natl Acad Sci U S A, 2013, 110(14): 5618-5623.
(本文编辑:鲁翠涛)
·论著 基础研究·
Experiment on ROS-induced soluble epoxide hydrolase in rats with portal hypertension
SHI Dan -li1, QIN Jun2, HE Yue2, LUO Meng3.1Department of General Surgery, Shanghai 3rdPeople’s Hospital Affiliated to School of Medicine, Shanghai Jiaotong University, Shanghai 201999, China;2Department of General Surgery, Renji Hospital Affiliated to School of Medicine, Shanghai Jiaotong University, Shanghai 200011, China;3Department of General Surgery, the 9thPeople’s Hospital Affiliated to School of Medicine, Shanghai Jiaotong University, Shanghai 200127, China
AbstractObjective To investigate the mechanism of reactive oxygen species (ROS) in the regulation of soluble epoxide hydrolase (sEH) in portal hypertensive rats, and to verify the influence of sEH on myogenic response. Methods Portal pressure was measured in normal rats group, carbon tetrachloride treated rats group,as well as rats group treated with NAPDH inhibitor. The protein expression levels of sEH, ROCK and p-moesin in mesenteric arteries tissues of rats in 3 groups were determined by Western-blotting. Myogenic response was detected by vascular perfusion system. All data was analyzed by variance or LSD-t test. Results (1)The portal pressures of the normal control group, experimental control group and Apo-treated group were (6.5±0.9) mmHg,(15.9±1.6) mmHg and (10.6±1.2) mmHg, respectively, with a significant difference among the 3 groups (F=96.5,P<0.05). (2)Compared with the normal control group, the protein expression level of sEH in mesenteric arteries of the experimental control group was significantly increased (P<0.05), while it decreased in the Apo-treated group (P<0.05). (3)The myogenic response in portal hypertensive rats was attenuated significantly and revivedbook=198,ebook=27after Apo treatment. Conclusion Apo can reduce the sEH levels in the mesenteric arteries, which suggests that sEH is regulated by ROS. Down-expression of sEH can be the future aim to cure the damaged myogenic response in portal hypertension.
Key wordsliver cirrhosis; portal hypertension; soluble epoxide hydrolase; myogenic response; rats
[通讯作者简介]罗蒙,主任医师,博士,E-mail:luotysy@sina.com。
[第一作者简介]施丹丽(1981-),女,上海人,主治医师。
[基金项目]国家自然科学基金项目(81370548)。
[收稿日期]2015-11-25
[中图分类号]R657.3+4
[文献标识码]A
DOI:10.11952/j.issn.1007-1954.2016.03.006

