轻链沉积病患者临床病理特征
李晓梅 谌达程 梁丹丹 徐峰 梁少姗 朱小东 张明超 黄湘华 刘志红 曾彩虹
·论著·
轻链沉积病患者临床病理特征
李晓梅 谌达程 梁丹丹 徐峰 梁少姗 朱小东 张明超 黄湘华 刘志红 曾彩虹
目的:阐明轻链沉积病(LCDD)患者的临床病理特征、预后及其相关危险因素。方法:回顾分析LCDD患者的临床、病理及随访资料,应用Kaplan-Meier法分析肾脏存活率,COX回归模型分析预后危险因素。结果:观察45例LCDD患者,肾活检时平均年龄50.8岁,男∶女1.6∶1。11例(24.4%)患者同时确诊多发性骨髓瘤(MM)。患者高血压、贫血、肾功能不全、尿蛋白定量≥3.5 g/24h和镜下血尿的发生率分别为80.0%、95.6%、95.6%、44.4%和82.2%。血清单克隆免疫球蛋白条带阳性者为26.2%,血清轻链κ/λ>1.65者占84.4%,31.1%为显著异常(>8),33.3%患者补体C3降低。80%的患者组织学改变为肾小球结节样病变,20%为肾小球轻至中度系膜增生,53.3%患者肾小管间质慢性病变重度,77.8%患者光镜下存在轻链相关动脉病变。免疫荧光提示κ轻链沉积占93.3%,沿肾小管和肾小球基膜线样分布,系膜区团块状分布。5例患者失随访,余40例患者平均随访22.1个月,共26例(65.0%)进入ESRD,平均肾脏存活时间为33.8月。单因素和多因素COX回归分析显示,肾活检时血清肌酐(SCr)、尿视黄醇结合蛋白(RBP)是进展至ESRD的重要危险因素,未发现其他临床及病理指标与肾脏预后相关。结论:LCDD多发于中年男性,临床表现高血压、蛋白尿、肾功能不全、贫血,血清轻链比值异常较血清免疫固定电泳是更为敏感的诊断提示。肾小球结节病变、肾小管基膜增厚,电子致密物沿肾小球基膜内侧缘和肾小管基膜外侧缘沉积是主要病理表现。轻链沉积以κ型为主。LCDD患者预后差,SCr、RBP是影响预后的独立危险因素。
轻链沉积病临床特点病理特征预后
轻链沉积病(LCDD)是由于单克隆免疫球蛋白轻链异常产生,并沉积于全身组织而导致的一种系统性疾病,常继发于浆细胞增生性疾病及淋巴瘤等[1]。LCDD与重链沉积病(HCDD)和轻重链沉积病(LHCDD)统称为单克隆免疫球蛋白沉积病(MIDD)[2]。LCDD最为常见,肾脏为其最常见的受累器官,国外研究显示,LCDD临床表现重、预后差,早期诊断积极治疗可提高患者生存率[3]。我国随着人平均寿命的延长,浆细胞增生性疾病的发生率有升高趋势,因此,了解我国LCDD患者的临床病理、预后特征及预后相关因素,对早期诊断、提高诊治水平具有重要意义。
对象和方法
病例选择LCDD诊断标准:(1)免疫荧光见单克隆轻链κ或λ沿肾小管基膜和(或)肾小球基膜线样沉积,无重链沉积;(2)电镜下肾小管基膜外侧缘和(或)肾小球基膜内侧缘泥沙状电子致密物沉积;(3)刚果红染色阴性。排除合并骨髓瘤管型肾病及肾淀粉样变性者,骨髓瘤诊断参照文献[4]。共45例患者符合上述标准入选。
相关定义收集患者的性别、年龄、临床及实验室资料。肾病范围蛋白尿:尿蛋白定量≥3.5 g/24h;肾功能不全:血清肌酐(SCr)>106.08 mmol/L;高血压:收缩压>140 mmHg,舒张压>90 mmHg,或持续抗高血压药物治疗;低蛋白血症:白蛋白<35 g/L。贫血:Hb男性<120 g/L,女性<110 g/L。异常血清游离轻链比值:κ/λ<0.26或>1.65;显著异常血清游离轻链比值:κ/λ<0.125或>8[3];尿视黄醇结合蛋白(RBP)升高:>0.5 mg/L;终末期肾病(ESRD):SCr>530.4 μmol/L或eGFR(EPI)<15 ml/min或接受肾脏替代治疗>3月。
肾脏病理肾活检标本分送光镜、免疫病理及电镜检查。肾小管间质半定量分级,以病变占皮质间质的面积定义:无病变(0),轻度(1%~25%),中度(26%~50%),重度(>50%)。
统计学方法采用SPSS 17.0统计软件进行数据分析。计量资料以均数±标准差或中位数(范围)表示,计数资料以百分比表示。肾脏生存率分析应用Kaplan-Meier法,肾脏生存相关危险因素分析采用COX回归模型。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结果
流行病学资料及临床特点南京军区南京总医院肾脏科2004年1月至2014年5月行自体肾活检患者共42 457例。排除1例LCDD合并骨髓瘤管型肾病患者,本研究共纳入单纯LCDD患者45例,占自体肾活检的0.106%。2004年~2008年17例(0.112%),2009年~2014年28例(0.103%)。同期诊断重链沉积病19例(0.045%)[5],轻-重链沉积病4例(0.009%)[6]。45例单纯LCDD患者肾活检时临床资料见表1。Pearson相关分析发现,尿轻链比值与血轻链比值具有相关性(r=0.652,P<0.001)。
肾组织形态学特点
光镜LCDD患者组织学特点见表2。光镜下,36例(80.0%)患者表现为肾小球结节病变(其中1例患者4/20个肾小球为结节病变,余肾小球呈缺血皱缩状),结节大小形态较均一,结节中心少细胞或无细胞增生,PAS染色强阳性(图1A),PASM-Masson染色结节不嗜银或嗜银性减弱。部分结节明显膨胀,挤压外周袢,致袢腔狭小、闭锁,亦见系膜溶解及外周袢融合扩张,呈假血管瘤样改变,其中部分见内皮细胞损伤,伴纤维素样渗出,外周袢无明显僵硬和增厚,有时伴扭曲。余9例(20.0%)患者为非结节型,为肾小球轻~中度系膜增生。所有患者均见肾小管间质慢性化病变,53.3%为重度病变。肾小管基膜增厚,呈PAS强阳性,有时扭曲呈绸带状,银染色下基膜外侧见不嗜银性物质,有的呈分层状改变。35例(77.8%)患者亦见轻链相关的肾小动脉病变,表现为血管平滑肌细胞之间见PAS强阳性物质分布,PASM-Masson染色为弱嗜银性棕色物质,平滑肌细胞胞质减少。

表145 例轻链沉积病患者的临床特点
免疫荧光单一轻链沿肾小管基膜线样沉积,93.3%为κ轻链,6.7%为λ轻链。66.7%患者同时伴单一轻链呈线状沉积于肾小球毛细血管袢,35.6%呈团块状沉积于肾小球系膜区(图1B)。33.3%患者伴有补体C3沉积,多呈团块状沉积于系膜区,少数沉积血管袢,5例(11.1%)伴有补体C1q沉积肾小球系膜区。11例患者包囊壁亦见相应轻链沉积。24例患者观察到血管壁上相应轻链沉积。

图1A:肾小球结节样病变,结节大小形态较均一,其中心少细胞增生,PAS染色强阳性(PAS,×400);B:κ轻链沿肾小球毛细血管袢及肾小管基膜呈线样沉积,团块状沉积于肾小球系膜区,血管壁亦见相应轻链阳性沉积(IF,×200)
超微结构所有患者均在电镜下观察到肾小管基膜(TBM)明显增厚、分层,见泥沙状电子致密物沉积于TBM外侧缘,呈连续性或不连续性分布。部分肾小管上皮细胞从TBM剥脱。1例患者电镜取材无肾小球,余44例患者见肾小球基膜(GBM)内侧缘(91.1%)和系膜区(34.1%)电子致密物沉积(图2A)。28例(62.2%)患者存在肾小球内皮细胞损伤,表现为内皮细胞肿胀,从GBM剥脱,内皮下区域疏松增宽,偶见纤维蛋白分布。24例(54.5%)患者足突融合>50%。各13例患者见包囊壁和血管平滑肌之间电子致密物沉积(图2B),其他病变还包括灶性细胞浸润和肾小管炎,间质胶原纤维明显增多等(表2)。
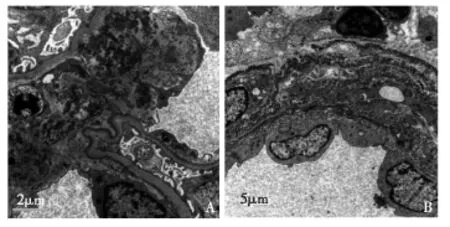
图2A:肾小球基膜内侧缘、系膜区泥沙状电子致密物沉积;B:血管平滑肌之间见电子致密物沉积(EM)
随访情况5例患者肾活检后即失随访。余40例患者平均随访22.1个月,中位随访6月,随访中共26例(65.0%)达ESRD,平均和中位肾脏存活时间分别为33.8±5.37月和18月。9例患者(20.0%)肾活检时已开始透析,随访时间短(<4月)。随访的40例患者,8例未接受化疗,其中6例(75.0%)进入ESRD。32例接受化疗,19例(59.4%)进入ESRD。化疗方案包括:TD(沙利度胺+地塞米松)方案18例,MTD(马法兰+沙利度胺+地塞米松)方案3例,BD(硼替佐米+地塞米松)方案2例,VAD(长春新碱+阿霉素+地塞米松)方案2例,MP(马法兰+泼尼松)方案1例,单用马法兰1例,美罗华+环磷酰胺+长春瑞宾方案1例。3例患者在我院BD方案后又行自体干细胞移植(SCT)(随访时间分别为8个月,22个月,20个月),1例患者化疗及SCT均在外院进行(随访37个月)。4例患者平均随访时间22个月,均未进入ESRD。

表245 例轻链沉积病患者肾活检组织学特点
单因素COX回归分析显示,SCr(P=0.005)、尿RBP(P<0.001)是进展至ESRD的重要危险因素,未发现其他临床及病理指标与肾脏预后相关。进一步将P<0.1的变量纳入多因素COX回归模型,显示SCr(P=0.011)(HR,1.321;95%CI,1.066~1.636)、RBP(P=0.049)(HR,1.029;95%CI,1.000~1.058)是进展至ESRD的独立危险因素。采用ROC曲线评价SCr对患者进入ESRD的预测价值,最佳截断值为296.1 μmol/L,将最佳截断值设为265.2 μmol/L(无敏感性及特异性降低),发现SCr<265.2 μmol/L者预后明显优于≥265.2 μmol/L的患者(P=0.001)(图3)。
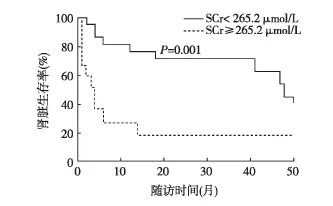
图3 轻链沉积病患者肾脏不同血清肌酐(SCr)水平的预后比较
讨论
本研究是目前国内最大系列关于LCDD临床病理及预后的报道。LCDD占同期肾活检比例为0.106%,接近Lin等[7]报道(0.17%),低于Nasr等[3]报道(0.7%)。本研究与国外报道LCDD患者比较,临床特点相似,多于中年起病,平均年龄为51岁,男性略多见。高血压、蛋白尿(肾病范围)及肾功能不全的发生率相似,>90%的患者肾活检存在肾功能不全,且肾功能损伤严重(表3)[3,7-9]。
LCDD属浆细胞异常增生性疾病,除严重的肾损害外,血液系统损害也尤为显著,表现为贫血发生率较高(本研究达95.6%),但平均血红蛋白下降多为轻度(本研究91 g/L,Nasr等[3]研究为102 g/L)。LCDD患者继发于MM的比例(24.4%)明显低于国外研究(58%~65%)。而且血清游离κ/λ轻链比值异常、显著异常及血清单克隆条带阳性的发生率也明显低于Nasr等[3]的报道,提示我国LCDD患者浆细胞异常增生程度较轻,但血清游离轻链和血清免疫固定电泳检测仍不失为提示诊断的重要手段。相较于血清免疫固定电泳,本研究和Nasr等[3]的研究均提示血清游离轻链检测敏感性更高,临床应重视开展血清游离轻链的检测。Dispenzieri等[10]研究显示,尿游离轻链与血清游离轻链检测结果无相关性,认为尿游离轻链检测对MM及相关疾病诊断意义不大,但本研究发现两者相关性显著(r=0.652,P<0.001),由于尿游离轻链检测留取方便,对LCDD的诊断作用应受临床重视。
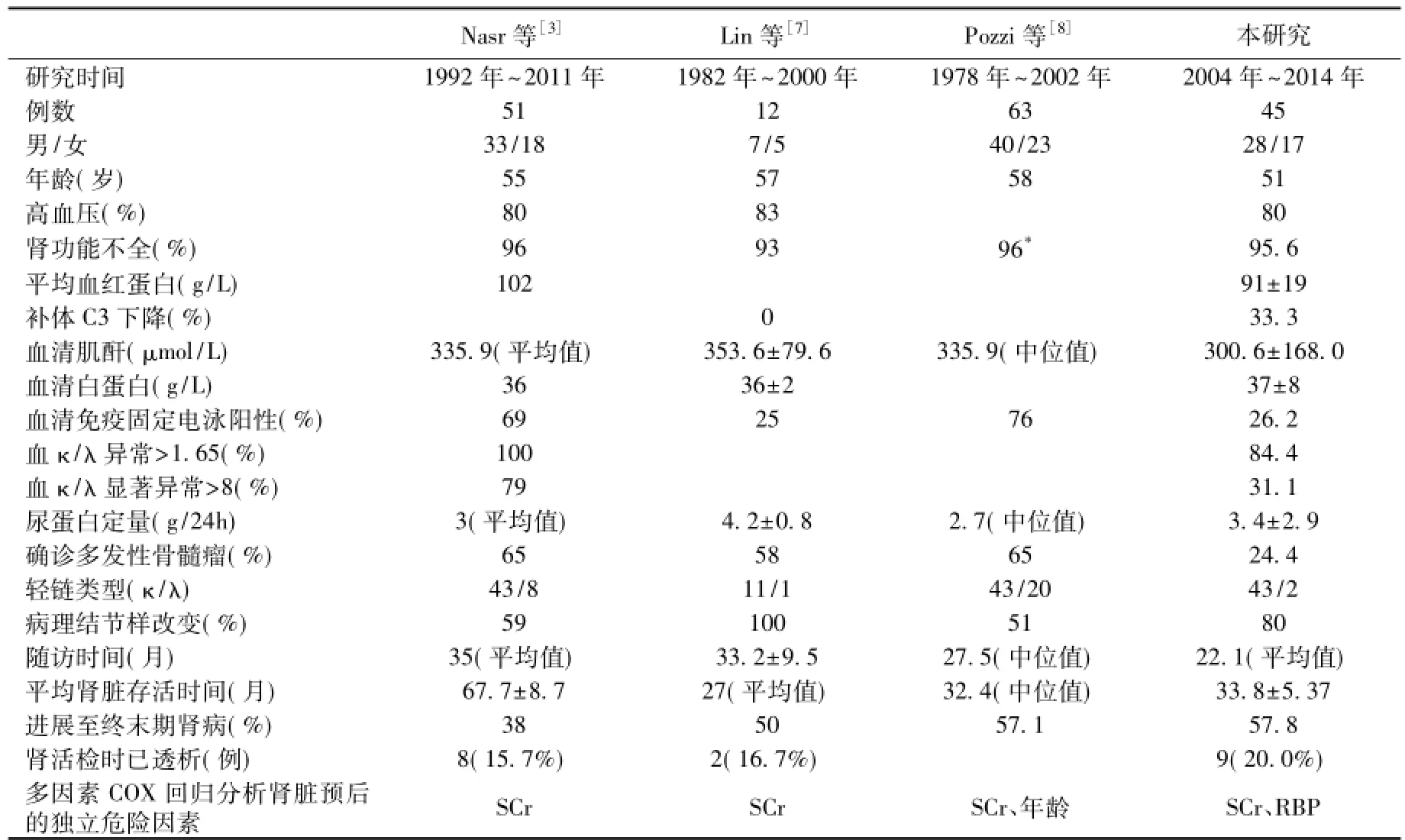
表3 轻链沉积病临床病理特点及预后比较
关于LCDD患者低补体血症的报道较少,补体主要通过结合于抗原抗体复合物的重链恒定区,通过经典途径活化补体,而既往认为游离轻链很弱或无抗原结合能力,故其补体激活能力较弱[11]。本研究发现LCDD补体C3下降的发生率达33.3%。推测游离轻链导致补体活化可能,并非通过经典途径直接激活,更可能是通过间接机制抑制补体调节蛋白(如H因子等),导致补体旁路途径的激活,致补体C3的沉积及血清补体下降[12]。Soma等[13]报道并总结12例HCDD患者补体C3下降发生率较高达66.7%,且补体C3的减低与重链亚型相关,可能机制是γ重链Fc段与C1q结合(经典途径)导致了补体的活化。
LCDD的典型光镜改变为肾小球结节样病变,本研究其发生率达80%,国外文献在51%~100%[3,7-8],少数报道为30%左右[14]。非结节病变患者为不同程度的肾小球系膜增生性病变。虽然LCDD的特征性病变是肾小球结节性病变,但TBM飘带样增厚、基膜PAS强阳性和不嗜银也是其重要特征,尤其对非结节病变者是提示诊断的重要病变。此外血管平滑间PAS阳性和不嗜银的物质沉积也是提示LCDD诊断的重要动脉病变,病理医师应加以重视,行轻链染色,以避免漏诊。
虽然LCDD光镜和轻链荧光染色具有特征性改变,但确诊还需电镜检查,即存在肾小管基膜外侧缘和肾小球基膜内侧缘泥沙样电子致密物沉积。尤其前者在LCDD患者阳性率达100%,后者为91.1%,而阴性者多为肾小球缺血皱缩所致。此外本研究还发现肾小球电子致密物沉积与免疫荧光存在不一致性,15例患者电镜下肾小球基膜内侧缘见泥沙状状电子致密物沉积,但免疫荧光为阴性,可能因沉积于基膜内侧的轻链被修饰致其抗原决定簇被掩盖,或因电子致密物沉积少,免疫荧光难以检出[15-16]。2例患者免疫荧光轻链肾小球血管袢和系膜区均阳性,电镜观察肾小球内未见电子致密物,可能原因在于轻链沉积物与基膜的密度相同而难以被发现[17],或因取材肾小球有关。而TBM免疫荧光轻链染色阳性与电镜下TBM电子致密物沉积完全一致。
LCDD患者临床表现重,预后差。>90%的LCDD患者肾活检时出现肾功能不全,甚至需要透析(16%~20%)。表3显示Lin等[7]、Pozzi等[8]和本研究平均肾存活时间和进展为ESRD患者比例接近,但明显差于Nasr等[3]的报道,这可能与后者研究中患者早期诊断并接受新的化疗方案包括自体干细胞移植有关。近期多项回顾性研究发现,大剂量化疗联合SCT能明显改善LCDD的预后[18-20]。本研究患者多采用TD方案,选用BD方案者均为近期确诊的患者,其对预后的影响尚需更长随访来观察。而4例接受了BD+SCT治疗的患者平均随访22.1个月,尿检缓解,肾功能改善。
已往研究发现肾活检时SCr是LCDD患者肾脏预后的独立危险因素,而肾活检病理学指标与预后无相关性,这在本研究中再次得到证实。本研究还首次发现尿RBP也是LCDD患者肾脏预后的独立危险因素。既往研究发现尿RBP与血BUN、SCr[21-22]及尿本周蛋白水平[23]相关,联合这些指标有助于识别早期肾脏损害,并提出早期肾脏损害是病情进展的高危因素。结合本研究,可见RBP可以作为LCDD患者肾脏预后评估的一项重要指标。
本项研究尚存在一定局限性:(1)为回顾性研究,少部分患者资料收集不全,随访时间、治疗不统一,对预后的评判存在局限性;(2)由于冰冻和电镜组织因取材少,有时无法取到血管,或荧光观察时对血管的忽略,使轻链在血管沉积的发生率得不到准确反映;(3)仍有部分患者未接受血清免疫固定电泳和尿轻链的检测。
小结:LCDD多发于中年男性,临床以高血压、蛋白尿、贫血及肾功能不全为主要表现。血清轻链的检测较血清免疫固定电泳更为敏感,且血、尿轻链检测具有相关性,两者对LCDD的诊断均有重要意义。肾脏病理以结节性肾小球病变及κ轻链沉积为主,TBM增厚,GBM内侧缘和TBM外侧缘沉积为特点。LCDD预后差,肾活检时SCr水平及RBP是影响肾脏预后的独立危险因素。
1Randall RE,Williamson WC Jr,Mullinax F,et al.Manifestations of systemic light chain deposition.Am J Med,1976,60(2):293-299.
2Ronco PM,Alyanakian MA,Mougenot B,et al.Light chain deposition disease:a model of glomerulosclerosis defined at the molecular level.J Am Soc Nephrol,2001,12(7):1558-1565.
3NasrSH,ValeriAM,CornellLD,etal.Renalmonoclonal immunoglobulin deposition disease:a report of 64 patients from a single institution.Clin J Am Soc Nephrol,2012,7(2):231-239.
4International Myeloma Working Group.Criteria for the classification of monoclonal gammopathies,multiple myeloma and related disorders:a report of the International Myeloma Working Group.Br J Haematol,2003,121(5):749-757.
5范芸,徐峰,陈浩,等.重链沉积病的临床病理特点.肾脏病与透析肾移植杂志,2013,22(3):230-237.
6梁少珊,曾彩虹.肾脏轻-重链沉积病.肾脏病与透析肾移植杂志,2013,22(1):90-94.
7LinJ,MarkowitzGS,ValeriAM,etal.Renalmonoclonal immunoglobulin deposition disease:the disease spectrum.J Am Soc Nephrol,2001,12(7):1482-1492.
8Pozzi C,D'Amico M,Fogazzi GB,et al.Light chain deposition disease with renal involvement:clinical characteristics and prognostic factors.Am J Kidney Dis,2003,42(6):1154-1163.
9Ronco P,Plaisier E,Mougenot B,et al.Immunoglobulin light(heavy)-chain deposition disease:from molecular medicine to pathophysiologydriven therapy.Clin J Am Soc Nephrol,2006,1(6):1342-1350.
10 Dispenzieri A,Kyle R,Merlini G,et al.International myeloma working group guidelines for serum-free light chain analysis in multiple myeloma and related disorders.Leukemia,2009,23(2):215-224.
11 Nakano T,Matsui M,Inoue I,et al.Free immunoglobulin light chain: its biology and implications in diseases.Clin Chim Acta,2011,412 (11-12):843-849.
12 Sethi S,Rajkumar SV.Monoclonal gammopathy-associated proliferative glomerulonephritis.Mayo Clin Proc,2013,88(11):1284-1293.
13 Soma J,Sato K,Sakuma T,et al.Immunoglobulin gamma3-heavy-chain depositiondisease:reportofacaseandrelationshipwith hypocomplementemia.Am J Kidney Dis,2004,43(1):E10-16.
14 Gokden N,Barlogie B,Liapis H.Morphologic heterogeneity of renal light-chain deposition disease.Ultrastruct Pathol,2008,32(1):17-24.15 HerreraGA,SandersPW,ReddyBV,etal.Ultrastructural immunolabeling:a unique diagnostic tool in monoclonal light chainrelated renal diseases.Ultrastruct Pathol,1994,18(4):401-416.
16 Herrera GA.Light chain deposition disease(nodular glomerulopathy,kappa light chain deposition disease):a case report.Ultrastruct Pathol,1994,18(1-2):119-126.
17陈惠萍,曾彩虹,尹广.浆细胞病的肾损害——轻链沉积病.肾脏病与透析肾移植杂志,1997,6(5):486-490.
18 Hassoun H,Flombaum C,D'Agati VD,et al.High-dose melphalan and auto-SCT in patients with monoclonal Ig deposition disease.Bone Marrow Transplant,2008,42(6):405-412.
19 Kastritis E,Migkou M,Gavriatopoulou M,et al.Treatment of light chaindepositiondiseasewithbortezomibanddexamethasone.Haematologica,2009,94(2):300-302.
20 Lorenz EC,Gertz MA,Fervenza FC,et al.Long-term outcome of autologous stem cell transplantation in light chain deposition disease.Nephrol Dial Transplant,2008,23(6):2052-2057.
21 Corso A,Serricchio G,Zappasodi P,et al.Assessment of renal function in patients with multiple myeloma:the role of urinary proteins.Ann Hematol,1999,78(8):371-375.
22 Corso A,Zappasodi P,Pascutto C,et al.Urinary proteins in multiple myeloma:correlationwithclinicalparametersanddiagnostic implications.Ann Hematol,2003,82(8):487-491.
23 Madalena L,Facio ML,Angerosa M,et al.Urinary excretion of low molecular weight proteins in patients with pure monoclonal light chain proteinuria.J Nephrol,2007,20(6):683-688.
Clinico-pathologic features in Chinese patients with light chain deposition disease
LI Xiaomei,CHEN Dacheng,LIANG Dandan,XU Feng,LIANG Shaoshan,ZHU Xiaodong,ZHANG Mingchao,HUANG Xianghua,LIU Zhihong,ZENG Caihong
National Clinical Research Center of Kidney Disease,Jinling Hospital,Nanjing University School of Medicine,Nanjing 210016,China Corresponding author:ZENG Caihong(E-mail:zengch_nj@hotmail.com)
Objective:To explore the clinico-pathologic features and prognosis in Chinese patients with light chain deposition disease(LCDD).Methodology:Forty five patients with LCDD fulfilled the inclusion criteria were recruited this retrospective study.Their clinical,pathologic and follow-up data were collected and analyzed.Kaplan-Meier estimate and Cox regression were used in the analysis of renal survival and prognostic factors respectively.Results:They were 28 males and 17 females with a mean age of 50.8 years old,and male/female ratio was 1.6∶1.11 patients were simultaneously diagnosed as multiple myeloma(MM).In clinical findings,hypertension was presented in 80.0%of cases,renal insufficiency in 95.6%,anemia in 95.6%,nephrotic-range proteinuria(≥3.5 g/24h)in 44.4%and microhematuria in 82.2%.Monoclonal Ig was detected in 26.2%of cases by serum immunofixation electrophoresis(sIFE).Serum free light chain(FLC)ratio was abnormal(κ/λ>1.65)in 84.4%of cases,and was markedly abnormal(κ/λ>8)in 31.1%.33.3%of patients had hypocomplementemia C3.In histopathological observation,80.0%of patients showed glomerular nodular lesions and the remaining patients(20.0%)displayed mild to moderate mesangial proliferation.Severe tubular atrophy and interstitial fibrosis were found in 53.3%of patients.77.8%of cases had light chain related arteriole lesion on light microscopy.Immunofluorescence revealed deposits of light chain(95.6%κ light chain)linear along the GBMs and TBMs.A total of 40 patients had followed-up for a mean time of 22.1 months,and 26 patients developed to ESRD.The mean renal survivals were 33.8 months.Univariate and multivariate COX analysis indicated the serum creatinine(SCr)(P=0.005)and the level of urinary retinol binding protein(RBP)(P<0.001)at renal biopsy predicting prognosis.Other clinical and histopathologic parameters did not correlate with renal survival.Conclusion: LCDD was more prevalent in middle-aged males and manifested by renal dysfunction,hypertension,anemia,abnormal serum FLC ratio,nephrotic proteinuria and microhematuria.The common pathologic features were deposition of κ light chain,nodular lesion,severe tubular-interstitial lesions and electron dense deposition along inner GBM and out layer TBM.LCDD patients had worse renal survival,and the independently prognostic factors were SCr and RBP.
light chain deposition diseaseclinical-pathologic characteristicsprognosisprognostic factors
2015-04-14
(本文编辑莫非凡心)
10.3969/cndt.j.issn.1006-298X.2016.01.001
国家科技支撑计划课题(2013BAI09B04,2015BAI12B05),江苏省临床医学科技专项(BL2012007)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科硕士研究生(李晓梅),国家肾脏疾病临床医学研究中心全军肾脏病研究所(南京,210016)
曾彩虹(E-mail:zengch_nj@hotmail.com)
2016年版权归《肾脏病与透析肾移植杂志》编辑部所有

