低氧运动对营养性肥胖大鼠骨骼肌PGC-1α及其下游因子的影响
吴菊花,杨亚南,翁锡全,徐国琴,林文弢3(.上海体育学院 运动科学学院,上海 00438;广州体育学院 省重点生化实验室,广东 广州 50500)
低氧运动对营养性肥胖大鼠骨骼肌PGC-1α及其下游因子的影响
吴菊花1,杨亚南2,翁锡全2,徐国琴2,林文弢123
(1.上海体育学院 运动科学学院,上海 200438;2广州体育学院 省重点生化实验室,广东 广州 510500)
摘 要:探讨低氧运动对营养性肥胖大鼠骨骼肌PGC-1α及其下游因子的影响。构建7周高脂膳食诱导SD大鼠营养性肥胖模型,建模后随机分为常氧高脂膳食安静组(NHQ)、常氧高脂膳食运动组(NHE)、16.3%低氧高脂膳食安静组(HGQ1)、16.3%低氧高脂膳食运动组(HGE1)、13.3%低氧高脂膳食安静组(HGQ2)、13.3%低氧高脂膳食运动组(HGE2),每组各10只。运动组进行8周耐力训练,即20 m/min、40 min/d,5 d/周。末次运动24 h后处死大鼠并采样,测定血脂4项和血糖(BG),qRT-PCR技术检测PGC-1α及其下游因子的表达(CPT-1、MCAD、PPARγ)。结果显示:1)7周高脂膳食可成功诱导营养性肥胖大鼠模型建立;2)与NHQ和HGQ1组相比,HGE1、HGE2 和NHE组体质量下降非常显著或显著(P<0.01或P<0.05);与NHE组相比,HGE1和HGE2组体质量显著性下降(P<0.05);3)与NHQ组相比,NHE组MCAD mRNA表达非常显著性上调(P<0.01);HGE1组PGC-1α、MCAD、PPARγ mRNA表达非常显著性增加或显著性增加(P<0.01或P<0.05);HGQ2组PGC-1α mRNA表达非常显著性上调(P<0.01);HGE2组PGC-1α 、MCAD、CPT-1、PPARγ mRNA表达非常显著性上调或显著性上调(P<0.01或P<0.05)。与NHE组相比,HGE1和HGQ2 组PGC-1α mRNA表达显著性增加(P<0.05);HGE2组PGC-1α 、MCAD、CPT-1、PPARγ mRNA表达非常显著性上调或显著性上调(P<0.01或P<0.05);NHQ、HGQ1和HGQ2组MCAD mRNA表达非常显著性下降或显著性下降(P<0.01或P<0.05)。与HGQ1组相比,HGE1和HGQ2组PGC-1α、MCAD表达非常显著性上调或显著性上调(P<0.01或(P<0.05);HGE2组PGC-1α、MCAD、CPT-1 mRNA表达非常显著性上调(P<0.01);NHE组MCAD、PPARγ mRNA表达非常显著性或显著性增加(P<0.01或P<0.05)。结果表明:(1)长期高脂膳食可诱导营养性肥胖发生。(2)低氧和(或)耐力运动可有效控制营养性肥胖大鼠体质量,增加骨骼肌PGC-1α及其下游基因的表达,13.3%低氧浓度下耐力运动效果较佳。
关 键 词:运动生物化学;低氧运动;营养性肥胖;骨骼肌;过氧化物酶体增殖物受体γ共激活分子;大鼠
生活水平提高和饮食习惯改变,营养性肥胖比例逐渐升高,而肥胖伴随机体脂代谢紊乱、胰岛素抵抗等不良病征,已逐渐成为威胁人类健康的重要因素之一。骨骼肌作为机体重要运动器官,是能量代谢重要场所,其代谢稳态是维持骨骼肌健康乃至整个机体健康的基本前提与重要保证[1]。当骨骼肌中脂肪供给与氧化代谢不均衡时,脂肪代谢异常往往会导致骨骼肌中脂代谢紊乱,发生胰岛素抵抗现象。路瑛丽等[2]揭示低氧运动对肥胖大鼠骨骼肌脂肪酸氧化相关基因表达的良性影响。过氧化物酶增殖物受体γ共激活分子(PGC-1α)表达于骨骼肌、心肌、肝脏、棕色脂肪组织等能量代谢活跃的组织[3],可调节线粒体生物发生、调控适应性产热、调控骨骼肌细胞内脂肪氧化累积等生理过程[4]。骨骼肌中肉毒碱棕榈酰转移酶1(CPT-1)和中链酰基辅酶A脱氢酶(MCAD)是调控脂肪酸合成或氧化的代谢关键酶,也是调控长链脂肪酸进入线粒体的重要酶,在脂肪酸氧化中起着重要作用,而PGC-1α可以调控CPT-1及MCAD表达[5-6]。过氧化物酶增殖物受体γ(PPARγ)介导的基因转录参与脂肪细胞分化、糖脂代谢等生理调控过程,而PGC-1α作为其转录辅激活因子,可辅助激活PPARγ的基因表达,骨骼肌糖脂代谢中发挥作用[7]。目前,在常氧状态下,耐力运动对高脂膳食大鼠骨骼肌中PGC-1α促进脂肪酸氧化作用已有所证实[8]。然而,低氧或(和)耐力运动是否影响高脂膳食大鼠骨骼肌中PGC-1α及其下游因子的表达,目前尚未见报道。本实验通过高脂膳食诱导生长期大鼠营养性肥胖模型并对其进行不同浓度低氧及运动干预,探讨不同低氧浓度及运动对大鼠骨骼肌中PGC-1α及其下游因子在其脂肪酸氧化过程的影响,旨在为代谢性疾病的低氧运动防治提供理论参考和实验依据。
1 材料与方法
1.1 营养性肥胖大鼠建模及低氧运动干预分组
1)营养性肥胖大鼠建模。
清洁级健康雄性SD大鼠(SCXK(粤)2011-0015)100只,由南方医科大学实验动物中心提供,体重170~220 g。动物分笼饲养,5只/笼,自然光照节律,自由摄食、饮水,温度22~24 ℃,湿度40%~55%,普通膳食为国家标准啮齿类动物干燥饲料(南方医科大学动物实验中心提供);高脂膳食:蔗糖20%、猪油15%、胆固醇1.2%、胆酸钠0.2%、酪蛋白10%、磷酸氢钙0.6%、石粉0.4%、预混料0.4%、基础饲料52.2%(均为质量分数)(广东省医学实验动物中心提供,SCXK(粤)2013-0002),高脂膳食供能比:蛋白质17.5%,脂肪37%,碳水化物45.5%(质量分数)。大鼠随机分为普通膳食组(CON,20只)和高脂膳食造模组(DIO,80只)。根据肥胖易感模型筛选规律,高脂膳食组大鼠的体重超过普通膳食组大鼠体重的20%即可作为营养性肥胖大鼠[9]。持续性喂养7周后,从CON组和DIO组分别随机挑选10只和18只,眼眶取血,测其血糖、血脂,结合大鼠体重、BMI,进而评价造模效果。
2)低氧运动干预分组。
营养性肥胖大鼠模型建立成功后的60只大鼠分为6组:常氧高脂膳食安静组(NHQ)、常氧高脂膳食运动组(NHE)、16.3%低氧高脂膳食安静组(HGQ1)、16.3%低氧高脂膳食运动组(HGE1)、13.3%低氧高脂膳食安静组(HGQ2)、13.3%低氧高脂膳食运动组(HGE2),每组10只持续干预8周,均进行高脂膳食饲养,运动组则进行8周跑台耐力训练,适应性1周后,均以20 m/min,40 min/d,5 d/周,跑台坡度为0%,进行耐力运动。末次训练24 h后处死大鼠,大鼠主动脉取血,3 000 r/min离心15 min,取血清;另取一侧腓肠肌置液氮速冻,均于-80 ℃超低温冰箱长期保存,待测。
1.2 血脂、血糖测定
半自动生化仪测定血脂四项(南京建成公司试剂盒):总胆固醇(COD-PAP法)、高密度脂蛋白(磷钨酸镁沉淀法)、低密度脂蛋白(聚乙烯硫酸沉淀法)、甘油三酯(GPO-PAP法)。京都血糖仪测定血糖含量(京都血糖试纸)。
1.3 实时荧光定量PCR测定PGC-1α及其下游基因表达
Trizol 法提取骨骼肌组织总RNA。取1 μg总RNA用TaKaRa公司的PrimeScript TM逆转录试剂盒进行逆转录反应获得cDNA,使用SYBR GreenⅠ荧光染料,实时荧光定量PCR(ABI 7500 型荧光定量PC R仪,美国)测定PGC-1α、CPT-1、MCAD、PPARγ mRNA表达量。扩增条件为:预变性每10 min 95 ℃;每30 s 95 ℃,60 ℃退火1 min(PGC-1α、MCAD、PPARγ和GAPDH)、CPT-1 58 ℃退火1 min,共40个循环。以GAPDH作为内参,计算目的基因的相对表达量( 对照组的倍数) 。利用Primer 5软件设计引物,由上海生工生物公司合成的引物序列见表1。

表1 qRT-PCR引物序列
1.4 数据统计
各检测数据录入Excel 2007,结果用平均数±标准差(±s),GraphPad Prism 5进行数理统计及图像生成,SPSS17.0软件进行多因素方差分析,两组之间进行独立样本t检验,以P〈0.05为差异显著性水平,P〈0.01为差异非常显著性水平。
2 实验结果及分析
2.1 高脂膳食诱导营养性肥胖大鼠模型建立
7周高脂膳食饲养后,DIO组大鼠较CON组体质量、体长、BMI均非常显著性增加(P〈0.01,见表2)。

表2 7周末两组大鼠体质量、体长和BMI比较
与CON组相比,DIO组大鼠血糖(Blood Glucose,以下简称BG)、总胆固醇(Total Cholesterol,TC)、低密度脂蛋白(Low Density Lipoprotein Cholesterol,LDL-c)均非常显著性增加(P〈0.01),甘油三脂(triglyceride,TG)显著性增加(P〈0.05)(见表3),而高密度脂蛋白(High Density Lipoprotein Cholesterol,HDL-c)无显著变化,仅略有降低。7周内两周大鼠摄食量并未有显著性差异(见表4)。
表3 两组大鼠血脂及血糖浓度(±s)比较 mmol/L

表3 两组大鼠血脂及血糖浓度(±s)比较 mmol/L
1)与CON组相比,P<0.05;2)与CON组相比,P<0.01
组别 n/只 BG TC TG HDL-c LDL-c CON 10 2.960±0.360 1.282±0.308 0.608±0.175 0.538±0.141 0.371±0.174 DIO 18 4.572±0.8342) 1.583±0.3492) 0.936±0.2201) 0.428±0.175 0.528±0.1072)
表4 建模期两组大鼠摄食量(±s)比较1) g
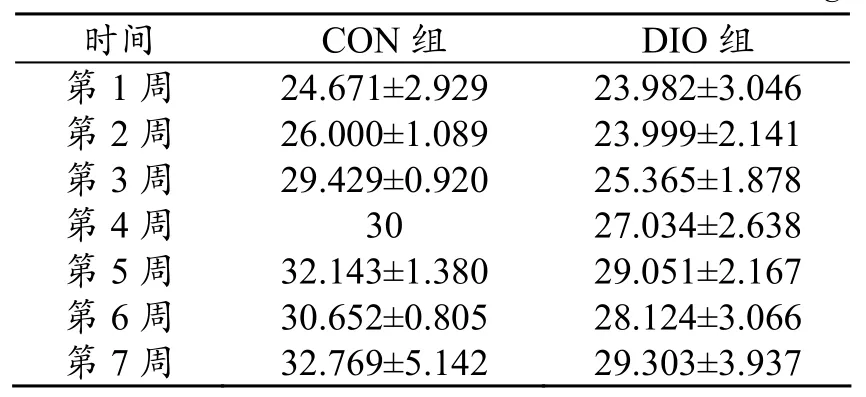
表4 建模期两组大鼠摄食量(±s)比较1) g
1)建模期两组大鼠摄食量无显著性差异
时间 CON组 DIO组第1周 24.671±2.929 23.982±3.046 第2周 26.000±1.089 23.999±2.141 第3周 29.429±0.920 25.365±1.878 第4周 30 27.034±2.638 第5周 32.143±1.380 29.051±2.167 第6周 30.652±0.805 28.124±3.066 第7周 32.769±5.142 29.303±3.937
综上,7周高脂膳食饲养后,DIO组大鼠形态学变化表现为体质量、BMI、体长显著高于CON组,且体质量增长超过CON组大鼠20%;血液生化相关指标表现为BG、TC、LDL-c含量非常显著性增加;两组大鼠摄食量无显著性差异,提示高脂膳食诱导的营养性肥胖大鼠模型建立成功[10]。
2.2 低氧运动干预对营养性肥胖大鼠体重的影响
与NHQ组和HGQ1组相比,营养性肥胖大鼠在低氧运动干预下,HGE1组和HGE2组大鼠体质量均非常显著性下降(P〈0.01),NHE组体质量显著性下降(P〈0.05);与NHE组相比,HGE1组和HGE2组大鼠体质量均显著下降(P〈0.05)。从第2周开始,低氧结合运动对大鼠体质量控制显著优于常氧运动组大鼠(P〈0.05)(见表5)。
表5 干预8周各组大鼠体质量(±s)比较 g
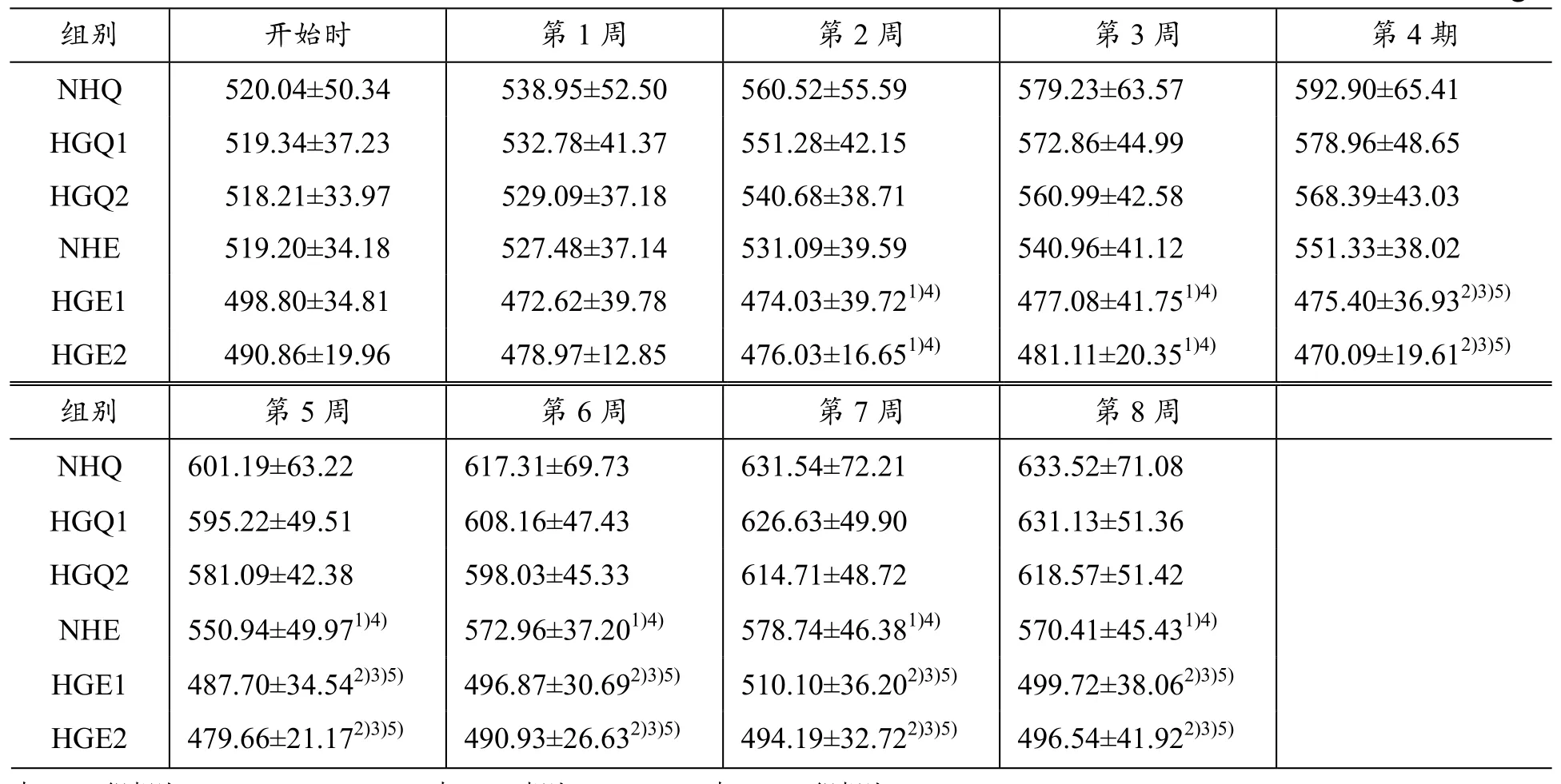
表5 干预8周各组大鼠体质量(±s)比较 g
与NHQ组相比,1)P〈0.05;2)P〈0.01;与NHE相比;3)P〈0.05;与HGQ1组相比;4)P〈0.05;5)P〈0.01
组别 开始时 第1周 第2周 第3周 第4期NHQ 520.04±50.34 538.95±52.50 560.52±55.59 579.23±63.57 592.90±65.41 HGQ1 519.34±37.23 532.78±41.37 551.28±42.15 572.86±44.99 578.96±48.65 HGQ2 518.21±33.97 529.09±37.18 540.68±38.71 560.99±42.58 568.39±43.03 NHE 519.20±34.18 527.48±37.14 531.09±39.59 540.96±41.12 551.33±38.02 HGE1 498.80±34.81 472.62±39.78 474.03±39.721)4) 477.08±41.751)4) 475.40±36.932)3)5)HGE2 490.86±19.96 478.97±12.85 476.03±16.651)4) 481.11±20.351)4) 470.09±19.612)3)5)组别 第5周 第6周 第7周 第8周NHQ 601.19±63.22 617.31±69.73 631.54±72.21 633.52±71.08 HGQ1 595.22±49.51 608.16±47.43 626.63±49.90 631.13±51.36 HGQ2 581.09±42.38 598.03±45.33 614.71±48.72 618.57±51.42 NHE 550.94±49.971)4) 572.96±37.201)4) 578.74±46.381)4) 570.41±45.431)4)HGE1 487.70±34.542)3)5) 496.87±30.692)3)5) 510.10±36.202)3)5) 499.72±38.062)3)5)HGE2 479.66±21.172)3)5) 490.93±26.632)3)5) 494.19±32.722)3)5) 496.54±41.922)3)5)
2.3 低氧运动干预对营养性肥胖大鼠骨骼肌组织中PGC-1α及其下游因子基因表达的影响
1)与NHQ组相比,HGE1组、HGQ2组和HGE2组大鼠PGC-1α mRNA表达上调非常显著(P〈0.01);NHE组和HGE2组大鼠MCAD mRNA表达上调非常显著(P〈0.01),HGE1组大鼠MCAD mRNA表达显著增加(P〈0.05);HGE2组大鼠CPT-1 mRNA表达上调非常显著(P〈0.01);HGE1组和HGE2大鼠PPARγ mRNA表达显著性增加(P〈0.05)。
2)与NHE组相比,HGE1组、HGQ2组大鼠PGC-1α mRNA表达显著性增加(P〈0.05),HGE2组大鼠PGC-1 α mRNA表达上调非常显著(P〈0.01);NHQ组和HGQ1组大鼠MCAD mRNA表达下降非常显著(P〈0.01),HGQ2组大鼠MCAD mRNA表达显著下降(P〈0.05),HGE2组大鼠MCAD mRNA表达上调非常显著(P〈0.01);HGE2组大鼠CPT-1 mRNA表达上调非常显著 (P〈0.01);HGE2大鼠PPARγ mRNA表达显著增加(P〈0.05)。
3)与HGQ1组相比,HGE1组、HGQ2组和HGE2组大鼠PGC-1α mRNA表达上调非常显著 (P〈0.01);NHE组和HGE2组大鼠MCAD mRNA表达上调非常显著(P〈0.01),HGE1组和HGQ2组大鼠MCAD mRNA表达显著增加(P〈0.05);HGE2组大鼠CPT-1 mRNA表达上调非常显著(P〈0.01);HGQ2组和HGE2大鼠PPARγ mRNA表达上调非常显著(P〈0.01),NHE组和HGE1 组PPARγ mRNA表达显著增加(P〈0.05)。
3 讨论
3.1 高脂膳食诱导营养性肥胖大鼠模型
肥胖危害人体健康,可引起高脂血症、糖尿病、脂肪肝、动脉粥样硬化等相关疾病,其脂代谢紊乱是这些疾病发生的主要原因之一[11]。然而引起机体肥胖的因素存在多方面因素,例如环境、遗传、高脂高糖饮食习惯等等。为探究不同体积分数低氧或(和)运动对能量过剩所诱导的营养性肥胖大鼠骨骼肌细胞PGC-1α及其下游基因的影响,本实验进行高脂膳食饲养以诱导营养性肥胖大鼠,随之进行低氧和(或)运动干预。由于实验动物自身存在“肥胖抵抗”与“肥胖易感”,且与人类肥胖标准评定不同,对于大鼠肥胖评定而言,目前尚未统一标准,目前有3种标准可用来评定大鼠是否肥胖,包括:(1)高脂组体重超过正常组体质量1.96个标准差。(2)高脂组体质量超过正常组体质量1.4个标准差。(3)高脂组体质量超过正常组20%[9]。(4)以BMI值是否与正常组大鼠具有显著性差异进行评定[10,12]。本研究结果显示,经7周高脂膳食饲养后,80%DIO组大鼠体重增长超过CON组20%,两组间BMI具有显著性差异,血糖血脂均增加显著,与相关文献报道一致,提示营养性肥胖大鼠建模成功[10,13]。
3.2 低氧运动对营养性肥胖大鼠身体形态学的影响
与以往的研究结果[14-15]一致,8周不同体积分数低氧运动均可有效降低肥胖大鼠体质量,并且13.3%低氧或(和)运动的干预效果较常氧或16.3%低氧运动而言更加明显,这可能是由于常氧下单纯运动只能消耗掉同步高脂饲料的过剩能量,而低氧运动往往易抑制大鼠食欲,摄食量减少,同时由于O2供应不足,机体能量消耗增加,而一定O2体积分数下,O2体积分数越低,对大鼠的摄食量及机体耗能影响越显著,因而较常氧或(和)运动而言,低氧或(和)运动可有效降低肥胖大鼠体质量,且体积分数13.3%低氧效果更加显著。
3.3 低氧运动对营养性肥胖大鼠骨骼肌细胞PGC-1α及其下游因子的影响
1998年,美国哈佛大学Puigserver 教授[16]首次发现PGC-1α,其在线粒体发生起关键调控作用,随后,关于PGC-1α生物学功能的研究随之越来越多:PGC-1α可调控肌纤维转化、糖脂代谢、白色脂肪棕色化转变等生理过程[17]。由于骨骼肌在机体整体代谢中具有重要意义,骨骼肌线粒体数目、呼吸链活性、脂肪酸氧化等均与机体新陈代谢密切相关,而PGC-1α在调节骨骼肌线粒体发生、脂肪酸氧化等过程中起重要作用[18],研究发现,PGC-1α基因敲除后,小鼠的脂肪酸氧化基因表达下调[19]。因此,提高骨骼肌中PGC-1α有益于机体代谢稳态。在骨骼肌中,调控脂肪酸合成或氧化代谢关键酶有肉毒碱棕榈酰转移酶1(CPT-1)、中链酰基辅酶A脱氢酶(MCAD),这两种分子是调控长链脂肪酸进入线粒体的关键酶,在脂肪酸氧化中起着重要作用。PGC-1α可以调控脂CPT-1及MCAD[5-6]。此外,Zhang Y等[20]研究发现PGC-α通过激活PPARγ,进而促进FXR(famesoid X受体)基因转录,最终促进脂肪代谢。这些研究表明PGC-1α及其下游基因在骨骼肌脂肪酸氧化代谢中起着积极促进作用。
已知常氧耐力运动可调控骨骼肌的脂肪酸氧化代谢,常氧运动可通过多条信号传导通路进而促进骨骼肌中PGC-1α基因表达[21-22]。Akimoto等[23]通过耐力运动干预活化小鼠p38MAPK信号通路,进而激活PGC-1α基因启动子活性。此外,常氧下,耐力运动也能诱导机体骨骼肌中CPT-1、MCAD、PPARγ的表达增加[24]。然而,关于常氧下,耐力运动同时影响PGC-1α、CPT-1、MCAD、PPARγ的研究,目前鲜有报道,本研究显示常氧下,肥胖大鼠经耐力运动干预后,其骨骼肌中PGC-1α mRNA、CPT-1mRNA、MCADmRNA、PPARγmRNA表达均有所上调,与Carnevali等[24-25]研究结果一致,然而本研究中CPT-1mRNA略有上调,与以往研究[8,26]不符,关于常氧下耐力运动与CPT-1mRNA的作用影响可能仍需进一步探讨。本实验研究中除了进行常氧耐力运动干预外,还进行了不同体积分数低氧和低氧运动干预。低氧和低氧运动可有效控制大鼠体质量,在以往的研究[2,14]和我们的研究中已有所证实。Bigard等[27]也发现低氧和低氧运动可增加骨骼肌脂肪酸氧化,然而,低氧和低氧运动影响骨骼肌中脂肪酸氧化相关分子(PGC-1α、CPT-1、MCAD、PPARγ)表达的研究相对较少。本研究结果显示不同体积分数低氧和低氧运动均促进PGC-1αmRNA的表达,而13.3%低氧干预效果优于16.3%低氧干预,与Gutsaeva等[28]研究结果一致:低氧体积分数越低,PGC-1α表达越上调。然而,低氧和低氧运动影响PGC-1α的研究主要集中于PGC-1α线粒体发生方面[28-30],而低氧和低氧运动对PGC-1α调控脂肪酸氧化方面的研究甚少,其机制尚需深入研究。Galbes等[31]和路瑛丽等[2]研究中发现低氧暴露会降低CPT-1表达,低氧运动会上调CPT-1表达,而我们的研究结果与之相符。低氧和低氧运动影响MCAD的研究目前较少见,我们的研究结果发现不同体积分数低氧运动均可上调MCAD表达,而16.3%低氧暴露却使MCAD表达下调,与此相比,13.3%低氧暴露则使MCAD表达上调,推测一定低氧体积分数下,低氧暴露影响MCAD的表达可能具有两相性。刘晓玲等[32]利用CoCl2诱导低氧环境,发现细胞中PPARγ2表达随之上调,而本实验研究结果展示低氧暴露下16.3%低氧暴露使PPARγ表达下调,13.3%低氧暴露则使PPARγ表达上调,表明低氧暴露对PPARγ的影响可能也具有两相性,而不同低氧运动则均上调PPARγ mRNA的表达,目前低氧和低氧运动对PPARγ调控方面的研究较少,仍需进一步研究。
综上,高脂膳食诱导的营养性肥胖大鼠骨骼肌细胞中PGC-1α及其下游因子的表达经常氧耐力运动、低氧和低氧运动干预后,均发生不同程度上调或下降,提示耐力运动、低氧或低氧运动在骨骼肌脂肪酸氧化代谢均起重要作用。然而,有趣的是,不同体积分数低氧运动均引起PGC-1α及其下游因子表达上调,而不同体积分数低氧暴露则可能引起表达下调,这可能是由于低氧体积分数对机体分子表达的调控存在一定阈值,具有两相性,在不同范围内所产生的作用效果可能截然不同。
长期高脂膳食可诱导营养性肥胖发生,导致机体代谢紊乱。低氧和(或)耐力运动可有效控制营养性肥胖大鼠体质量,低氧和(或)耐力运动可上调骨骼肌PGC-1α及其下游基因,进而改善骨骼肌脂肪代谢,其中13.3%低氧体积分数下耐力运动效果较佳。
参考文献:
[1] 钱帅伟,漆正堂,孙易,等. 下一个将是谁?—关键信号分子对运动性骨骼肌能量代谢的调控[J]. 体育科学,2015,35(7):83-89.
[2] 路瑛丽,谢敏豪,冯连世,等. 高住高练对肥胖大鼠腓肠肌脂肪酸氧化的影响[J]. 中国运动医学杂志,2014,33(11):1060-1068.
[3] RUAS J L,WHITE J P,RAO R R,et al. A PGC-1alpha isoform induced by resistance training regulates skeletal muscle hypertrophy[J]. Cell,2012,151(6):1319-1331.
[4] FINCK B N,KELLY D P. PGC-1 coactivators:inducible regulators of energy metabolism in health and disease[J]. The Journal of Clinical Investigation,2006,116(3):615-622.
[5] OLESEN J,KIILERICH K,PILEGAARD H. PGC-1α-mediated adaptations in skeletal muscle[J]. Pflügers Archiv-European Journal of Physiology,2010,460(1):153-162.
[6] SUMMERMATTER S,TROXLER H,SANTOS G,et al. Coordinated balancing of muscle oxidative metabolism through PGC-1alpha increases metabolic flexibility and preserves insulin sensitivity[J]. Biochem Biophys Res Commun,2011,408(1):180-185.
[7] 齐美玲,赵越. PPARγ辅调节因子与脂代谢关系的研究进展[J]. 生命科学,2012,24(10):1151-1156.
[8] 张媛,漆正堂,郭维,等. 耐力训练队高脂膳食大鼠骨骼肌线粒体脂肪氧化及PGC-1α基因表达的影响[J]. 天津体育学院学报,2010,25(3):193-196.
[9] CHANDLER P C,VIANA J B,OSWALD K D,et al. Feeding response to melanocortin agonist predicts preference for and obesity from a high-fat diet[J]. Physiol Behav,2005,85(2):221-230.
[10] 汤锦花,严海东. 营养性肥胖大鼠模型的建立与评价[J]. 同济大学学报(医学版),2010,31(1):32-34.
[11] D E ALMEIDA A R,MONTE-ALEGRE S,ZANINI M B,et al. Association between prehypertension,metabolic and inflammatory markers,decreased adiponectin and enhanced insulinemia in obese subjects [J]. Nutr Metab (Lond),2014,11:25-35.
[12] ALTUNKAYNAK M E,OZBEK E,ALTUNKAYNAK B Z,et al. The effects of high-fat diet on the renal structure and morphometric parametric of kidneys in rats[J]. J Anat,2008,212(6):845-852.
[13] 孙志,张中成,刘志诚. 营养性肥胖动物模型的实验研究[J]. 中国药理学通报,2002,18(4):466-467.
[14] 陈瑜文,林文弢,邱烈峰,等. 间歇低氧大鼠对肥胖大鼠食欲的影响及其机制分析[J]. 体育学刊,2011,18(4):133-136.
[15] 黄徐根,冯连世,徐建方,等. 低氧训练过程中大鼠体重及能量代谢的变化[J]. 体育科学,2004,27(10):61-68.
[16] PUIGSERVER P,WU Z,PARK C W,et al. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis[J]. Cell,1998,92(6):829-839.
[17] VILLENA J A. New insights into PGC-1 coactivators: redefining their role in the regulation of mitochondrial function and beyond[J]. FEBS J,2015,282(4):647-672.
[18] SCHNYDER S,HANDSCHIN C. Skeletal muscleas an endocrine organ:PGC-1α,myokines and exercise[J]. Bone,2015,80:115-125.
[19] KOO S H,SATOH H,HERZIG S,et al. PGC-1 promotes insulin resistance in liver through PPAR-α-dependent induction of TRB-3[J]. Nature Medicine,2004,10(5):530-534.
[20] ZHANG Y,CASTELLANI L W,SINAL C J,et al. Peroxisome proliferator-activated receptor-γ coactivator 1α (PGC-1α) regulates triglyceride metabolism by activation of the nuclear receptor FXR[J]. Genes Development,2004,18(2):157-169.
[21] GU Q,WANG B,ZHANG X F,et al. Chronic aerobic exercise training attenuates aortic stiffening and endothelial dysfunction through preserving aortic mitochondrial function in aged rats[J]. Exp Gerontol,2014,56:37-44.
[22] 林文弢,吴菊花,鞠丽丽,等. 转录共激活分子PGC-1α与肥胖者减体重研究现状的探讨[J]. 广州体育学院学报,2015,35(1):91-94.
[23] AKIMOTO T,POHNERT S C,LI P,et al. Exercise stimulates Pgc-1α transcription in skeletal muscle through activation of the p38 MAPK pathway[J]. Journal of Biological Chemistry,2005,280(20):19587-19593.
[24] CARNEVALI JR L C,EDER R,LIRA F S,et al. Effects of high-intensity intermittent training on carnitine palmitoyl transferase activity in the gastrocnemius muscle of rats[J]. Braz J Med Biol Res,2012,45(8):777-783.
[25] 孙垂华,蔡颖,张文亮,等. 游泳训练对载脂蛋白E基因敲除小鼠过氧化物酶体增殖物激活受体-γ及脂代谢酶肉碱棕榈酰转移酶-1、中链酰基辅酶A脱氢酶的影响[J]. 中国康复医学杂志,2013,28(2):134-138.
[26] TUNSTALL R J,MEHAN K A,HARGREAVES M,et al. Fasting activates the gene expression of UCP3 independent of genes necessary for lipid transport and oxidation in skeletal muscle[J]. Biochem Biophys Res Commun,2002,29(2):301-308.
[27] BIGARD A X,BRUNET A,GUEZENNEC C Y,et al. Skeletal muscle changes after endurance training at high altitude[J]. J Appl Physiol,1991,71(6):2114-2121. [28] GUTSAEVA D R,CARRAWAY M S,SULIMAN H B,et al. Transient hypoxia stimulates mitochondrial biogenesis in brain subcortex by a neuronal nitric oxide synthase-dependent mechanism[J]. J Neurosci,2008,28(9):2015-2024.
[29] LI J,ZHANG Y,LIU Y,et al. PGC-1α plays a major role in the anti-apoptotic effect of 15-HETE in pulmonary artery endothelial cells[J]. Respir Physiol Neurobiol,2015,205:84-91.
[30] ZHU L,WANG Q,ZHANG L,et al. Hypoxia induces PGC-1α expression and mitochondrial biogenesis in the myocardium of TOF patients [J]. Cell Research,2010,20(6):676-687.
[31] GALBÈS O,GORET L,CAILLAUD C,et al. Combined effects of hypoxia and endurance training on lipid metabolism in rat skeletal muscle[J]. Acta Physiol (Oxf),2008,193(2):163-173.
[32] 刘晓玲,包韩乌云,赵华路,等. 在CoCl2模拟低氧条件下HIF-1α直接调控PPARγ2的表达[J]. 基础医学与临床,2015,35(5):585-589.
Effects of hypoxic exercise on PGC-1α in skeletal muscle of rats with alimentary obesity and its downstream factors
WU Ju-hua1,YANG Ya-nan2,WENG Xi-quan2,XU Guo-qin2,LIN Wen-tao1(1.School of Sport Science,Shanghai University of Sport,Shanghai 200438,China;2.Provincial Key Laboratory of Biochemistry,Guangzhou Sport University,Guangzhou 510500,China)
Abstract:In order to probe into the effects of hypoxic exercise on PGC-1α in skeletal muscle of rats with alimentary obesity and its downstream factors, the authors built a model of SD rats with alimentary obesity induced bybook=131,ebook=1367-week high-fat diet, then divided the rats randomly into a normoxic high-fat diet quit group (NHQ), a normoxic high-fat diet exercise group (NHE), a 16.3% hypoxic high-fat diet quit group (HGQ1), a 16.3% hypoxic high-fat diet exercise group (HGE1), a 13.3% hypoxic high-fat diet quit group (HGQ2), and a 13.3% hypoxic high-fat diet exercise group (HGE2), each of which consisted of 10 rats, continued to feed the rats with high-fat food, let them undergo 8-week endurance training, i.e. 20m/min, 40min/d, 5d/week, killed and sampled the rats 24h after the last exercise, measured 4 blood lipid indexes and blood glucose (BG) by means of test kit, measured PGC-1α and its downstream factors CPT-1, MCAD and PPARγ by means of qRT-PCR technology, and revealed the following findings: 1) 7-week high-fat diet could induced the increase or significant increase of the weight, BMI, as well as BG, CHO, LDL-L and TG contents of the rats (P<0.01 or P<0.05); 2) as compared with the rats in groups NHQ and HGQ1, the rats in groups HGE1, HGE2 and NHE had a decreased or significantly decreased weight (P<0.01 or P<0.05); as compared with the rats in group NHE, the rats in groups HGE1 and HGE2 had a decreased weight (P<0.05); 3) as compared with the rats in group NHQ, the rats in group NHE had a significantly increased MCAD mRNA expression (P<0.01); the rats in group HGE1 had increased or significantly increased PGC-1α, MCAD and PPARγ mRNA expressions (P<0.01 or P<0.05); the rats in group HGQ2 had a significantly increased PGC-1α mRNA expression (P<0.01); the rats in group HGE2 had increased or significantly increased PGC-1α , MCAD, CPT-1 and PPARγ mRNA expressions (P<0.01 or P<0.05); as compared with the rats in group NHE, the rats in groups HGE1 and HGQ2 had an increased PGC-1α mRNA expression (P<0.05); the rats in group HGE2 had increased or significantly increased PGC-1α , MCAD, CPT-1 and PPARγ mRNA expressions (P<0.01 or P<0.05); the rats in groups NGQ, HGQ1 and HGQ2 had a decreased or significantly decreased MCAD mRNA expression (P<0.01 or P<0.05); as compared with the rats in group HGQ1, the rats in groups HGE1 and HGQ2 had increased or significantly increased PGC-1α and MCAD expressions (P<0.01 or P<0.05); the rats in group HGE2 had significantly increased PGC-1α, MCAD and CPT-1 mRNA expressions (P<0.01); the rats in group NHE had increased or significantly increased MCAD and PPARγ mRNA expressions (P<0.01 or P<0.05). The said findings indicate the followings: 1) long-term high-fat diet can induce the occurrence of alimentary obesity; 2) hypoxia and/or endurance exercise can effectively control the weight of rats with alimentary obesity, increase PGC-1α in skeletal muscle and its downstream factors, while endurance exercise under a 13.3% hypoxic condition can achieve a better result.
Key words:sports biochemistry;hypoxic exercise;alimentary obesity;skeletal muscle;PGC-1α;rats
作者简介:吴菊花(1985-),女,博士研究生,研究方向:运动生物化学。E-mail:juhuahf@163.com 通讯作者:林文弢教授。
基金项目:运动健身科技省部共建教育部重点实验室(上海体育学院)资助项目;广东省教育厅科技创新项目(2013KJCX0115)。
收稿日期:2015-10-02
中图分类号:G804.7
文献标志码:A
文章编号:1006-7116(2016)03-0130-07

