全二维液相色谱的构建及其在鹿茸蛋白分离中的应用
周 杰
(泸州医学院附属医院,四川 泸州 646000 )
全二维液相色谱的构建及其在鹿茸蛋白分离中的应用
周杰
(泸州医学院附属医院,四川 泸州 646000 )
[摘要]目的建立SAX-RP模式的在线二维液相色谱系统,并将其应用于鹿茸蛋白的分离、分析中。方法样品首先由第一维强阴离子交换色谱(COSMOGEL QA Glass Packed Column,75 mm×8.0 mm I.D)在pH 9.16的Tris-HCl缓冲体系中以0.8 mL/min的流速洗脱分离,采用不连续的逐步增加盐浓度的8步台阶梯度方式洗脱,洗脱产物富集在与反相柱相同填料的捕集柱顶端,通过阀切换将富集在捕集柱上的组分反向冲入第二维反相分析柱(Shodex Rspak RP18~415,150 mm×4.6 mm I.D)继续分析。结果鹿茸蛋白在所构建的二维系统上得到了较好的分离,与一维色谱相比,系统的总峰容量、分辨率在一定程度上得到了提高,系统总出峰数为30,总峰容量为240。结论使用常规尺寸的色谱柱构成的二维液相色谱系统仪器要求简单,对鹿茸为代表的动物类中药的分离、分析有一定指导意义。
[关键词]全二维液相色谱;鹿茸蛋白;SAX/RP
中药组成成分极其复杂,特别是中药中的动物药,常常含有几百甚至上千种组分。对复杂组份的分离,传统的色谱方法受到峰容量和分辨率的限制,远不能满足分离的要求,而组合不同模式构建多维系统是解决这一问题的有效途径。二维液相色谱由2种不同分离机理的液相色谱模式通过一定的切换接口构成,样品经第一维色谱分离后,由切换接口导入第二维色谱继续分离。二维液相色谱大大提高了整个系统的分辨率和峰容量,在蛋白质组学、药物分析中得到了广泛的应用[1-3]。根据不同分离目的,尺寸排阻色谱(SEC)、离子交换色谱(IEC)、反相色谱(RP)、疏水作用色谱(HIC)、亲和色谱(AC)等都可以用于构建二维液相色谱系统。IEC/RP模式因其具有溶剂匹配,易与质谱连接,可以提高进样量及方便实现快速分析等特点,在生物样品的分离分析中有广泛的应用[4-8]。本研究以常规尺寸的色谱柱构建全二维液相色谱,第一维根据样品所带电荷采用强阴离子交换色谱(SAX)进行分离,第二维根据样品极性差异采用反相液相色谱(RP)进一步分离,采用捕集柱富集接口,构建正交的SAX/RP 在线二维液相色谱分离系统,并将此二维系统用于鹿茸蛋白的分离分析中,取得了较好的结果。现报道如下。
1实验资料
1.1仪器与试剂色谱系统为Agilent 1100系列(美国安捷伦公司)、岛津10A系列(日本岛津公司),7725i六通阀(美国RHEODYNE公司)。第一维SAX柱为CO-SMOGEL QA Glass Packed Column(8.0 mm×75 mm,10 μm,1 000 Å),日本Nacalai tesque公司;第二维RP柱为Shodex RSpak RP18-415(4.6 mm×150 mm,6 μm,450 Å),捕集柱为RSpak RP18-G(4.6 mm×10 mm,6 μm,450 Å),均购于日本Shodex公司。乙腈(ACN,色谱纯,美国Fisher公司)、三氟乙酸(TFA,色谱纯,美国Fisher公司)、三羟甲基氨基甲烷(Tris,北京拜耳迪公司);实验用水为优普超纯水器(成都超纯科技有限公司)制备;其他化学试剂为国产分析纯试剂。
1.2样品与处理鹿茸来源于内蒙古赤峰雄性马鹿茸,采茸方式为全身麻醉消毒锯茸留血密封后冷藏运输,2h内放置-80 ℃冷冻保存。取冻鲜马鹿茸10 g,解冻至冰血融化,切薄片,用预冷的蒸馏水(4 ℃)冲洗至无血色;4 ℃下,用50 mL的Tris-HCl缓冲液(50mmol/L,pH=7)浸提24h;在圆桶里装满冰袋,将电动匀浆机放入其中,制备一个小型的密闭冰柜;将浸提液加鹿茸组织放入匀浆机中匀浆3次,每次10 s,其间暂停3 s,使其充分散热,收集渗出液;将渗出液与残渣合并,4 ℃下浸提24 h;用冷冻高速离心机(10 000 r/min,4 ℃)离心20 min,取上清,得到待测样品。
1.3系统组成本文采用SAX/RP模式构建正交的在线二维液相色谱分离系统,第一维SAX根据样品所带电荷不同进行分离,第二维RP根据样品极性的差异进一步分离,中间接口以捕集柱为桥梁,由阀接口进行切割转移,其流程如图1所示。该系统由2台色谱泵、3个六通进样阀、1根强阴离子交换色谱柱、1根反相色谱柱、1根捕集柱、2台紫外检测器组成。其中,切换阀1的1,2,3,4,5号孔分别与废液瓶、检测器1、捕集柱进口端、分析柱2、切换阀2的3号孔相连;切换阀2的1,2,6号孔分别与捕集柱出口端、泵2、废液瓶相连。如图1所示A状态,泵1、泵2同时运行,实现进样、样品第一维SAX分离,分析柱2进行流动相的平衡;B状态,泵1、泵2同时运行,第一维洗脱的样品组分在捕集柱柱顶富集,而不保留的盐分和多余的第一维流动相流入废液装置,分析柱2继续流动相的平衡;C状态,泵1停止,泵2运行,将通过第一维离子交换分析后富集在捕集柱上的组分反向冲入第二维的反相分析柱继续分析。重复以上过程,直到样品分析完。
2结果
2.1样品提取条件的选择本文考察提取溶剂Tris-HCl浓度10,20,30,50 mmol/L,pH 7.00,8.00,9.00,提取次数1,2,3,4,5次。最终确定Tris-HCl浓度为50 mmol/L,pH值为7,提取次数为3效果最好,故本实验采用此方法。
2.2一维SAX条件的选择由于大多数蛋白质含酸性基团多于碱性基团,其pH<7,一般情况下带负电荷,阴离子交换柱的固定相基团带正电荷,其可交换离子为阴离子,其pH适应范围广,离子化程度高,重现性好,且强阴离子交换柱(SAX)相比弱阴离子交换柱(WAX)具有更大的蛋白质负载量,所用流动相的pH条件更接近于生理pH,能减少部分蛋白质在酸性条件下的损失[9],因此本研究采用SAX作为第一维分离柱。本文考察流动相Tris-HCl缓冲液浓度10,30,50 mmol/L,pH 7.00,8.00,9.00,9.06,9.16,最终确定Tris-HCl缓冲液的浓度为30 mmol/L,pH为9.16分离效果最好。本研究还不断优化了台阶梯度洗脱条件,可见鹿茸蛋白在第一维SAX上得到较好的分离,见图2。
色谱柱:COSMOGEL QA Glass Packed Column,10 μm,75 mm×8.0 mm I.D;流动相为A:30 mmol/L Tris-HCl(pH 9.16),B:30 mmol/L Tris-HCl+1 mmol/L NaCl(pH 9.16);8个台阶梯度依次为0% B,12% B,15% B,20% B,30% B,50% B,60%B,100% B;流速0.8 mL/min;检测波长280 nm。
2.3一维RP条件的选择第二维反相色谱比较了Shodex RSpak RP18-415(4.6 mm×150 mm,6 μm,450 Å)和ShodexAsahipak ODP-50 4D(4.6 mm×150 mm,5 μm,250 Å)两种规格的色谱柱,在相同色谱条件下,Shodex RSpak RP18-415较Shodex Asahipak ODP-50 4D保留时间小,分辨率更高,因此选用Shodex RSpak RP18-415作为第二维反相色谱分析柱。实验中还考察了流动相酸种类三氟乙酸、甲酸,酸浓度0.03%,0.05%,0.10%,柱温20 ℃,30 ℃,40 ℃,流速0.6,0.8,1 mL/min。最终确定流动相中含0.10%三氟乙酸,柱温为30 ℃,流速为1 mL/min,不断优化了梯度洗脱条件,确定了45min的洗脱条件,得到鹿茸蛋白一维反相色谱分析图,见图3。
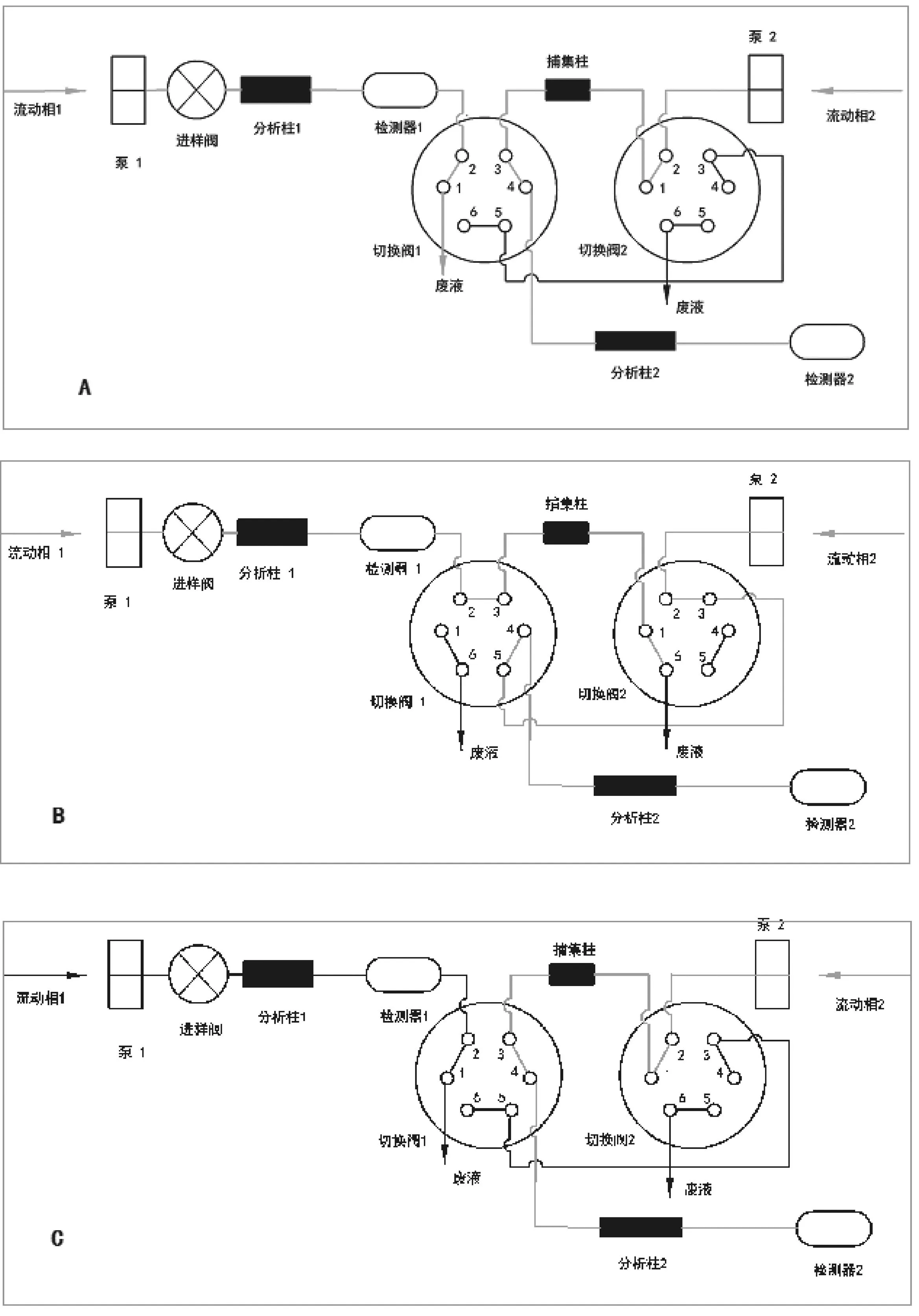
A为第一维SAX分离;B为样品捕集;C为第二维RP分离。
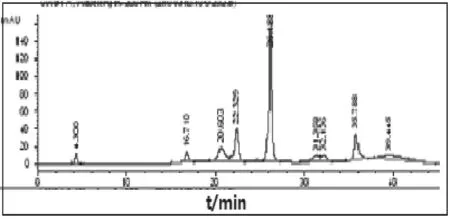
图2 鹿茸蛋白一维SAX分离色谱图
色谱柱:Shodex RSpak RP18-415,6 μm,150 mm×4.6 mm,I.D;流动相为:A:H2O+ 0.1% trifluo-Åroacetic acid(TFA),B:乙腈(acetonitrile)+0.085% TFA;梯度条件:0-0-45-65-100-100B% (0-5-15-35-37 min);流速1 mL/min;检测波长280 nm。
2.4在线二维SAX-RP切换分析鹿茸蛋白经第一维SAX分离的组分在捕集柱上得以富集、脱盐,通过六通阀的切换,第二维的流动相将捕集柱上的蛋白质反冲至反相分析柱上进行分离。在实验条件下二维分析结果见图4。
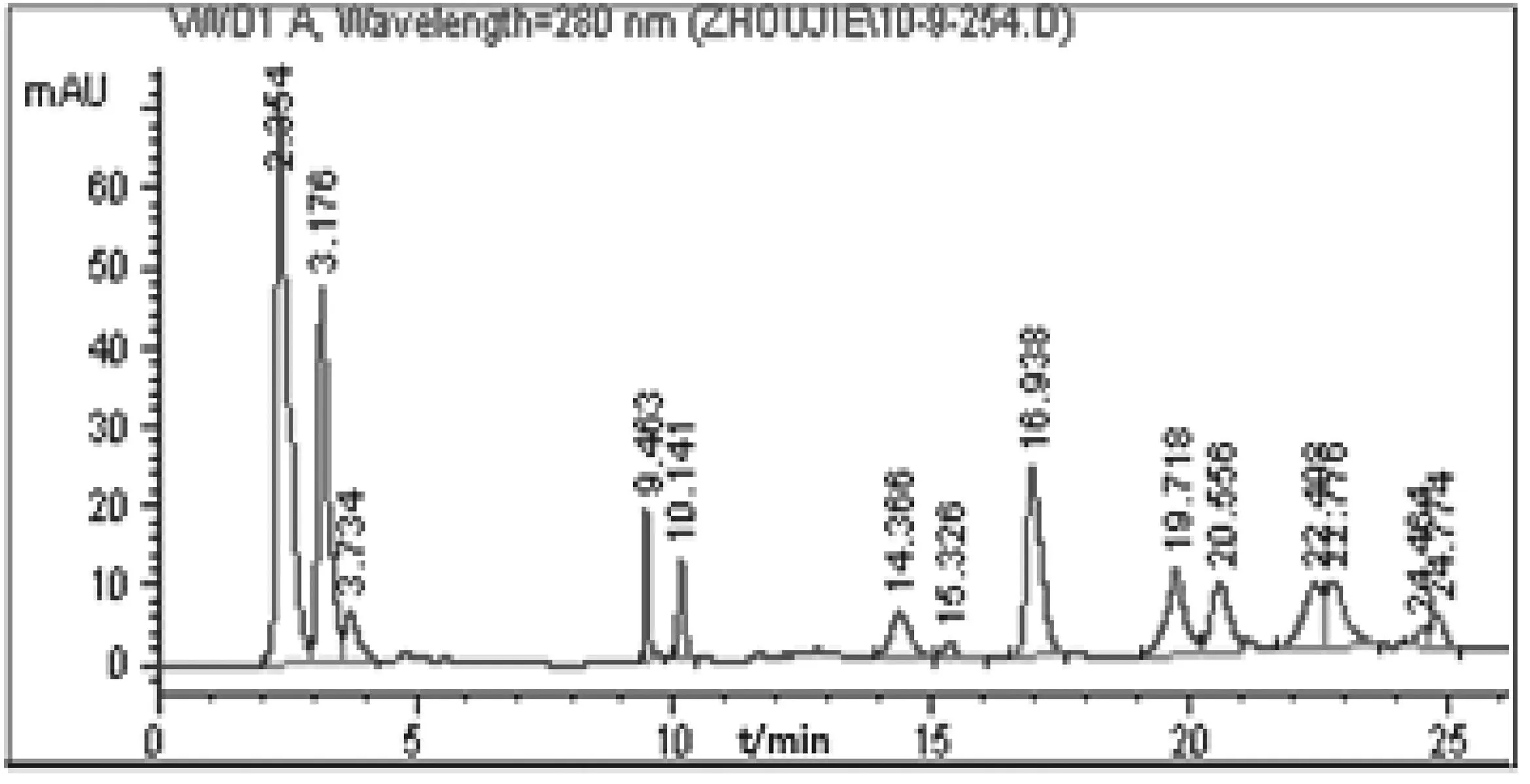
图3 鹿茸蛋白一维反相色谱分析图
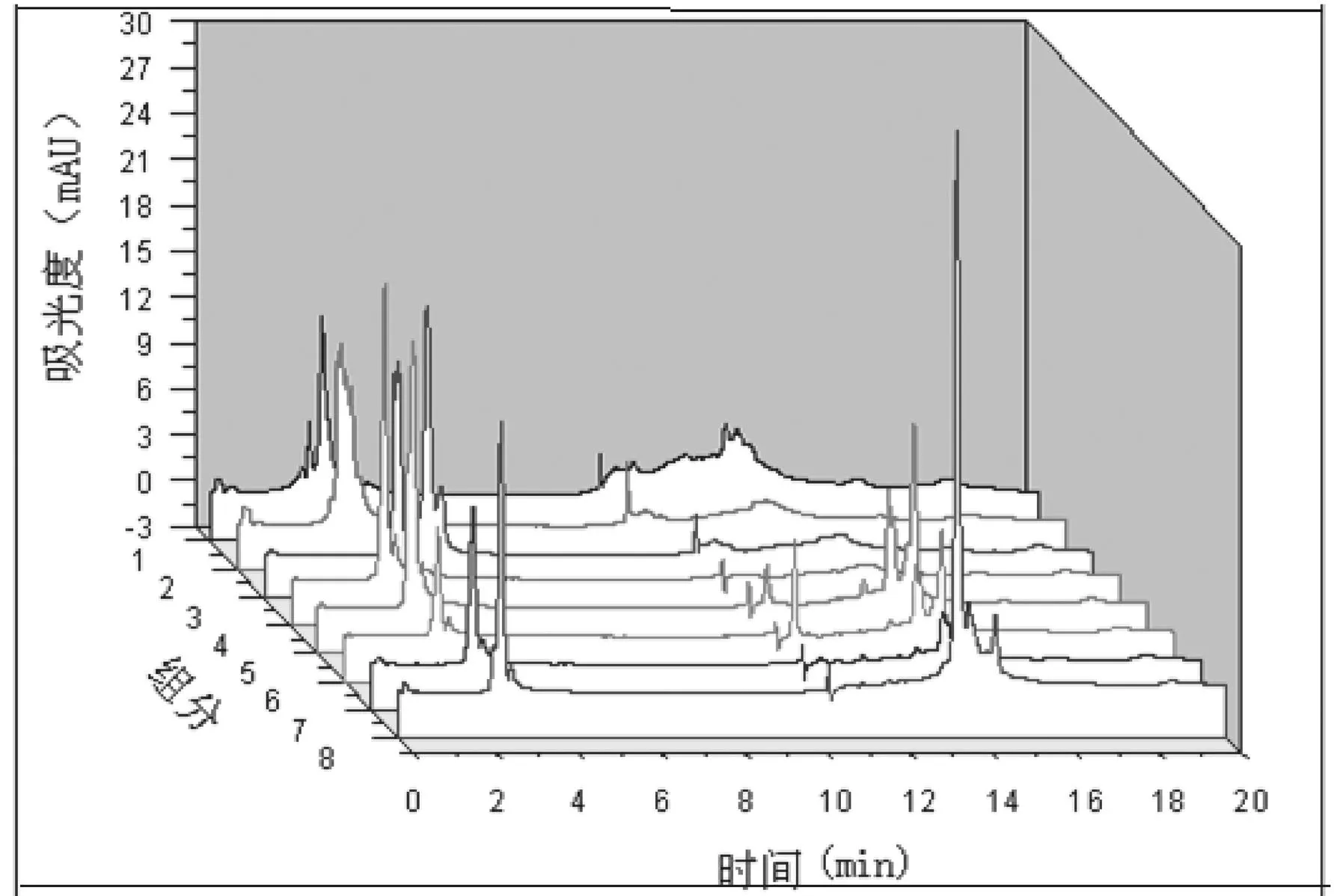
图4 鹿茸蛋白分析的三维图谱
3讨论
多维色谱的切换方式有部分切换和整体切换,整体切换又分按时间切换和按峰切换,按时间切换模式即每隔一定时间切换一次,按峰切换模式即在色谱峰出现后的某个时间点进行切换。由前面的实验知鹿茸的总蛋白成分并不是很复杂,在离子交换色谱中,各个峰又相差较远,采用按时间切换会浪费时间,因此本研究采用按色谱峰切换方式,这样目的性更强,更节约时间。如上所述,系统的总出峰数相比一维的RP系统增加不到3倍,是鹿茸总蛋白成分本身不复杂,还是采取按色谱峰切换方式切割次数相对较少等原因,本课题将继续进行下一步实验研究。
本文建立了以捕集柱为切换接口的SAX-RP在线二维液相色谱系统,并将其用于鹿茸蛋白的分离分析中,二维系统的总出峰数为30,总峰容量为240。与一维色谱相比,系统的总峰容量、分辨率在一定程度上得到了提高。本文使用常规尺寸的色谱柱构成的二维液相色谱系统仪器要求简单,对鹿茸为代表的动物类中药的分离、分析有一定指导意义。
[参考文献]
[1]Dvais MT,Beierle J,Bures ED,et al. Automated LC-LC-MS-MS platform using binary ion-exchange and gradient reversed-phase chromatography for improved proteomic analyses[J]. Chromatogr B,2001,752(2):281-291
[2]黄志,洪广峰,高明霞,等. 用于人血浆中蛋白质分离的在线阵列式二维常规柱液相色谱系统的建立[J]. 色谱,2014,32(4):343-348
[3]李威,肖轶雯,邱细敏,等. 2D-HPLC结合捕集柱同时测定黄连药材中6个生物碱[J]. 药物分析杂志,2014,32(4):654-658
[4]王智聪,张庆合,张维冰,等. 全二维液相色谱(IEC/RP)的构建与评价[J]. 高等学校化学学报,2005,26(3):426-429
[5]宋伦,李笃信,张凌怡,等. IEX/RP二维液相色谱中弱保留组分收集模式的构建及系统评价[J]. 分析测试学报,2009,28(11):1266-1269;1274
[6]李笃信,张凌怡,李彤,等. 二维液相色谱接口的改进及其在蛋白质组学研究中的应用(英文)[J]. 色谱,2010,28(2):163-167
[7]Mitulovic G,Stingl C,Smoluch M,et al. Automated,on-line two-dimensional nano liquid chromatography tandem mass spectrometry for rapid analysis of complex protein digests[J]. Proteomics,2004,4(9):2545-2557
[8]Mawuenyega KG,Kaji H,Yamauchi Y,et al. Large-scale identification of Caenorhabditis elegans proteins by multi-dimensional liquid chromatography-tandem mass spectrometry[J]. Proteome Research,2003,2(1):23-35
[9]朱绍春,张学洋,高明霞,等. 去除血浆中高丰度蛋白质的二维液相色谱体系的建立[J]. 色谱,2011,29(9):837-842
[10] Jinzhi C,Balgley BM,DeVoe DL,et al. Capillary isoelectric focusing-based multidimensional concentration/ separation platform for proteome analysis[J]. Anal Chem,2003,75(13):3145-3152
[11] Moore AW,Jorgenson JW. Comprehensive three-dimensional separation of peptides using size exclusion chromatography/reversed phase liquid Chromatography/ optically gated capillary zone electrophoresis[J]. Anal Chem,1995,67(19):3456-3463
[12] Giddings JC. Two-dimensional separations: concept and promise[J]. Anal Chem,1984,56(12):1258A-1270A
[收稿日期]2015-08-31
[中图分类号]R284.2
[文献标识码]B
[文章编号]1008-8849(2016)04-0437-03
doi:10.3969/j.issn.1008-8849.2016.04.035

