瓜类疫霉菌对烯酰吗啉的敏感性及其室内抗药突变体研究
吴永官 程亮 康德贤 王益奎 付岗 李文嘉 黎炎 曾燕红


摘 要 采用菌丝生长速率法,对采自广西6个冬瓜和黄瓜产区的116株瓜类疫霉菌进行烯酰吗啉的敏感性检测。结果表明:敏感菌株和中间型菌株分别占测试菌株的8.6%和91.4%,以中间型菌株为优势菌群,所有样区均未检测到抗性菌株;待测菌株的EC50值范围为0.081 3~1.340 0 μg/mL,最不敏感菌株是最敏感菌株的16倍,平均EC50值为(0.274 6±0.092 8)μg/mL;116株瓜类疫霉对烯酰吗啉的敏感性分布呈单峰曲线,未出现敏感性下降的亚群体,可将其单峰曲线作为瓜类疫霉对烯酰吗啉的敏感性基线,将烯酰吗啉对该病原群体的平均EC50值作为田间抗药性检测的参考标准。通过室内对敏感菌株进行药剂驯化选育20代,获得抗性指数大于2.0的抗药突变体3株;采用紫外线处理未获得有明显抗性的突变体。3株突变体的部分生物学性状结果表明,突变体对寄主的致病力明显弱于其亲本菌株,突变株DRGL-4和DRYL-154菌株几乎丧失致病力;在不同pH及不同温度培养条件下,部分抗药突变体菌丝生长率与亲本菌株相比均有不同程度的提高。综合分析表明,在当前的管理水平和栽培模式下,瓜类疫霉菌抗药突变体群体在田间难以形成和发展,烯酰吗啉属于低抗性风险的用于防治瓜类疫病的有效杀菌剂。
关键词 瓜类疫霉;烯酰吗啉;敏感性;突变体
中图分类号 S436.42 文献标识码 A
Abstract The sensitivity of 116 Phytophthora melonis isolates, which were collected from six wax gourd and cucumber growing areas in Guangxi to dimethomorph was determined by the mycelia growth inhibition method. The results showed that the sensitive, moderate and resistant strains was accounted for 8.6%, 91.4% and 0, respectively. The EC50 values of P. melonis populations ranged from 0.081 3 μg/mL to 1.340 0 μg/mL. EC50 of the most insensitive strain was 16 folds of the most sensitive one, with a mean of(0.274 6±0.092 8)μg/mL. The sensitivity frequency of P. melonis to dimethomorph distributed as unimodal curve, which indicated that there was no resistant subpopulation among these strains, so this sensitivity baseline could be used for resistance monitoring of P. melonis to dimethomorph. Three resistant mutants(resistant factor>2.0)were generated after 20 generations subcultured on dimethomorph-amended medium, but failed to generate resistant mutants by UV-irradiation. Some biological characteristics of resistant mutants were studied in this paper. The results showed that there were significantly differences between the mutants and wild type in pathogenicity, e.g. two of these mutants almost lost their pathogenicity on their host. However, the growth rates of most resistant mutants were greater than that of their parental strains on different pH values and different temperatures. Based on these results, the development of field resistance to dimethomorph in populations of P. melonis is unlikely under the currently employed resistance management strategies, which indicated that the dimethomorph belonged to a low risk fungicide in field application.
Key words Phytophthora melonis; Dimethomorph; Sensitivity; Resistant mutant
doi 10.3969/j.issn.1000-2561.2016.10.023
瓜类疫霉(Phytophthora melonis Katsura)由日本学者桂琦一[1]在1951年首次从罹病的黄瓜上分离得到,并鉴定为新种。之后由该菌引起的植物病害相继在少数的几个亚洲国家和地区,如中国大陆、台湾地区、日本、伊朗及印度等地有报道[2]。由瓜类疫霉(P. melonis)引起的瓜类疫病是华南地区冬瓜和黄瓜产区最严重的病害之一[3],该病在温湿度适合的情况下能在极短时间内导致大流行,田间植株发病率可达90%以上[4]。目前对该病害的防治主要以化学防治为主。甲霜灵(metalaxyl)具有优良的保护、治疗和铲除作用而广泛应用于卵菌病害的防治。甲霜灵属苯基酰胺类杀菌剂,其作用机制主要是特异地抑制病原核糖体RNA聚合酶,从而抑制RNA的合成[5],由于作用位点单一,病原菌容易产生抗药性,目前已在许多国家和地区普遍发现疫霉菌(Phytophthora spp.)对甲霜灵产生抗性的报道[6-9]。吴永官等[9]曾对广西、广东两省(区)的9个样区193株瓜类疫霉进行甲霜灵的抗药性检测,结果表明,敏感、中间型菌株及抗性菌株分别占测试菌株的29.0%、18.1%和52.8%,抗性菌株占据了优势类群,表明华南地区瓜类疫霉对甲霜灵已产生极高的抗性。
近年来,氟吗啉、烯酰吗啉等羧酸氨基类(Carboxylic Acid Amides,CAA)杀菌剂以其抑菌活性高、内吸传导作用强、对卵菌特效并与苯基酰胺类杀菌剂无交互抗性等特点受到广泛的重视,是继甲霜灵之后防治卵菌病害的一种理想杀菌剂。该类杀菌剂自上世纪90年代进入中国市场后,已在多种卵菌病害如辣椒疫病、番茄晚疫病、黄瓜霜霉病和荔枝霜疫霉等的防治中获得登记许可并广泛应用[10]。但随着使用量不断增大,病原的抗药性问题引起人们极大的关注。目前,已在辣椒疫霉、寄生疫霉、致病疫霉及霜霉菌等卵菌方面开展了对CAA类杀菌剂的抗药性研究[10-13]。广西作为南菜北运最主要的生产基地,每年冬瓜和黄瓜的种植面积超过5万公顷,因作物生长期正值雨热同季,也成为瓜类疫病发生的重灾区和高发区。据作者调查,作为防治疫病的最主要药剂,烯酰吗啉用于冬瓜和黄瓜疫病的防治已超过10年的用药历史,目前有关瓜类疫霉对烯酰吗啉的抗药性研究国内外未见报道。本研究旨在通过系统检测瓜类疫霉对烯酰吗啉的敏感性,建立瓜类疫霉对烯酰吗啉的敏感性基线,为开展田间抗药性监测提供科学依据,同时通过室内抗药突变体诱导并研究其生物学特性,为瓜类疫霉对烯酰吗啉的抗药性风险评估和抗性治理提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 2012~2014年期间自广西南宁、桂林、玉林、武鸣、柳州及崇左6个不同地区的冬瓜和黄瓜上采集具典型疫病症状植株样品150余份,用组织分离法分离、纯化和鉴定[14-15],共获得瓜类疫霉116株。
1.1.2 供试药剂和培养基 烯酰吗啉原药,由陕西康禾立丰生物科技药业公司生产,原药用少量丙酮溶解,配制成50 mg/mL的母液,于4 ℃冰箱保存备用。供试培养基为PDA培养基。
1.2 方法
1.2.1 瓜类疫霉对烯酰吗啉的敏感性测定 敏感性测定采用菌丝生长速率法[9],自PDA平板上培养5 d的菌落边缘取直径5 mm的菌饼,将各待测菌株分别移入含烯酰吗啉0、0.05、0.1、0.2、0.4、0.6、0.8、1.0 μg/mL的培养基平板中培养5~7 d,当对照(即不含烯酰吗啉的PDA培养基平板)的菌落直径至少达6 cm时,用十字交叉法测量菌落直径。每处理重复3次。通过菌丝生长抑制几率值和烯酰吗啉的浓度对数之间的线性回归分析,求出各菌株的EC50值,按朱桂宁等[8]的方法将菌株对烯酰吗啉的敏感性划分为抗性(EC50值﹥10 μg/mL)、中间型(0.1 μg/mL≤EC50值≤10 μg/mL)和敏感(EC50值<0.1 μg/mL)3个级别。最后根据敏感群体的EC50分布建立瓜类疫霉对烯酰吗啉的敏感性基线。
1.2.2 抗药突变体的诱导 (1)药剂驯化。将供试敏感菌株在含烯酰吗啉的PDA培养基培养,选择压保持在抑制菌落生长50%~60%,连续选择20代,每代培养时间为6 d,每隔5代则根据1.2.1的方法计算继代分离物的EC50值,比较不同时期继代分离物对烯酰吗啉的抗性变化。抗性指数=抗药突变体的EC50/亲本菌株的EC50,下同。以在无药培养基上连续培养的敏感菌株亲本为对照。
(2)紫外线诱导。参照胡燕[16]的方法并加以改进,将敏感菌株培养5 d,沿边缘取直径5 mm的菌饼,接入PDA培养基平板上培养24 h后,置于已预热10 min的紫外灯(25 W,波长250 nm)下方25 cm处照射,照射时间分别设10、15、20、25、30、35、40 min等7个处理。照射后置于28 ℃黑暗培养,以不照射为对照,4 d后调查不同处理的致死率,找出菌落亚致死的照射时间用于随后的突变体诱导。
敏感菌株培养5 d后,制成直径5 mm的菌饼,接入选择压保持在抑制菌丝生长50%~60%的含药PDA平板上,培养24 h后,置于已预热10 min的紫外灯下照射亚致死时间,后置于28℃黑暗培养7~10 d。平板上长出的扇形角变菌落即为突变体,将突变体转移到空白平板上。试验重复3次,每个重复12皿,共36皿。对诱导获得的突变体进行烯酰吗啉敏感性测定,明确其对烯酰吗啉的抗性指数。
1.2.3 抗药突变体的部分生物学特性 (1)抗药突变体的致病力。致病力测定采用无伤菌饼接种法[3],将供试突变体及其亲本菌株分别在PDA培养基上培养5 d,沿菌落边缘制成直径为5 mm的菌饼,贴于温室栽培的苗龄为18~21叶的冬瓜植株基部4~6节的茎表面,接种部位用脱脂棉蘸灭菌水覆盖保湿,每菌株接种寄主植物6株,重复3次。接种后室温控制在25~31 ℃。接种72 h后,调查致病情况,根据各处理的病斑大小来评价各菌株的致病力差异。
(2)抗药突变体的菌丝生长速率和生长量。将供试突变体及其亲本菌株制成5 mm菌饼,移入PDA平板上28 ℃培养,分别在培养24、72、120 h时测定各菌株菌落直径。此外,各菌株取4块菌饼接入100 mL PDB液体培养基中,28 ℃黑暗振荡培养3 d后,取菌丝冻干称重,每处理2瓶,重复3次。
(3)pH值对抗药突变体菌丝生长的影响。用1 mol/L的HCl和NaOH将PDA培养基pH分别调节至4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0等9个梯度值,分别接种直径5 mm的突变体及其亲本菌株的菌饼,于28 ℃恒温条件下培养,每处理重复3次,培养4 d后测量各菌株菌落直径。
(4)温度对抗药突变体菌丝生长的影响。将直径为5 mm的突变体及其亲本菌株的菌饼分别接于PDA平板上,后分别置于16、20、24、28、32、36、40 ℃下培养,每处理重复3次,4 d后测量各菌株菌落直径。
1.3 数据处理
实验数据采用Excel 软件进行整理分析,采用T检验进行差异显著性分析。
2 结果与分析
2.1 瓜类疫霉对烯酰吗啉的敏感性
对分离自广西6个地区的116株瓜类疫霉进行烯酰吗啉的敏感性测定,结果表明(表1),10株属敏感菌株,占测试菌株的8.6%,106株属中间型菌株,占测试菌株的91.4%,以中间型菌株为优势类群,所有样区均未检测到抗性菌株。不同地区来源的瓜类疫霉对烯酰吗啉的敏感性差异较大,南宁样区的中间型菌株所占比例最大,达97.2%(35/36),桂林样区的中间型菌株所占比例最小,为85.7%(12/14)。比较不同寄主来源的瓜类疫霉对烯酰吗啉的敏感性,分离自冬瓜的瓜类疫霉群体中,均可以检测到中间型和敏感菌株,而来自于黄瓜的瓜类疫霉中,全部均为中间型菌株。
2.2 瓜类疫霉对烯酰吗啉的敏感性基线
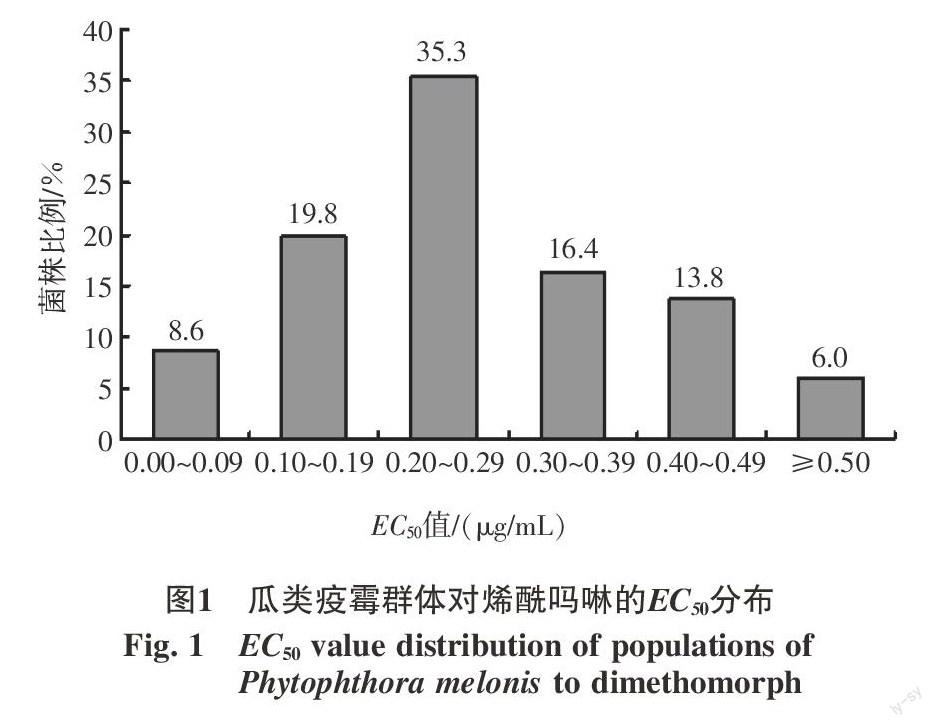
从116株瓜类疫霉的EC50值分布可以看出(图1),田间瓜类疫霉菌株对烯酰吗啉的敏感性呈单峰曲线,接近正态分布,未出现敏感性下降的亚群体,它们的EC50值在0.081 3~1.340 0 μg/mL之间,最大值是最小值的16倍,绝大部分菌株(98.3%)的EC50值﹤1.000 0 μg/mL,只有2株菌株 EC50超过1.000 0 μg/mL,因此可将116株菌株的平均EC50值(0.274 6±0.092 8)μg/mL作为瓜类疫霉对烯酰吗啉的敏感性基线。
2.3 室内抗药突变体的获得
通过室内药剂驯化,对8株敏感菌株进行抗药诱导,经120 d 20代继代培养筛选后,部分菌株的抗性指数随诱导代数增多呈现先升后降或先降后升的现象,而部分菌株经多代诱导后其抗药性反而比其亲本菌株降低。有3株菌株(DRGL-4,DRNN-14,DRYL-154)的抗性指数呈现稳定上升(图2)。经诱导第20代后,抗药突变体DRGL-4、DRYL-154和DRNN-14菌株的抗性指数分别为2.3、4.1和4.2,将这3株抗药突变体与其亲本菌株做进一步的生物学特性比较(以“DR”开头的菌株均为相应亲本菌株经诱导后获得的抗药突变体,如菌株DRYL-154是由亲本菌株YL-154经诱导后获得的抗药突变体,下同)。通过紫外线照射诱导筛选,未获得抗性指数大于2.0的突变体菌株。
2.4 抗药突变体的生物学特性
2.4.1 抗药突变体的致病力 接种72 h后致病力测定结果显示(图3),3株亲本菌株(GL-4,NN-14,YL-154)及1株突变体(DRNN-14)对冬瓜茎表现出很强的致病力,均在接种部位产生超过40 mm病斑,其中突变株(DRNN-14)与其亲本(NN-14)的致病力差异不明显,但其致病力弱于其亲本,另2株突变菌株(DRGL-4和DRYL-154)已对寄主冬瓜几乎丧失了致病力,仅在接种的茎蔓表面产生微小的病斑。致病力试验表明,抗药性的产生已在很大程度上降低了病原菌的致病力。
2.4.2 抗药突变体的菌落生长速率和菌丝干重
分别在培养的第24、72、120 h测量各突变体及其亲本的菌落直径,结果显示(表2),突变体菌株DRYL-154的菌落直径在不同时间段均比其亲本菌株YL-154的大,差异达显著水平,其余突变体菌株和对应的亲本菌株菌落直径均没有显著差异。3株抗药突变体菌株与其对应亲本菌株的菌丝干重不存在明显差异。
2.4.3 不同pH值对抗药突变体生长的影响 各突变体及其亲本在pH4.0~12.0的PDA上于28 ℃培养4 d,菌落直径测定结果表明(表3),突变体DRYL-154除在pH9-11时与其亲本的菌落直径没有差异外,其余pH培养条件下菌落直径均比其亲本大;突变体DRNN-14在pH为4和12两个较极端的pH条件下,其菌落直径明显大于其亲本菌落直径;而突变体DRGL-4在强碱性(pH11和12)环境下其菌落直径也显著大于其亲本菌落直径。试验结果说明部分敏感菌株经诱导后获得的抗药突变体比其亲本菌株较耐强酸或强碱环境。
2.4.4 不同温度对抗药突变体生长的影响 结果显示(表4),各突变体及其亲本菌株在16~36 ℃均能生长,以24~32 ℃范围内生长最快,最适宜生长温度为28 ℃。在16、20、24、28 ℃等4个温度培养条件下,突变体DRYL-154的菌落直径明显大于其亲本菌株;突变体DRNN-14在16 ℃和40 ℃两个较极端温度下菌落直径明显大于其亲本菌株,其余温度条件下菌落直径没有明显的差异;而另1株突变体DRGL-4在不同温度条件下与其亲本菌株的菌落直径相当。试验研究表明,部分敏感菌株经诱导后获得的抗药突变体在一定程度上比其亲本较耐高温或低温环境。
3 讨论与结论
研究发现不同地区来源和不同分离寄主的瓜类疫霉对烯酰吗啉的敏感性差异较大,如分离自黄瓜的瓜类疫霉中,没有分离到敏感菌株,全部为中间型菌株,原因可能为黄瓜的生长期较短,一年之中可以多茬种植,相应接触到杀菌剂的次数就会增加,相反,冬瓜的生育期较长,如桂北地区一年只能种植一茬,因此接触到杀菌剂的次数就会减少,从冬瓜上分离到的瓜类疫霉对烯酰吗啉的敏感性就会比分离自黄瓜的敏感。因此,作者认为瓜类疫霉对烯酰吗啉的敏感性与广西主要瓜类产区长期频繁施用烯酰吗啉杀菌剂有密切关系,这与瓜类疫霉对甲霜灵抗药性的研究结果[9]相一致。
评价病原对CAA类杀菌剂的抗药性风险,目前常采用药剂驯化、紫外线诱导及化学试剂诱变等方式获得抗药突变体。崔晓岚等[10]通过紫外线照射辣椒疫霉菌株N-7的菌丝,共获得了12株抗烯酰吗啉突变体,抗性指数在16.4~132.2,通过紫外照射菌株DZ-16的游动孢子,获得1株抗性指数为680倍的高抗水平的突变体;但袁善奎等[12]采用紫外线诱变菌丝的方法,从l株致病疫霉敏感菌株中获得3%突变频率的抗烯酰吗啉突变体,抗性倍数仅为1.5~1.9,未获得高抗水平的突变体。Stein等[17]则采用化学诱变剂溴化乙锭和紫外光处理相结合,获得抗性指数大于20.0的2株致病疫霉抗药突变株,而用含药培养基进行持续性驯化筛选,选到第10代时所获得突变体菌株的抗性指数均小于8.0;本研究对8株敏感菌株经120 d(20代)连续在含烯酰吗啉培养基上进行驯化后,部分菌株的抗性指数随驯化代数增多呈现先升后降或先降后升的现象,如菌株DRLZ-13第5代的抗性指数达4.1,第10代达最大值为87.3,之后第15代和第20代分别降到58.9和50.4,而部分菌株如DRGL-16经20代诱导后其抗药性反而比其亲本菌株降低,表明部分瓜类疫霉菌突变体对烯酰吗啉的抗药性极不稳定,仅3株突变体(DRGL-4,DRNN-14,DRYL-154)的抗性指数呈现稳定上升,到第20代时其EC50值分别为0.486 8、0.385 8、0.468 9 μg/mL,但它们仍属中间型菌株,未达到抗性(EC50值﹥10 μg/mL)菌株水平。在紫外线诱导抗药突变体时,紫外照射95%的菌落致死时间后,经7天培养,供试的5株菌株在培养基平板上均没有长成扇形角突变,在此基础上,进行二次紫外线照射再培养才获得1株抗药突变体(DRNN-308),抗性指数仅为1.4。由此可见,通过药剂驯化或紫外诱导等方法较难获得高抗水平的瓜类疫霉突变体。
适合度是抗性菌株和亲本菌株单独存在时的生存或致病能力的反映[18]。有文献报道,经诱导获得的抗药突变体,其菌丝生长率和侵染率均有所下降,适合度普遍降低,认为致病疫霉的大田抗性发展不太可能发生[17];部分研究结果也表明,对烯酰吗啉抗药性的产生没有导致突变体致病性丧失,但在RSA平板上的生长速率和产孢能力以及在离体叶盘上的产孢能力都较亲本菌株有显著下降,表明致病疫霉抗药突变体的总体适合度较敏感亲本有所下降,不利于抗药群体的发展[12]。崔晓岚等[10]的研究结果显示,部分突变体如菌株N-13的致病力与其亲本相比明显减弱,而其他突变体与其亲本菌株致病力相当,综合分析认为,抗性突变体的产生有利于辣椒疫霉抗药性群体的发展;本研究结果显示,在致病力方面,抗药突变体明显比亲本菌株减弱,部分突变体几乎已失去对原始寄主的致病力,但在不同pH和不同温度培养条件下,部分抗药突变体菌丝生长率与亲本菌株相比均有不同程度的提高。
烯酰吗啉用于疫病的防治已近30年的时间[19],但目前仍未见从大田中检测到抗性菌株的报道,此外,基于本研究的综合结果,作者认为在当前的大田管理水平和栽培模式下,瓜类疫霉抗药突变体群体在田间的形成和发展不大可能发生,烯酰吗啉仍属于低抗性风险的用于防治卵菌病害的有效杀菌剂,大田使用过程应注意与嘧菌酯、氰霜唑、霜脲氰、霜霉威等不同作用机理的药剂混配或轮换使用[8,20]。
参考文献
[1] 桂琦一. キュウリ疫病を起因するPhytophthora melonis n. sp.について[J]. 日本植物病理学会報, 1968, 34: 167.
[2] 吴永官, 蒋雅琴, 黄思良, 等. 华南瓜类疫霉的RAPD遗传多样性分析[J]. 菌物学报, 2015, 34(3): 410-423.
[3] 吴永官, 胡春锦, 黄思良, 等. 华南瓜类疫霉种群的致病力及其寄主嗜好性[J]. 植物保护学报, 2012, 39(2): 103-108.
[4] 朱豪红, 陈景成, 吴永官, 等. 玉林市黑皮冬瓜疫病发生影响因素分析及防治技术措施[J]. 中国植保导刊, 2009, 29(4): 22-23.
[5] Davidse L C, Hofman A E, Velthuis G C M. Specific interference of metalaxyl with endogenous RNA polymerase activity isolated nuclei from Phytophthora megasperma f. sp. Medicaginis[J]. Experimental Mycology, 1983, 7: 344-361.
[6] Parra G, Ristaino J B. Resistance to mefenoxam and metalaxyl among field isolates of Phytophthora capsici causing Phytophthora blight of bell pepper[J]. Plant Disease, 2001, 85: 1 069-1 075.
[7] Shew H D. Response of Phytophthora parasitica var. nicotianae isolates to metalaxyl exposure[J]. Plant Disease, 1985, 69: 559-562.
[8] 朱桂宁, 黄福新, 冯兰香, 等. 番茄晚疫病菌对甲霜灵、 霜脲氰和烯酰吗啉的敏感性检测[J]. 中国农业科学, 2008, 41(5): 1 355-1 365.
[9] 吴永官, 陆少峰, 黄思良, 等. 华南地区瓜类疫霉对甲霜灵的田间抗药性[J]. 微生物学报, 2011, 51(8): 1 078-1 086
[10] 崔晓岚, 孟庆晓, 毕 扬, 等. 辣椒疫霉对烯酰吗啉的敏感性基线及室内抗药突变体研究[J]. 植物病理学报, 2009, 39(6): 630-637.
[11] Chabane K, Leroux P, Bompeix G. Selection and characterization of Phytophthora parasitica mutants with ultraviolet-induced resistance to dimethomorph or metalaxyl[J]. Pestic Sci, 1993, 39: 325-329.
[12] 袁善奎, 刘西莉, 刘 亮, 等. 马铃薯晚疫病菌对烯酰吗啉的敏感性基线及其室内抗药突变体的研究[J]. 植物病理学报, 2005, 35(6): 545-551.
[13] Zhu S S, Liu X L, Wang Y, et al. Resistance of Pseudoperonospora cubensis to flumorph on cucumber in plastic houses[J]. Plant Pathology, 2007, 56: 967-975.
[14] 李卫民, 晏卫红, 黄思良, 等. 广西黑皮冬瓜疫病的病原菌鉴定及其生物学特性[J]. 植物病理学报, 2007, 37(3): 333-336.
[15] Gallegly M E, Hong C X. Phytophthora: Identifying species by morphology and DNA fingerprints[M]. Minnesota: American Phytopathological Society Press, 2008: 100.
[16] 胡 燕. 烟草黑胫病菌对烯酰吗啉的抗性风险研究[D]. 泰安: 山东农业大学, 2007.
[17] Stein J M, Kirk W W. The generation and quantification of resistance to dimethomorph in Phytophthora infestans[J]. Plant Disease, 2004, 88(9): 930-934.
[18] 翟明涛, 王开运, 许 辉, 等. 抗氟吡菌胺辣椒疫霉菌株的诱导及其生物学特性的研究[J]. 植物病理学报, 2014, 44(1): 88-96.
[19] Albert G, Curtze J, Drandarevski A C. Dimethomorph(CME 151), a novel curative fungicide[J]. Proceedings of the Brighton Crop Protection Conference-Pests and Diseases, 1988, 1: 17-23.
[20] Meng Q X, Cui X L, Bi Y, et al. Biological and genetic characterization of Phytophthora capsici mutants resistant to flumorph[J]. Plant Pathology, 2011, 60: 957-966.

