剑麻不定芽玻璃化过程中的细胞学和生理变化研究
张燕梅 李俊峰 陆军迎 鹿志伟 周文钊

摘 要 玻璃化问题是植物组织培养过程中的普遍现象,已成为植物组织快速繁殖的瓶颈。本研究以H.11648为材料,分析H.11648不定芽玻璃化过程中气孔形态、DNA含量、叶片含水量、可溶性蛋白含量、丙二醛(MDA)含量以及过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)和超氧化物歧化酶(SOD)等防御酶活性变化情况,结果表明:玻璃化后的不定芽叶片保卫细胞膨大,气孔变大。体细胞DNA含量没有变化,但细胞数减少。随着玻璃化程度的增加,叶片含水量显著增加,可溶性蛋白和丙二醛含量明显降低,POD活性显著上升,SOD活性先上升后又略有下降,但均显著高于正常水平,APX活性先明显上升后又恢复到正常水平,CAT活性略有下降但不显著。本研究为揭示剑麻不定芽玻璃化的生理机制提供参考。
关键词 剑麻;不定芽;玻璃化
中图分类号 S563.8 文献标识码 A
Abstract Hyperhydricity is a serious problem during in vitro culture of plant, and it is considered as a bottleneck to micropropagation of plants. Stomata form and DNA content, water content, concentrations of soluble protein and malonyldialdehyde, the activities of antioxidative enzymes, e.g. peroxidase(POD), catalase(CAT), ascorbate peroxidase(APX)and superoxide dismutase(SOD), were examined in adventitious shoots of H.11648. The results showed that guard cell expanded and the pore surrounded by the guard cues in hyperhydric leaves were more rounded in contrast to the elliptical pore in normal leaves. The DNA content was not changed while cell number decreased after hyperhydriciting. Hyperhydric shoots had higher water content,lower soluble protein and MDA concentration than normal shoots. The activities of antioxidant enzymes, such as POD and SOD significantly increased in hyperhydric shoots than in healthy shoots. CAT showed a slight decrease in activity in the hyperhydric leaves than in healthy leaves, APX activity significantly increased at H1 stage and then recovered normal levels at H2 stage. The results would provide a reference for revealing the physiological mechnism of hyperhydricity of adventitious shoots of H.11648.
Key words H.11648; Adventitious shoots; Hyperhydricity
doi 10.3969/j.issn.1000-2561.2016.10.010
剑麻是一种极具特色的热带纤维作物,它不仅是主要的热带纤维原料[1],同时剑麻茎心也是酿造龙舌兰酒的主要原料[2]。此外,剑麻汁液含有较高皂素,可用来制药[3],同时剑麻也可视为是一种重要的生物质能源作物[4-5],经济价值高。剑麻是营养体繁殖为主的植物,组培快繁是其重要的繁殖手段之一,然而,在剑麻植株再生过程中发现,不定芽玻璃化比较严重,玻璃化的植株常呈透明或半透明水渍状,叶片卷曲、膨大变厚且易碎,最终因无法正常生长而死亡[6-7](图1-c)。张燕梅等[8]曾通过改良培养基来克服剑麻再生植株玻璃化问题,但对于引起玻璃化的原因及机制还不是十分清楚。针对上述现象,本研究从生理和细胞学水平对玻璃化的剑麻进行了研究,旨在为探讨剑麻玻璃化的发生机理和控制玻璃化的发生提供参考。
1 材料与方法
1.1 材料
以主栽品种H.11648为试材,将其愈伤组织接种于不定芽诱导培养基上,不定芽诱导培养基参照张燕梅等[9]的方法。待不定芽长至2~3 cm时,采取叶片并按照玻璃化程度进行分级,其中0级为正常不定芽(H0),Ⅰ级为叶片玻璃化面积占总面积的1/2及以下(H1),Ⅱ级为叶片玻璃化面积占总面积的1/2以上(H2)(图1)。
1.2 方法
1.2.1 含水量测定 分别取0级、Ⅰ级和Ⅱ级的叶片1 g(G0),装入牛皮纸袋中,于80 ℃烘箱中烘干至恒重(G1),按下式计算叶片含水量:
叶片含水量/(g/g FW)=[(G0-G1)/G0]×100%
1.2.2 可溶性蛋白含量(μg/g)测定 分别取0级、Ⅰ级和Ⅱ级剑麻叶片0.5 g,采用考马斯亮蓝G-250染色法进行测定,具体参照高俊凤[10]的方法。
1.2.3 叶片下表皮气孔特征观察 取0级、Ⅰ级和Ⅱ级剑麻叶片,在显微镜(Nikon ECLIPSE 80i)下观察叶片下表皮气孔特征。具体参照张燕梅等[11]的方法。
1.2.4 流式细胞仪检测 取0级、Ⅰ级和Ⅱ级剑麻不定芽,采用流式细胞仪(Beckman)测定正常不定芽与玻璃化不定芽体细胞DNA的相对含量。具体参照Palomino等[12]方法进行。DNA含量由中国热带农业科学院热带作物品种资源研究所检测。
1.2.5 防御酶活性测定 分别取0级、Ⅰ级和Ⅱ级的剑麻不定芽0.5 g,加入2 mL提前预冷的酶液提取液后于冰浴下研磨成浆,再加提取液冲洗2~3次(总体积为5 mL),转入离心管中,于4 ℃ 10 000 r/min下离心15 min,取上清液分装后于4 ℃保存备用。
抗坏血酸过氧化物酶(APX)活性测定参考孙云等[13]的方法,以每分钟氧化1 μmol抗坏血酸(AsA)的酶量为一个酶活单位(U)。超氧化物歧化酶(SOD)活性测定参照南京建成公司的SOD试剂盒说明书进行,以每克鲜样中SOD抑制率达50%时所对应的SOD量为一个酶活单位(U)。过氧化氢酶(CAT)活性测定采用比色法,具体参照刘琳等[14]的方法,以每分钟内A240变化0.01为1个酶活性单位(U)。过氧化物酶(POD)活性测定采用愈创木酚法,具体参照邹琦[15]的方法进行,以每分钟内A470变化0.01为1个酶活性单位(U)。丙二醛(MDA)的含量测定参照Wang等[16]的方法进行。
1.3 数据处理
上述所有数据均采用SAS分析软件统计并进行差异显著性分析(p≤0.05)。
2 结果与分析
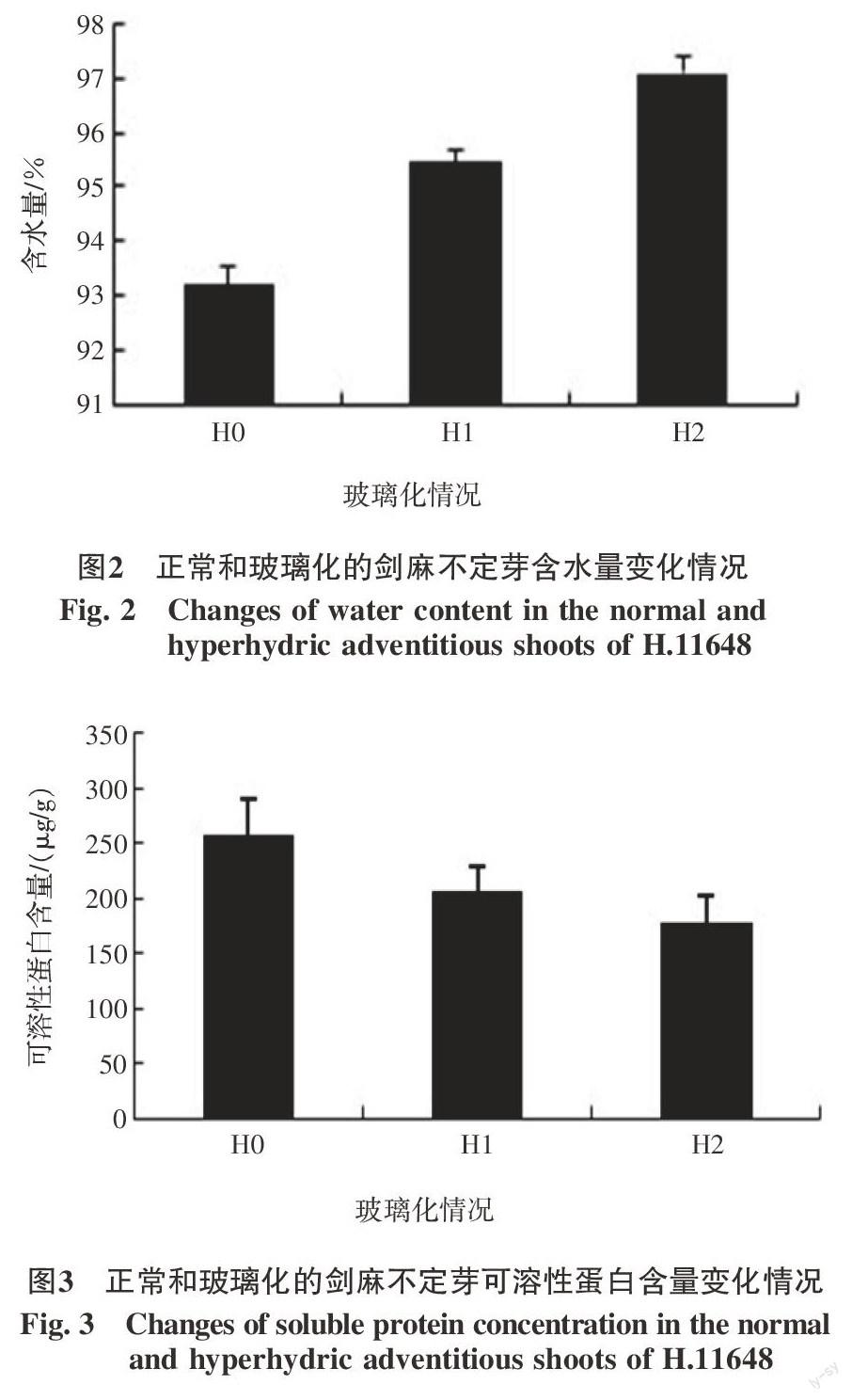
2.1 玻璃化过程中含水量变化情况
正常不定芽(H0)含水量为93.215%,部分玻璃化后的不定芽(H1)含水量为95.457%,玻璃化后的不定芽(H2)含水量为97.09%,玻璃化后的不定芽含水量显著高于正常不定芽含水量。在整个玻璃化过程中,不定芽含水量呈现明显递增趋势(图2)。
2.2 玻璃化过程中可溶性蛋白变化情况
正常不定芽(H0)可溶性蛋白含量为258.007 μg/g,部分玻璃化的不定芽(H1)可溶性蛋白含量为205.773 μg/g,玻璃化后的不定芽(H2)可溶性蛋白含量为178.282 μg/g,玻璃化后的不定芽可溶性蛋白显著低于正常不定芽可溶性蛋白。在整个玻璃化过程中,不定芽可溶性蛋白呈现明显递减趋势(图3)。说明在玻璃化过程中,蛋白质合成减少,分解速率增加。
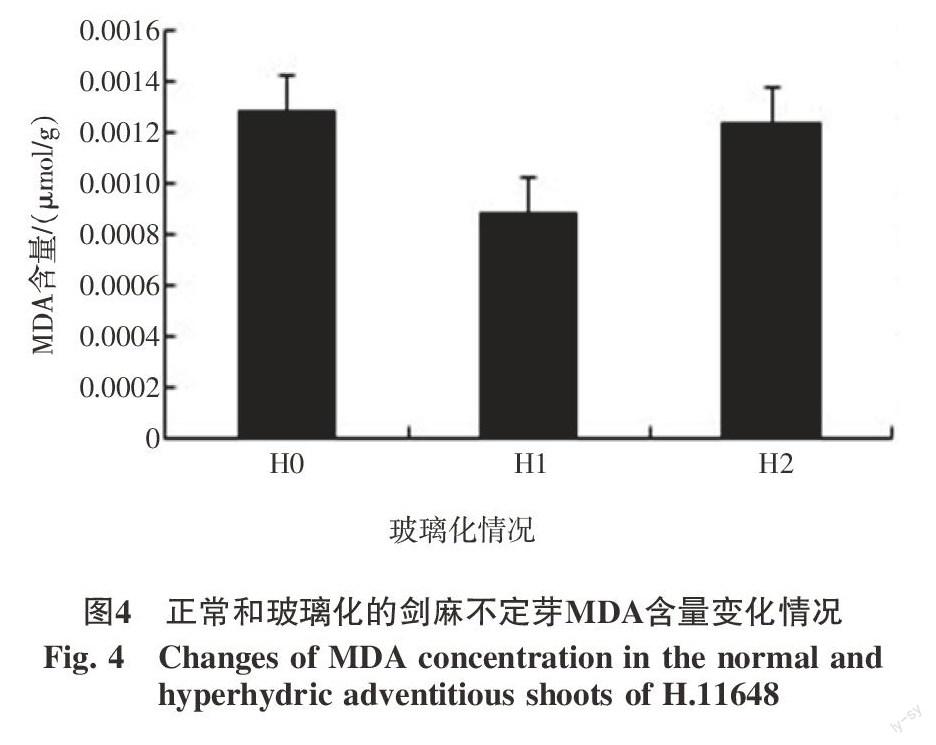
2.3 玻璃化过程中MDA含量变化情况
正常不定芽(H0)MDA含量为0.001 3 μmol/g,部分玻璃化(H1)时MDA含量明显下降,为0.000 9 μmol/g,但不定芽完全玻璃化(H2)时,MDA又略有上升,为0.001 2 μmol/g,在整个玻璃化过程中表现为先下降然后又恢复到正常水平(图4)。
2.4 叶片下表皮气孔特征观察
显微镜观察显示:正常叶片下表皮细胞呈长条形,排列整齐致密,2个肾形保卫细胞位于2个表皮细胞的交联处,气孔长条形,气孔和2个保卫细胞组成一个纺锤体形,放大后可看到大量的叶绿体整齐地排列在保卫细胞内(图5-a,5-d)。完全玻璃化(H2)后的叶片下表皮细胞明显比正常叶片下表皮细胞短、粗,保卫细胞膨胀并向内弯曲,气孔变大,气孔和2个保卫细胞组成一个球形。保卫细胞内的叶绿体数也明显减少(图5-c,5-f)。部分玻璃化的叶片下表皮细胞则处于两者之间,细胞有长条形,也有粗壮形,叶绿体减少不明显(图5-b,5-e)。另外,在单个视野内,气孔密度H0>H1>H2(图5-a,5-b,5-c)。
2.5 体细胞DNA相对含量测定
如图6所示:正常不定芽(H0)在荧光强度为55处出现了一个单峰(图6-a),玻璃化的不定芽(H2)在55处出现了一个单峰(图6-b),即在不定芽玻璃化过程中,体细胞DNA相对含量没有发生变化。在相同条件下,正常不定芽细胞数约500,玻璃化后的不定芽细胞数为280,即玻璃化后的细胞数目减少,细胞分裂减慢。
2.6 玻璃化过程中抗氧化酶APX、POD、CAT和SOD变化情况
剑麻不定芽玻璃化过程中4种抗氧化酶APX、POD、CAT和SOD变化情况如表1所示。正常不定芽APX活性为4 944.762 μmol/(g·min),在H1时显著上升,达到最高值6 665.357 μmol/(g·min),在H2时又略有下降,为4 420.952 μmol/(g·min),但与H0相比,降低不显著,在整个玻璃化过程中,APX活性呈现先上升后下降。CAT活性在整个玻璃化过程中呈现逐渐下降趋势,正常不定芽CAT活性为3 322.000 U/(g·min),H1时为2 837.778 U/(g·min),H2时为2 712.444 U/(g·min),随着玻璃化程度的增加,其活性下降但不显著。POD酶活性在玻璃化过程中呈递增趋势,在H0时为904.271 U/(g·min),H1时为1 340.486 U/(g·min),H2时最高,为2 102.343 U/(g·min),完全玻璃化后的不定芽POD显著高于正常不定芽。SOD酶活性在玻璃化过程中则先升高后下降,H0时为17.577 U/g,H1时最高,为29.713 U/g,H2又略有减低,为24.613 U/g,玻璃化后的不定芽(H1和H2)SOD酶活性均显著高于正常不定芽。
3 讨论与结论
玻璃化是植物组织培养过程中的普遍现象,在玛珈[16]、甜樱桃[17]、康乃馨[18]、拟南芥[19]、苹果[20]、大蒜[21]等植物中均有报道。本研究发现H.11648不定芽玻璃化过程中含水量增加,气孔变大且无法正常关闭。关于含水量与玻璃化的关系较为复杂,van den Dries等[19]认为玻璃化的叶片质外体腔中的水积累过多,气体体积严重变小,气体交换速率减慢,这样反过来会使质外体中乙烯,茉莉酸甲酯等浓度升高,从而导致植物玻璃化。气孔的大小和关闭是由保卫细胞细胞壁调控,玻璃化后的叶片保卫细胞木质素、纤维素等含量降低[22],次生壁和细胞板形成受阻,细胞无法正常分裂,细胞壁也随之受损,因此无法正确调控气孔的关闭[23],这与苹果[24]、康乃馨[25]、香草[26]等研究结果一致。
流式检测表明,在剑麻玻璃化过程中,体细胞数目减少,DNA相对含量不变。这与Franck等[17]的研究结果一致。Franck等[17]认为细胞数目减少是由于玻璃化过程中细胞分裂频率降低了,这样可以防止活性氧引起的子细胞DNA的损伤。Ochatt等[27]则认为,玻璃化能引起DNA含量的改变,但两者之间的因果关系仍需进一步的实验验证。此外,也有学者认为玻璃化不仅能引起DNA含量变化,还可引起染色体断裂、重排以及DNA甲基化等[28-30]。
本研究中的剑麻不定芽玻璃化过程中MDA含量下降,POD、SOD、APX和CAT抗氧化酶活性发生明显改变。SOD、CAT、 POD 和APX是4 个重要抗氧化酶,其中 SOD 能催化体内的歧化反应,使超氧阴离子自由基(O2·- )转化为 H2O2和O2,其在玻璃化过程中活性的显著升高可以减少剑麻不定芽玻璃化过程中由于活性氧爆发产生的超氧阴离子自由基对细胞膜的损害,这与Franck等[17]和Chakrabarty等[20]的研究结果一致。而POD、APX和CAT的高活性,则可进一步将H2O2分解成没有毒害的H2O和O2,维持H2O2的动态平衡,抑制MDA 的积累,从而降低膜脂过氧化程度,减缓玻璃化的发生[19]。
玻璃化是一个非常复杂的生理生化过程,本研究仅对剑麻不定芽玻璃化进行了初步的探讨,有关不定芽玻璃化过程中是否存在活性氧的爆发、活性氧与玻璃化的关系以及引起剑麻不定芽玻璃化的生理机制则需更深入的研究。
参考文献
[1] Iniguez-Covarrubias G, Diaz-Teres R, Sanjuan-Duenas R, et al. Utilization of by-products from the tequila industry. Part 2: potential value of Agave tequilana Weber azul leaves[J]. Bioresource Technology, 2001, 77(2): 101-108.
[2] Martinez-Aguilar J F, Pena-Alvarez A. Charactirization of five typical agave plants used to produce mescal through their simple lipid composition analysis by gas chromatography[J]. J Agric Food Chem, 2009, 57: 1 933-1 939.
[3] Mancilla-Margalli N A, Lopez M G. Generation of Maillard compounds from inulin during the thermal processing of Agave tequilana Weber Var. azul[J]. J Agric Food Chem, 2002, 50(4): 806-812.
[4] Chambers D, Holtum J A M. Feasibility of Agave as a feedstock for biofuel production in Australia[J]. GCB Bioenergy, 2011, 3(10): 58-67.
[5] Borland A M, Griffiths H, Hartwell J, et al. Exploiting the potential of plants with crassulacean acid metabolism for bioenergy production on marginal lands[J]. Journal of Experimental Botany, 2009, 60(10): 2 879-2 896.
[6] Zhang Y M, Xin L, Zhi C, et al. Shoot organogenesis and plant regeneration in Agave hybrid No.11648[J]. Scientia horticulturae, 2013, 161: 30-34.
[7] Kevers C, Franck T, Strasser R J, et al. Hyperhydricity of micropropagated shoots: a typically stress-induced change of physiological state[J]. Plant Cell Tiss Org, 2004, 77(2): 181-191.
[8] 张燕梅, 周文钊, 李俊峰, 等. 一种克服剑麻不定芽玻璃化的方法: 中国, ZL201210293863.3[P]. 2012-08-17.
[9] 张燕梅, 陈 志, 李俊峰, 等. 剑麻愈伤组织的诱导和再生体系的建立[J]. 热带作物学报, 2013, 34(1): 61-66.
[10] 高俊凤. 植物生理学实验指导[M].北京:高等教育出版社, 2006:142-143.
[11] 张燕梅, 李俊峰, 陆军迎, 等. 剑麻四倍体诱导与倍性鉴定[J]. 热带作物学报, 2013, 34(8): 1 409-1 415.
[12] Palomino G, Dolezel J, Méndez I, et al. Nuclear genome size analysis of Agave tequilana Weber[J]. Caryologia, 2003, 56(1): 37-46.
[13] 孙 云, 江春柳, 赖钟雄, 等. 茶树鲜叶抗坏血酸过氧化物酶活性的变化规律及测定方法[J]. 热带作物学报, 2009, 29(5):562-566.
[14] 刘 琳, 侯喜林, 王丽英, 等. 不结球白菜感染芜箐花叶病毒后4种防御酶活性变化及其抗病相关性[J]. 南京林业大学学报, 2009, 32(3): 14-18.
[15] 邹 琦. 植物生理学实验指导[M]. 北京:中国农业出版社, 2000.
[16] Wang Y L, Wang X D, Zhao B, et al. Reduction of hyperhydricity in the culture of Lepidium meyenii shoots by the addition of rare earth elements[J]. Plant Growth Regulation, 2007, 52(2):151-159.
[17] Franck T, Kevers C, Gaspar T, et al. Hyperhydricity of Prunus avium shoots cultured on gelrite: a controlled stress response[J]. Plant Physiology and Biochemistry, 2004, 42: 519-527.
[18] Saher S, Piqueras A, Hellin E, et al. Hyperhydricity in micropropagated carnation shoots: the role of oxidative stress[J]. Physiologia plantarum, 2004, 120: 152-161.
[19] van den Dries N, Giannì S, Czerednik A, et al. Flooding of the apoplast is a key factor in the development of hyperhydricity[J]. J Exp Bot, 2013, 64(16): 5 221-5 230.
[20] Chakrabarty D, Park S Y, Ali M B, et al. Hyperhydricity in apple: Ultrastuctural and physiological aspects[J]. Tree physiology, 2005, 26(3): 377-388.
[21] Wu Z, Chen L J, Long Y J. Analysis of ultrastructure and reactive oxygen species of hyperhydric garlic(Allium sativum L.)shoots[J]. In Vitro Cellular and Developmental Biology Plant, 2009, 45(4): 483-490.
[22] Zil M, Ariel T. The relationship between cell wall deformity and stomatal malfunction in the leaves of carnation in vitro[C]. Proceedings of the International Society Congress on Plant Molecular Biology, Jerusalem: Israel, 1988: 425.
[23] Laloi C, Apel K, Danon A. Reactive oxygen signalling: the latest news[J]. Curr Opin Plant Biol, 2004, 7(3): 323-328.
[24] Blanke M M, Belcher A. Stomata of apple leaves cultured in vitro[J]. Plant Cell Tissue Organ Cult, 1989, 19: 85-89.
[25] Meira Z I V. Quality of micropropagated plants-vitrification[J]. In Vitro Cell Dev Biol, 1991, 27: 64-69.
[26] Sreedhar RV, Venkatachalam L, Neelwarne B. Hyperhydricity-related morphologic and biochemical changes in Vanilla(Vanilla planifolia)[J]. J Plant Growth Regul, 2009, 28(1): 46-57.
[27] Ochatt S J, Muneaux E, Machado C, et al. The hyperhydricity of in vitro regenerants of grass pea(Lathyrus sativus L.)is linked with an abnormal DNA content[J]. J Plant Physiol, 2002, 159(9): 1 021-1 028.
[28] Bohr V A, Dianov G L. Oxidative DNA damage processing in nuclear and organellar DNA[J]. Biochimie, 1999, 81: 155-160.
[29] Cerda S, Weitzman S A. Influence of oxygen radical injury on DNA methylation[J]. Mutation Res, 1997, 386: 141-152.
[30] Kaeppler S M, Phillips R L. DNA methylation and tissue culture induced variation in plants[J]. In Vitro Cell Dev Biol, 1993, 29: 125-130.

