芒果采后炭疽菌Colletotrichum asianum鉴定及生物学特性研究
孙珊 谭丽玲 庞小婧 吴文嫱 黄东益 黄小龙
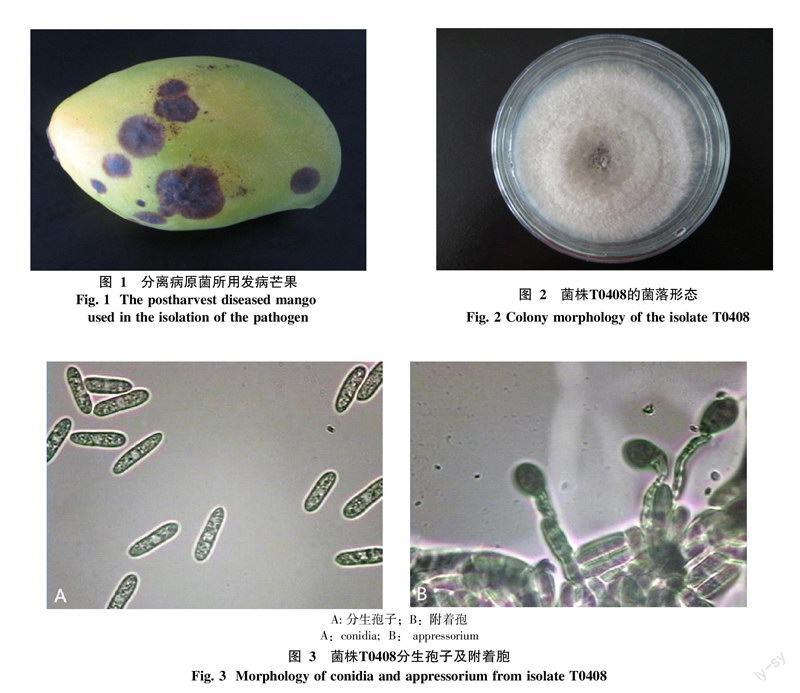

摘 要 采用组织块分离法从采后发病芒果果肉中分离病原菌,通过形态学观察、rDNA-ITS序列和系统发育树分析对其进行鉴定,并初步研究其生物学特性。结果表明:从发病芒果中分离到的病菌T0408鉴定为Colletotrichum asianum Prihastuti, L. Cai & K.D. Hyde。该菌菌丝生长的适宜温度为20~30 ℃、适宜pH值为5~8;环境湿度在75%~98%范围内,湿度越大,菌丝生长速度越快,在3 000 lx日光灯的光照强度下连续光照有利于菌丝的生长和产孢;孢子萌发的适宜温度为25~30 ℃、适宜pH值为6~8,环境湿度为75%~98%,湿度越大、在3 000 lx日光灯的光照强度下连续光照有利于孢子的萌发。
关键词 芒果;采后病害;炭疽病
中图分类号 S667.7 文献标识码 A
芒果(Mangifera indica L.)为漆树科芒果属植物,因其营养丰富、口味独特、外形美观而被誉为“热带水果之王”。原产于亚洲南部热带的印度、缅甸、泰国、印度尼西亚、菲律宾一带,现已广泛分布于热带、亚热带地区。中国芒果主要分布在海南、广西、广东、云南、四川、福建和台湾,经过多年发展,芒果产业已经成为中国热区重要的农业支柱产业之一[1-2]。
芒果采后病害是导致芒果采后损失的主要原因之一,严重影响着芒果的贮运质量、贮藏期和货架期, 造成果实大量腐烂和严重的经济损失。据报道,每年中国的芒果采后损失高达20%~30%,而发达国家的采后损失也达到15%左右[3]。芒果采后病害有炭疽病、蒂腐病、果腐病、黑腐病、黑星病等,其中炭疽病是导致采后果实腐烂的主要病害之一[4]。引起芒果采后炭疽病的病原菌主要是胶孢炭疽菌(Colletotrichum gloeosporioides)[5],其次是尖孢炭疽菌(Colletotrichum acutatum)[6]。但Phoulivong等[7]报道了引起泰国芒果采后炭疽病的病原菌为Colletotrichum asianum而非前人所报道的C. gloeosporioides。Honger等[8]也证实从感病的芒果果实、叶片和花序上分离到60株病原真菌,其中来自加纳的16株和来自墨西哥的5株鉴定为C. asianum。最近笔者从海南椰香芒(Dashehari)采后病斑的病健交界处分离到一株炭疽菌(编号T0408),该菌致病性较强,具有进一步研究的价值。本研究采用形态学特征、rDNA-ITS 序列和系统发育树分析等方法对其进行种类鉴定,并对该菌生物学特性进行研究,以期为芒果采后炭疽病的防治提供理论依据。
1 材料与方法
1.1 材料
用于病原菌分离的发病芒果购自海南大学水果街,用于致病性测定和回接炭疽菌的健康芒果购自海南大学附近的南国超市,品种均为椰香芒。
1.2 方法
1.2.1 病原菌的分离纯化 参照何秀娟[9]的方法并稍加改进,将发病果实先用自来水清洗,再用去离子水冲洗干净,在病健交界处切取长5 mm×5 mm的正方形组织块,在0.1%升汞中浸泡30 s,立即取出,然后用无菌水清洗3次,再刮取黏在果皮内部的黑色发病组织,放在PDA平板上,28 ℃培养3~4 d,在组织块周围长出的菌落边缘挑取菌丝在PDA平板上点接培养,进一步采用单胞分离的方法纯化得培养物。
1.2.2 病原菌的致病性测定 参照何秀娟[9]的方法并稍加改进,取健康无病的椰香芒,用自来水洗净果皮并用75%酒精浸泡2 min,然后无菌水清洗3次,用脱脂棉吸干表面水分后,采用刺伤接种法,每个果实刺伤2个点,将培养8 d的菌丝块(Φ=5 mm)接种于刺伤点上,3个重复,以接种无菌PDA培养基为对照,置于保鲜盒中保湿(保鲜盒中放入2张无菌滤纸,并加入少量无菌水),于28 ℃培养箱中培养待其发病,并对发病组织的病原菌按组织分离方法分离,接种后分离获得菌株与原分離菌株形态一致的则鉴定为病原菌。
1.2.3 病原菌形态学鉴定 (1)病原菌的培养性状观察 参照朱桂宁等[10]的方法进行,将分离到的菌株T0408移接于PDA平板上,28 ℃培养7~8 d,观察菌落形态和颜色,并挑取少量分生孢子于显微镜下观察,检测分生孢子的形状、大小及数量。
(2)病原菌的附着胞诱发培养及观察 参照朱桂宁等[10]的方法,在干净的凹玻片上分别滴1滴无菌水和1滴1%葡萄糖溶液,将菌株T0408的分生孢子分别挑入无菌水和葡萄糖溶液中,再将凹玻片放入有湿润的无菌滤纸片的培养皿内,28 ℃下保湿培养15~24 h,观察分生孢子的萌发情况及附着胞的形态特征。
1.2.4 病原菌分子鉴定 菌株T0408基因组DNA提取及rDNA-ITS扩增参照陈吉良等[11]的方法,PCR扩增引物为ITS-1 5′-TCCGTAGGTGAACCTGC
GG-3′,ITS-4:5′-TCCTCCGCTTATTGATATGC-3′。PCR产物送至上海生工生物工程技术服务有限公司测序,ITS序列测序后,利用NCBI中BLAST在线比对服务进行同源性比较分析,并以Neighbor-Joining方法构建系统发育树。
1.2.5 病原菌生物学特性研究 (1)不同温度对菌丝生长及孢子萌发的影响:将菌株T0408在PDA平板上培养7 d,沿菌丝生长前沿(呈同心圆状),用直径5 mm打孔器制成小菌碟,分别移接1枚于PDA平板中央。分别置于10、15、20、25、30、35和40 ℃的温度下倒置恒温培养7 d,设3次重复。逐日定时定点按十字交叉法测量菌落直径,计算菌丝日均生长速度。
取浓度为1×105个/mL分生孢子悬浮液20 μL, 滴于干燥洁净凹型玻片上,盖上盖玻片,分别放置在10、15、20、25、30、35和40 ℃温度下恒温培养10 h,镜检分生孢子萌发率,计数孢子数量,设3次重复。当芽管长度大于或等于孢子长度的一半时认定为萌发。
(2)不同湿度对菌丝生长及孢子萌发的影响:利用饱和盐或硫酸在25 ℃下对湿度的影响,分别在密闭的玻璃容器中设置98%、93%、90%、85%、80%、75%的相对湿度(RH)。接种方法同(1),将接种好的PDA平板敞口放置于调节好相对湿度的玻璃容器内,25 ℃恒温培养7 d,每一湿度设3次重复,计算菌丝日均生长速度。
取浓度为1×105个/mL分生孢子悬浮液20 μL,滴于干燥洁净玻片上,在超净工作台上迅速风干,分别置RH为98%、93%、90%、85%、80%、75%的密闭玻璃容器中,置25 ℃下恒温培养10 h,镜检分生孢子萌发率。
(3)不同pH对菌丝生长及孢子萌发的影响:在PDA培养基凝固之前,用1 mol/L HCl或1 mol/L NaOH分别调节pH值为4,5,6,7,8和9,倒入无菌培养皿中,制成pH值分别为4,5,6,7,8和9的PDA平板,接种方法同(1),28 ℃恒温培养7 d,计算菌丝日均生长速度。
将浓度为1×105个/mL分生孢子悬浮液,用1 mol/L HCl或1 mol/L NaOH分别调节pH值为4,5,6,7,8和9,接种方法同(1),25 ℃恒温培养10 h,镜检分生孢子萌发率。
(4)不同光照对菌丝生长及孢子萌发的影响:参照刘爱媛等[12]的方法。在PDA平板上移入直径5 mm的小菌碟,分别置于连续光照(3 000 lx日光灯)、12 h光暗交替、完全黑暗3种光照条件下25 ℃培养7 d后测量菌落半径和产孢量,3次重复。
将滴有20 μL(浓度为1×105个/mL)分生孢子悬浮液的载玻片置于上述3种光照处理下,25 ℃保湿培养10 h后镜检萌发率。3次重复。
2 结果与分析
2.1 病原菌T0408的分离及形态鉴定
在发病芒果果实(图1)病斑处,采用组织分离法分离到芒果炭疽病病原菌菌株T0408。该菌在PDA平板上生长,菌落圆形,边缘整齐,初为白色,后从中央到边缘逐渐转为灰白色,具有同心轮纹,菌丝绒毛状,7 d左右中央菌丝上出现褐色或橘色分生孢子堆(图2)。分生孢子单胞,棍棒形,两端钝圆,无色透明,大小为(11.0~21.0)μm×(2.0~4.0)μm(图3);在无菌水中培养的分生孢子未萌发产生附着胞,在1%葡萄糖溶液中培养的分生孢子萌发,部分产生附着胞,附着胞近圆形或不规则形,浅褐色或深褐色(图3)。上述形态鉴定结果与James等[13]和Prihastuti等[14]对分离自芒果和咖啡豆的C. asianum描述相似,故将菌株T0408初步鉴定为Colletotrichum属的病菌。
2.2 病原菌的致病性测定
将菌株T0408接种到健康芒果果实上,开始接口发黑,后有白色菌丝长出,4 d后产生明显症状,病斑黑色、圆形或近圆形,病健交界明显(图4-B)。7 d后病斑扩大至直径2.3~2.7cm,病斑表面产生大量黑色小颗粒,为分生孢子器(图4-C)。后期果肉液化、流汁,白色菌丝布满果实,最后全果腐烂(图4-D)。表明菌株T0408对芒果具有较强的致病性。
2.3 病原菌rDNA-ITS测序与分析
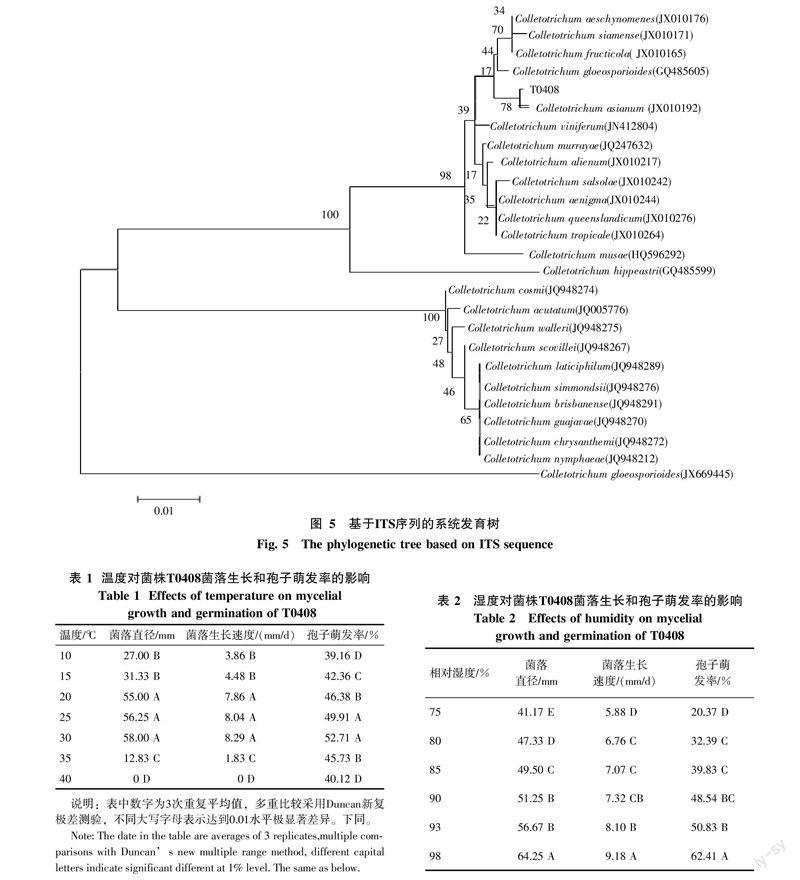
测序获得菌株T0408的ITS序列长度为536 bp(登录号:KX710103),将该序列在NCBI上进行BLAST 比对发现,该菌株ITS序列与GenBank已提交的C. asianum序列(登录号:JX010192;KU498256;KC702983;KC820803)相似性为99%~100%,将菌株T0408的ITS序列与GenBank中的同属真菌构建系统发育树(图5)结果显示,分离所得菌株T0408与C. asianum归为同一类群,且种群间具有明显地区别,上述结果与病原菌的形态鉴定结果一致,由此可以进一步确定本研究中引起芒果炭疽病的病原菌为C. asianum。
2.4 病原菌生物学特性研究
2.4.1 温度对菌落生长及孢子萌发的影响 在10~40 ℃,该菌菌落均能生长,但生长速度不同,20~30 ℃适合该菌生长,35 ℃时,该菌菌落生长速度下降明显(表1),40 ℃时菌落不生长。在10~40 ℃,该菌的孢子均能萌发,但萌发率有所不同,其中25~30 ℃适合孢子萌发,30 ℃孢子萌发率最高,10 ℃孢子萌发率最低(表1)。
2.4.2 湿度对菌落生长及孢子萌发的影响 当环境相对湿度(RH)控制在75%~98%时,该菌均能生长,但培养7 d后该菌的菌落直径不同,日均生长速度也不同,该菌的孢子在此相对湿度范围之内也可以萌发。其中,随着相对湿度增加,菌落的日均生长速度、孢子的萌发率均增长,当相对湿度达到98%时,两者均达到最大值(表2)。
2.4.3 pH对菌丝生长及孢子萌发的影响 在pH值4~9时,该菌均能生长,但是不同pH值的培养环境下,培养7 d后该菌的菌落直径不同,菌丝日均生长速度也不同,pH值为5~7时适合菌丝生长,其中pH值為6时,菌丝生长速度最快。在实验所设置的pH值范围内,该菌的孢子也均可萌发,但是孢子萌发率有所不同,pH值为5~8时适合孢子萌发,其中pH值为7时,孢子萌发率最高(表3)。
2.4.4 光照对菌丝生长及孢子萌发的影响 在3种光照条件下,该菌均能生长、产孢,孢子也均可萌发,但是不同光照条件下培养7 d后,发现该菌的菌落直径不同。在连续光照的条件下,该菌生长最快、产孢量最多,孢子的萌发率也最高;在12 h光暗交替的条件下该菌生长良好,但此处理下产孢量和孢子萌发率均显著低于连续光照处理下的产孢量和孢子萌发率。完全黑暗处理不利于该菌生长、产孢以及孢子萌发(表4)。
3 讨论与结论
炭疽病菌(Colletotrichum asianum Prihastuti, L. Cai & K.D. Hyde)是Prihastuti等[14]从泰国的咖啡豆中分离得到,并进行了新种鉴定。随后Phoulivong等[7]从泰国感病的芒果、红辣椒果实中也分离到该菌种。此后,在加纳、澳大利亚、哥伦比亚、日本、巴拿马和菲律宾等国家的芒果上都发现了C. asianum, 并对当地的芒果果实造成了一定的危害[8,15]。但国内至今尚未见报道,本研究从海南发病香芒中分离到的炭疽菌T0408,通过形态与ITS序列分析将其确定为C. asianum。尽管该菌在国外已有报道,但均未对其生物学特性进行过研究。鉴于此,开展炭疽菌T0408(C. asianum)生物学特性研究对指导该病的防治更加必要和有意义。本研究发现,炭疽菌株T0408菌丝生长的适宜温度为20~30 ℃,40 ℃仍能生长;分生孢子在10~40 ℃范围内均能萌发,孢子萌发的适宜温度为25~30 ℃;菌丝适宜生长的pH值为5~8,孢子适宜萌发的pH值为5~8。与黄思良等[16]报道的芒果炭疽病菌C. gloeosporioides的生物学特性比较,炭疽菌株T0408在菌丝生长、孢子萌发的适宜温度和pH等方面与C. gloeosporioides相似,但炭疽菌株T0408相对更耐热些。此外,炭疽菌株T0408在相对湿度越大的环境下,菌丝生长和孢子萌发速度越快,这与C.gloeosporioides的特性也基本一致。而连续光照有利于炭疽菌株T0408菌丝的生长和产孢,这与炭疽病菌C. gloeosporioides存在差异。本研究结果可为炭疽病菌C. asianum病情的预测预报提供一定的参考,从而达到预防该病害发生的目的。而有关该菌的营养特性、致死温度(耐热性)以及常用药剂的敏感性等还有待进一步探讨。
参考文献
[1] 陈 菁, 韦家少, 易小平,等. 海南西南部芒果營养特性的研究[J]. 热带作物学报, 2001, 22(4): 23-28.
[2] 贺军虎, 陈业渊, 魏守兴. 中国杧果产业的现状、存在问题与发展对策[J]. 热带农业科学, 2006, 26(6): 59-62.
[3] 罗云波, 生吉萍. 园艺产品贮藏加工学(贮藏篇)[M]. 北京: 中国农业大学出版社, 2010.
[4] 胡美姣, 高兆银, 李 敏,等. 杧果果实潜伏侵染真菌种类研究[J]. 果树学报, 2012, 1: 105-110.
[5] Dodd J C, Estrada A B, Matchmen J, et al. The effect of climatic factors on Colletotrichum gloeosporioides, causal agent of mango anthracnose, in the Philippines[J]. Plant Pathology,2007, 40(4): 568-575.
[6] Fitzell R D. Colletotrichum acutatum as a cause of anthracnose of mango in New South Wales[Australia][J]. Plant Disease Reporter, 1979, 63: 1 067-1 070.
[7] Phoulivong S, CaiL, Chen H, et al. Colletotrichum gloeospori-
oides is not a common pathogen on tropical fruits[J]. Fungal Diversity, 2010, 44(1): 33-43.
[8] Honger J O, Offei S K, Oduro K A, et al. Identification and species status of the mango biotype of Colletotrichum gloeosporioides in Ghana[J]. Eur J Plant Pathol, 2014, 140(3): 455-467.
[9] 何秀娟. 筛选芒果采后炭疽病和蒂腐病的生防菌研究[D]. 武汉: 华中农业大学, 2006.
[10] 朱桂宁, 蔡健和, 胡春锦,等. 广西山药炭疽病病原菌的鉴定与ITS序列分析[J]. 植物病理学报, 2007, 37(6): 572-577.
[11] 陈吉良, 黄小龙, 吴安迪,等. 一种快速高效提取病原真菌DNA作为PCR模板的方法[J]. 菌物学报, 2011, 30(1): 147-149.
[12] 刘爱媛, 陈维信, 李欣允. 荔枝炭疽病菌生物学特性的研究[J]. 植物病理学报, 2003, 33(4): 313-316.
[13] James R S, Ray J, Tan Y P, et al. Colletotrichum siamense,C. theobromicola and C. Queenslandicum from several plant species and the identification of C. asianumin the Northern Territory, Australia[J]. Australasian Plant Dis Notes, 2014, 9(1): 1-6.
[14] Prihastuti H, Mckenzie E H C, Hyde K D, et al. Characterization of Colletotrichum species associated with coffee berries in Chiang Mai, Thailand[J]. Fungal Diversity, 2009, 39(2): 89-109.
[15] Weir B S, Johnston P R, Damm U. The Colletotrichum gloeosporioides species complex[J]. Studies in Mycology, 2011, 73(1): 115-180.
[16] 黄思良,霍秀娟,韦 刚. 芒果炭疽病菌, Colletotrichum gloeosporioides的生物学特性[J]. 西南农业学报, 1999(2): 83-89.

