蓖麻根际土壤解钾菌的筛选鉴定及发酵条件的优化
张妙宜 陈宇丰 周登博 起登凤 高祝芬 张锡炎


摘 要 为了提高钾肥的利用效率,根据解钾菌的特性及分离方法,从药用植物蓖麻根际土壤中分离出6株高效解钾菌,测定并分析它们的解钾效率。结果表明:获得1株最高效、稳定的解钾细菌,将其命名为MY-1。通过形态观察、生理生化特性和16S rDNA基因序列分析,初步鉴定菌株MY-1是嗜线虫赛雷氏菌(Serratia nematodiphila)。并对菌株MY-1的发酵条件进行优化,确定其在温度37 ℃,时间24 h,钾长石粉量为10 g,pH值为5,摇床转速为250 r/min,以蔗糖和硫酸铵为碳、氮源时,发酵效果最佳,发酵液中可溶性钾含量最高,达65.04 mg/L。菌株MY-1有稳定且较强的解钾能力,将为今后微生物菌肥研究、开发及土壤肥力优化提供理论依据。
关键词 蓖麻;根际土壤;微生物;解钾;发酵条件优化
中图分类号 S565.6 文献标识码 A
蓖麻系蓖麻属大戟科一年或多年生草本喜温作物,原产地非洲东部,适种于热带地区[1],其综合利用价值高,是世界上十大油料作物之一,具有一定的药用价值。它周身是宝,从叶片、茎秆到根部均可入药,根系发达,呈圆锥形,主根入土可深达2~4 m,侧根横向分布可达1.5~2 m,耐旱性和抗贫瘠能力极强[2]。在含钾量高的盐碱地中,蓖麻的另一“耐盐”特性能运用自身的耐盐性机制从根部向地上部运输,提高钾的吸收效率,维持钾、钠离子的平衡[3]。
地壳矿质元素中排名第7位的钾元素含量为2.47%,是作物生长的重要营养要素之一[4],对促进作物生长发育、提高代谢能力、增强酶活性和作物光合作用,以及增强作物抗病、抗冻、抗旱、抗盐等能力起重要作用[5]。然而钾在土壤中有95%是以矿物钾的形态存在于钾长石和云母这两大矿物中,无法被作物直接吸收利用,在农业生产过程中使用化肥钾肥补充作物生长所需的钾元素,见效虽快,却破坏了土壤结构、造成有机质含量逐年下降[6],不利于生态平衡与农业生产持续健康稳定的发展。
硅酸盐细菌(Silicate bacteria)俗称“解钾菌”,大量存在于土壤中,1912年被Bassalik首次分离于蚯蚓肠道中,1939年被科研人员从土壤中分离并被正式命名,1950年其释放铝硅酸盐矿物中钾元素的能力被前苏联学者亚历山大罗夫发掘[7],之后人们开始尝试研究利用其改善土壤中可溶性钾严重缺失的状况。解钾菌能分解土壤中钾长石等不溶性无机矿物质,将其转化为可供作物直接吸收利用的有效钾,溶磷固氮、改善作物氮磷营养[8],促进作物生长,改良土壤环境。
近年来更有研究结果表明,根际解钾菌比普通解钾菌更能产生对土壤微生物活性有促生作用的分泌物[9]。根际土壤解钾菌通过刺激作物生长激素分泌,增强作物对环境的胁迫耐性和对病原菌的抗病性[10]。史静静[11]从棉花根际分离筛选出5株(K1111、K1114、K2115、K3105和K3205)具有亲和性的促生效果明显的优良PGPR菌株;罗娜等[12]从降香黄檀、檀香根际土壤中分离筛选出解钾率高达221.18%的恶臭假单胞菌JT-K21。苟志辉[13]从油茶根际分离纯化出73株解钾细菌,其中菌株K50的活性达121.71 mg/kg;陈宇丰[14]从香蕉根际土壤中筛选出16株高效解钾菌,并最终获得解钾率约为20%的陕西链霉菌(Streptomyces shaanxiensis)M3-4。但受气候、土壤类型、作物品系等综合因素的影响,作物根际土壤解钾菌的解钾能力在一定程度上受到制约。
本研究以钾长石粉为唯一钾源对蓖麻根际土壤进行解钾细菌的分离与筛选,获得6株解钾能力较强的细菌,选取其中1株抗逆性较好,生长能力较强,且解钾能力最佳的解钾细菌MY-1作为研究对象,通过观察菌株的形态、生理生化特征,分析16S rDNA序列;优化发酵条件,测定该解钾菌株的解钾能力,为研究开发具有稳定高效解钾能力的作物根际解钾菌提供理论基础,以缓解当前土壤“少钾”现状。
1 材料与方法
1.1 材料
1.1.1 样品采集 土壤样品分别采自海南省临高县南宝镇、美台镇、皇桐镇3地的蓖麻植株根际土壤。采用五点交叉取样法,共采集土样8份,分别放入无菌封口袋中混匀、封口、编号,装入冰盒内保存后,除去根系、石块等杂物,4 ℃保存备用。
1.1.2 仪器设备 超净工作台:SW-CF-1F,苏州苏洁净化设备有限公司;生化培养箱:SPX-150,北京恒瑞天创机电设备有限公司;冷冻离心机:ST16R,德国Thermo公司;PCR仪:9701,赛飞(中国)有限公司;水平电泳槽:HR/022,北京恒瑞天创机电设备有限公司;凝胶成像仪:BG-gds Auto,北京百晶生物技术有限公司;恒温水浴锅:HHS-11-2,杭州汇尔仪器;紫外可见分光光度计:UV1000,上海天美科学仪器有限公司。
1.1.3 主要试剂 分析纯试剂:磷酸二氢钾、硫酸镁、氯化钠、无水硫酸钙、碳酸钙、磷酸氢二钠、氯化铁、蔗糖等;生化试剂:酵母粉、胰蛋白胨、琼脂、四苯硼钠等。
1.1.4 培养基 分离培养基:葡萄糖10.0 g,碳酸钙5 g,磷酸二氢钾0.2 g,硫酸镁0.2 g,无水硫酸钙0.2 g,氯化钠 0.2 g,琼脂15 g,去离子水1 000 mL,pH7.2;筛选培养基:蔗糖5 g,磷酸氢二钠2 g,硫酸镁0.5 g,碳酸钙0.1 g,氯化铁0.005 g,土壤矿物1 g,琼脂20 g,蒸馏水1 000 mL,pH7.0~7.5;LB营养培养基:酵母粉5 g,胰蛋白胨10 g,氯化钠l0 g,琼脂20 g,去離子水1 000 mL,pH7.2~7.5。
1.2 方法
1.2.1 根际土壤解钾菌的分离、筛选 (1)初筛:将新鲜土样(10 g)放入无菌水(90 mL)中,利用磁力搅拌器充分混合均匀后,在无菌操作条件下,采用稀释涂布平板法分别配制10-4、10-5、10-6三个浓度梯度的土壤悬液备用,各吸取100 μL悬液涂布于分离培养基上(每个梯度设3个重复),37 ℃下培养1~3 d,观察细菌菌落生长和形态特征,运用平板划线法纯化直至获得纯培养。
(2)复筛:将初筛获得的纯化菌株转接到以钾长石为唯一钾源的筛选培养基上,37 ℃下培养2 d,采用四苯硼钠滴定法测定钾,菌落周围呈现亮蓝色,初步确定含有解钾细菌,将其纯化得到6种菌株,分别编号MY-1、MY-2、MY-3、MY-4、MY-5、MY6,并保存至LB斜面培养基上扩大培养。
(3)解钾能力测定:将测定取出的培养液样品倒入蒸发皿中,用恒温水浴锅干燥蒸馏至10 mL,加入4 mL H2O2继续蒸发除去菌体及残渣至无粘稠物,4 ℃,4 000 r/min,离心10 min,收集上清液至容量瓶(50 mL)中定容。同时设置空白对照(未接种),每个处理重复3次,利用火焰原子吸收光度计测定钾含量(mg/L)。
1.2.2 解钾菌的鉴定 (1)菌株形态学和生理生化鉴定:将保藏处理的菌种活化后,37 ℃下培养1~3 d,观察其菌落形态特征,然后挑取菌株分别进行细菌革兰氏、荚膜、芽孢染色镜检观察,并参考《常见细菌鉴定手册》[15]、《伯杰氏细菌鉴定手册》[16]对菌株进行生理生化测定。
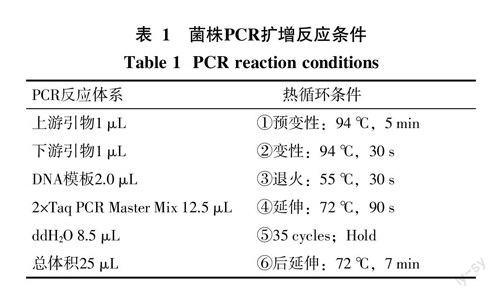
(2)菌株16S rDNA分子生物学鉴定:将活化后的菌种接入LB液体培养基中,选用16S rDNA通用引物27F(5′-AGAGTTTGATCCTG-GCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),建立PCR扩增体系进行扩增(表1)。
扩增处理后的DNA样品,经1%琼脂糖凝胶电泳预检测后,送往北京六合华大基因股份有限公司纯化测序,获得DNA序列后输入GenBank,用Blast程序与数据库中的所有序列进行比对,使用邻接法Neighbor Joining method[17]选取最相似的模式菌株作为参比对象,运用MEGA5.05软件构建系统发育树。
1.2.3 解钾细菌发酵条件优化 解钾菌自身的遗传特性、种类成分决定了它对难溶性钾矿石有高效的解钾作用,为尽可能地使菌株MY-1的解钾量达到最大化,本研究通过优化菌株的培养时间、pH值、钾长石粉量、摇床转速、碳源种类、氮源种类共6个因素,设定每个因素适合的水平数,并通过单因素方差设计,分析在不同培养条件下解钾菌MY-1的解钾量变化,得出MY-1的最佳发酵条件。
(1)培养时间对解钾量的影响:在LB培养基上将已筛选出的解钾菌株培养24 h,然后接种到无菌水中,置于摇床上充分震荡,制成悬液备用;另配制解钾培养基(无钾),取100 mL分装于已加有1 g钾长石粉的三角瓶(250 mL)内,121 ℃,25 min灭菌后,接入1%接种量的备用悬液,37 ℃,150 r/min,分别在培养12、24、36、48、60、72 h后取样。
(2)pH值对解钾量的影响:配制解钾菌备用悬液和无钾解钾培养基(步骤同上),调节培养液pH值分别为3、4、5、6、7、8、9,培养2 d后取样。
(3)钾长石粉量对解钾量的影响:配制解钾菌备用悬液和无钾解钾培养基(步骤同上),分别加入0.5、1、1.5、2.5、5、10 g的钾长石粉,培养2 d后取样。
(4)摇床转速对解钾量的影响:配制解钾菌备用悬液和无钾解钾培养基(步骤同上),分别置于50、100、150、200、250 r/min转速的摇床上振荡,培养2 d后取样。
(5)不同碳源种类对解钾量的影响:配制解钾菌备用悬液和无钾解钾培养基(步骤同上),分别以葡萄糖、蔗糖、乳糖、果糖、淀粉、麦芽糖为碳源,培养2 d后取样。
(6)不同氮源种类对解钾量的影响:配制解钾菌备用悬液和无钾解钾培养基(步骤同上),分别以氯化铵、硝酸铵、硫酸铵、硝酸钠、酵母粉、蛋白胨为氮源,培养2 d后取样。
1.3 数据处理
采用WPS和SAS9.1统计软件DUI对实验数据进行分析及多重比较。
2 结果与分析
2.1 根际土壤解钾菌的筛选
本研究对蓖麻根际土壤样品进行涂布处理,初步筛选得到83株菌,通过分离、初筛等步骤挑取6株生长效率高、具高效解钾能力的菌株,再经过优化发酵条件、采用过氧化氢灰化法[18]等进一步地优化鉴定菌株,并使用火焰原子吸收分光光度计测定这6株解钾细菌的可溶性解钾含量,得出其解钾能力均较强。其中接种MY-1菌株的培养液所产生的速效钾含量最高,解钾效果较其他菌株更加明显,因此,确定以MY-1菌株为实验研究对象,进行生理生化特性鉴定和发酵条件优化,分析其解钾特性的变化为后续研究奠定基础。
2.2 解钾菌MY-1的生理生化鉴定
由表2可知,菌株能使明胶液化,接触酶、硝酸盐还原、甲基红等试验呈现阳性;不能水解淀粉、纤维素,丙二酸、乙酰甲基甲醇、硫化氢等试验呈现阴性。
在碳源利用方面:菌株MY-1可利用α-乳糖、D-纤维二糖、D-果糖、D-半乳糖、D-葡萄糖、D-甘露糖、D-山梨醇、D-海藻糖、D-木糖、L-阿拉伯糖、L-苯丙氨酸、棉子糖、木聚糖、肌醇、松三糖、鼠李糖、水杨苷、可溶性淀粉和蔗糖,但不能利用核糖。
在氮源利用方面:菌株MY-1可利用L-精氨酸、L-苯基丙氨酸、甘氨酸、L-乙硫氨酸、缬氨酸、组氨酸和乙酸铵作为唯一氮源,但不能利用L-丝氨酸、蛋氨酸、L-羟基脯氨酸、L-半胱氨酸、硝酸铵、氯化铵、硫酸铵、草酸铵和四水合钼氨酸。
菌株MY-1的最适生长温度为37 ℃,pH值为5;且能生长在NaCl含量小于10%的培养基上。
2.3 菌株16S rDNA分子生物学鉴定
对菌株MY-1进行测序,获得1 530 bp的序列片段,將菌株的序列分别在GenBank和EzBioCloud数据库中进行同源性比对,并选取20株同源性较高的标准菌株序列,与靶标菌株MY-1的基因序列一起,应用MEGA 5.1软件的相关功能构建邻接距离矩阵法系统发育关系进化树(图1)[19]。结果显示,菌株MY-1与链霉菌属(Streptomyces)的同源性均较高,大多数的序列聚集在同一节点处,并且具有较近的遗传距离。MY-1与嗜线虫赛雷氏菌Serratia nematodiphila DSM 21420T(JPUX01
000001)和粘质沙雷氏菌Serratia marcescens subsp.sakuensis KREDT(AB061685)亲缘关系最近,相似率均达100%。根据系统发育树相似性和同源性分析结合形态特征、培养特征和生理生化特征,鉴定此菌株为嗜线虫赛雷氏菌(Serratia nematodiphila)。
2.4 解钾菌MY-1发酵条件的优化研究
2.4.1 不同培养时间对解钾菌解钾量的影响 由图2可知,在72 h内,菌株MY-1对钾长石的解钾能力变化显著。当培养时间从12 h增加至36 h时,解钾量总体呈上升趋势,并在36 h时达到峰值,解钾量为44.57 mg/L;在36 h后,48、60、72 h的解钾量略有下降并保持较平稳状态,分别为34.95、35.61、34.62 mg/L。这表明菌株MY-1在培养了36 h后的解钾能力最强,在36 h后因受代谢产物的影响,其解钾能力略有降低但基本处于平稳状态。这对今后开发具有稳定解钾能力的菌肥生产具有十分重要的意义。
2.4.2 不同pH值条件对解钾菌解钾量影响 由图3可知,调节培养pH值可使菌株MY-1的解钾能力发生显著变化.设定pH值从3~9,菌株解钾能力总体为先升后降,在pH为5时达到峰值,解钾量为31.30 mg/L,比pH3时的解钾量飙升了40.32%;将pH值调至6,开始明显下降,降至8.72 mg/L;并在pH值为7、8时保持稳定,均为7.06 mg/L;当pH9时解钾量降至最低值4.74 mg/L。这表明改变pH值对菌株MY-1的解钾量变化有显著影响,菌株MY-1最適合酸性环境下生长,这为改良土壤肥力提供有利依据。
2.4.3 不同钾长石粉量对解钾菌解钾量影响 由图4可知,在钾长石粉量为0.5、1.0 g时,解钾量变化甚小,分别为42.58、46.23 mg/L;当增加到1.5、2.5、5.0 g时,菌株解钾能力呈稳定增加趋势,解钾量分别为73.46、94.04、112.30 mg/L;当加入10.0 g的钾长石粉时,菌株的解钾能力最强,解钾量为183.01 mg/L。这表明菌株MY-1的解钾能力随着钾长石粉量的增加而递增,不溶性钾矿石含量越高,解钾能力越高,这对充分利用土壤钾元素有着重要的意义。
2.4.4 不同摇床转速对解钾菌解钾量的影响 由图5可知,从50~250 r/min为观察周期,摇速每间隔50 r/min提取1次培养液测定其解钾量,在50、100、150、200 r/min时,解钾量稳定增加,分别为36.61、50.88、55.53、63.17 mg/L;当摇床转速为250 r/min时,菌株解钾量达到峰值为63.50 mg/L,比转速为200 r/min时略高,但基本保持恒定。这表明不同摇床转速对菌株MY-1的解钾能力产生显著影响,摇速增大时,解钾量也随之增加,并在250 r/min转速时,解钾量最佳。
2.4.5 不同碳源种类对解钾菌解钾量的影响 由图6可知,不同碳源种类对菌株解钾量影响的强弱顺序为:蔗糖>葡萄糖>乳糖>果糖>淀粉>麦芽糖。以蔗糖为碳源时,接种了菌株MY-1的培养液解钾量最大,达32.62 mg/L,其次是葡萄糖;以麦芽糖碳源时,解钾效果最差,解钾量降至1.56 mg/L。这表明该解钾菌发酵培养时,以蔗糖、葡萄糖、乳糖为碳源,发酵效果最好,解钾量最大,其中蔗糖是发酵时的最佳碳源。
2.4.6 不同氮源种类对解钾菌解钾量的影响 由图7可知,不同的氮源种类对解钾菌解钾量的影响强弱顺序为:硫酸铵>氯化铵>硝酸铵>硝酸钠>酵母粉>蛋白胨,以硫酸铵为氮源时,解钾量达42.0 mg/L,以蛋白胨为氮源时,解钾效果最差,解钾量为2.33 mg/L。这表明解钾菌MY-1发酵培养时,对氮源的利用以有机氮为主,有机氮利用效率优于无机氮,且以硫酸铵为氮源,发酵效果最好。
3 讨论
解钾菌能分解钾长石、云母等不溶硅铝酸盐类无机矿物,大量存在于土壤中,并将土壤中的固态钾分解转化为可溶性速效钾。已有大量研究结果表明,从作物根际土壤中分泌出来的解钾菌更能产生对土壤微生物活性有促生作用的分泌物,刘璇等[20]从青岛即墨烟草根际土壤中筛选到的8株解钾菌并最终确定其中1株变栖克雷伯氏菌(Klebsiella variicola)产生的速效钾能力最强;张朝辉等[21]从环神农架烟区烤烟根际土壤分离出1株使钾有效性提高约27%的解钾菌K03;罗华元等[22]从云烟高端品牌直烟区根际土壤中分离出77株解钾菌株,并高温筛选获得1株解钾活性达10.6 mg/L的侧孢芽孢杆菌(Bacillus Lateraporus)K77解钾菌。目前以药用植物根际土壤解钾菌为研究对象的报道还相对较少,从慕东艳等[23]在黑龙江省6个地区栽培的药用植物根际土壤样品中,分离和鉴定出真菌35属86种的试验可以看出,药用植物根际土壤的菌类多样性可研究性。油料作物蓖麻,具有很高的药用价值,蓖麻根醇提物具有体外抗乙肝病毒和抑菌作用[24],另一方面,蓖麻对土壤重金属污染修复和微生物的强化作用也不容小觑,从蓖麻根际土壤中分离筛选出的解钾菌具有较高的解钾活性,可为将来的农业生产利用奠定基础。本研究是针对蓖麻根际土壤进行试验分析,从蓖麻根际土壤中分离得到6株高效解钾菌,通过解钾量的测定和菌株鉴定,利用分离筛选培养基获得1株高效解钾细菌MY-1,在经过发酵培养36 h后,解钾量可达44.57 mg/L,与同类文献相比[7],发酵周期较短,这有利于加快对土壤钾的调控速度。通过形态观察、生理生化试验和16S rRNA基因序列分析对菌株进行鉴定,初步鉴定该菌株为嗜线虫赛雷氏菌(Serratia nematodiphila),目前研究较广泛的高效解钾硅酸盐细菌多为胶质芽孢杆菌B. mucilaginosus,如Karavaiko等[25]的研究,还未见从药用作物根际土壤中分离出嗜线虫赛雷氏菌的报道,菌株MY-1在不同的钾长石粉量培养条件下,不溶性钾矿石含量越高,解钾能力越高,当加入10 g的钾长石粉时,解钾量可为183.01 mg/L,绝对解钾含量值较高,这有利于提高对根际土壤钾元素的利用率。
解钾菌解钾量的多少是影响菌株性能的重要因素,本研究从海南省临高县蓖麻种植区根际土壤中采样筛选出1株具有高效解钾能力的解钾菌株MY-1,可溶性钾含量高达65.04 mg/L,初步鉴定为嗜线虫赛雷氏菌(Serratia nematodiphila),通过单因素发酵条件优化结合方差分析统计得出,MY-1菌株在以蔗糖和硫酸铵为碳氮源时的最佳发酵条件为:培养温度为37 ℃,pH值为5,摇床转速为250 r/min,培养时间为24 h,钾长石粉量为10 g。本研究着重利用蓖麻自身能从根部向地上部运输钾离子的耐盐性机制,提取根部土壤解钾菌,并进行发酵条件优化,使该解钾菌的解钾量达到最大化,为今后减少工业化肥,改善植株抗逆性、提高代谢能力,平衡土壤肥力和改善土壤环境提供可行性措施,进而为今后开展有益微生物菌肥田间试验和农业生产提供理论依据。
参考文献
[1] 张良波, 李昌珠, 宋 炜. 能源植物系列讲座(8)世界十大油料作物之一——蓖麻[J]. 太阳能, 2009(8): 17-19.
[2] 张宝贤,谭德云. 中国蓖麻的发展优势与加快能源化利用的决策[J]. 中国农村小康科技, 2009(12): 12-16.
[3] 孙振钧. 蓖麻产业发展:从种植到利用[J]. 中国农业大学学报,2012, 17(6), 204-214.
[4] 伍善东, 雷 平, 郭照辉, 等. 1株高效解钾菌的分离、鉴定及培养条件优化[J]. 贵州农业科学, 2016, 44(5): 77-80.
[5] 李新新, 高新新, 陈 星, 等. 一株高效解钾菌的筛选、鉴定及发酵条件的优化[J]. 土壤学报, 2014, 51(2): 381-388.
[6] 周毅峰, 羅云霞, 刘华中. 解钾菌的筛选[J]. 湖北民族学院学报(自然科学版), 2009, 27(3): 285-288.
[7] 陈 易, 程永毅, 郭 涛, 等.一株具紫色土亲和性解钾菌的筛选及促生效应[J]. 西南大学学报(自然科学版), 2016, 38(5): 58-65.
[8] 陈廷伟.胶质芽孢杆菌分类名称及特性研究(综述)[J].土壤肥料, 2002, 5(4): 5-10.
[9] Sugumaran P, Janarthanam B. Solubilization of potassium containing minerals by bacteria and their effect on plant growth[J]. Wor J Agr Sci, 2007, 3(3): 350-355.
[10] Sturz A V, Christie B R, Nowak J. Bacterial endophy tes,Potential role in developing sustainable system of cropproduction[J]. Citical Reviews in Plant Sciences, 2000, 19(1): 1-30.
[11] 史静静. 棉花根际解钾菌的生理活性和促生效果评价[D]. 合肥: 安徽农业大学, 2012.
[12] 罗 娜, 周德明, 徐 睿, 等. 降香黄檀、檀香根际解钾菌的筛选与活性研究[J]. 热带作物学报, 2016, 37(5): 964-970.
[13] 苟志辉. 油茶根际功能菌株的组合优化及菌肥研究[D]. 株洲:中南林业科技大学, 2010: 1-51.
[14] 陈宇丰. 香蕉根际土壤解钾放线菌的筛选鉴定及解钾特性研究[J]. 生物技术通报, 2015, 31(6): 129-137.
[15] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 364-398.
[16] Buchanan R E, Gibbons N E. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984.
[17] Hong K, Gao A H, Xie Q Y, et al. Actino-mycetes for marine drug discovery isolated from man-grove soils and plants in China[J]. Mar Drugs,2009,7(1):24-44.
[18] 陈华癸. 微生物学实验[M]. 北京: 农业出版社,1962.
[19] Wang F, Xu X X, Qu Z, et al. Nonomuraea wenchangensis Sp. Nov,isolated from mangrove rhizosphere soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(7): 1 304-1 308. Doi, 10.1099/ijs.0.025742-0.
[20] 刘 璇, 孔凡玉, 张成省, 等. 烟草根际解钾菌的筛选与鉴定[J]. 中国烟草科学, 2012, 33(3): 28-31.
[21] 张朝辉, 王豹祥, 席淑雅,等. 一株烤烟根际解钾细菌的鉴定及其在烤烟生产中的应用[J]. 浙江农业学报, 2011, 23(3):553-558.
[22] 罗华元, 常寿荣, 王绍坤,等. 云烟高端品牌植烟区根际土壤高效解钾菌的筛选[J]. 西南农业学报, 2011, 24(5): 1 813-1 817.
[23] 慕东艳, 吕国忠, 孙晓东,等. 黑龙江省药用植物根际土壤真菌多样性[J]. 生态学报, 2013, 33(1): 229-237.
[24] 唐祖年,徐雅娟,冯 梅,等. 蓖麻根提取物对HepG2 2 15HBsAg和HBeAg表达和抗菌作用的研究[J].时珍国医国药,2010, 21(11): 3 006-3 008.
[25] Karavaiko G I. Role of microoganisms and some physico-chemical factors of the medium in quartz destruction[J]. Mikrobiologiya, 1984, 53(6): 976-981.

