农杆菌介导的芦笋遗传转化体系的建立
鹿志伟 侯晓婉 高建明 张燕梅 杨子平 陆军迎 李俊峰 赵艳龙 周文钊 易克贤


摘 要 以芦笋“井岗701”胚状体为试验材料,在构建pCAMBIA3300-35S-hevein-NOS植物表达载体基础上,采用农杆菌介导的转基因方法,探究菌液浓度、AS浓度、侵染时间和共培养时间等4个因素对芦笋转基因效率的影响,以期建立高效的芦笋转基因体系。结果表明:用菌液浓度OD600=0.6,AS终浓度为200 μmol/L的农杆菌菌液进行侵染,侵染10 min后,暗培养4 d的转基因效率最佳,经PCR检测,阳性转化率达21%,获得了转基因幼苗。本实验构建了完整的农杆菌介导的芦笋遗传转化体系。
关键词 芦笋;农杆菌介导;遗传转化体系
中图分类号 S644.6 文献标识码 A
Abstract Embryoids derived from asparagus“Jinggang 701”were chosen as the experimental materials. With construction of plant expression vector-pCAMBIA3300-35S-hevein-NOS, the effects of liquid bacterial concentration, AS concentration, infection time and co-culture time on asparagus transgenic efficiency were explored by the agrobacterium-mediated transgenic method. The high-efficiency transgenic system of asparagus was expected to be established in this study. The result showed that the optimal infection conditions were liquid bacterial concentration OD600=0.6, adding AS up to final concentration of 200 μmol/L, infecting for 10min and culturing under darkness for 4 d, which made the transformation rate up to 21% and got transgenic plant.
Key words Asparagus(Asparagus officinalis L.);Agrobacterium-mediated;Genetic transformation system
doi 10.3969/j.issn.1000-2561.2016.08.009
芦笋(Asparagus officinalis L.)属于天门冬属的多年生草本植物,在欧洲、亚洲、澳大利亚以及美洲的分布尤为广泛,中国是芦笋的主要生产国之一[1]。芦笋除了具有重要的食用价值外,还对多种疾病具有良好的治疗效果,如降血糖、抗癌等,享有“蔬菜之王”的美誉[2-4]。当前市场上流行的芦笋品种虽然高产但是均易感病,尤其是茎枯病严重影响着芦笋的产量,高产、抗病芦笋新品种的选育已成为当务之急。新品种选育主要有杂交育种和转基因育种2种方式,杂交育种的随机性、过程繁琐、育种周期长等特征致使新品种培育具有很大的不可控性,短期内难以得到抗病高产的芦笋新品种。而转基因育种则不同,其可以对植株性状进行定向的改变,品种选育周期短、可控性高,日益成为品种选育的首选方式。
Hevein基因又称为橡胶树凝集因子基因,其表达产生的橡胶树凝集因子是一个富含Cys和Gly的小分子单链蛋白质,具有结合几丁质的作用,是乳胶中橡胶粒子凝集的主要影响因素,也是乳胶中黄色物质的主要蛋白质之一[5]。后来从甜菜叶片、小麦等植物种子中也发现了类似的hevein-like蛋白,经研究发现hevein和hevein-like蛋白在植物体内和体外还表现出广谱的抗菌性,对细菌、真菌等病原菌都具有良好的抑菌性能[6-8]。
目前,国内外有关芦笋转基因育种的相关研究较少,在国内尚未有相关报道,而国外仅3人对芦笋转基因有过报道:Hernalsteens等[9]将空的根癌农杆菌转入芦笋茎中,并成功地在转化植株中检测到胭脂碱和农杆菌素碱,证明根癌农杆菌成功地转入了芦笋中。Bytebier等[10]将含有NOS-APHⅡ基因的根癌农杆菌成功转入芦笋中;Limanton-Grevet等[11]将含有uidA和nptⅡ基因农杆菌AGL1成功转入芦笋胚性系中,并对后代进行了遗传分析。虽然研究人员已成功将外源基因转入芦笋植株中,但是转化体系中转化率均较为低下,转化周期长,且均无目的基因转入。笔者在前人研究的基础上,以芦笋胚状体作为外植体,在构建含有35S-hevein-NOS表达元件的pCAMBIA3300植物表达载体基础上,探究菌液浓度、AS浓度、侵染时间和共培养时间等4个因素对农杆菌介导的芦笋转基因效率的影响,以期进一步完善农杆菌介导的芦笋遗传转化体系,提高遗传转化率,并导入目的基因,为后期芦笋转基因抗病高产新品种选育奠定研究基础。
1 材料与方法
1.1 材料
植物表达载体:pBI121、pCAMBIA3300,均由中国热带农业科学院热带生物技术研究所张树珍实验室惠赠。农杆菌EHA105菌株和Puc57-hevein由本实验室保存。限制性内切酶均为fermentas公司产品,DNA聚合酶和连接酶为NEB公司产品,其它分析纯药品及试剂盒。芦笋“井岗701”购自江西省农业科学院。
1.2 方法
1.2.1 外植体制备 外植体制备方法参照鹿志伟等[12]的研究方法。
1.2.2 植物表达载体构建 设计5′TGCTCTAGAAT
GAAATACTGTACTATGTTTAT3′(添加XbaⅠ酶切位点)和5′CGAGCTCTCAGTTGGCACCGC3′(添加SacⅠ酶切位点)引物对hevein基因进行扩增,随后对扩增得到的目的片段进行电泳检测。准确无误后,对扩增得到的目的基因和pBI121进行XbaⅠ和SacⅠ双酶切,分别使用PCR产物回收试剂盒和胶回收试剂盒对二者进行目的片段回收,将回收得到的目的基因和pBI121大片段进行T4 DNA连接酶连接,获得含hevein基因的pBI121载体(图1)。随后分别对改造后的pBI121载体和pCAMBIA3300进行HindⅢ和EcoRⅠ双酶切,使用胶回收试剂盒对pBI121进行小片段回收,而对pCAMBIA3300则进行大片段回收,对得到的2个片段进行T4 DNA连接酶连接,从而完成含有35S-hevein-NOS基因表达元件的pCAMBIA3300植物表达载体构建(图2),最后采用冻融法将构建好的植物表达载体转入农杆菌EHA105中,-20 ℃备用。
1.2.3 芦笋胚状体对PPT的抗性实验 将芦笋胚状体切成0.6 cm2大小,添加至含0、5、10、20、40、80 mg/L PPT的转化培养基中,每组实验添加20块外植体,重复3次,培养20 d后,观察芦笋胚状体生长状况并统计死亡率。
1.2.4 预培养 将培养好的芦笋胚状体切成0.6 cm2左右的小块,置于预培养基上,26 ℃光培养2 d。预培养培养基:MS+4%蔗糖+800 mg/L谷氨酰胺+500 mg/L酸水解酪素+0.70 mg/L嘧啶醇+0.10 mg/L NAA+0.50 mg/L kinetin,pH5.8。
1.2.5 转化菌液的制备 取-70 ℃保存含pCAMBI
A3300-35S-Hevein-NOS质粒的转化农杆菌菌液20 μL,置于YEP固体培养基(含Kanamycin 50 mg/L和Rifampicin100 mg/L)中,涂布均匀。静置30 min,28 ℃倒置培养2 d。挑取单菌落接种至含Kanamycin 50 mg/L和Rifampicin 100 mg/L 的YEP液体培养基中,28 ℃、250 r/min震荡培养直至对数期(OD600约为0.55左右),5 500 r/min,-4 ℃离心8 min,收集菌体,液体转化培养基悬浮。
1.2.6 侵染和共培养 使用液体转化培养基将上述菌体OD600值分别调节为0.2、0.4、0.6、0.8。将预培养2d芦笋胚状体置于150 mL无菌锥形瓶中,同时锥形瓶中添加50 mL含转化农杆菌菌体和乙酰丁香酮(浓度分别为0、50、100、200 μmol/L)的液体转化培养基,从而对胚状体进行农杆菌侵染,侵染时间为5、10、20、40 min,26 ℃ 150 r/min振荡。无菌滤纸擦干芦笋胚状体表面液体,转移至固体转化培养基中,26 ℃,暗培养2、4、6、8 d。
1.2.7 脱菌与选择培养 使用200 mg/L Timentin对共培养后的芦笋胚状体进行脱菌10 min,100 r/min轻轻振荡,然后无菌水清洗3次。重复3次。无菌滤纸擦干芦笋胚状体表面液体。最后转移至含Timentin和PPT的固体转化培养基中,26 ℃,光培养,直至原有胚状体表面有新的胚状体生成,上述每组实验添加80块胚状体,重复3次,统计抗性胚状体转化率,抗性胚状体转化率/%=抗性胚状体个数/胚状体处理总个数×100。
1.2.8 分子水平检测 PCR检测是一种非常简单、快速和直接的转基因苗检测方法,本实验用此方法对抗性胚状体进行检测。胚状体经PPT筛选后进行PCR验证以及植株再生。采用OMEGA植物DNA提取试剂盒对抗性胚状体进行DNA提取,并进行PCR检测,统计阳性转化率。
1.2.9 抗性植株再生 将选择培养后新长出的胚状体转移到生苗培养基中,进行苗诱导。
1.3 数据分析
使用SPSS19.0和Excel2007软件对试验数据进行统计分析[13-14]。
2 结果与分析
2.1 植物表达载体构建
2.1.1 pBI121-Hevein载体的构建 对pBI121-hevein植物表达载体进行PCR扩增以及电泳分析,发现有且仅有一条约276 bp目的基因条带,与目的基因hevein相符(图3)。
2.1.2 植物表达载体pCAMBIA3300-35S-Hevein-NOS的构建 对pCAMBIA3300-35S-Hevein-NOS植物表达载体进行双酶切以及电泳分析,发现经双酶切后载体被分为2个片段,其中小片段大小为1 100 bp左右,与目的基因表达元件35S-Hevein-NOS相符(图4)。
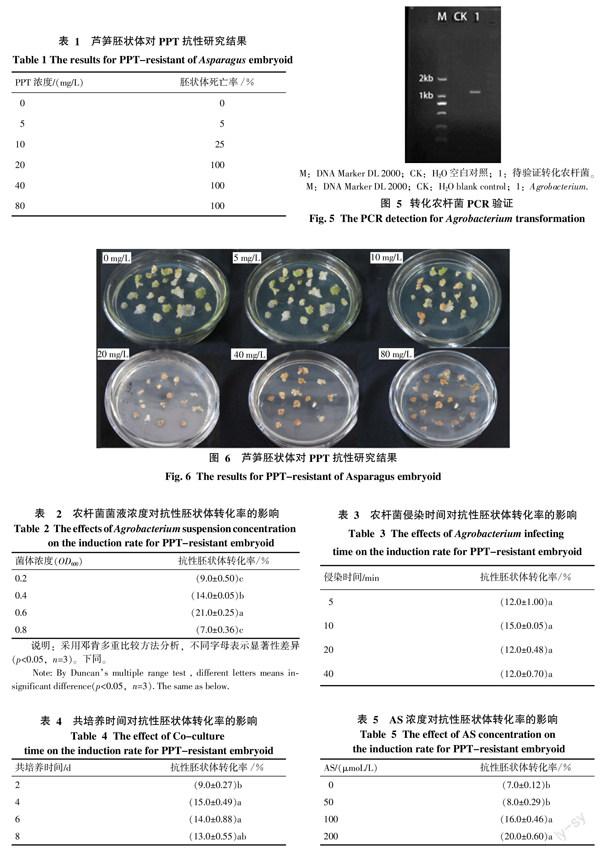
2.1.3 植物表达载体pCAMBIA3300-35S-Hevein-NOS转化农杆菌及其验证 对pCAMBIA3300-35S-Hevein-NOS植物表达载体进行菌落PCR验证,发现在PCR目的条带大小为1 100 bp左右,与目的基因表达元件35S-Hevein-NOS相符(图5)。
2.2 芦笋胚状体对PPT抗性的研究
由表1和图6可以看出,随着PPT浓度的增加,芦笋胚状体发生萎缩、变黄直至死亡,死亡率逐渐增加,PPT浓度为20 mg/L时胚状体全部死亡。
2.3 不同农杆菌菌液浓度和侵染时间对芦笋遗传转化的影响
由表2可知,不同菌体浓度对抗性胚状体的转化率存在显著性差异(p<0.05),当菌体浓度为0.6时,转化率最高。由表3可知,不同侵染时间对抗性胚状体的转化率不存在显著性差异(p<0.05),为达到侵染时间最短以及转化率较高的目标,侵染时间选择10 min为佳。因此,农杆菌菌液浓度OD600=0.6,侵染时间10 min时为最佳作用条件。
2.4 不同共培养时间对芦笋遗传转化的影响
由表4可知,当共培养时间为4 d和6 d时,抗性胚状体转化率与其它处理相比差异显著,转化率分别为15.0%和14.0%。为了节省培养时间,同时又使转化率达到最高,共培养时间选择4 d为佳。
2.5 不同浓度AS对芦笋遗传转化的影响
由表5可知,不同AS浓度对抗性胚状体转化率存在显著性差异(p<0.05)。当AS浓度为100、200 μmoL/L时,抗性胚状体转化率与其它处理相比差异显著,转化率分别为16.0%和20.0%。为了使转化率达到最高,AS添加浓度选择200 μmoL/L作为最佳。
2.6 转基因植株的PCR检测
由图7可知,阳性对照和再生芦笋植株PCR结果中目的条带大小一致,约为1 100 bp,大小与基因表达元件35S-Hevein-NOS相符。整个转基因过程见图8。
3 讨论与结论
农杆菌介导的植物遗传转化是一个非常复杂的过程,受外植体类型、菌液浓度、菌株类型、侵染时间、共培养时间、以及乙酰丁香酮浓度等多种因素影响,而且不同植物基因型、外植体其对应的农杆菌最佳侵染条件不同,转化率也具有很大差异。农杆菌作为转化效果最好的植物转化方式之一,目前为止已有很多相关研究,如周月等[15]通过农杆菌介导法将LJAMP2基因成功导入“红阳”泥猴桃中,其使用的最佳农杆菌侵染条件为:共培养时间为2 d,农杆菌菌液浓度为OD600=0.5,侵染时间为10 min,AS浓度为100 μmol/L,转化率达到5.11%;Gnasekaran等[16]农杆菌介导的兰花转基因中,最佳的农杆菌侵染条件为:OD600=0.8,侵染时间30 min,共培养4 d,AS浓度为200 μmol/L,转化率高达33.6%。
农杆菌介导的芦笋遗传转化体系的研究已有部分工作,如Bytebier等[17]使用愈伤组织作为外植体,经过侵染、选择培养以及植株再生等得到了转基因芦笋植株,但是转化周期较长。Bruno等[18]使用C58农杆菌菌株,同时对3个基因型的芦笋体细胞进行转化,检测得到阳性植株,但是转化率较低,为0.6%~4%。Limanton-Grevet等[19]使用AGL1Gin农杆菌菌株,选用5个胚性系作为侵染对象,结果发现转化率为0.8%~12.8%,转化率得到提高。本研究在综合对比分析前人研究的基础上,以芦笋胚状体作为侵染对象,采用EHA105农杆菌菌株,并对菌体浓度、侵染时间、共培养时间等侵染条件进行优化。结果表明,芦笋转化率大大提高,最高可达21%。转化周期得到有效地缩短,遗传效率得到极大地提高。另外,实验中成功将hevein基因和bar基因转入芦笋植株中,有利于后期抗病、抗除草剂芦笋新品种的选育。
参考文献
[1] Huang X F, Lin Y Y, Kong L Y. Steroids from the roots of Asparagus officinalis and their cytotoxic activity[J]. Journal of Integrative Plant Biology, 2008, 50(6): 717-722.
[2] Nindo C I, Sun T, Wang S W, et al. Evaluation of drying technologies for retention of physical quality and antioxidants in Asparagus(Asparagus officinalis L.)[J]. Food Science and Technology, 2003, 36(5): 507.
[3] Hafizur R M, Kabir N,Chishti S. Asparagus officinalis extract controls blood glucose by improving insulin secretion and β-cellfunction in streptozotocin -induced type 2 diabetic rats[J]. British Journal of Nutrition, 2012, 108: 1 586-1 595.
[4] Jang D S, Cuendet M, Fong H H S, et al. Constituents of Asparagus officinalis evaluated for inhibitory activity against cyclooxygenase-2[J]. J Agric Food Chem, 2004, 52: 2 218-2 222.
[5] Gidrol X, Chrestin H, Tan H L, et al. Hevein, a lectin-like protein from Hevea brasiliensis (rubber tree) is involved in the coagulation of latex[J]. J BIOl Chem, 1994, 269: 9 278.
[6] 刁现民, 王永芳, 李 伟, 等. 抗除草剂基因Bar转化谷子研究[C]. 全国作物遗传育种学术研讨会论文集, 2003: 613-618. [7] Davis E G, Sang Y M, Blecha F. Equine β-defensin-1:full-length cDNA sequence and tissue expression[J]. Vet Immunol Immunopathol, 2004, 99: 127-132.
[8] De Leeuw E, Li C Q, Zeng P Y, et al. Functional interaction of human neutrophil peptide-1 with the cell wall precursor lipidⅡ[J]. FEBS Lett, 2010, 584(8): 1 543-1 548.
[9] Hernalsteens J P, Thia-Toong L, Schell J, et al. An Agrobacterium-transformed cell culture from the monocot Asparagus officinalis[J]. The EMBO Journal, 1984, 3(13): 3 039-3 041.
[10] Bytebier B, Deboeck F, Greve H D, et al. T-DNA organization in tumor cultures and transgenic plants of the monocotyledon Asparagus officinalis[J]. Proc Nati Acad Sci, 1987, 84(15): 5 345-5 349.
[11] Limanton-Grevet A, Jullien M. Agrobacterium-mediated transformation of Asparagus officinalis L.: molecular and genetic analysis of transgenic plants[J]. Molecular Breeding, 2001, 7(2): 141-150.
[12] 鹿志伟, 高建明, 侯晓婉,等. 芦笋组培快繁体系的建立[J]. 北方园艺, 2015(9): 83-86.
[13] 刘瑞江, 张业旺,闻崇炜,等. 正交试验设计和分析方法研究[J]. 实验技术与管理, 2010, 27(9): 52-55.
[14] 高忠江, 施树良, 李 钰. SPSS方差分析在生物统计的应用[J]. 现代生物医学进展, 2008, 8(11): 2 116-2 120.
[15] 周 月, 赵许朋, 吴秀华,等. 农杆菌介导LJAMP2基因导入‘红阳猕猴桃及分子鉴定[J]. 生物工程学报, 2014, 30(6):931-942.
[16] Gnasekaran P, Uddain J, Subramaniam S, et al. Agrobacterium-mediated transformation of the recalcitrant Vanda Kasems Delight Orchid with higher efficiency[J/OL]. The Scientific World Journal, 2014: http://dx.doi.org/10.1155/2014/583934.
[17] Bytebier B, Deboeck F, Greve H D, et al. T-DNA organization in tumor cultures and transgenic plants of the monocotyledon Asparagus officinalis[J]. Proc Nati Acad Sci, 1987, 84(15): 5 345-5 349.
[18] Bruno Delbreil, Phifippe Guerche t, M. Jullien. Agrobacterium-mediated transformation of Asparagus officinalis L. long-term embryogenic callus and regeneration of transgenic plants[J]. Plant Cell Reports, 1993, 12: 129-132.
[19] Limanton-Grevet A, Jullien M. Agrobacterium-mediated transfo-
rmation of Asparagus officinalis L.: molecular and genetic analysis of transgenic plants[J]. Molecular Breeding, 2001, 7(2): 141-150.
——防口干

